Method Article
Analyse du microenvironnement hépatique au cours de la progression précoce du carcinome hépatocellulaire associé à la stéatose hépatique non alcoolique chez le poisson zèbre
Dans cet article
Résumé
Ici, nous présentons comment générer un modèle de poisson zèbre associé à la stéatose hépatique non alcoolique (NAFLD) associé au carcinome hépatocellulaire (CHC) pour étudier l’impact du surplus de cholestérol sur le microenvironnement hépatique et le paysage des cellules immunitaires.
Résumé
Le cancer du foie est actuellement la troisième cause de décès lié au cancer dans le monde, et le carcinome hépatocellulaire (CHC) représente 75 à 90% de tous les cas de cancer du foie. Avec l’introduction de traitements efficaces pour prévenir et traiter l’hépatite B / C, la stéatose hépatique non alcoolique (NAFLD) et la forme plus agressive connue sous le nom de stéatohépatite non alcoolique (NASH) deviennent rapidement les principaux facteurs de risque de développer un CHC dans les sociétés modernes. Pour mieux comprendre le rôle de la NASH dans le développement du CHC, nous avons conçu un poisson-zèbre HCC associé à la NASH. La clarté optique et la traçabilité génétique des larves de poisson zèbre en font un modèle attrayant et puissant pour étudier le microenvironnement hépatique et la composition des cellules immunitaires à l’aide d’une imagerie fluorescente vivante non invasive. Ce protocole décrit comment utiliser un modèle de poisson-zèbre HCC associé à la NASH pour étudier l’effet du surplus de cholestérol dans le microenvironnement hépatique et son impact sur la composition des cellules immunitaires aux premiers stades de la maladie. Tout d’abord, nous nourrissons les larves de CHC (s704Tg), qui expriment la bêta-caténine activée spécifique des hépatocytes, avec un régime riche en cholestérol à 10% pendant 8 jours pour développer un modèle de CHC associé à la NASH. Nous décrivons ici comment utiliser différentes lignées transgéniques pour évaluer plusieurs caractéristiques de malignité précoce dans le foie par microscopie confocale non invasive, telles que la région du foie, la cellule et la morphologie nucléaire (zone des hépatocytes, zone nucléaire, rapport nucléaire: cytoplasmique (rapport N: C), circularité nucléaire, score des micronoyaux / hernie nucléaire) et angiogenèse. Ensuite, en utilisant des lignées transgéniques avec des cellules immunitaires marquées (neutrophiles, macrophages et cellules T), nous montrons comment analyser la composition des cellules immunitaires hépatiques chez les larves de CHC associées à la NASH. Les techniques décrites sont utiles pour évaluer le microenvironnement hépatique et la composition des cellules immunitaires aux premiers stades de l’hépatocarcinogenèse, mais elles peuvent également être modifiées pour étudier de telles caractéristiques dans d’autres modèles de maladies hépatiques.
Introduction
Le carcinome hépatocellulaire (CHC) est un cancer agressif avec des options thérapeutiques limitées. Il a été constaté que plus de 30% de tous les patients atteints de CHC sont obèses et ont NASH, une forme agressive de NAFLD 1,2,3,4. La consommation de régimes riches en calories augmente considérablement la disponibilité des acides gras qui provoque des changements métaboliques locaux et systémiques et déclenche la stéatose, les lésions hépatocytes, l’inflammation et la fibrose - toutes les caractéristiques clés de la NASH. La progression de la NASH vers le CHC implique l’accumulation de lipides dans le foie, ce qui déclenche une inflammation et une altération de la composition des cellules immunitaires 5,6,7. Il est particulièrement intéressant et important de comprendre comment le microenvironnement hépatique et le paysage des cellules immunitaires sont modifiés au cours de la progression de la maladie hépatique, et comment il change en raison de certains facteurs étiologiques. Pour mieux identifier l’impact de l’excès de cholestérol sur le microenvironnement hépatique et le paysage des cellules immunitaires, nous avons développé un modèle unique de poisson zèbre du CHC associé à la NASH. L’utilisation de ce modèle nous a permis de mieux comprendre l’impact de l’alimentation et de la surnutrition sur le microenvironnement hépatique et la progression de la maladie hépatique.
Les modèles de mammifères, tels que les échantillons de souris et de tissus humains, ont été essentiels pour comprendre la pathogenèse de la stéatohépatite et de la stéatose8. Les souris sont le modèle préféré pour les maladies du foie et le cancer, mais elles manquent de clarté optique au niveau cellulaire, tandis que les échantillons de tissus humains manquent souvent de l’environnement 3D que les modèles animaux sont capables d’imiter. Ces obstacles ont fait du poisson-zèbre un modèle puissant dans la communauté des chercheurs. Le poisson zèbre a des similitudes remarquables avec les humains, avec au moins 70% de conservation des gènes. Ils maintiennent le microenvironnement hépatique, la composition cellulaire hépatique, la fonction, la signalisation et la réponse aux blessures 9,10. En utilisant un régime riche en cholestérol (HCD) en combinaison avec un modèle établi de poisson zèbre transgénique de HCC, nous avons développé un modèle de poisson zèbre de HCC associé à la NASH.
Nous présentons ici un protocole expliquant comment générer un modèle de poisson-zèbre associé au CHC associé à la NASH et comment étudier le microenvironnement hépatique et traiter les caractéristiques de malignité précoce in vivo. En utilisant la microscopie confocale non invasive en combinaison avec des lignées transgéniques de poisson zèbre avec membrane et noyau d’hépatocytes marqués par fluorescence, nous pouvons traiter les caractéristiques de malignité précoce en analysant la morphologie du foie (surface, volume et surface), la morphologie cellulaire et nucléaire (zone des hépatocytes, zone nucléaire, rapport N:C, circularité nucléaire, score des micronoyaux / hernie nucléaire) et l’angiogenèse (densité des vaisseaux). Le microenvironnement des cellules immunitaires est également une caractéristique importante de l’hépatocarcinogenèse11,12,13,14, par conséquent, nous montrons également comment analyser la composition des cellules immunitaires hépatiques chez les larves de CHC associées à la NASH, en utilisant des lignées de poisson-zèbre transgéniques avec des cellules immunitaires marquées (neutrophiles, macrophages et cellules T). Les techniques décrites sont uniques au modèle et extrêmement utiles pour évaluer le microenvironnement hépatique et la composition des cellules immunitaires dans la progression de la maladie hépatique.
Protocole
Les études sur les animaux sont effectuées selon des procédures approuvées par le comité institutionnel de soin et d’utilisation des animaux (IACUC) de l’Albert Einstein College of Medicine. Pour les recettes relatives aux tampons et aux solutions utilisées dans le protocole, veuillez vous reporter au tableau supplémentaire 1.
1. Préparation d’un régime enrichi en cholestérol à 10% pour l’excédent aigu de cholestérol.
- Peser 2 x 4 g de sphères actives (GPAS) Golden Pearl Diet 5-50 nm dans deux béchers en verre de 25 mL, l’un pour le régime normal (ND) et l’autre pour le régime riche en cholestérol (HCD) à 10%.
REMARQUE: Tout régime alimentaire sec commercial pour les larves de poisson zèbre peut être utilisé. - Peser 0,4 g de cholestérol dans un bécher en verre de 10 mL. Couvrir le bécher avec du papier d’aluminium.
- Mesurer 5 mL d’éther diéthylique à l’aide d’une seringue de 10 mL avec une aiguille de 20 G. Ensuite, ajoutez l’éther diéthylique au bécher ND et mélangez-le immédiatement avec la nourriture sèche à l’aide d’une spatule.
ATTENTION: L’éther diéthylique provoque une irritation des yeux, de la peau et des voies respiratoires. Utiliser uniquement dans une hotte chimique. - Mesurer à nouveau 5 mL d’éther diéthylique à l’aide d’une seringue de 10 mL avec une aiguille de 20 G et l’ajouter au bécher de 10 ml contenant du cholestérol, mélanger immédiatement en aspirant de haut en bas avec la seringue.
- Ajouter rapidement la solution de cholestérol au bécher HCD et la mélanger immédiatement avec une spatule jusqu’à ce que la solution soit uniforme.
- Laissez les béchers dans le capot jusqu’à 24 h pour évaporer complètement l’éther diéthylique. Le lendemain, broyez les régimes GPAS en particules fines à l’aide d’un pilon et d’un mortier.
NOTE: Le broyage des régimes est une étape cruciale, les larves ne pourront pas manger de particules supérieures à 50 nm. - Transférer chaque régime dans un petit sac en plastique étiqueté ou dans un tube à centrifuger de 50 ml et conserver à -20 °C.
2. Induction de la NASH avec alimentation à court terme des larves avec un régime enrichi en cholestérol - conditions statiques.
- Installez des lignes de poissons transgéniques le jour -1 (tableau 1). Le lendemain matin (jour 0), après le frai des poissons, ramassez les œufs dans une passoire à mailles.
- À l’aide d’un flacon de lavage avec de l’eau embryonnaire (E3), rincer soigneusement les œufs et transférer soigneusement les œufs dans une boîte de Petri de 10 cm avec milieu E3.
- Nettoyez les plaques de tous les débris qui pourraient s’être accumulés dans les boîtes de reproduction, y compris les œufs morts ou non fécondés.
NOTE: Le rinçage des œufs et le nettoyage des plaques sont cruciaux pour éviter la croissance incontrôlée de micro-organismes et les défauts consécutifs au développement des larves. - Répartir les œufs dans une densité de 70/80 par boîte de Pétri de 10 cm (dans 25 ml de E3). Au jour 1, sous une lunette de dissection équipée d’une base de transillumination, vérifier et nettoyer les embryons morts ou présentant des défauts de développement.
REMARQUE: Utilisez le mode fond noir de base de transillumination pour identifier les embryons ayant des effets sur le développement et pour vérifier la croissance de micro-organismes dans les plaques. Différentes installations ont un rendement différent en micro-organismes dans leurs systèmes. Changez le milieu E3 et/ou la vaisselle si nécessaire, pour éviter les effets négatifs. - Au jour 5, mélanger les larves de tous les plats dans une boîte de Petri de 15 cm, ajouter E3 sans bleu de méthylène. Ensuite, divisez les larves dans les boîtes d’alimentation comme suit (tableau 2).
REMARQUE: Dans les conditions de contrôle, pour générer des larves saines sans déclencher d’inflammation chronique systémique, les larves doivent être nourries avec environ 0,1 mg de nourriture par larve et par jour. Notez que la quantité totale de nourriture (tableau 2) est divisée également en deux tétées par jour. - Garder les larves dans un incubateur à 28 °C, dans un cycle lumière-obscurité (p. ex. 14 h de lumière / 10 h de cycle d’obscurité) et nourrir les larves deux fois par jour du jour 5 au jour 12.
- Aspirer quotidiennement tous les débris alimentaires, ainsi que 90 à 95% du milieu à l’aide d’un système de vide fixé à un embout de pipette de 1 mL. Ensuite, versez soigneusement le nouvel E3 sans bleu de méthylène dans un coin de la boîte d’alimentation pour éviter d’endommager les larves.
REMARQUE: Le nettoyage quotidien des boîtes d’alimentation est crucial pour éviter la croissance incontrôlée des micro-organismes.
3. Collecte de larves 13 jours après la fécondation dans des boîtes d’alimentation.
- Au jour 13, préparez les plats de collecte en fonction du nombre de conditions expérimentales qui ont été mises en place. Avec un marqueur permanent, faites une marque sur le côté de la vaisselle (couvercle et fond) pour éviter de changer d’échantillon, par exemple une bande noire pour l’alimentation normale (ND) et deux bandes noires pour HCD.
- Versez suffisamment d’E3 sans bleu de méthylène pour couvrir le fond de chaque plat. En utilisant soigneusement le système d’aspiration de l’eau des boîtes d’alimentation, essayez d’aspirer les débris ou les larves mortes du fond pour éviter de transférer ces matériaux dans les boîtes de collecte.
- Lorsque le niveau de l’eau commence à baisser, soulevez lentement la boîte d’alimentation pour que les larves nagent jusqu’à l’un des coins, puis aspirez dans la direction opposée.
REMARQUE : Utilisez une pipette de 1 mL avec des embouts coupés, à différentes hauteurs, pour permettre différents diamètres lors de l’aspiration de l’eau. Alternez entre les différentes tailles, commencez avec un diamètre plus grand et changez pour un diamètre plus petit à mesure que le volume d’eau diminue et que la densité des larves augmente. - Une fois qu’il n’y a qu’environ 20 à 30 ml de liquide, décanter soigneusement les larves dans la boîte de Pétri de collection préparée à l’étape 1. Placez le ruban étiqueté de la boîte d’alimentation sur le couvercle du plat.
- Répétez les étapes 3.2 à 3.4 pour toutes les boîtes d’alimentation.
4. Test de contrôle pour la stéatose hépatique induite par l’alimentation - coloration, imagerie et notation Oil Red O (ORO).
- À l’aide d’une pipette Pasteur en verre, transférer 15 à 20 larves dans un tube à fond rond de 2 ml et les placer sur de la glace pendant environ 15 à 30 minutes. Retirez la plupart des médias du tube.
- Ajouter 2 mL de 4 % de paraformaldéhyde (PFA) pour fixer les larves et incuber à 4 °C pendant la nuit.
- Le lendemain matin, retirer la solution de PFA à 4 % et laver les larves trois fois avec 2 mL de 1x PBS.
- Préparer une plaque de 12 puits (figure 2A) par condition avec un insert de puits à mailles.
- À l’aide d’une pipette en verre, transférer la larve du tube de 2 mL à l’insert précédemment placé dans le puits, ajouter 5 mL de 1x PBS. Conservez les tubes de 2 ml pour stocker les échantillons après la coloration.
ATTENTION: Les larves sont extrêmement collantes à ce stade, n’utilisez pas de pipettes en plastique. - Transférer l’insert avec les larves dans un autre puits contenant 5 ml de solution d’isopropanol à 60 %. Incuber les larves pendant 30 min à température ambiante (RT).
- Pendant ce temps, préparer une solution d’huile rouge à 0,3% dans une solution d’isopropanol à 60%. Filtrer deux fois la solution de rouge huile à 0,3 % à l’aide d’un filtre à seringue de 0,45 μm.
REMARQUE : Préparer 5 mL de solution par puits en mélangeant 3 mL d’Oil Red O à 0,5 % dans de l’isopropanol avec 2 mL d’eau distillée. La solution Oil Red O à 0,3% dans 60% d’isopropanol doit être fraîchement préparée. - Ensuite, transférer l’insert de maille avec les larves dans un autre puits avec 5 ml d’Oil Red O à 0,3% fraîchement préparé dans une solution d’isopropanol à 60%. Larves incubées pendant 3 h à TA avec balancement doux.
- Après coloration ORO, rincer les larves en transférant l’insert dans un autre puits avec 60% d’isopropanol. Lavez les larves deux fois dans de l’isopropanol à 60% pendant 30 minutes à chaque fois en transférant l’insert séquentiellement dans des puits contenant de l’isopropanol à 60%.
- Laver les larves trois fois pendant 5 minutes dans 1x PBS-0,1% Tween en transférant l’insert séquentiellement dans des puits avec 1x PBS-0,1% Tween.
- Transvaser les larves dans les tubes de 2 mL. Retirer le PBST, ajouter 1 mL de glycérol à 80 % et conserver à 4 °C jusqu’à l’imagerie.
- Pour une meilleure imagerie, transférer les larves à 1x PBS-0,1% Tween et, sous une lunette de dissection, disséquer les foies en tirant soigneusement les tissus à l’aide de deux pinces #55.
REMARQUE: Si vous utilisez un Casper, l’imagerie de fond peut être effectuée en utilisant les larves entières. - À l’aide d’une pipette en verre, transférer soigneusement les foies dans un puits d’une assiette en porcelaine contenant 50% de glycérol. Positionner les foies à l’aide d’un petit outil pour manipuler les larves (p. ex., outil pour les cils - Figure 2B). Image des foies dans un stéréomicroscope équipé d’une caméra couleur.
- Score de stéatose hépatique (pas de coloration ORO = aucune; coloration ORO rouge clair = légère; coloration ORO rouge-rouge foncé = modérée/sévère).
5. Imagerie confocale non invasive à l’aide du dispositif de blessure et de piégeage du poisson zèbre pour la croissance et l’imagerie (zWEDGI).
- Préparez une boîte de Petri de 10 cm avec 15-20 ml de 1x Tricaine-E3, juste assez pour couvrir le fond.
REMARQUE : Une solution de travail 1x Tricaine-E3 (0,16 mg/mL) peut être obtenue en diluant 2 mL d’une solution mère de Tricaïne 25x (4 mg/mL) dans 48 mL d’E3. La concentration de tricaïne ne doit pas dépasser 0,16 mg/mL puisque les larves sont extrêmement sensibles à l’anesthésie à ce stade de développement. - Transférer 15 à 20 larves à l’aide d’une pipette Pasteur en plastique dans la boîte de Petri contenant 1x Tricaine-E3 et anesthésier les larves pendant 5 min.
- Préparer une plaque de 6 puits avec 2-3 mL d’E3 sans bleu de méthylène par puits.
- Sur un stéréomicroscope fluorescent, cribler les larves anesthésiées pour détecter les marqueurs fluorescents souhaités (tableau 1). Transférer les larves criblées dans la quantité minimale de Tricaine dans E3 et les laisser récupérer dans la plaque de 6 puits jusqu’à ce qu’il soit temps d’imager.
REMARQUE : Le criblage des larves transgéniques doubles, triples et quadruples prend du temps, place les larves dans E3 et change souvent de milieu à partir de la plaque à 6 puits pour réduire l’exposition inutile à la tricaïne. En outre, les larves à ce stade de développement flottent, alors utilisez un outil de cils pour positionner les larves pour le dépistage sans induire de lésions tissulaires. - Après le dépistage, préparer une boîte de Petri de 10 cm avec 25 ml de 1x Tricaine-E3. Transférer 15 à 20 larves à l’aide d’une pipette Pasteur en plastique dans la boîte de Pétri contenant 1x Tricaine-E3 et anesthésier les larves pendant 5 min.
- Pendant ce temps, sous le stéréomicroscope, ajouter 1x Tricaine-E3 dans les chambres du dispositif de blessure et de piégeage (par exemple, zWEDGI)15,16. Enlevez les bulles d’air des chambres et du tunnel de retenue à l’aide d’une micropipette P200. Enlevez tout excès de 1x Tricaine-E3 en ne laissant que suffisamment de volume pour remplir les chambres.
- Transférer une larve anesthésiée dans la chambre de chargement du zWEDGI et la positionner à l’aide d’un outil de cils sous le stéréomicroscope. Doucement, tapotez la tête des larves et poussez-la pour que la queue pénètre dans le tunnel de retenue. De plus, à l’aide de la micropipette, retirez 1x Tricaine-E3 de la chambre de blessure pour aider la larve à entrer dans le tunnel. S’assurer que la larve est positionnée de manière appropriée pour l’imagerie du lobe gauche - Microscope inversé: côté gauche orienté vers le bas; Microscope vertical: côté gauche orienté vers le haut.
REMARQUE: Si un zWEDGI n’est pas disponible, le poisson peut être monté et positionné dans 1% d’agarose à bas point de fusion dans 1x Tricaine-E3, cependant, l’immersion d’agarose peut être utilisée uniquement pour une imagerie rapide (jusqu’à 15 min). - Pour l’analyse de la morphologie des hépatocytes et des noyaux, imagez les foies avec un microscope confocale à l’aide d’un objectif d’air 40x et de piles z de sections optiques de 2 μm. Pour la morphologie du foie, l’angiogenèse et les tests de recrutement des cellules immunitaires, imagez les foies à l’aide d’un objectif d’air 20x et de piles z de sections optiques de 5 μm. Pour les larves ayant un gros foie, des images de tuiles 2 x 2 doivent être prises pour assurer une imagerie de tout le foie et de la zone environnante de 75 μm.
- Après l’imagerie, utiliser une pipette Pasteur en plastique avec 1x Tricaine-E3 pour extraire la larve du tunnel de retenue et transférer dans une boîte de Pétri avec E3 sans bleu de méthylène.
6. Analyse des variations morphologiques du foie.
REMARQUE: Les étapes énumérées ci-dessous sont effectuées pour la quantification de la surface et du volume du foie:
- Logiciel d’imagerie ouvert. Ajoutez un dossier contenant les fichiers image à analyser à Arena en sélectionnant l’icône Observer le dossier . Ensuite, en cliquant avec le bouton droit de la souris sur les vignettes, sélectionnez Convertir au format de fichier Imaris natif pour convertir les fichiers au format (.ims).
- Dans le sous-menu Surpasser, réglez la luminosité et le contraste pour chaque canal. Ensuite, créez une surface à partir du foie en cliquant sur le bouton bleu Ajouter de nouvelles surfaces .
- Ensuite, dans le panneau de création de surface, sélectionnez Segmenter uniquement une région d’intérêt pour créer manuellement une surface du foie.
- Cliquez sur Ignorer la création automatique | Option Modifier manuellement . Sélectionnez Contour et désélectionnez l’option « Volume » dans le panneau de scène.
REMARQUE: L’option d’affichage du volume doit être désélectionnée, sinon la sélection de la région d’intérêt dans différentes piles z ne pourra pas. - Naviguez à travers les piles z et dessinez la région d’intérêt dans chaque plan en sélectionnant Mode, choisissez le mode de dessin que vous préférez. Pour commencer à dessiner changer le pointeur sur le mode Sélectionner et non naviguer, cliquez ensuite sur Dessiner et commencez à faire glisser le pointeur à travers le foie pour dessiner un retour sur investissement.
- Après avoir sélectionné un ROI dans les différents plans focaux, sélectionnez Créer une surface pour fusionner tous les ROI sélectionnés et créer une surface hépatique.
- Ensuite, en utilisant la surface nouvellement créée, créez un masque du signal des hépatocytes. Cliquez sur la surface et sous l’onglet Modifier (le crayon), choisissez Masquer tout. Dans la fenêtre qui apparaît, choisissez le canal que vous souhaitez masquer qui sera utilisé pour quantifier le volume et la surface du foie. Ensuite, choisissez définir les voxels à l’extérieur de la surface sur 0 et cochez l’option Dupliquer le canal avant d’appliquer le masque.
- Utilisez les valeurs de surface et de volume hépatique du menu d’analyse statistique pour l’analyse.
REMARQUE: Effectuez les étapes suivantes pour la quantification de la zone du foie.
- Ouvrez le logiciel Fidji. Dans le menu Plugins, sélectionnez Bio-formats suivi de Bio-formats Importer, cochez l’option Split channels pour ouvrir le fichier image.
- Dans le menu Image, sélectionnez Propriétés pour vérifier que l’image a la taille de pixel et la profondeur de voxel correctes, sinon les valeurs correctes. Ensuite, allez dans le menu Images, cliquez sur Ajuster suivi de Luminosité et contraste, ajustez la luminosité et le contraste de l’image.
- Ensuite, l’utilisation du canal des hépatocytes crée une projection d’intensité maximale du foie. Allez dans le menu Images, cliquez sur Piles suivi de Projet Z. Sélectionnez Projection d’intensité maximale.
- À l’aide de l’outil de sélection à main levée, créez manuellement une région d’intérêt (ROI) entourant le foie larvaire. Ensuite, dans le menu Analyser , cliquez sur Mesurer pour obtenir la zone du foie. Enregistrez les résultats sous forme de feuille de calcul pour une analyse plus approfondie.
7. Analyse morphologique des hépatocytes et du nucléaire.
- Ouvrez le logiciel Fidji. Dans le menu Plugins, sélectionnez Bio-formats suivi de Bio-formats Importer cochez l’option Split channels pour ouvrir le fichier image.
- Dans le menu Image, sélectionnez Propriétés pour vérifier que l’image a la taille de pixel et la profondeur de voxel correctes, sinon les valeurs correctes. Ensuite, allez dans le menu Images, cliquez sur Ajuster suivi de Luminosité et contraste, ajustez la luminosité et le contraste de l’image.
- Dans le menu Analyser , sélectionnez Définir les mesures , cochez tous les paramètres que vous souhaitez analyser (par exemple, les descripteurs de surface, de périmètre et de forme). Sélectionnez le canal fluorescent de la membrane hépatocytes. En naviguant à travers Z, utilisez l’outil de sélection à main levée pour obtenir un retour sur investissement parfait autour d’un hépatocytes. Ensuite, dans le menu Analyser , cliquez sur Mesurer pour calculer la surface des hépatocytes.
- Répétez l’étape 7.3 pour 15-30 hépatocytes. Enregistrez les résultats sous forme de feuille de calcul pour une analyse plus approfondie.
- Ensuite, sélectionnez le canal fluorescent du noyau. En naviguant à travers Z, utilisez l’outil de sélection à main levée pour obtenir un retour sur investissement parfait autour du noyau des hépatocytes. Ensuite, dans le menu Analyser , cliquez sur Mesure pour calculer la surface nucléaire et la circularité.
- Répétez l’étape 7.5 pour 15-30 hépatocytes. Enregistrez les résultats sous forme de feuille de calcul pour une analyse plus approfondie, y compris la quantification du rapport nucléaire:cytoplasmique.
- Noter les échantillons pour la présence de micronoyaux et de hernie comme suit (tableau 3).
8. Analyse de l’angiogenèse.
- Créez manuellement une surface pour le foie comme décrit à la section 6 de ce protocole. Nommez cette surface « Surface du foie ».
- Créez un masque pour le signal des cellules endothéliales à l’intérieur du foie. Cliquez sur la surface et sous l’onglet d’édition (le crayon), choisissez Masquer tout. Dans la fenêtre qui apparaît, choisissez le canal des cellules endothéliales pour isoler les signaux des vaisseaux uniquement du foie. Choisissez Définir les voxels extérieurs de la surface sur 0 et cochez l’option Dupliquer le canal avant d’appliquer Masque.
- Renommez les nouvelles cellules endothéliales canal masqué en Vascularisation du foie.
- Pour mesurer le volume et la surface du navire, créez une deuxième surface. Cliquez sur le bouton bleu Ajouter de nouvelles surfaces . Dans la première étape de la création de surface, assurez-vous que toutes les options sont désélectionnées pour créer automatiquement une surface.
- Dans la deuxième étape, choisissez le canal vasculaire du foie pour créer une surface. Désélectionnez l’option de lissage pour détecter autant de détails que possible des navires et activer la soustraction d’arrière-plan dans l’option de seuillage.
- Ajustez le seuillage en vous assurant que la surface détectée colocalise avec le signal vasculaire hépatique. Utilisez les valeurs de surface et de volume du menu Analyse statistique. Calculez l’indice de densité des navires à l’aide des équations suivantes :
Indice de densité des vaisseaux (par foie μm 2) = (surface des vaisseaux (μm 2)) / (surface hépatique (μm2))
Indice de densité des vaisseaux (par le foie μm 3) = (Volume des vaisseaux (μm 3)) / (Volume du foie (μm3))
9. Analyse du recrutement des cellules immunitaires.
- Ouvrez le logiciel Fidji. Dans le menu Plugins, sélectionnez Bio-formats suivi de Bio-formats Importer cochez l’option Split channels pour ouvrir le fichier image.
- Dans le menu Image , sélectionnez Propriétés pour vérifier que l’image a la taille de pixel et la profondeur de voxel correctes, sinon les valeurs correctes. Ensuite, allez dans le menu Images , cliquez sur Ajuster suivi de Luminosité et contraste, ajustez la luminosité et le contraste de l’image (par exemple, macrophages - mCherry ou dTomate; neutrophiles - BFP; lymphocytes T - EGFP; hépatocytes - EGFP ou mCherry).
- Ensuite, créez des projections d’intensité maximale sur chaque canal.
- Comme décrit à la section 6 (étapes 6.9-6.12), créer un retour sur investissement entourant le foie larvaire et mesurer la surface du foie. Créer un deuxième retour sur investissement incluant la zone hépatique et la zone environnante de 75 μm (« zone de recrutement »).
- Ensuite, dans le menu Edition , sélectionnez l’option Sélection suivie de Ajouter au gestionnaire. En sélectionnant une projection d’intensité maximale du canal cellulaire immunitaire inné, cliquez sur le retour sur investissement du foie dans la fenêtre ROI Manager pour définir la zone de recrutement.
- Dans le menu Plugins, sélectionnez l’option Analyser suivie de Compteur de cellules et comptez les cellules immunitaires dans la zone de recrutement. Enregistrer le nombre de cellules immunitaires recrutées dans la région du foie sur une feuille de calcul.
- Calculer les densités des neutrophiles, des macrophages et des lymphocytes T en normalisant le nombre de cellules immunitaires par région hépatique.
Résultats
En introduisant un régime riche en cholestérol à court terme dans un modèle de poisson zèbre de carcinome hépatocellulaire (CHC), qui surexprime une forme constitutivement active spécifique aux hépatocytes de bêta-caténine (s704Tg; Tg(fabp10a:pt-B-cat, cryaa:Venus)17, nous sommes en mesure de créer un modèle de CMC associé à la NASH chez les vertébrés non-mammifères. La progression de la maladie hépatique peut être surveillée tôt en mesurant la stéatose hépatique, la taille du foie, l’hépatocytes, la morphologie nucléaire, l’angiogenèse et l’infiltration des cellules immunitaires (Figure 1).
Les larves de CHC nourries avec un régime alimentaire normal ne présentent aucune stéatose hépatique légère, mesurée par coloration Oil Red O. Cependant, les larves de CHC nourries avec un régime riche en cholestérol montrent une augmentation significative de la stéatose hépatique (Figure 2).
Un marqueur bien connu de la maladie du foie est l’hépatomégalie17. Pour évaluer la taille du foie, les larves de CHC peuvent être croisées avec une lignée transgénique exprimant spécifiquement un marqueur fluorescent sur les hépatocytes, tel que le Tg (fabp10a: H2BmCherry). Pour évaluer l’hépatomégalie, une évaluation de la zone hépatique (2D), de la surface hépatique et du volume hépatique (3D) est effectuée. Après 8 jours d’exposition à un surplus de cholestérol, une hypertrophie hépatique a été observée chez les larves de CHC (Figure 3).
En utilisant l’imagerie vivante non invasive, des lignées de poissons transgéniques exprimant des protéines fluorescentes dans les membranes des hépatocytes (telles que Tg(fabp10a: Life-actin-EGFPP) et dans les noyaux d’hépatocytes (tels que Tg(Fabp10a: H2B-mCherry) peuvent être utilisées pour évaluer les altérations de la morphologie cellulaire et nucléaire associées à la malignité des hépatocytes. La surface hépatocytaire a été augmentée dans le HCC associé à la NASH (Figure 4A,B,D), ainsi que dans la zone nucléaire (Figure 4C,E) et le rapport nucléaire:cytoplasmique (Figure 4F). Une diminution significative de la circularité nucléaire a également été observée dans le groupe HCD+HCC (Figure 4G). La lipotoxicité déclenche des dommages à l’ADN, une caractéristique de la cancérogenèse en présence de micronoyaux. En utilisant le marqueur H2B-mCherry, nous avons observé une plus grande incidence de micronoyaux chez les larves de CHC nourries avec un régime riche en cholestérol (Figure 4H).
Le système vasculaire hépatique peut facilement être évalué dans des modèles de poisson zèbre à l’aide d’une ligne marquée transgénique, telle que Tg (kdrl:mCherry ou Tg(fli:EGFP), qui marquent le système vasculaire. Une augmentation significative de la densité des vaisseaux a été observée chez les larves HCC+HCD (figure 5).
Pour observer la réponse inflammatoire déclenchée au début du CHC associé à la NASH, une lignée de poissons transgéniques exprimant des protéines fluorescentes dans les macrophages et les neutrophiles, telles que Tg(mfap4:tdTomato-CAAX; lyz:BFP), a été croisée avec la lignée transgénique HCC. L’infiltration des neutrophiles et des macrophages se produit dans le CHC et le HCC nourris avec HCD, ce qui a été évalué par quantification du nombre et de la densité des neutrophiles/macrophages dans le foie et les environs (zone environnante jusqu’à 75 μm) (Figure 6A-H). Néanmoins, le HCC+HCD a montré une augmentation significative du nombre et de la densité des neutrophiles (figures 6F-H). 13 jours après la fécondation, le système immunitaire adaptatif est déjà fonctionnel. Utilisation d’une lignée de poissons transgéniques exprimant une protéine fluorescente dans des cellules T, telles que Tg(lck: EGFP), et en combinaison avec la lignée transgénique HCC; nous avons évalué l’impact du surplus de cholestérol sur le recrutement des lymphocytes T dans le foie. Une diminution significative de la densité et du nombre total de lymphocytes T a été observée chez les larves de CHC nourries avec HCD (Figure 6I-K).
| Lignées de poisson-zèbre transgénique | Référence ZFIN | Test |
| Casper | RoyA9; MitfaW2 | Osis de stéatose hépatique |
| Tg(fabp10a:pt-β-catenin_cryaa:Vénus / fabp10a:H2B-mCherry ) | s704Tg / uwm41Tg | Morphologie du foie |
| Tg(fabp10a:pt-β-catenin_cryaa:Vénus; fabp10a:H2B-mCherry; fabp10a:LIFEACT-EGFP) | s704Tg / uwm41Tg / uwm42Tg | Hépatocytes et morphologie nucléaire |
| Tg(fabp10a:pt-β-catenin_ cryaa:Vénus; fli:EGFP) | s704Tg / y1Tg | Angiogenèse |
| Tg(fabp10a:pt-β-catenin_cryaa:Vénus; mfap4:Tomate-CAAX; lyzC:BFP) | s704Tg / xt6Tg / zf2171Tg | Recrutement de macrophages et de neutrophiles |
| Tg(fabp10a:pt-β-catenin_cryaa:Vénus; lck:EGFP) | s704Tg / cz1Tg | Recrutement de lymphocytes T |
Tableau 1 : Lignées de poissons-zèbres transgéniques à utiliser dans différents essais.
| Nombre de larves | Taille de la boîte d’alimentation | Quantité de nourriture par jour (mg) | Volume E3 (ml) |
| 30-40 | Petit bac d’élevage | 3-4 | 200 |
| 60-80 | Petite/Grande boîte d’élevage | 6-8 | 400 |
| 100-150 | Grand bac d’élevage | 10-15 | 500 |
Tableau 2 : Configurer les conditions des boîtes d’alimentation.
| Phénotype | Méthode de notation |
| Aucun | Noyaux normaux, pas de micronoyaux ou de hernie |
| Douleur légère | Faible nombre de micronoyaux (moins de 5 par champ de vision) et/ou hernie |
| Modérée/sévère | Nombre modéré à élevé de micronoyaux (plus de 5 par champ de vision) et/ou hernie |
Tableau 3 : Score des micronoyaux et des hernies nucléaires.
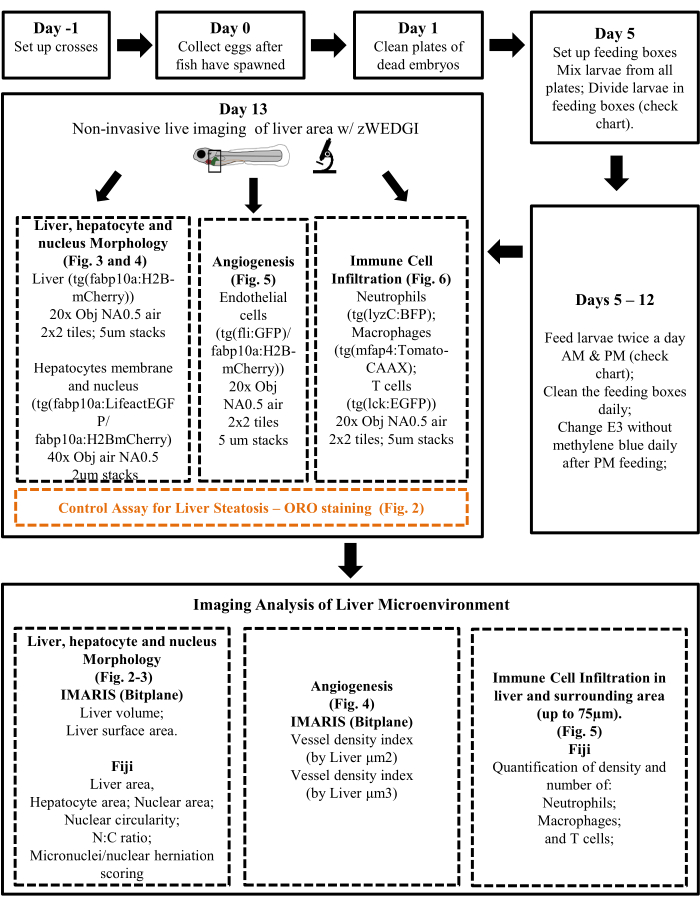
Figure 1 : Diagramme de protocole résumant les principales étapes expérimentales et l’approche d’analyse. Veuillez cliquer ici pour voir une version agrandie de cette figure.
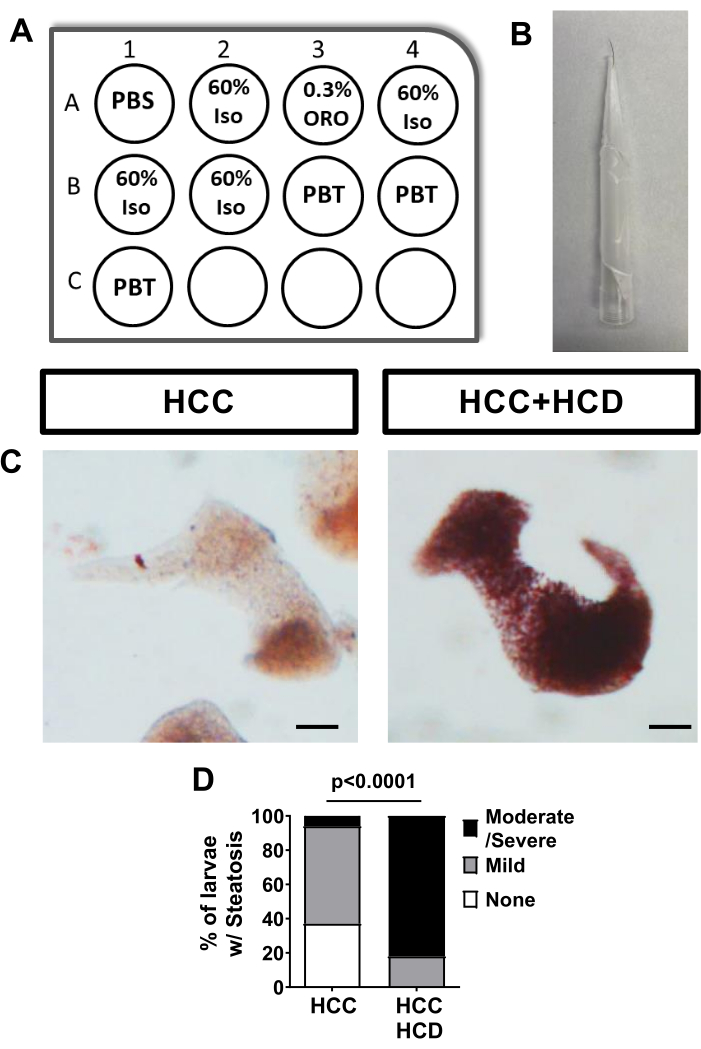
Figure 2 : Essai de contrôle pour la stéatose hépatique - coloration ORO. Les larves de CHC ont été nourries avec un régime alimentaire normal ou riche en cholestérol et une coloration Oil Red O (ORO) a été effectuée pour évaluer la stéatose hépatique. (A) Schéma de la plaque de 12 puits pour effectuer une coloration ORO séquentielle à l’aide des inserts de puits en maille. (B) Image d’un outil de cils utilisé pour manipuler les larves. (C) Images représentatives de foies colorés au rouge huile; Larves HCC et HCC+HCD. (D) Graphique du chi carré montrant le pourcentage de larves présentant différents scores de stéatose hépatique. Barre d’échelle = 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
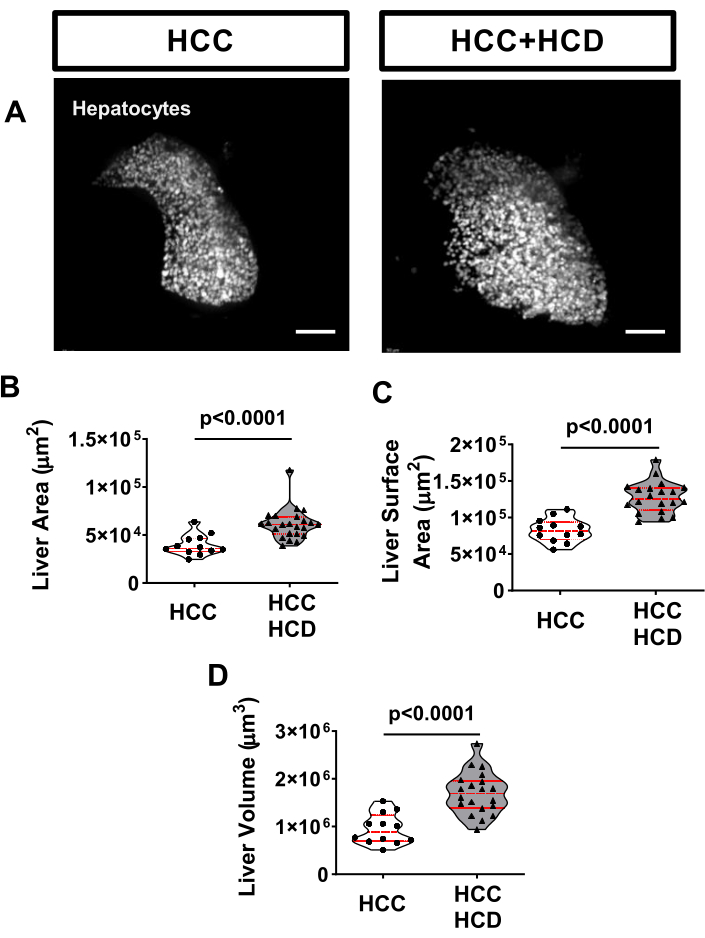
Figure 3 : Images représentatives de la taille du foie. Des larves transgéniques de CHC exprimant un marqueur hépatique (Tg(fabp10a:H2B-mCherry)) ont été imagées en direct et de manière non invasive sur un microscope confocale à disque rotatif inversé à l’aide d’un zWEDGI. (A) Reconstitutions 3D représentatives du foie chez les larves HCC et HCC+HCD. (B-D) Graphique montrant les altérations morphologiques du foie, y compris la surface hépatique (B), la surface hépatique (C) et le volume hépatique (D) chez les larves CHC et HCC + HCD. Barre d’échelle = 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
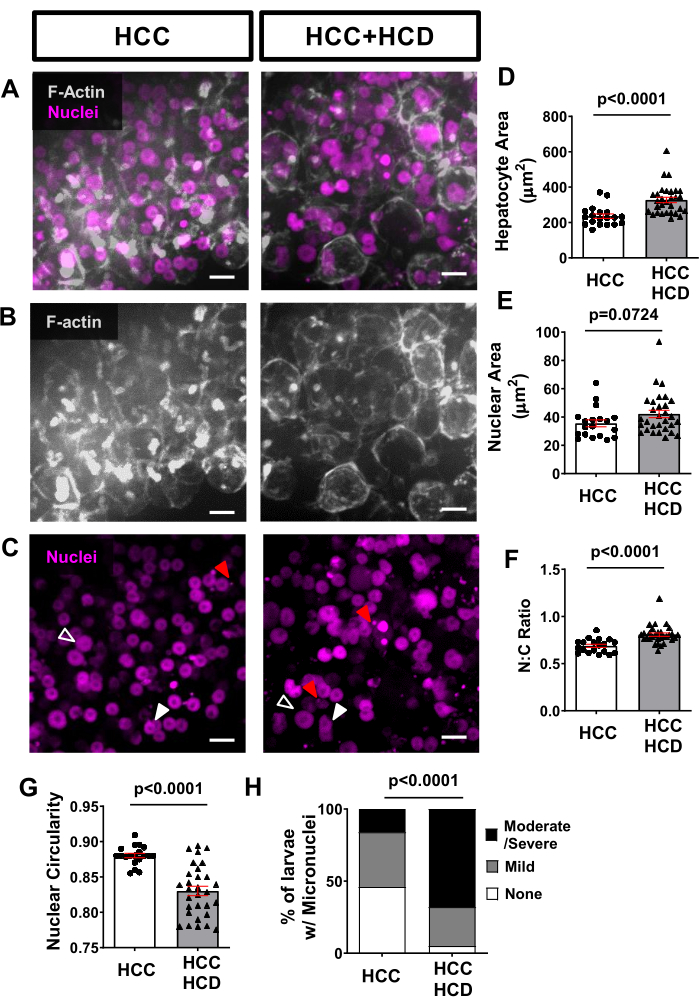
Figure 4 : Images représentatives de la morphologie des hépatocytes et des noyaux. Des lignées transgéniques de CHC exprimant des protéines fluorescentes dans les membranes hépatocytes (Tg(fabp10a:Life-actin-EGFP) et dans les noyaux d’hépatocytes (Tg(fabp10a:H2B-mCherry) ont été imagées. (A-C) Reconstructions 3D représentatives des noyaux F-actine et hépatocytes des larves HCC et HCC+HCD. Les pointes de flèches ouvertes montrent des noyaux élargis; les pointes de flèches blanches montrent un noyau avec une forme modifiée; et les flèches rouges montrent des micronoyaux et une hernie nucléaire. (D-G) Graphiques montrant les moyennes des paramètres cellulaires et nucléaires chez les larves de HCC et HCC+HCD âgées de 13 jours. (D) Zone des hépatocytes. e) Domaine nucléaire. (F) Rapport nucléaire/cytoplasme. G) Circularité nucléaire. Chaque point représente des moyennes par larve. Les diagrammes à points montrent des graphiques ± chi carrés moyens MEB (H) montrant le pourcentage de larves avec un score différent des micronoyaux et de la hernie nucléaire. Barre d’échelle = 10 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
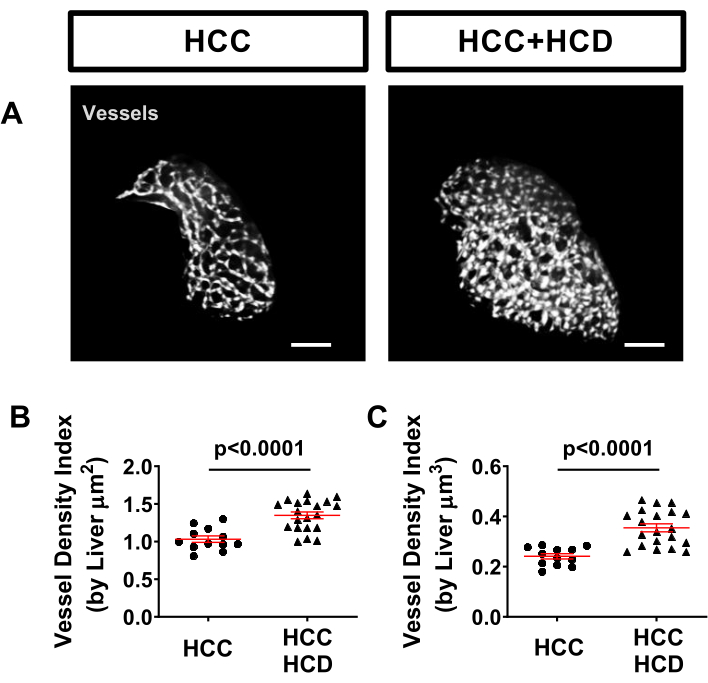
Figure 5 : Images représentatives du système vasculaire hépatique. Lignées transgéniques de CHC exprimant des protéines fluorescentes dans des noyaux d’hépatocytes (Tg(Fabp10a:H2B-mCherry) et dans des cellules endothéliales (Tg)fli:EGFP)). (A) Reconstructions 3D représentatives du système vasculaire hépatique chez les larves HCC et HCC+HCD. (B-C) Graphique montrant l’indice de densité des vaisseaux par surface hépatique (B) volume (C) chez les larves de CHC et de HCC+HFCD. Les diagrammes à points montrent la moyenne ±SEM. Barre d’échelle = 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
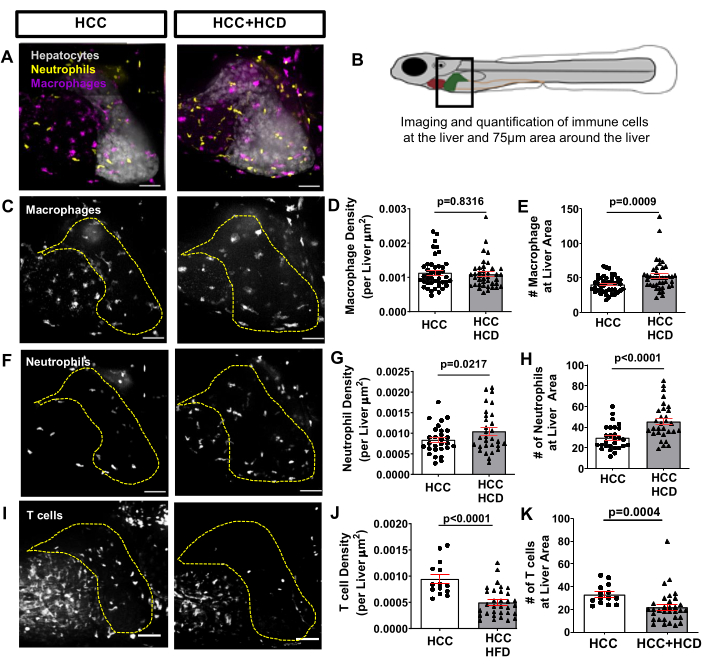
Figure 6 : Images représentatives du paysage des cellules immunitaires du foie. Lignée transgénique de CHC exprimant des protéines fluorescentes dans les macrophages et les neutrophiles (Tg(mfap4:tdTomato-CAAX; lyz:BFP) ou dans les lymphocytes T (Tg(lck-EGFP). (A, C, F) Reconstitutions 3D représentatives du foie et du recrutement leucocytaire dans la région hépatique chez des larves de CHC et HCC+HCD âgées de 13 jours. (B) Schéma de la zone hépatique imagée. (D-E) Graphique montrant la densité et le nombre de macrophages (D) dans la région hépatique chez les larves de CHC et de HCC + HCD. (G-H) Graphique montrant la densité et le nombre de neutrophiles (G) dans la région du foie chez les larves de CHC et de HCC + HCD. (G) Reconstructions 3D représentatives du recrutement des lymphocytes T dans la zone hépatique chez les larves CHC et HCC+HCD. (H-I) Graphique montrant la densité et le nombre de lymphocytes T (H) dans la région hépatique chez les larves de CHC et de HCC+HCD. Les diagrammes à points montrent la moyenne ±SEM. Barre d’échelle = 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau supplémentaire 1 : Tableau des tampons et solutions Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Avec une incidence accrue de CHC, en particulier de HCC induit par la NASH, il est très important de disposer de modèles plus efficaces pour étudier les mécanismes cellulaires et moléculaires impliqués dans le CHC associé à la NASH. La déconvolution des interactions cellule-cellule au niveau du foie est cruciale pour mieux comprendre la progression de la maladie hépatique et l’hépatocarcinogenèse. L’approche décrite dans ce protocole offre un moyen unique d’analyser la progression de la maladie hépatique in vivo et de manière non invasive.
La préparation du régime alimentaire est essentielle au succès de l’établissement d’un modèle de CHC associé à la NASH. Il est important de laisser l’éther diéthylique s’évaporer complètement à l’intérieur de la hotte pour éviter les effets nocifs, tout en préparant les régimes pour le poisson zèbre. Pour utiliser ces régimes avec des larves (5-12 jours après la fécondation), il est extrêmement important de broyer les régimes en particules fines pour assurer l’apport alimentaire par les larves. L’utilisation d’analogues d’acides gras marqués par fluorescence peut être utilisée pour évaluer l’apport alimentaire chez les larves.
Avant de placer les larves dans les boîtes de reproduction et de commencer la procédure d’alimentation, il est crucial de s’assurer que l’échantillonnage expérimental est uniformisé en mélangeant les larves de différentes plaques. Cette étape est importante car différents microenvironnements, à partir du jour 0, sont favorisés dans chacune des plaques et peuvent affecter la réponse inflammatoire.
Une autre étape importante consiste à compter les larves, pour savoir combien de nourriture est nécessaire pour chaque boîte d’alimentation. Si la quantité de nourriture n’est pas suffisante pour le nombre de larves présentes dans chaque boîte, l’un des deux scénarios se produira : 1) les larves seront sous-alimentées; 2) les larves seront suralimentées. Une alimentation inexacte conduira à des conditions malsaines associées à la malnutrition ou à la surnutrition, telles que l’inflammation, ce qui affectera considérablement le microenvironnement hépatique. Si une alimentation inexacte se produit, les larves présenteront des problèmes de mouvement. À ce stade de développement, les larves doivent nager intensivement, donc si des problèmes de mouvement sont remarqués, les larves ont été élevées dans des conditions malsaines (malnutrition ou exposition à des doses toxiques de cholestérol dues à une suralimentation). Pour cette raison, les procédures d’alimentation doivent être étroitement contrôlées pour les deux régimes, normaux et enrichis en cholestérol. Certains tests peuvent être effectués pour traiter rapidement de la précision de l’alimentation et de la santé des larves, y compris la présence d’hépatomégalie (taille du foie) et l’inflammation des tissus et des organes, en particulier le foie et l’intestin (infiltration accrue visible des neutrophiles et des macrophages).
Le nettoyage quotidien et le remplacement de 95% de l’E3 sont essentiels pour réduire la croissance des micro-organismes dans les boîtes d’alimentation et améliorer la santé et la survie des larves. Alternativement, les larves peuvent être placées dans un système de rack autonome. Pour de meilleurs résultats, placez 60 à 80 larves dans un réservoir de 3 litres. Maintenez le débit d’eau au minimum en ajustant le débit à un mode d’égouttement rapide et en nourrissant les larves 3-4 mg deux fois par jour (AM et PM). Le débit d’eau doit être vérifié régulièrement pour assurer un débit correct dans chaque réservoir. Dans notre laboratoire, cette méthode nous donne une survie de 95 à 100% avec une alimentation à court terme de 10% de HCD. De plus, cette méthode a considérablement réduit la charge de travail inhérente au nettoyage quotidien et à l’échange d’eau nécessaires dans le protocole d’alimentation statique décrit.
Alors que nous avons utilisé un régime enrichi en cholestérol à 10% pour induire la NASH dans une exposition à court terme (5 jours suffisent pour induire une stéatohépatite), des modifications du régime alimentaire peuvent être effectuées et étendues pour utiliser du fructose 18, des acides gras (tels que l’acide palmitique)19 ou des protocoles d’alimentation qui peuvent être étendus en utilisant un régime enrichi en cholestérol à 4%20. Actuellement, il existe peu de cibles thérapeutiques réussies pour le CHC et aucune pour la NASH. L’utilisation de modèles de poisson-zèbre offre une occasion unique d’élargir nos connaissances sur l’hépatocérogenèse mais aussi un système de vertébrés inégalé pour effectuer des criblages de médicaments à haut débit. Les techniques décrites dans ce protocole faciliteront les découvertes futures et les cibles thérapeutiques pour les maladies du foie et l’hépatocarcinogenèse.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
L’auteur tient à remercier Clinton DePaolo et Spartak Kalinin, techniciens de l’Albert Einstein College of Medicine Zebrafish Core Facility, pour leur assistance et leur entretien de nos lignées de poissons zèbres. FJMN est soutenu par le Cancer Research Institute et la Fibrolamellar Cancer Foundation.
matériels
| Name | Company | Catalog Number | Comments |
| Cholesterol | Sigma | C8667-25G | Easily degraded. Store -20°C. |
| Corning Netwells carrier kit 15 mm | Fisher | 07-200-223 | |
| Corning Netwells inserts | Fisher | 07-200-212 | |
| Diethyl ether | Fisher | 60-046-380 | Highly Volatile. |
| Dumont forceps #55 dumostar | Fisher | NC9504088 | |
| Fisherbrand Pasteur Pipets 5.75in | Fisher | 22-183624 | |
| 4% paraformaldehyde (PFA) | Electron Microscopy Science | 15710 | |
| Golden Pearl Diet 5–50 nm Active Spheres | Brine Shrimp Direct | - | Any commercial dry powder food for larvae can be used. |
| Graduated Transfer Pipets | Fisher | 22-170-404 | |
| Isopropanol | Fisher | BP26181 | |
| PBS, pH7.4, 10X, 10 Pack | Crystalgen | 221-1422-10 | |
| Petri Dishes 100X20MM | Fisher | 08-747D | |
| Tricaine | Sigma | A-5040 | |
| Tween 20 | Fisher | BP337-500 | |
| Oil Red O solution 0.5% isopropanol | Sigma | O1391-500ML | |
| Tricaine | Sigma | A-5040 | |
| Tween 20 | Fisher | BP337-500 | |
| Vactrap | VWR | 76207-630 | Vacuum system for larvae collection |
| Microscopes | |||
| Fluorescent Stereomicroscope | Leica | M205 FCA THUNDER Imager Model Organism Large | |
| Spinning Disk Confocal Microscope | Nikon | Nikon CSU-W1 | |
| Stereomicroscope | Leica | S9i with transilluminated base | |
| Software | |||
| Fiji | Open-source Java image processing program. | ||
| Imaris 9.6 | Bitplane; Oxford Instruments. |
Références
- Pocha, C., Kolly, P., Dufour, J. F. Nonalcoholic Fatty Liver Disease-Related Hepatocellular Carcinoma: A Problem of Growing Magnitude. Seminals in Liver Disease. 35 (3), 304-317 (2015).
- El-Serag, H. B., Kanwal, F. Epidemiology of hepatocellular carcinoma in the United States: where are we? Where do we go. Hepatology. 60 (5), 1767-1775 (2014).
- Estes, C., et al. Modeling NAFLD disease burden in China, France, Germany, Italy, Japan, Spain, United Kingdom, and United States for the period 2016-2030. Journal of Hepatology. 69 (4), 896-904 (2018).
- Estes, C., Razavi, H., Loomba, R., Younossi, Z., Sanyal, A. J. Modeling the epidemic of nonalcoholic fatty liver disease demonstrates an exponential increase in burden of disease. Hepatology. 67 (1), 123-133 (2018).
- Meli, R., Mattace Raso, G., Calignano, A. Role of innate immune response in non-alcoholic Fatty liver disease: metabolic complications and therapeutic tools. Frontiers in Immunology. 5, 177 (2014).
- Ganz, M., et al. Progression of non-alcoholic steatosis to steatohepatitis and fibrosis parallels cumulative accumulation of danger signals that promote inflammation and liver tumors in a high fat-cholesterol-sugar diet model in mice. Journal of Translational Medicine. 13, 193 (2015).
- Ma, C., et al. NAFLD causes selective CD4(+) T lymphocyte loss and promotes hepatocarcinogenesis. Nature. 531 (7593), 253-257 (2016).
- Reimer, K. C., Wree, A., Roderburg, C., Tacke, F. New drugs for NAFLD: lessons from basic models to the clinic. Hepatology International. 14 (1), 8-23 (2020).
- Wrighton, P. J., Oderberg, I. M., Goessling, W. There is something fishy about liver cancer: Zebrafish models of hepatocellular carcinoma. Cellular and Molecular Gastroenterology and Hepatology. 8 (3), 347-363 (2019).
- Goessling, W., Sadler, K. C. Zebrafish: An important tool for liver disease research. Gastroenterology. 149 (6), 1361-1377 (2015).
- Huo, X., et al. Transcriptomic profiles of tumor-associated neutrophils reveal prominent roles in enhancing angiogenesis in liver tumorigenesis in zebrafish. Science Reports. 9 (1), 1509 (2019).
- Yan, C., Yang, Q., Gong, Z. Tumor-associated neutrophils and macrophages promote gender disparity in hepatocellular carcinoma in zebrafish. Cancer Research. 77 (6), 1395-1407 (2017).
- Capece, D., et al. The inflammatory microenvironment in hepatocellular carcinoma: A pivotal role for tumor-associated macrophages. Biomed Research International. 2013, 187204 (2013).
- de Oliveira, S., et al. Metformin modulates innate immune-mediated inflammation and early progression of NAFLD-associated hepatocellular carcinoma in zebrafish. Journal of Hepatology. 70 (4), 710-721 (2019).
- Huemer, K., et al. Long-term live imaging device for improved experimental manipulation of zebrafish larvae. Journal of Visualized Experiments. (128), e56340 (2017).
- Huemer, K., et al. zWEDGI: Wounding and entrapment device for imaging live zebrafish larvae. Zebrafish. 14 (1), 42-50 (2017).
- Evason, K. J., et al. Identification of chemical inhibitors of beta-catenin-driven liver tumorigenesis in zebrafish. PLoS Genetics. 11 (7), 1005305 (2015).
- Sapp, V., Gaffney, L., EauClaire, S. F., Matthews, R. P. Fructose leads to hepatic steatosis in zebrafish that is reversed by mechanistic target of rapamycin (mTOR) inhibition. Hepatology. 60 (5), 1581-1592 (2014).
- Park, K. H., Ye, Z. W., Zhang, J., Kim, S. H. Palmitic acid-enriched diet induces hepatic steatosis and injury in adult zebrafish. Zebrafish. 16 (6), 497-504 (2019).
- Progatzky, F., et al. Dietary cholesterol directly induces acute inflammasome-dependent intestinal inflammation. Nature Communication. 5, 5864 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon