Method Article
Análisis del microambiente hepático durante la progresión temprana del carcinoma hepatocelular asociado a la enfermedad del hígado graso no alcohólico en pez cebra
En este artículo
Resumen
Aquí, presentamos cómo generar un modelo de pez cebra de carcinoma hepatocelular (HCC) asociado a la enfermedad del hígado graso no alcohólico (NAFLD) para estudiar el impacto del excedente de colesterol en el microambiente hepático y el paisaje de las células inmunes.
Resumen
El cáncer de hígado es actualmente la tercera causa principal de muerte relacionada con el cáncer en todo el mundo, y el carcinoma hepatocelular (CHC) representa el 75-90% de todos los casos de cáncer de hígado. Con la introducción de tratamientos efectivos para prevenir y tratar la hepatitis B / C, la enfermedad del hígado graso no alcohólico (NAFLD) y la forma más agresiva conocida como esteatohepatitis no alcohólica (NASH), se están convirtiendo rápidamente en los factores de riesgo número uno para desarrollar CHC en las sociedades modernas. Para comprender mejor el papel que tiene NASH en el desarrollo de HCC, diseñamos un pez cebra HCC asociado a NASH. La claridad óptica y la trazabilidad genética de las larvas de pez cebra las convierten en un modelo atractivo y poderoso para estudiar el microambiente hepático y la composición de las células inmunes utilizando imágenes fluorescentes no invasivas en vivo. Este protocolo describe cómo utilizar un modelo de pez cebra HCC asociado a NASH para investigar el efecto del excedente de colesterol en el microambiente hepático y su impacto en la composición de las células inmunes en las primeras etapas de la enfermedad. Primero, alimentamos larvas de HCC (s704Tg), que expresan beta-catenina activada específica para hepatocitos, con una dieta alta en colesterol al 10% durante 8 días para desarrollar un modelo de HCC asociado a NASH. Aquí describimos cómo hacer uso de diferentes líneas transgénicas para evaluar varias características de malignidad temprana en el hígado mediante microscopía confocal no invasiva, como el área hepática, la célula y la morfología nuclear (área de hepatocitos, área nuclear, relación nuclear: citoplasma (relación N: C), circularidad nuclear, puntuación de micronúcleos / hernia nuclear) y angiogénesis. Luego, utilizando líneas transgénicas con células inmunes marcadas (neutrófilos, macrófagos y células T) mostramos cómo analizar la composición de las células inmunes hepáticas en larvas de HCC asociadas a NASH. Las técnicas descritas son útiles para evaluar el microambiente hepático y la composición de las células inmunes en etapas tempranas de hepatocarcinogénesis, pero también pueden modificarse para estudiar tales características en otros modelos de enfermedad hepática.
Introducción
El carcinoma hepatocelular (CHC) es un cáncer agresivo con opciones terapéuticas limitadas. Se ha encontrado que más del 30% de todos los pacientes con CHC son obesos y tienen NASH, una forma agresiva de NAFLD 1,2,3,4. El consumo de dietas ricas en calorías aumenta drásticamente la disponibilidad de ácidos grasos que causan cambios metabólicos locales y sistémicos y desencadenan esteatosis, lesión de hepatocitos, inflamación y fibrosis, todas características clave de NASH. La progresión de NASH a HCC implica la acumulación de lípidos en el hígado, lo que desencadena inflamación y alteración de la composición de las células inmunes 5,6,7. Es de particular interés e importancia comprender cómo el microambiente hepático y el paisaje de células inmunes se alteran durante la progresión de la enfermedad hepática, y cómo cambia debido a ciertos factores etiológicos. Para identificar mejor el impacto que el excedente de colesterol tiene en el microambiente hepático y el paisaje de las células inmunes, hemos desarrollado un modelo único de pez cebra de HCC asociado a NASH. El uso de este modelo nos ha dado una mejor comprensión del impacto de la dieta y la sobrenutrición en el microambiente hepático y la progresión de la enfermedad hepática.
Los modelos de mamíferos, como ratones y muestras de tejido humano, han sido esenciales para comprender la patogénesis de la esteatohepatitis y la esteatosis8. Los ratones son el modelo preferido para la enfermedad hepática y el cáncer, pero carecen de claridad óptica a nivel celular, mientras que las muestras de tejido humano a menudo carecen del entorno 3D que los modelos animales pueden imitar. Estos obstáculos han hecho del pez cebra un modelo poderoso en la comunidad de investigación. El pez cebra tiene similitudes notables con los humanos, con al menos un 70% de conservación de genes. Mantienen el microambiente hepático, la composición celular hepática, la función, la señalización y la respuesta a las lesiones 9,10. Usando una dieta alta en colesterol (HCD) en combinación con un modelo establecido de HCC de pez cebra transgénico, hemos desarrollado un modelo de pez cebra de HCC asociado a NASH.
Aquí presentamos un protocolo que explica cómo generar un modelo de pez cebra HCC asociado a NASH y cómo estudiar el microambiente hepático y abordar las características de malignidad temprana in vivo. Utilizando microscopía confocal no invasiva en combinación con líneas transgénicas de pez cebra con membrana y núcleo de hepatocitos marcados con fluorescencia, podemos abordar las características de malignidad temprana mediante el análisis de la morfología hepática (área, volumen y área de superficie), morfología celular y nuclear (área de hepatocitos, área nuclear, relación N: C, circularidad nuclear, puntuación de micronúcleos / hernia nuclear) y angiogénesis (densidad de vasos). El microambiente de las células inmunes también es una característica importante de la hepatocarcinogénesis11,12,13,14, por lo tanto, también mostramos cómo analizar la composición de las células inmunes hepáticas en larvas de HCC asociadas a NASH, utilizando líneas transgénicas de pez cebra con células inmunes marcadas (neutrófilos, macrófagos y células T). Las técnicas descritas son exclusivas del modelo y extremadamente útiles para evaluar el microambiente hepático y la composición de las células inmunes en la progresión de la enfermedad hepática.
Protocolo
Los estudios en animales se llevan a cabo siguiendo procedimientos aprobados por el comité institucional de cuidado y uso de animales (IACUC) de Albert Einstein College of Medicine. Para obtener recetas de tampones y soluciones utilizadas en el protocolo, consulte la Tabla suplementaria 1.
1. Preparación de una dieta enriquecida con colesterol al 10% para el excedente agudo de colesterol.
- Pese 2 x 4 g de Golden Pearl Diet 5-50 nm Active Spheres (GPAS) en dos vasos de vidrio de 25 ml, uno para la dieta normal (ND) y el otro para la dieta alta en colesterol al 10% (HCD).
NOTA: Se puede utilizar cualquier dieta comercial de alimentos secos para larvas de pez cebra. - Pesar 0,4 g de colesterol en un vaso de precipitados de vidrio de 10 ml. Cubra el vaso de precipitados con un poco de papel de aluminio.
- Mida 5 ml de éter dietílico con una jeringa de 10 ml con una aguja de 20 g. A continuación, agregue el éter dietílico al vaso de precipitados ND e inmediatamente mézclelo con el alimento seco con una espátula.
PRECAUCIÓN: El éter dietílico causa irritación de los ojos, la piel y el tracto respiratorio. Usar solo en una campana extractora de humos químicos. - Mida de nuevo 5 ml de éter dietílico con una jeringa de 10 ml con una aguja de 20 g y agréguelo al vaso de precipitados de 10 ml con colesterol, mezcle inmediatamente aspirando hacia arriba y hacia abajo con la jeringa.
- Agregue rápidamente la solución de colesterol al vaso de precipitados HCD e inmediatamente mézclela con una espátula hasta que la solución esté uniforme.
- Deje los vasos de precipitados en la capucha durante un máximo de 24 h para evaporar completamente el éter dietílico. Al día siguiente, muele las dietas GPAS en partículas finas usando un mortero.
NOTA: Moler las dietas es un paso crucial, las larvas no podrán comer partículas mayores de 50 nm. - Transfiera cada dieta a una pequeña bolsa de plástico etiquetada o a un tubo de centrífuga de 50 ml y guárdela a -20 °C.
2. Inducción de NASH con larvas a corto plazo alimentándose con dieta enriquecida con colesterol - condiciones estáticas.
- Establecer líneas de peces transgénicos el día -1 (Tabla 1). A la mañana siguiente (Día 0), después de que los peces hayan desovado, recolecte los huevos en un colador de malla.
- Usando una botella de lavado con agua embrionaria (E3), enjuague bien los huevos y transfiera cuidadosamente los huevos a placas de Petri de 10 cm con medio E3.
- Limpie las placas de todos los desechos que puedan haberse acumulado en las cajas de reproducción, incluidos los huevos muertos o no fertilizados.
NOTA: Enjuagar los huevos y limpiar las placas es crucial para evitar el crecimiento incontrolado de microorganismos y los consiguientes defectos en el desarrollo de las larvas. - Dividir los huevos en una densidad de 70/80 por placas de Petri de 10 cm (en 25 mL de E3). En el día 1, bajo un alcance de disección equipado con una base de transiluminación, verifique y limpie embriones muertos o embriones con defectos de desarrollo.
NOTA: Utilice el modo de campo oscuro de base de transiluminación para identificar embriones con efectos de desarrollo y para verificar el crecimiento de microorganismos en las placas. Diferentes instalaciones tienen diferentes rendimientos de microorganismos en sus sistemas. Cambie el medio E3 y / o platos si es necesario, para evitar efectos negativos. - En el día 5, combine las larvas de todos los platos en una placa de Petri de 15 cm, agregue E3 sin azul de metileno. A continuación, divida las larvas en las cajas de alimentación de la siguiente manera (Tabla 2).
NOTA: En condiciones de control, para generar larvas sanas sin desencadenar inflamación crónica sistémica, las larvas deben ser alimentadas con alrededor de 0,1 mg de alimento por larva por día. Observe que la cantidad total de alimentos (Tabla 2) se divide en partes iguales en dos comidas por día. - Mantener las larvas en una incubadora a 28 °C, en un ciclo de luz oscura (por ejemplo, 14 h de luz/10 h de oscuro), y alimentar a las larvas dos veces al día desde el día 5 hasta el día 12.
- Aspire diariamente cualquier residuo de alimentos, así como el 90-95% del medio utilizando un sistema de vacío conectado a una punta de pipeta de 1 ml. A continuación, vierta cuidadosamente el nuevo E3 sin azul de metileno en una esquina de la caja de alimentación para evitar dañar las larvas.
NOTA: La limpieza diaria de las cajas de alimentación es crucial para evitar el crecimiento descontrolado de microorganismos.
3. Recolección de larvas de 13 días después de la fertilización de cajas de alimentación.
- En el día 13, prepare platos de recolección de acuerdo con la cantidad de condiciones experimentales que se establecieron. Con un rotulador permanente, haga una marca en el costado de los platos (tapa e inferior) para evitar cambiar las muestras, por ejemplo, una franja negra para la dieta normal (ND) y dos rayas negras para HCD.
- Vierta suficiente E3 sin azul de metileno para cubrir el fondo de cada plato. Usando cuidadosamente el sistema de vacío aspirar el agua de las cajas de alimentación, trate de aspirar cualquier residuo o larva muerta del fondo para evitar transferir estos materiales a los platos de recolección.
- Cuando el nivel del agua comience a bajar, levante lentamente la caja de alimentación para hacer que las larvas naden hacia una de las esquinas, luego aspire en la dirección opuesta.
NOTA: Utilice una pipeta de 1 ml con puntas cortadas, a diferentes alturas, para permitir diferentes diámetros al aspirar el agua. Alterne entre los diferentes tamaños, comience con un diámetro más grande y cambie a uno más pequeño a medida que el volumen de agua se reduce y aumenta la densidad de larvas. - Una vez que solo haya alrededor de 20-30 ml de líquido, decanta cuidadosamente las larvas en la placa de Petri de recolección preparada en el Paso 1. Coloque la cinta etiquetada de la caja de alimentación en la tapa del plato.
- Repita los pasos 3.2-3.4 para todas las cajas de alimentación.
4. Ensayo de control para esteatosis hepática inducida por la dieta: tinción, imágenes y puntuación de Oil Red O (ORO).
- Con una pipeta de vidrio Pasteur, transfiera 15-20 larvas a un tubo de fondo redondo de 2 ml y colóquelas en hielo durante unos 15-30 minutos. Retire la mayor parte del medio del tubo.
- Añadir 2 ml de 4% de paraformaldehído (PFA) para fijar las larvas e incubar a 4 °C durante la noche.
- A la mañana siguiente, retire la solución de PFA al 4% y lave las larvas tres veces con 2 ml de 1x PBS.
- Prepare una placa de 12 pocillos (Figura 2A) por condición con un inserto de pozo de malla.
- Usando una pipeta de vidrio, transfiera la larva del tubo de 2 ml al inserto previamente colocado en el pozo, agregue 5 ml de 1x PBS. Guarde los tubos de 2 ml para almacenar la muestra después de la tinción.
PRECAUCIÓN: Las larvas son extremadamente pegajosas en esta etapa, no use pipetas de plástico. - Transfiera el inserto con larvas a otro pocillo con 5 mL de solución de isopropanol al 60%. Incubar las larvas durante 30 min de temperatura ambiente (RT).
- Mientras tanto, prepare un 0.3% de aceite rojo O en una solución de isopropanol al 60%. Filtrar la solución de Oil Red al 0,3% dos veces con un filtro de jeringa de 0,45 μm.
NOTA: Prepare 5 ml de solución por pocillo mezclando 3 ml de aceite rojo al 0,5% en isopropanol con 2 ml de agua destilada. La solución de 0,3% de aceite rojo O en isopropanol al 60% debe estar recién preparada. - A continuación, transfiera el inserto de malla con larvas a otro pocillo con 5 ml de aceite rojo al 0,3% recién hecho en una solución de isopropanol al 60%. Larvas incubadas durante 3 h en RT con balanceo suave.
- Después de la tinción ORO, enjuague las larvas transfiriendo el inserto a otro pocillo con isopropanol al 60%. Lave las larvas dos veces en isopropanol al 60% durante 30 minutos cada vez transfiriendo el inserto secuencialmente a pocillos con isopropanol al 60%.
- Lave las larvas tres veces durante 5 min en 1x PBS-0.1% Tween transfiriendo el inserto secuencialmente a pocillos con 1x PBS-0.1% Tween.
- Transfiera las larvas a los tubos de 2 ml. Retire PBST, agregue 1 ml de glicerol al 80% y guárdelo a 4 °C hasta obtener imágenes.
- Para obtener mejores imágenes, transfiera las larvas a 1x PBS-0.1% Tween y bajo un alcance de disección diseccione los hígados tirando cuidadosamente de los tejidos usando dos pinzas # 55.
NOTA: Si se utiliza una imagen de fondo Casper se puede realizar utilizando las larvas enteras. - Usando una pipeta de vidrio, transfiera cuidadosamente los hígados a un pocillo de una placa puntual de porcelana con 50% de glicerol. Coloque los hígados usando una herramienta pequeña para manipular las larvas (p. ej., herramienta para pestañas- Figura 2B). Imágenes de hígados en un microscopio estereoscópico equipado con una cámara a color.
- Puntuación esteatosis hepática (sin tinción de ORO = ninguna; tinción de ORO de color rojo claro = leve; tinción de ORO rojo-rojo oscuro = moderada/grave).
5. Imágenes confocales no invasivas utilizando el dispositivo de herida y atrapamiento del pez cebra para el crecimiento y la imagen (zWEDGI).
- Prepare una placa de Petri de 10 cm con 15-20 ml de 1x Tricaine-E3, lo suficiente para cubrir el fondo.
NOTA: Se puede obtener una solución de trabajo 1x Tricaine-E3 (0.16 mg/mL) diluyendo 2 mL de una solución madre de Tricaine 25x (4 mg/mL) en 48 mL de E3. La concentración de tricocaína no debe exceder 0.16 mg / ml ya que las larvas son extremadamente sensibles a la anestesia en esta etapa de desarrollo. - Transfiera 15-20 larvas con una pipeta de plástico Pasteur a la placa de Petri que contiene 1x Tricaine-E3 y anestesie las larvas durante 5 min.
- Prepare una placa de 6 pocillos con 2-3 mL de E3 sin azul de metileno por pocillo.
- En un microscopio estereoscópico fluorescente, examinar las larvas anestesiadas para detectar los marcadores fluorescentes deseados (Tabla 1). Transfiera las larvas seleccionadas en la cantidad mínima de tricocaína en E3 y déjelas recuperarse en la placa de 6 pocillos hasta que sea el momento de obtener la imagen.
NOTA: La detección de larvas transgénicas dobles, triples y cuádruples lleva tiempo, coloque las larvas en E3 y cambie los medios de la placa de 6 pocillos a menudo para disminuir la exposición innecesaria a Tricaine. Además, las larvas en esta etapa de desarrollo flotan, así que use una herramienta de pestañas para posicionar las larvas para la detección sin inducir daño tisular. - Después del cribado, prepare una placa de Petri de 10 cm con 25 ml de 1x Tricaine-E3. Transfiera 15-20 larvas con una pipeta de plástico Pasteur a la placa de Petri que contiene 1x Tricaine-E3 y anestesiar las larvas durante 5 min.
- Mientras tanto, bajo el microscopio estereoscópico, agregue 1x tricocaína-E3 en las cámaras del dispositivo de herida y atrapamiento (por ejemplo, zWEDGI)15,16. Retire las burbujas de aire de las cámaras y del túnel de sujeción con una micropipeta P200. Retire todo el exceso de 1x Tricaine-E3 dejando solo el volumen suficiente para llenar las cámaras.
- Transfiera una larva anestesiada a la cámara de carga del zWEDGI y colóquela con una herramienta de pestañas debajo del microscopio estereoscópico. Suavemente, golpee la cabeza de las larvas y empújela para que la cola entre en el túnel de restricción. Además, usando la micropipeta elimine 1x Tricaine-E3 de la cámara de heridas para ayudar a la larva a entrar en el túnel. Asegúrese de que la larva esté colocada adecuadamente para obtener imágenes del lóbulo izquierdo - Microscopio invertido: lado izquierdo hacia abajo; Microscopio vertical: lado izquierdo hacia arriba.
NOTA: Si un zWEDGI no está disponible, los peces se pueden montar y colocar en agarosa de bajo punto de fusión al 1% en 1x Tricaine-E3, sin embargo, la inmersión en agarosa se puede usar solo para obtener imágenes rápidas (hasta 15 min). - Para el análisis de morfología de hepatocitos y nucleares, se obtienen imágenes de hígados con un microscopio confocal utilizando un objetivo de aire 40x y pilas z de secciones ópticas de 2 μm. Para la morfología hepática, la angiogénesis y los ensayos de reclutamiento de células inmunes, los hígados de imagen utilizan un objetivo de aire 20x y pilas z de secciones ópticas de 5 μm. Para las larvas con hígados grandes, se deben tomar imágenes de baldosas de 2 x 2 para asegurar imágenes de todo el hígado y el área circundante de 75 μm.
- Después de la obtención de imágenes, use una pipeta de plástico Pasteur con 1x tricocaína-E3 para extraer la larva del túnel de restricción y transferirla a una placa de Petri con E3 sin azul de metileno.
6. Análisis de variaciones morfológicas hepáticas.
NOTA: Los pasos enumerados a continuación se realizan para la cuantificación del área de superficie hepática y el volumen:
- Software de imagen abierto. Agregue la carpeta que contiene archivos de imagen para analizar a Arena seleccionando el icono de carpeta Observar . A continuación, haciendo clic derecho en las miniaturas, seleccione Convertir al formato de archivo nativo de Imaris para convertir los archivos al formato (.ims).
- En el submenú Superar, ajuste el brillo y el contraste de cada canal. A continuación, cree una superficie a partir del hígado haciendo clic en el botón azul Agregar nuevas superficies .
- A continuación, en el panel de creación de superficies, seleccione Segmentar solo una región de interés para crear manualmente una superficie del hígado.
- Haga clic en Omitir | creación automática Opción Editar manualmente . Seleccione Contorno y anule la selección de la opción "Volumen" en el panel de escena.
NOTA: La opción de vista de volumen debe no estar seleccionada, de lo contrario, la selección de la región de interés en diferentes pilas z no podrá hacerlo. - Navegue a través de pilas z y dibuje la región de interés en cada plano seleccionando Modo, elija el modo de dibujo que prefiera. Para comenzar a dibujar, cambie el puntero al modo Seleccionar y no a Navegar, haga clic en Dibujar y comience a arrastrar el puntero a través del hígado para dibujar un ROI.
- Después de seleccionar un ROI en los diferentes planos focales, seleccione Crear una superficie para fusionar todos los ROI seleccionados y crear una superficie hepática.
- A continuación, utilizando la superficie recién creada crear una máscara de la señal de los hepatocitos. Haga clic en la superficie y, en la pestaña Editar (el lápiz), elija Enmascarar todo. En la ventana que aparece, elija el canal que desea enmascarar que se utilizará para cuantificar el volumen hepático y el área de superficie. Luego, elija establecer vóxeles fuera de la superficie en 0 y marque la opción Duplicar canal antes de aplicar la máscara.
- Utilice el área de superficie hepática y los valores de volumen hepático del menú de análisis estadístico para el análisis.
NOTA: Realice los siguientes pasos para la cuantificación del área hepática.
- Abra el software Fiji. En el menú Plugins, seleccione Bio-formatos seguido de Bio-formatos Importador, marque la opción Dividir canales para abrir el archivo de imagen.
- En el menú Imagen, seleccione Propiedades para comprobar que la imagen tiene el tamaño de píxel y la profundidad de vóxel correctos, si no los valores correctos. A continuación, vaya al menú Imágenes, haga clic en Ajustar seguido de Brillo y contraste, ajuste el brillo y el contraste de la imagen.
- A continuación, el uso de hepatocitos del canal crea una proyección de máxima intensidad del hígado. Vaya al menú Imágenes, haga clic en Pilas seguido de Proyecto Z. Seleccione Proyección de intensidad máxima.
- Usando la herramienta de selección a mano alzada, cree manualmente una región de interés (ROI) que rodea el hígado larval. A continuación, en el menú Analizar , haga clic en Medir para obtener el área del hígado. Guarde los resultados como hoja de cálculo para su posterior análisis.
7. Análisis morfológico de hepatocitos y nucleares.
- Abra el software Fiji. En el menú Plugins, seleccione Bio-formatos seguido de Bio-formatos Importador marque la opción Dividir canales para abrir el archivo de imagen.
- En el menú Imagen, seleccione Propiedades para comprobar que la imagen tiene el tamaño de píxel y la profundidad de vóxel correctos, si no los valores correctos. A continuación, vaya al menú Imágenes, haga clic en Ajustar seguido de Brillo y contraste, ajuste el brillo y el contraste de la imagen.
- En el menú Analizar , seleccione Establecer medidas y marque todos los parámetros que desee analizar (por ejemplo, descriptores de área, perímetro y forma). Seleccione el canal fluorescente de la membrana de los hepatocitos. Navegando a través de Z, use la herramienta de selección a mano alzada para dibujar un ROI perfecto alrededor de un hepatocito. A continuación, en el menú Analizar , haga clic en Medir para calcular el área de los hepatocitos.
- Repita el paso 7.3 para 15-30 hepatocitos. Guarde los resultados como hoja de cálculo para su posterior análisis.
- A continuación, seleccione el canal fluorescente del núcleo. Navegando a través de Z, use la herramienta de selección a mano alzada para dibujar un ROI perfecto alrededor del núcleo de los hepatocitos. A continuación, en el menú Analizar , haga clic en Medir para calcular el área nuclear y la circularidad.
- Repita el paso 7.5 para 15-30 hepatocitos. Guarde los resultados como una hoja de cálculo para su posterior análisis, incluida la cuantificación de la relación nuclear: citoplasmática.
- Puntúe las muestras para la presencia de micronúcleos y hernia de la siguiente manera (Tabla 3).
8. Análisis de angiogénesis.
- Crear manualmente una superficie para el hígado como se describe en la sección 6 de este protocolo. Nombra esta superficie como "Superficie del hígado".
- Crear una máscara para la señal de las células endoteliales dentro del hígado. Haga clic en la superficie y debajo de la pestaña de edición (el lápiz) elija Enmascarar todo. En la ventana que aparece, elija el canal de células endoteliales para aislar las señales de los vasos solo del hígado. Elija establecer vóxeles fuera de la superficie en 0 y marque la opción Duplicar canal antes de aplicar la máscara.
- Cambiar el nombre del nuevo canal enmascarado de células endoteliales como vasculatura hepática.
- Para medir el volumen del recipiente y el área de superficie, cree una segunda superficie. Haga clic en el botón azul Agregar nuevas superficies . En el primer paso de la creación de la superficie, asegúrese de que todas las opciones no estén seleccionadas para crear automáticamente una superficie.
- En el segundo paso, elija el canal de vasculatura hepática para crear una superficie encima. Anule la selección de la opción de suavizado para detectar tantos detalles de los recipientes como sea posible y habilite la sustracción de fondo en la opción de umbral.
- Ajuste el umbral asegurando que la superficie detectada se está colocalizando con la señal de vasculatura hepática. Utilice los valores de área de superficie y volumen del menú de análisis estadístico. Calcule el índice de densidad del vaso utilizando las siguientes ecuaciones:
Índice de densidad de vasos (por hígado μm 2) = (área de superficie del vaso (μm 2)) / (área de superficie hepática (μm2))
Índice de densidad de vasos (por hígado μm 3) = (Volumen del vaso (μm 3)) / (Volumen hepático (μm3))
9. Análisis de reclutamiento de células inmunes.
- Abra el software Fiji. En el menú Plugins, seleccione Bio-formatos seguido de Bio-formatos Importador marque la opción Dividir canales para abrir el archivo de imagen.
- En el menú Imagen , seleccione Propiedades para comprobar que la imagen tiene el tamaño de píxel y la profundidad de vóxel correctos, si no los valores correctos. A continuación, vaya al menú Imágenes , haga clic en Ajustar seguido de Brillo y contraste, ajuste el brillo y el contraste de la imagen (por ejemplo, macrófagos - mCherry o dTomato; neutrófilos - BFP; Células T - EGFP; hepatocitos - EGFP o mCherry).
- A continuación, cree proyecciones de intensidad máxima para cada canal.
- Como se describe en la sección 6 (Pasos 6.9-6.12), cree un ROI que rodea el hígado larvario y mida el área del hígado. Crear un segundo ROI que incluya el área hepática y el área circundante de 75 μm ("Área de reclutamiento").
- A continuación, en el menú Editar , seleccione la opción Selección seguida de Agregar al administrador. Al seleccionar una proyección de intensidad máxima del canal de células inmunes innatas, haga clic en el ROI del hígado desde la ventana del Administrador de ROI para establecer el área de reclutamiento.
- En el menú Plugins, seleccione la opción Analizar seguida de Cell Counter y cuente las células inmunes dentro del área de reclutamiento. Número récord de células inmunes reclutadas en el área del hígado en una hoja de cálculo.
- Calcule las densidades de neutrófilos, macrófagos y células T normalizando el número de células inmunitarias por área hepática.
Resultados
Al introducir una dieta alta en colesterol a corto plazo en un modelo de pez cebra de carcinoma hepatocelular (HCC), que sobreexpresa una forma constitutivamente activa específica de hepatocitos de beta-catenina (s704Tg; Tg(fabp10a:pt-B-cat, cryaa:Venus)17, somos capaces de crear un modelo de vertebrados no mamíferos de HCC asociado a NASH. La progresión de la enfermedad hepática se puede controlar temprano midiendo la esteatosis hepática, el tamaño del hígado, el hepatocitos, la morfología nuclear, la angiogénesis y la infiltración de células inmunitarias (Figura 1).
Las larvas de HCC alimentadas con una dieta normal no muestran ninguna esteatosis hepática leve, medida por tinción de O rojo aceite. Sin embargo, las larvas de HCC alimentadas con una dieta alta en colesterol muestran un aumento significativo en la esteatosis hepática (Figura 2).
Un marcador bien conocido de enfermedad hepática es la hepatomegalia17. Para evaluar el tamaño del hígado, las larvas de HCC pueden cruzarse con una línea transgénica que expresa específicamente un marcador fluorescente en los hepatocitos, como el Tg(fabp10a: H2BmCherry). Para evaluar la hepatomegalia, se realiza una evaluación del área hepática (2D), el área de superficie hepática y el volumen hepático (3D). Después de 8 días de exposición a un excedente de colesterol, se observó agrandamiento del hígado en larvas de CHC (Figura 3).
Utilizando imágenes vivas no invasivas, las líneas de peces transgénicos que expresan proteínas fluorescentes en las membranas de los hepatocitos (como Tg(fabp10a:Life-actin-EGFPP) y en núcleos de hepatocitos (como Tg(Fabp10a:H2B-mCherry) se pueden utilizar para evaluar las alteraciones de la morfología celular y nuclear asociadas con la malignidad en los hepatocitos. El área de hepatocitos aumentó en el HCC asociado a NASH (Figura 4A, B, D), así como en el área nuclear (Figura 4C, E) y la relación nuclear: citoplasma (Figura 4F). También se observó una disminución significativa de la circularidad nuclear en el grupo HCD+HCC (Figura 4G). La lipotoxicidad desencadena daños en el ADN, una característica de la carcinogénesis en presencia de micronúcleos. Utilizando el marcador H2B-mCherry observamos una mayor incidencia de micronúcleos en las larvas de HCC alimentadas con una dieta alta en colesterol (Figura 4H).
La vasculatura hepática se puede evaluar fácilmente en modelos de pez cebra utilizando una línea marcada transgénica, como Tg (kdrl: mCherry o Tg (fli: EGFP), que etiquetan la vasculatura. Se observó un aumento significativo de la densidad de vasos en larvas de HCC+HCD (Figura 5).
Para observar la respuesta inflamatoria desencadenada temprano en el CHC asociado a NASH, una línea de peces transgénicos que expresa proteínas fluorescentes en macrófagos y neutrófilos, como Tg(mfap4: tdTomato-CAAX; lyz: BFP), se cruzó con la línea transgénica HCC. La infiltración de neutrófilos y macrófagos ocurre tanto en HCC como en HCC alimentados con HCD, que se evaluó mediante la cuantificación del número y la densidad de neutrófilos/macrófagos en el hígado y sus alrededores (área circundante de hasta 75 μm) (Figura 6A-H). Sin embargo, el HCC+HCD mostró un aumento significativo en el número y densidad de neutrófilos (Figuras 6F-H). A los 13 días después de la fertilización, el sistema inmune adaptativo ya está funcionando. Usando una línea de peces transgénicos que exprese proteína fluorescente en células T, como la Tg(lck: EGFP), y en combinación con la línea transgénica HCC; Se evaluó el impacto del exceso de colesterol en el reclutamiento de células T para el hígado. Se observó una disminución significativa en la densidad de células T y el número total en larvas de HCC alimentadas con HCD (Figura 6I-K).
| Líneas transgénicas de pez cebra | Referencia ZFIN | Ensayo |
| Casper | RoyA9; MITFAW2 | Estetina hepáticaosis |
| Tg(fabp10a:pt-β-catenin_cryaa:Venus / fabp10a:H2B-mCherry ) | s704Tg / uwm41Tg | Morfología hepática |
| Tg(fabp10a:pt-β-catenin_cryaa:Venus; fabp10a:H2B-mCherry; fabp10a:LIFEACT-EGFP) | s704Tg / uwm41Tg / uwm42Tg | Hepatocitos y morfología nuclear |
| Tg(fabp10a:pt-β-catenin_ cryaa:Venus; fli:EGFP) | s704Tg / y1Tg | Angiogénesis |
| Tg(fabp10a:pt-β-catenin_cryaa:Venus; mfap4:Tomate-CAAX; lyzC:BFP) | s704Tg / xt6Tg / zf2171Tg | Reclutamiento de macrófagos y neutrófilos |
| Tg(fabp10a:pt-β-catenin_cryaa:Venus; lck:EGFP) | s704Tg / cz1Tg | Reclutamiento de células T |
Tabla 1: Líneas de pez cebra transgénico para usar en diferentes ensayos.
| Número de larvas | Tamaño de la caja de alimentación | Cantidad de alimentos por día (mg) | E3 Volumen (ml) |
| 30-40 | Pequeña caja de cría | 3-4 | 200 |
| 60-80 | Caja de cría pequeña/grande | 6-8 | 400 |
| 100-150 | Gran caja de cría | 10-15 | 500 |
Tabla 2: Configurar las condiciones de las cajas de alimentación.
| Fenotipo | Método de puntuación |
| Ninguno | Núcleos normales, sin micronúcleos ni hernia |
| Leve | Bajo número de micronúcleos (menos de 5 por campo de visión) y/o hernia |
| Moderado/Severo | Número moderado a alto de micronúcleos (más de 5 por campo de visión) y/o hernia |
Tabla 3: Puntuación de micronúcleos y hernia nuclear.
Figura 1: Diagrama de protocolo que resume los principales pasos experimentales y el enfoque de análisis. Haga clic aquí para ver una versión más grande de esta figura.
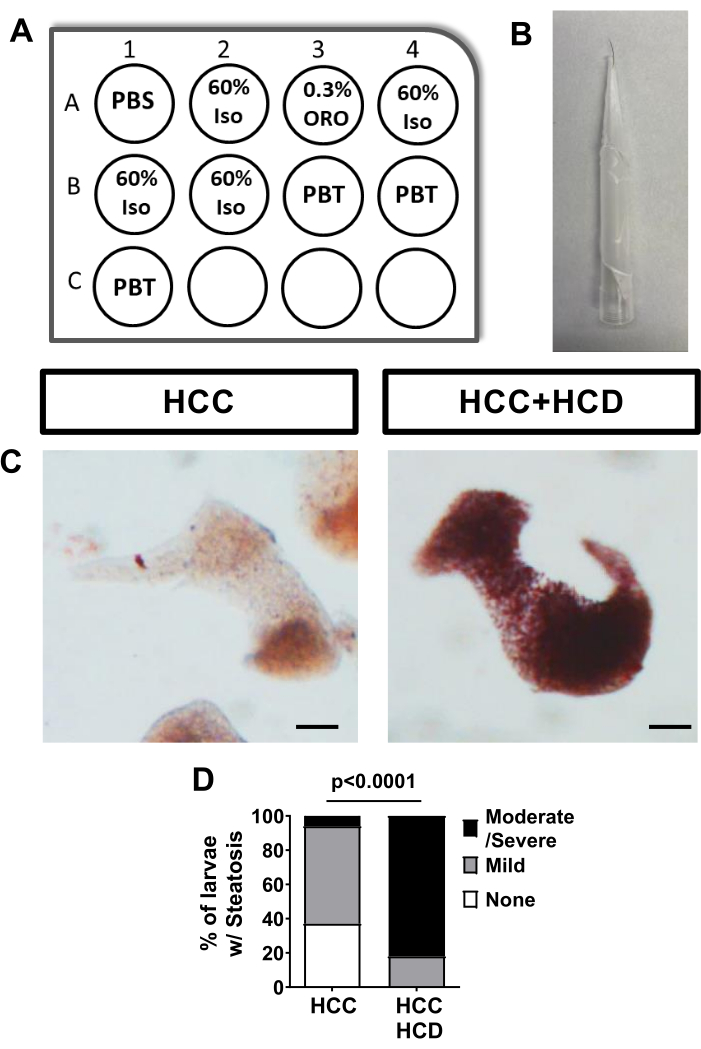
Figura 2: Ensayo de control para esteatosis hepática - tinción ORO. Las larvas de HCC se alimentaron con una dieta de colesterol normal o alta y se realizó tinción Oil Red O (ORO) para evaluar la esteatosis hepática. (A) Diagrama de la placa de 12 pocillos para realizar tinción secuencial ORO utilizando los insertos de pocillos de malla. (B) Imagen de la herramienta de pestañas utilizada para manipular larvas. (C) Imágenes representativas de hígados teñidos con rojo aceite; Larvas de HCC y HCC+HCD. (D) Gráfico de Chi-cuadrado que muestra el porcentaje de larvas con diferente puntuación de esteatosis hepática. Barra de escala = 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
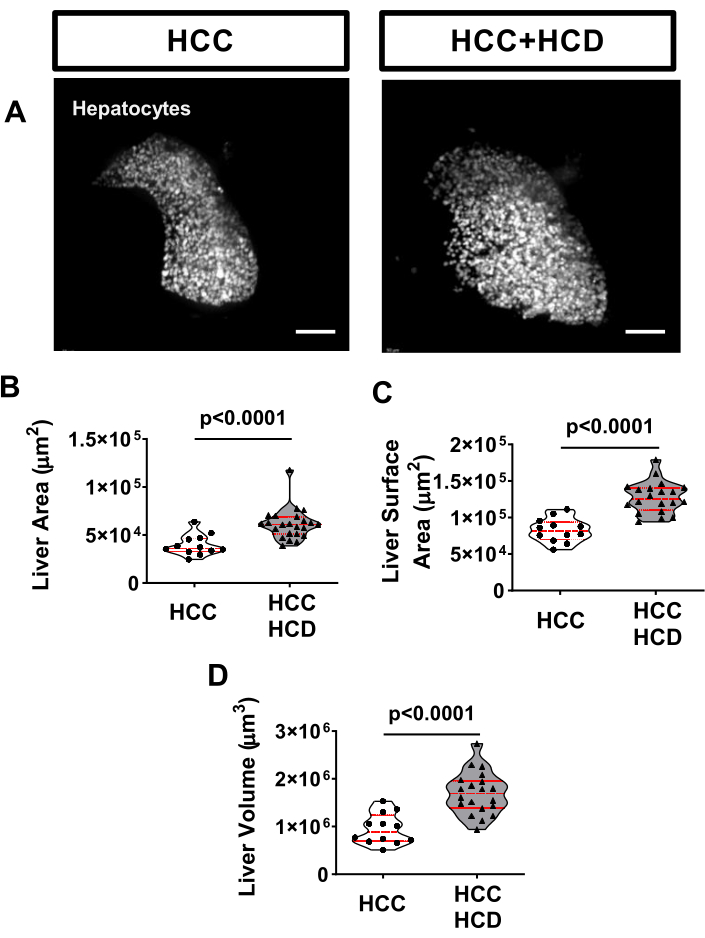
Figura 3: Imágenes representativas del tamaño del hígado. Las larvas transgénicas de HCC que expresan un marcador hepático (Tg(fabp10a: H2B-mCherry)) se obtuvieron imágenes vivas y no invasivas, en un microscopio confocal de disco giratorio invertido utilizando un zWEDGI. (A) Reconstrucciones 3D representativas de hígados en larvas de HCC y HCC+HCD. (B-D) Gráfico que muestra alteraciones morfológicas hepáticas incluyendo área hepática (B), área de superficie hepática (C) y volumen hepático (D) en larvas de HCC y HCC+HCD. Barra de escala = 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
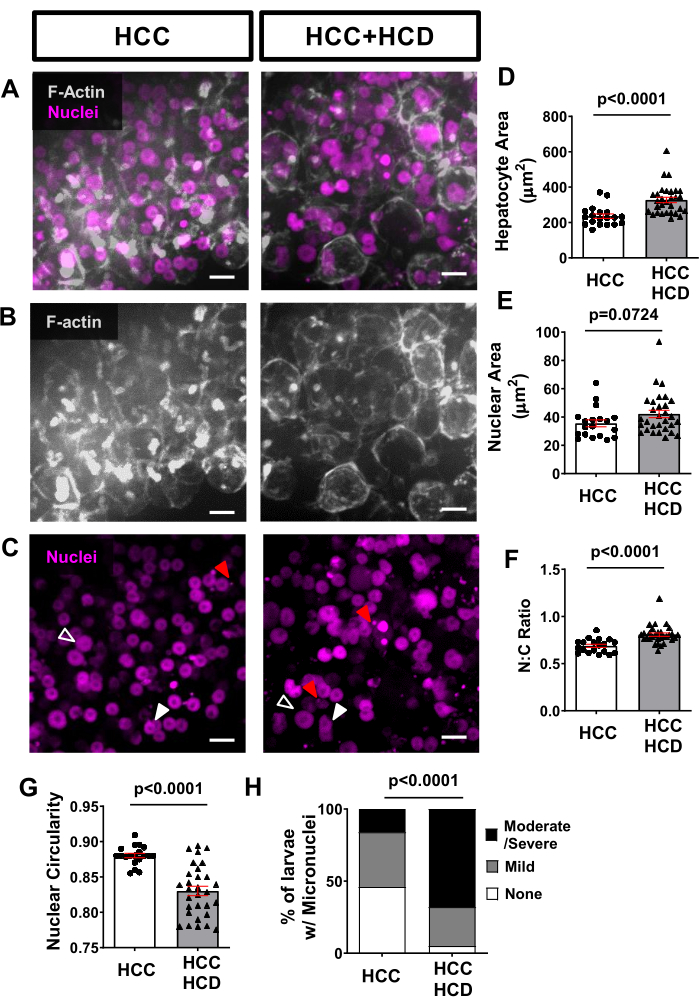
Figura 4: Imágenes representativas de hepatocitos y morfología de núcleos. Se obtuvieron imágenes de líneas de HCC transgénicos que expresan proteínas fluorescentes en membranas de hepatocitos (Tg(fabp10a:Life-actin-EGFP) y en núcleos de hepatocitos (Tg(fabp10a:H2B-mCherry). (A-C) Reconstrucciones 3D representativas de núcleos de actina F y hepatocitos de larvas de HCC y HCC+HCD. Las puntas de flecha abiertas muestran núcleos agrandados; las puntas de flecha blancas muestran un núcleo con forma alterada; y las flechas rojas muestran micronúcleos y hernia nuclear. (D-G) Gráficos que muestran promedios de parámetros celulares y nucleares en larvas de 13 días de HCC y HCC + HCD. (D) Área de hepatocitos. e) Zona nuclear. (F) Relación nuclear:citoplasma. G) Circularidad nuclear. Cada punto representa promedios por larva. Los diagramas de puntos muestran gráficos de Chi-cuadrado medios ±SEM (H) que muestran el porcentaje de larvas con diferente puntuación de micronúcleos y hernia nuclear. Barra de escala = 10 μm. Haga clic aquí para ver una versión más grande de esta figura.
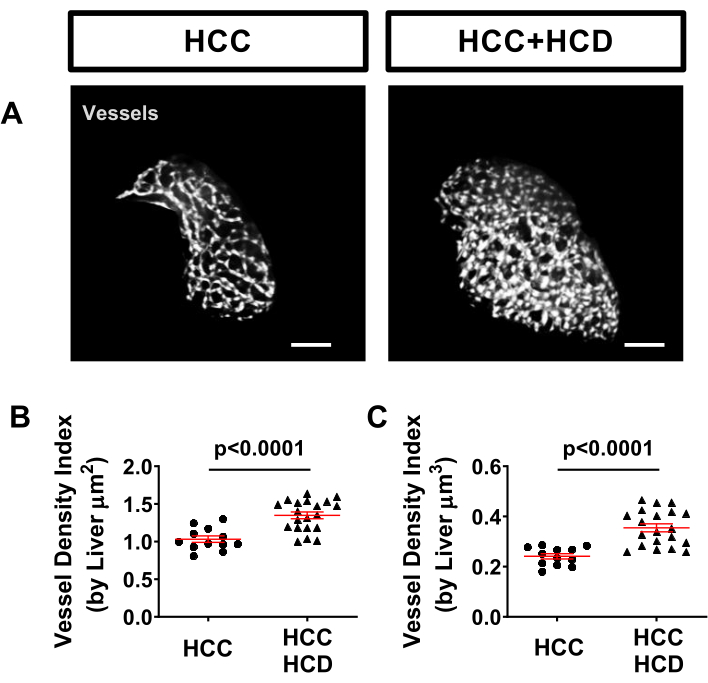
Figura 5: Imágenes representativas de la vasculatura hepática. Líneas de HCC transgénicas que expresan proteínas fluorescentes en núcleos de hepatocitos (Tg(Fabp10a:H2B-mCherry) y en células endoteliales (Tg)fli:EGFP)). (A) Reconstrucciones 3D representativas de la vasculatura hepática en larvas de HCC y HCC+HCD. (B-C) Gráfico que muestra el índice de densidad de vasos por área de superficie hepática (B) volumen (C) en larvas de HCC y HCC + HFCD. Los diagramas de puntos muestran la media ±SEM. Barra de escala = 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
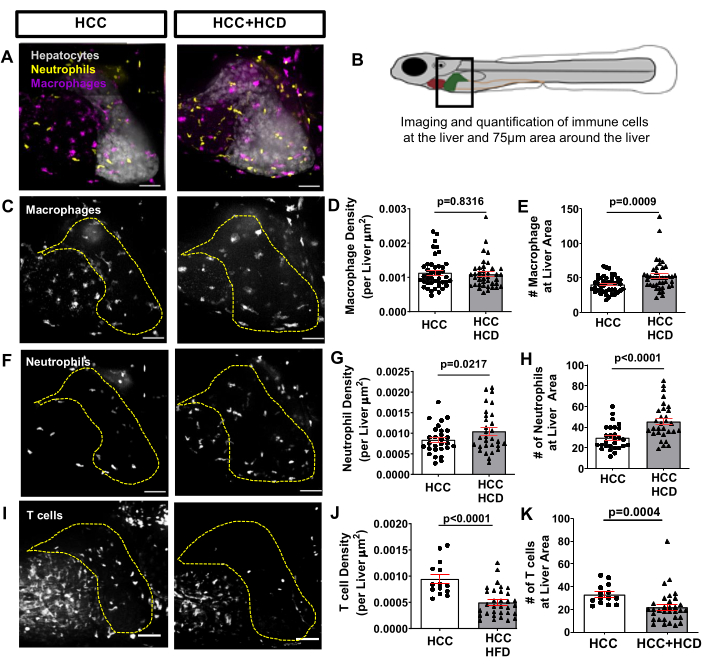
Figura 6: Imágenes representativas del paisaje de células inmunes hepáticas. Línea de HCC transgénica que expresa proteínas fluorescentes en macrófagos y neutrófilos (Tg(mfap4:tdTomato-CAAX; lyz:BFP) o en células T (Tg(lck-EGFP). (A,C,F) Reconstrucciones 3D representativas de hígados y reclutamiento de leucocitos en el área hepática en larvas de HCC y HCC+HCD de 13 días de edad. (B) Diagrama del área del hígado fotografiada. (D-E) Gráfico que muestra la densidad de macrófagos (D) y el número (E) en el área hepática en larvas de HCC y HCC + HCD. (G-H) Gráfico que muestra la densidad (G) y el número (H) de neutrófilos en el área hepática en larvas de HCC y HCC + HCD. (G) Reconstrucciones 3D representativas del reclutamiento de células T en el área hepática en larvas de HCC y HCC + HCD. (H-I) Gráfico que muestra la densidad de células T (H) y el número (I) en el área hepática en larvas de HCC y HCC + HCD. Los diagramas de puntos muestran la media ±SEM. Barra de escala = 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
Tabla suplementaria 1: Tabla de tampones y soluciones Haga clic aquí para descargar esta tabla.
Discusión
Con una mayor incidencia de CHC, específicamente CHC inducido por NASH, es de gran importancia tener modelos más eficientes para estudiar los mecanismos celulares y moleculares involucrados en el HCC asociado a NASH. La deconvolución de las interacciones célula-célula en el hígado es crucial para comprender mejor la progresión de la enfermedad hepática y la hepatocarcinogénesis. El enfoque descrito en este protocolo ofrece una forma única de analizar la progresión de la enfermedad hepática in vivo y de forma no invasiva.
La preparación de la dieta es fundamental para el éxito de establecer un modelo de HCC asociado a NASH. Es importante dejar que el éter dietílico se evapore completamente dentro de la campana extractora para evitar efectos nocivos, mientras se preparan dietas para el pez cebra. Para usar estas dietas con larvas (5-12 días después de la fertilización), es extremadamente importante moler las dietas en partículas finas para asegurar la ingesta de alimentos por parte de las larvas. El uso de análogos de ácidos grasos marcados con fluorescencia se puede utilizar para evaluar la ingesta de alimentos en larvas.
Antes de colocar las larvas en las cajas de reproducción y comenzar el procedimiento de alimentación, es crucial asegurarse de que el muestreo experimental esté uniformizado mezclando larvas de diferentes placas. Este paso es importante ya que diferentes microambientes, a partir del día 0, se promueven en cada una de las placas y pueden afectar la respuesta inflamatoria.
Otro paso importante es contar las larvas, para saber cuánta comida se necesita para cada caja de alimentación. Si la cantidad de alimento no es adecuada para el número de larvas presentes en cada caja, ocurrirá uno de los dos escenarios: 1) las larvas estarán subalimentadas; 2) Las larvas serán sobrealimentadas. La alimentación inadecuada conducirá a condiciones poco saludables asociadas con la desnutrición o la sobrenutrición, como la inflamación, que afectará drásticamente el microambiente del hígado. Si se produce una alimentación inexacta, las larvas mostrarán problemas de movimiento. En esta etapa de desarrollo, las larvas deben nadar intensamente, por lo tanto, si se notan problemas de movimiento, las larvas se criaron en condiciones insalubres (desnutrición o exposición a dosis tóxicas de colesterol debido a la sobrealimentación). Por esta razón, los procedimientos de alimentación deben controlarse estrictamente para ambas dietas, normal y enriquecida con colesterol. Se pueden realizar algunos ensayos para abordar rápidamente la precisión de la alimentación y la salud de las larvas, incluida la presencia de hepatomegalia (tamaño del hígado) y la inflamación de tejidos y órganos, particularmente hígado e intestino (aumento visible de la infiltración de neutrófilos y macrófagos).
La limpieza diaria y el reemplazo del 95% de E3 es fundamental para reducir el crecimiento de microorganismos en las cajas de alimentación y mejorar la salud y la supervivencia de las larvas. Alternativamente, las larvas se pueden colocar en un sistema de rack independiente. Para obtener los mejores resultados, coloque 60-80 larvas en un tanque de 3 litros. Mantenga el flujo de agua en el nivel mínimo ajustando el flujo a un modo de goteo rápido y alimentando a las larvas 3-4 mg dos veces al día (AM y PM). El flujo de agua debe revisarse regularmente para asegurar el flujo correcto en cada tanque. En nuestro laboratorio, este método nos da una supervivencia del 95-100% con una alimentación a corto plazo de 10% de HCD. Además, este método redujo en gran medida la carga de trabajo inherente a la limpieza diaria y el intercambio de agua necesarios en el protocolo de alimentación estática descrito.
Si bien utilizamos una dieta enriquecida con colesterol al 10% para inducir NASH en una exposición a corto plazo (5 días son suficientes para inducir esteatohepatitis), las alteraciones de la dieta se pueden realizar y ampliar para usar fructosa 18, ácidos grasos (como el ácido palmítico)19 o protocolos de alimentación que pueden extenderse usando una dieta enriquecida con colesterol al 4%20. Actualmente, hay pocos objetivos terapéuticos exitosos para el CHC y ninguno para la EHNA. El uso de modelos de pez cebra ofrece una oportunidad única para ampliar nuestro conocimiento sobre la hepatocarcinogénesis, pero también un sistema de vertebrados sin paralelo para realizar exámenes de detección de drogas de gran rendimiento. Las técnicas descritas en este protocolo facilitarán futuros hallazgos y dianas terapéuticas para la enfermedad hepática y la hepatocarcinogénesis.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
El autor desea agradecer a los técnicos de la Instalación Central de Pez Cebra de la Facultad de Medicina Albert Einstein, Clinton DePaolo, y al Spartak Kalinin por la asistencia y el mantenimiento de nuestras líneas de pez cebra. FJMN cuenta con el apoyo del Instituto de Investigación del Cáncer y la Fundación del Cáncer Fibrolamelar.
Materiales
| Name | Company | Catalog Number | Comments |
| Cholesterol | Sigma | C8667-25G | Easily degraded. Store -20°C. |
| Corning Netwells carrier kit 15 mm | Fisher | 07-200-223 | |
| Corning Netwells inserts | Fisher | 07-200-212 | |
| Diethyl ether | Fisher | 60-046-380 | Highly Volatile. |
| Dumont forceps #55 dumostar | Fisher | NC9504088 | |
| Fisherbrand Pasteur Pipets 5.75in | Fisher | 22-183624 | |
| 4% paraformaldehyde (PFA) | Electron Microscopy Science | 15710 | |
| Golden Pearl Diet 5–50 nm Active Spheres | Brine Shrimp Direct | - | Any commercial dry powder food for larvae can be used. |
| Graduated Transfer Pipets | Fisher | 22-170-404 | |
| Isopropanol | Fisher | BP26181 | |
| PBS, pH7.4, 10X, 10 Pack | Crystalgen | 221-1422-10 | |
| Petri Dishes 100X20MM | Fisher | 08-747D | |
| Tricaine | Sigma | A-5040 | |
| Tween 20 | Fisher | BP337-500 | |
| Oil Red O solution 0.5% isopropanol | Sigma | O1391-500ML | |
| Tricaine | Sigma | A-5040 | |
| Tween 20 | Fisher | BP337-500 | |
| Vactrap | VWR | 76207-630 | Vacuum system for larvae collection |
| Microscopes | |||
| Fluorescent Stereomicroscope | Leica | M205 FCA THUNDER Imager Model Organism Large | |
| Spinning Disk Confocal Microscope | Nikon | Nikon CSU-W1 | |
| Stereomicroscope | Leica | S9i with transilluminated base | |
| Software | |||
| Fiji | Open-source Java image processing program. | ||
| Imaris 9.6 | Bitplane; Oxford Instruments. |
Referencias
- Pocha, C., Kolly, P., Dufour, J. F. Nonalcoholic Fatty Liver Disease-Related Hepatocellular Carcinoma: A Problem of Growing Magnitude. Seminals in Liver Disease. 35 (3), 304-317 (2015).
- El-Serag, H. B., Kanwal, F. Epidemiology of hepatocellular carcinoma in the United States: where are we? Where do we go. Hepatology. 60 (5), 1767-1775 (2014).
- Estes, C., et al. Modeling NAFLD disease burden in China, France, Germany, Italy, Japan, Spain, United Kingdom, and United States for the period 2016-2030. Journal of Hepatology. 69 (4), 896-904 (2018).
- Estes, C., Razavi, H., Loomba, R., Younossi, Z., Sanyal, A. J. Modeling the epidemic of nonalcoholic fatty liver disease demonstrates an exponential increase in burden of disease. Hepatology. 67 (1), 123-133 (2018).
- Meli, R., Mattace Raso, G., Calignano, A. Role of innate immune response in non-alcoholic Fatty liver disease: metabolic complications and therapeutic tools. Frontiers in Immunology. 5, 177 (2014).
- Ganz, M., et al. Progression of non-alcoholic steatosis to steatohepatitis and fibrosis parallels cumulative accumulation of danger signals that promote inflammation and liver tumors in a high fat-cholesterol-sugar diet model in mice. Journal of Translational Medicine. 13, 193 (2015).
- Ma, C., et al. NAFLD causes selective CD4(+) T lymphocyte loss and promotes hepatocarcinogenesis. Nature. 531 (7593), 253-257 (2016).
- Reimer, K. C., Wree, A., Roderburg, C., Tacke, F. New drugs for NAFLD: lessons from basic models to the clinic. Hepatology International. 14 (1), 8-23 (2020).
- Wrighton, P. J., Oderberg, I. M., Goessling, W. There is something fishy about liver cancer: Zebrafish models of hepatocellular carcinoma. Cellular and Molecular Gastroenterology and Hepatology. 8 (3), 347-363 (2019).
- Goessling, W., Sadler, K. C. Zebrafish: An important tool for liver disease research. Gastroenterology. 149 (6), 1361-1377 (2015).
- Huo, X., et al. Transcriptomic profiles of tumor-associated neutrophils reveal prominent roles in enhancing angiogenesis in liver tumorigenesis in zebrafish. Science Reports. 9 (1), 1509 (2019).
- Yan, C., Yang, Q., Gong, Z. Tumor-associated neutrophils and macrophages promote gender disparity in hepatocellular carcinoma in zebrafish. Cancer Research. 77 (6), 1395-1407 (2017).
- Capece, D., et al. The inflammatory microenvironment in hepatocellular carcinoma: A pivotal role for tumor-associated macrophages. Biomed Research International. 2013, 187204 (2013).
- de Oliveira, S., et al. Metformin modulates innate immune-mediated inflammation and early progression of NAFLD-associated hepatocellular carcinoma in zebrafish. Journal of Hepatology. 70 (4), 710-721 (2019).
- Huemer, K., et al. Long-term live imaging device for improved experimental manipulation of zebrafish larvae. Journal of Visualized Experiments. (128), e56340 (2017).
- Huemer, K., et al. zWEDGI: Wounding and entrapment device for imaging live zebrafish larvae. Zebrafish. 14 (1), 42-50 (2017).
- Evason, K. J., et al. Identification of chemical inhibitors of beta-catenin-driven liver tumorigenesis in zebrafish. PLoS Genetics. 11 (7), 1005305 (2015).
- Sapp, V., Gaffney, L., EauClaire, S. F., Matthews, R. P. Fructose leads to hepatic steatosis in zebrafish that is reversed by mechanistic target of rapamycin (mTOR) inhibition. Hepatology. 60 (5), 1581-1592 (2014).
- Park, K. H., Ye, Z. W., Zhang, J., Kim, S. H. Palmitic acid-enriched diet induces hepatic steatosis and injury in adult zebrafish. Zebrafish. 16 (6), 497-504 (2019).
- Progatzky, F., et al. Dietary cholesterol directly induces acute inflammasome-dependent intestinal inflammation. Nature Communication. 5, 5864 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados