需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
大鼠部分异位欣德利姆移植模型
* 这些作者具有相同的贡献
摘要
本文介绍了大鼠部分异位骨质皮瓣移植方案及其中期随访的潜在结果。
摘要
血管化复合异位移植 (VCA) 是患者在复杂组织缺陷后没有自体手术可能性的最高级重建选项。脸部和手部移植改变了毁容患者的生活,赋予他们新的审美和功能社会器官。尽管结果大有希望,但由于终生免疫抑制合并症和传染性并发症,VCA仍然表现不佳。大鼠是研究免疫途径和移植排斥机制 的活体 研究的理想动物模型。大鼠还广泛应用于新型复合组织移植保存技术,包括灌注和低温保存研究。大鼠VCA的模型必须可重复、可靠和高效,术后发病率和死亡率较低。异位肢体移植程序符合这些标准,比矫肢移植更容易执行。掌握啮齿动物显微外科模型需要在显微外科和动物护理方面有扎实的经验。据报道,这是大鼠部分异位骨皮瓣移植、术后结果和预防潜在并发症的方法的可靠和可重复的模型。
引言
在过去的二十年里, VCA 已经发展成为一种革命性的治疗患者谁遭受严重毁容,包括脸部1 ,上肢截肢2 ,3 ,和其他复杂的组织缺陷4 , 5 。然而,终生免疫抑制的后果仍然阻碍这些复杂的重建手术的广泛应用。基础研究对于改进反排斥策略至关重要。增加VCA保存时间对于改善移植物流和增加捐赠者库也至关重要(因为VCA捐赠者必须比实体器官捐献者满足更多的标准,包括肤色、解剖大小、性别)。在此背景下,大鼠肢体移植被广泛应用于6、7、新耐受诱导方案8、保存研究9、10、11等免疫排斥的研究中。因此,这些 VCA 模型是 VCA 转化研究需要掌握的关键元素。
骨皮瓣在文献中被描述为研究8、12、13、14大鼠VCA的可靠模型。虽然正位全肢移植允许长期评估移植功能,但它是一个耗时的程序,与更高的术后发病率和死亡率14。相比之下,异位肢体移植模型是非功能性的,但能够对VCA进行可重复的研究。在开始大鼠VCA移植研究之前,可以可靠地预测术后的结果。本研究报告了大鼠的部分异位骨质皮瓣移植模型,其中包括在三周的随访期内可能出现的频繁可能的结果和术后并发症。
研究方案
所有动物都根据《国家卫生研究院护理和使用实验室动物指南》得到人道护理。机构动物护理和使用委员会(IACUC-协议2017N000184)和动物护理和使用审查办公室(ACURO)批准了所有动物协议。近亲繁殖的雄性刘易斯大鼠(250-400克)用于所有实验。
1. 手术
- 使用异黄素吸入麻醉刘易斯大鼠。诱导感应室中5%异黄素的麻醉,通过呼吸锥体保持1.5-3%异黄酮吸入麻醉。
- 手术前在存活程序中应用眼润滑剂。剃掉手术现场,用脱皮霜、磨砂和披肩用无菌窗帘治疗。
- 切口前和手术过程中定期用脚趾捏测试确认完全麻醉。在整个过程中监测心脏和呼吸速率。对于所有手术,使用无菌仪器、用品、窗帘和手套保持无菌状态。有关程序使用的工具列表,请参阅 材料表 。
2. 捐赠人权利部分后肢采购
- 在腿部的三分之一处对脚踝上方的皮肤进行环切切。
- 使用双极钳将尖骨动脉和流行动脉的末梢部分骨架化和烧灼。烧灼和切断胃内皮,鞋底,头骨前,和二头肌股骨肌肉,直到头骨暴露。
- 在右侧的内侧折痕处切口 2.5 厘米。解剖内在脂肪垫,并收回它令人惊异地暴露股骨血管。使用鱼钩减记器抓住静脉韧带和夹钳,以保持在静脉脂肪垫远程。
注意: 内皮脂肪垫包含在部分肢体的收获中。 - 解剖股骨血管,个性化墨菲分支(深肌肉辅助分支通常位于静脉韧带和外周支部之间的中间),并以8-0连接尼龙领带。
- 用 100 个 IU / kg 肝素对供体大鼠进行肝素化,用 27 . 5G 针注射多静脉。
- 完成臀部周围的皮肤切口。
- 使用双极钳对二头肌和谷胱甘肽超纤维肌进行烧结。在股骨中长烧灼和切开坐骨神经。在后股骨峰的水平上近似地暴露股骨。
注:添加剂和四头肌被排除在采购之外。指定的脚踏车被保存下来。 - 利盖特股骨血管与8/0尼龙领带在静脉韧带的水平。在连体下方的股动脉上进行动脉切除术,并进行扩散,以便插入 24 G 血管导管。
- 烧灼和切割脚踏下剩余的肌肉,露出股骨前侧。
- 分别使用骨切割机尽可能接近和尽可能切开头骨和股骨(中长)。
- 用2mL肝素盐水(100 IU/mL)冲洗部分后肢,以获得清晰的静脉外流。将冰放在无菌纱布中,直到微血管转移(图1)。
- 当动物处于全身麻醉状态时,通过排泄来实施安乐死,直到动物没有生命迹象(没有呼吸运动,没有心跳)。

图1:鼠局部后肢收获。 24G血管卡插入股动脉,准备异位微血管转移。 请单击此处查看此图的较大版本。
3. 接受手术
- 切口前,剃掉颈部后部,皮下施用丁丙诺啡0.01-0.05毫克/千克。将鼠放在加热垫上的上位。
- 在右侧的内侧折痕处切口 2.5 厘米。解剖内在脂肪垫,并倾斜它断然暴露股骨血管。使用钩子缩回静脉韧带和夹钳,以保持在偏心脂肪垫远程。
- 解剖股骨血管,个性化墨菲分支,用8/0尼龙领带唇部。
- 使用 8/0 尼龙领带将两个容器放在表胃容器上方。将近似夹子放在近处,并压平容器末端:用肝素盐水冲洗。
- 在臀部上方的左侧切口,并创建一个皮下口袋,用皮下隧道进入皮肤折痕。
注:插入切口位于臀部运动范围之上,以确保动物保持正常的后肢运动。此外,在移植内嵌物和微血管转移位点之间保持一个皮质的桥梁,可以更好地固定移植物(图2)。 - 将部分肢体的近部和阴性脂肪垫通过皮下隧道进行微血管转移。使用 10/0 尼龙缝合线执行静脉和动脉麻醉剂。取下两个近似夹,观察肢体的转速。对两艘船进行"挤奶测试",以评估每个麻醉症的轻率。
注:静脉麻醉通常需要8至9条缝合线,动脉麻醉通常需要6条缝合线。 - 在移植肢体的内侧进行纵向皮肤切口,并插入移植物。去除移植物的多余的皮肤,用单独的缝合线和可吸收的4/0缝合线关闭伤口。
- 用两种独立的可吸收缝合线将移植肢体的阴性脂肪垫与接受者缝合在一起,并在微血管麻醉剂最后一次检查后关闭阴性折痕。
注:阴性脂肪垫被紧紧缝合,在麻醉剂上方添加一层保护性脂肪,并确保移植物及其足部的安全位置。一丝不苟的封闭对伤口愈合更好:它还可防止伤口残留出血,并降低自残风险。 - 根据围手术出血量,用1-3mL的盐水皮下补偿液体损失。
- 将伊丽莎白领子套在动物的脖子上,并在皮肤上涂上两条松动的缝合线,使其保持在正确的位置。
- 停止异黄素吸入,并在加热垫上持续监测动物,直到完全清醒和流动。
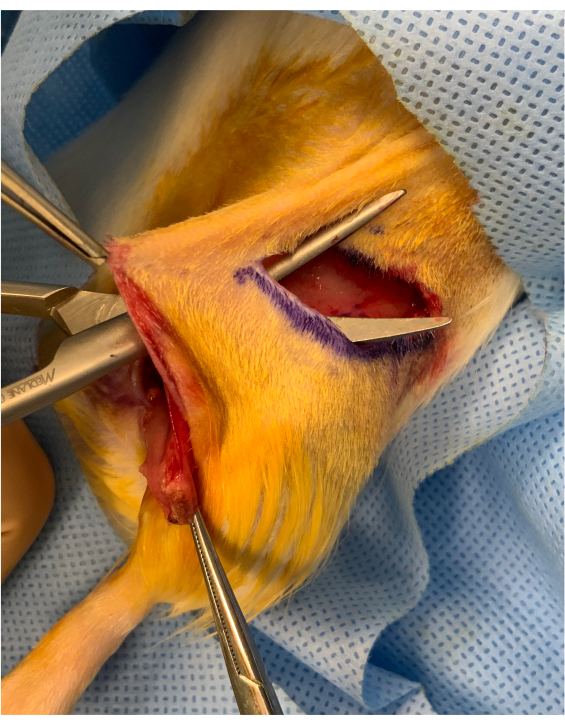
图2:骨质疏松肢体开始前的围手术图像。 在皮肤折痕切口和臀部上方移植物的插入之间保留着一座约1厘米的皮质桥。移植物被放置在桥下,保持其稳定用于微血管转移。 请单击此处查看此图的较大版本。
4. 术后护理
- 每天监测动物两次,持续72小时,然后每天监测一次,直到术后一天(POD)7,然后每周监测两次。
注:监测必须根据动物和移植情况进行调整(苍白的眼睛可能需要补充液体,作为动物疼痛的指标,移植颜色/温度异常),并应与兽医讨论进一步护理。在整个研究期间,受体大鼠需要单一的住房,以避免对移植物造成任何损害。 - 根据 IACUC 指南,用皮下注射丁丙诺啡和/或非类固醇抗炎药物进行镇痛。
- 评估移植物,并每天使用同一设备使用图片进行身体检查。
注:在移植物的皮肤上使用脱毛霜有助于更好地评估移植的肤色。
结果
在这项单操作者研究中,进行了30例同步异位部分肢体移植。成功定义为术后第21天没有VCA失败或需要安乐死的并发症。移植物的正常演变表现在图3中。接受者部分肢体采购和移植插入的平均持续时间分别为35分钟和105分钟:平均缺血时间是105分钟。在随访过程中,发生两种类型的并发症(表1)早或晚。有的需要安乐死,有的需要抢救,都与兽医人员讨论过(
讨论
在文献15、16、17中描述了啮齿动物的矫肢移植模型:然而,他们需要神经修复,肌肉重新连接,和完美的骨合成股骨,这可能是一个非常困难的步骤。这些模型也与14号啮齿动物的发病率和死亡率较高有关,特别是在短期随访中,因为移植后肢的正常功能的恢复可能需要几个月的时间。然而,...
披露声明
作者没有披露。
致谢
这项工作得到了助理国防部长办公室的支持,通过国会指导的医学研究计划,根据第一奖。W81XWH-17-1-0680。意见、解释、结论和建议是作者的意见,不一定得到国防部的赞同。
材料
| Name | Company | Catalog Number | Comments |
| 24 GA angiocatheter | BD Insyte Autoguard | 381412 | |
| 4-0 suture Black monofilament non absorbable suture | Ethicon | 1667 | Used to suture the E-collar to the back of the neck |
| 4-0 suture Coated Vicryl Plus Antibacterial | Ethicon | VCP496 | |
| Adson Tissue Forceps, 11 cm, 1 x 2 Teeth with Tying Platform | ASSI | ASSI.ATK26426 | |
| Bipolar cords | ASSI | 228000C | |
| Black Polyamide Monofilament USP 10-0, 4 mm 3/8c | AROSurgical | T04A10N07-13 | Used to perform the microvascular anastomoses |
| Buprenorphine HCl | Pharmaceutical, Inc | 42023-179-01 | |
| Dilating Forceps | Fine science tools (FST) | 18131-12 | |
| Dissecting Scissors 15 cm, Round Handle 8 mm diameter, Straight Slender Tapered Blade 7 mm, Lipshultz Pattern | ASSI | ASSI.SAS15RVL | |
| Double Micro Clamps 5.5 x 1.5 mm | Fine science tools (FST) | 18040-22 | |
| Elizabethan collar | Braintree Scientific | EC-R1 | |
| Forceps 13.5 cm long, Flat Handle, 9 mm wide Straight Tips 0.1 mm diameter (x2) | ASSI | ASSI.JFL31 | |
| Halsey Micro Needle Holder | Fine science tools (FST) | 12500-12 | |
| Heparin Lock Flush Solution, USP, 100 units/mL | BD PosiFlush | 306424 | |
| Isoflurane | Patterson Veterinary | 14043-704-06 | |
| Jewelers Bipolar Forceps Non Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Lone Star Elastic Stays | CooperSurgical | 3314-8G | Used to retract the inguinal ligament for femoral vessels dissection |
| Lone Star Self-Retaining Retractors | CooperSurgical | 3301G | |
| Micro-Mosquito Hemostats | Fine science tools (FST) | 13010-12 | Used to retract the inguinal fat pad distally |
| Needle Holder, 15 cm Round Handle, 8 mm diameter, Superfine Curved Jaw 0.2 mm tip diameter, without lock | ASSI | ASSI.B1582 | |
| Nylon Suture Black Monolfilament 8-0, 6.5 mm 3/8c | Ethilon | 2808G | Used to ligate collateral branches on the femoral vessels |
| Offset Bone Nippers | Fine science tools (FST) | 16101-10 | |
| S&T Vascular Clamps 5.5 x 1.5 mm | Fine science tools (FST) | 00398-02 | |
| Walton scissors | Fine science tools (FST) | 14077-09 |
参考文献
- Lanteiri, L., et al. Feasibility, reproducibility, risks and benefits of face transplantation: a prospective study of outcomes. American Journal of Transplantation. 11 (2), 367-378 (2011).
- Park, S. H., Eun, S. C., Kwon, S. T. Hand transplantation: current status and immunologic obstacles. Experimental and Clinical Transplantation. 17 (1), 97-104 (2019).
- Cetrulo, C. L., et al. Penis transplantation: first US experience. Annals of Surgery. 267 (5), 983-988 (2018).
- Grajek, M., et al. First complex allotransplantation of neck organs: larynx, trachea, pharynx, esophagus, thyroid, parathyroid glands, and anterior cervical wall: a case report. Annals of Surgery. 266 (2), 19-24 (2017).
- Pribaz, J. J., Caterson, E. J. Evolution and limitations of conventional autologous reconstruction of the head and neck. Journal of Craniofacial Surgery. 24 (1), 99-107 (2013).
- Lipson, R. A., et al. Vascularized limb transplantation in the rat. I. Results with syngeneic grafts. Transplantation. 35 (4), 293-299 (1983).
- Lipson, R. A., et al. Vascularized limb transplantation in the rat. II. Results with allogeneic grafts. Transplantation. 35 (4), 300-304 (1983).
- Adamson, L. A., et al. A modified model of hindlimb osteomyocutaneous flap for the study of tolerance to composite tissue allografts. Microsurgery. 27 (7), 630-636 (2007).
- Arav, A., Friedman, O., Natan, Y., Gur, E., Shani, N. Rat hindlimb cryopreservation and transplantation: a step toward "organ banking". American Journal of Transplantation. 17 (11), 2820-2828 (2017).
- Gok, E., et al. Development of an ex-situ limb perfusion system for a rodent model. ASAIO Journal. 65 (2), 167-172 (2019).
- Gok, E., Rojas-Pena, A., Bartlett, R. H., Ozer, K. Rodent skeletal muscle metabolomic changes associated with static cold storage. Transplantation Proceedings. 51 (3), 979-986 (2019).
- Brandacher, G., Grahammer, J., Sucher, R., Lee, W. P. Animal models for basic and translational research in reconstructive transplantation. Birth Defects Research. Part C, Embryo Today. 96 (1), 39-50 (2012).
- Fleissig, Y., et al. Modified heterotopic hindlimb osteomyocutaneous flap model in the rat for translational vascularized composite allotransplantation research. Journal of Visualized Experiments: JoVE. (146), e59458 (2019).
- Ulusal, A. E., Ulusal, B. G., Hung, L. M., Wei, F. C. Heterotopic hindlimb allotransplantation in rats: an alternative model for immunological research in composite-tissue allotransplantation. Microsurgery. 25 (5), 410-414 (2005).
- Jang, Y., Park, Y. E., Yun, C. W., Kim, D. H., Chung, H. The vest-collar as a rodent collar to prevent licking and scratching during experiments. Lab Anim. 50 (4), 296-304 (2016).
- Kern, B., et al. A novel rodent orthotopic forelimb transplantation model that allows for reliable assessment of functional recovery resulting from nerve regeneration. American Journal of Transplantation. 17 (3), 622-634 (2017).
- Perez-Abadia, G., et al. Low-dose immunosuppression in a rat hind-limb transplantation model. Transplant International. 16 (12), 835-842 (2003).
- Sucher, R., et al. Orthotopic hind-limb transplantation in rats. Journal of Visualized Experiments. (41), e2022 (2010).
- Fleissig, Y. Y., Beare, J. E., LeBlanc, A. J., Kaufman, C. L. Evolution of the rat hind limb transplant as an experimental model of vascularized composite allotransplantation: Approaches and advantages. SAGE Open Medicine. 8, 2050312120968721 (2020).
- Lindboe, C. F., Presthus, J. Effects of denervation, immobilization and cachexia on fibre size in the anterior tibial muscle of the rat. Acta Neuropathologica. 66 (1), 42-51 (1985).
- Nazzal, J. A., Johnson, T. S., Gordon, C. R., Randolph, M. A., Lee, W. P. Heterotopic limb allotransplantation model to study skin rejection in the rat. Microsurgery. 24 (6), 448-453 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。