Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Модель частичной гетеротопной трансплантации задних налимов у крыс
* Эти авторы внесли равный вклад
В этой статье
Резюме
В этой статье представлен протокол частичной гетеротопной трансплантации остеомиокожного лоскута у крыс и ее потенциальные результаты в среднесрочном последующем наблюдение.
Аннотация
Васкуляризированные композитные аллотрансплантации (VCA) представляют собой наиболее продвинутый вариант реконструкции для пациентов без аутологичные хирургические возможности после сложного дефекта тканей. Трансплантация лица и рук изменила жизнь изуродованных пациентов, придав им новый эстетический и функциональный социальный орган. Несмотря на многообещающие результаты, VCA по-прежнему отстает из-за пожизненных сопутствующих заболеваний иммуносупрессии и инфекционных осложнений. Крыса является идеальной животной моделью для исследований in vivo, изучающих иммунологические пути и механизмы отторжения трансплантата. Крысы также широко используются в новых методах сохранения композитных тканевых трансплантатов, включая исследования перфузии и криоконсервации. Модели, используемые для VCA у крыс, должны быть воспроизводимыми, надежными и эффективными с низкой послеоперационной заболеваемостью и смертностью. Гетеротопные процедуры трансплантации конечностей соответствуют этим критериям и их легче выполнить, чем ортотопическую трансплантацию конечностей. Освоение микрохирургических моделей грызунов требует солидного опыта в микрохирургии и уходе за животными. В настоящем документе представлена достоверная и воспроизводимая модель частичной гетеротопной трансплантации остеокожной лоскутной лоскута у крыс, послеоперационные исходы и средства профилактики потенциальных осложнений.
Введение
За последние два десятилетия VCA развивался как революционное лечение для пациентов, которые страдают от тяжелого обезображивание, включая лицо1,ампутации верхних конечностей2,полового клетки3и другие сложные дефекты тканей4,5. Однако последствия пожизненной иммуносупрессии по-прежнему препятствуют более широкому применению этих сложных реконструктивных операций. Фундаментальные исследования имеют решающее значение для улучшения стратегий борьбы с отторжением. Увеличение времени сохранения VCA также имеет важное значение для улучшения логистики трансплантации и увеличения донорского пула (поскольку доноры VCA должны соответствовать большему объему критериев, чем доноры твердых органов, включая тон кожи, анатомический размер, пол). В этом контексте трансплантация конечностей крыс широко используется в исследованиях иммунного отторжения аллотрансплантатов6,7,новых протоколов индукции толерантности8и исследований сохранения9,10,11. Следовательно, эти модели VCA являются ключевым элементом для освоения трансляционных исследований VCA.
Остеокожные лоскуты были описаны в литературе как надежные модели для изучения VCA у крыс8,12,13,14. Хотя ортотопическая трансплантация целых конечностей позволяет проводить долгосрочную оценку функции трансплантата, это трудоемкая процедура, связанная с более высокими показателями послеоперационной заболеваемости и смертности14. Напротив, гетеротопные модели трансплантации конечностей нефункциональны, но позволяют воспроизводить исследования VCA. Послеоперационные исходы можно достоверно предвидеть до начала исследования по трансплантации VCA на крысах. В этом исследовании сообщается о частичной гетеротопной модели трансплантации остеомиокожного лоскута у крысы, которая включает частые возможные исходы и осложнения, которые могут возникнуть внутриоперационно и послеоперационно в течение периода наблюдения в три недели.
протокол
Все животные получали гуманую помощь в соответствии с Руководством NIH по уходу за лабораторными животными и их использованию. Институциональный комитет по уходу за животными и их использованию (IACUC-protocol 2017N000184) и Управление по уходу за животными и их использованию (ACURO) одобрили все протоколы для животных. Инбредные самцы крыс Льюиса (250-400 г) использовались для всех экспериментов.
1. Хирургия
- Обезболивайте крыс Льюиса с помощью ингаляции изофлурана. Индуцировать анестезию 5% изофлураном в индукционной камере и поддерживать анестезию с 1,5-3% вдыханием изофлурана через дыхательный конус.
- Применяйте глазную смазку перед операцией в процедурах выживания. Побрить место операции, обработать кремом для депиляции, скрабом и драпировать стерильными шторами.
- Подтвердите полную анестезию с помощью теста на щипки носа перед разрезом и регулярно во время процедуры. Контролируйте частоту сердечных и дыхательных путей на протяжении всей процедуры. Для всех операций поддерживайте стерильные условия с помощью стерильных инструментов, расходных материалов, штор и перчаток. Список инструментов, используемых для процедур, приведен в Таблице материалов.
2. Частичное приобретение заднего задней частичного права
- Сделайте окружной разрез кожи над лодыжкой в дистальной трети ноги.
- Скелетонизируют и прижигают подкожную артерию и терминальную ветвь подколенной артерии с помощью биполярных щипцов. Прижигайте и отрезайте икроножные мышцы, камбалу, переднюю и двуберцовую мышцы бедра до тех пор, пока большеберцовая кость не будет открыта.
- Сделайте разрез 2,5 см в правой паховой складке. Рассеките паховую жировую подушку и втяните ее дистально, чтобы обнажить бедренные сосуды. Используйте втягивающее машину для захвата паховой связки и зажимные щипцы, чтобы держать паховую жировую подушку дистально.
ПРИМЕЧАНИЕ: Паховая жировая подушка включается в сбор частичной конечности. - Рассечение бедренных сосудов, индивидуализация ветвей Мерфи (глубокие мышечные коллатеральные ветви обычно расположены на полпути между паховой связкой и эпигастральной ветвью) и лигата с 8-0 нейлоновые галстуки.
- Гепаринизировать крысу-донора 100 МЕ/кг гепарина, вводимого в дорсальную вену полового железа с помощью иглы 27,5 г.
- Завершите разрез кожи вокруг бедра.
- Прижигают бицепс бедра и ягодичную мышцу с помощью биполярных щипцов. Прижижьте и перережьте седалищный нерв на средней длине бедренной кости. Обнажают бедренную комть проксимально на уровне заднего бедренного гребня.
ПРИМЕЧАНИЕ: Мышцы аддуктора и квадрицепса исключены из закупки. Безымяная педикула сохранилась. - Лигат бедренных сосудов с 8/0 нейлоновыми завязками на уровне паховой связки. Выполните артериотомию бедренной артерии чуть ниже лигатуры и расширьте, чтобы обеспечить введение ангиокатетера 24 G.
- Прижигите и разрежьте оставшуюся мышцу под педикулой, обнажив переднюю сторону бедренной кости.
- Разрезайте большеберцовую и бедренную кости с помощью костяного резца как можно более проксимально и дистально соответственно (средней длины).
- Промыть частичную заднюю конечность 2 мл гепаринового физиологического раствора (100 МЕ/мл) для получения прозрачного венозного оттока. Хранить на льду в стерильной марле до микрососудистогопереноса (рисунок 1).
- Пока животное находится под общим наркозом, выполняйте эвтаназию путем экссангинации до тех пор, пока животное не покажет никаких признаков жизни (никаких дыхательных движений и сердцебиения).

Рисунок 1:Крысы частично заготавливают задние налимы. Ангиокарт 24 Г вводится в бедренную артерию, готовую к гетеротопному микрососудистой передаче. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Хирургия реципиента
- Перед разрезом побрейте заднюю часть шеи и вводят бупренорфин 0,01-0,05 мг/кг подкожно. Поместите крысу в лежачем положении на грелке.
- Сделайте разрез 2,5 см в правой паховой складке. Рассеките паховую жировую подушку и откидывайте ее дистально, чтобы обнажить бедренные сосуды. Используйте крючок, чтобы втянуть паховую связку и зажимные щипцы, чтобы держать паховую жировую подушку дистально.
- Рассекте бедренные сосуды, индивидуализируйте ветви Мерфи и обжайте с помощью 8/0 нейлоновых завязок.
- Раздвигайте оба сосуда над эпигастральными сосудами с помощью 8/0 нейлоновых связей. Расположите аппроксиматорные зажимы проксимально и расширите концы сосудов; промыть гепарином физиологическим раствором.
- Сделайте разрез на левом боку над бедром, и создайте подкожный карман с подкожным туннелем к паховой складке.
ПРИМЕЧАНИЕ: Разрез вставки делается выше диапазона движения бедра, чтобы гарантировать, что животное поддерживает нормальное движение задней конечности. Кроме того, поддержание кожного моста между вставкой трансплантата и местом микрососудистого переноса позволяет лучше фиксировать трансплантат(рисунок 2). - Поместите проксимальную часть частичной конечности и паховую жировую подушку через подкожный туннель для микрососудистого переноса. Выполняйте венозные и артериальные анастомозы с использованием 10/0 нейлоновых швов. Снимите оба аппроксиматорных зажима и наблюдайте за реваскуляризацией конечности. Выполните «тест на доение» на обоих сосудах, чтобы оценить проходимость каждого анастомоза.
ПРИМЕЧАНИЕ: Восемь-девять швов обычно необходимы для венозного анастомоза, 6 швов в среднем для артериального анастомоза. - Сделайте продольный разрез кожи на медиальную сторону пересаженная конечность и вставьте трансплантат. Удалите лишнюю кожу трансплантата и закройте рану отдельными швами и бегущим швом с помощью рассасывающихся швов 4/0.
- Сшивайте паховые жировые подушечки пересаженного конечности и реципиента с помощью двух отдельных рассасывающихся швов, а паховую складку закрывают на самом конце после последнего осмотра микрососудистых анастомозов.
ПРИМЕЧАНИЕ: Паховые жировые подушечки плотно зашиваются, чтобы добавить защитный слой жира над анастомозами и обеспечить надежное положение трансплантата и его цветоножки. Тщательное закрытие лучше для заживления ран; он также предотвращает остаточное кровотечение из раны и снижает риск членовредительства. - Компенсируют потерю жидкости подкожно 1-3 мл физиологического раствора в зависимости от количества периоперационного кровотечения.
- Поместите елизаветинский ошейник на шею животного, и нанесите 2 свободных шва на кожу, чтобы сохранить ее в правильном положении.
- Прекратите вдыхание изофлурана и постоянно наблюдайте за животным на согревающей подушке до полного сознания и амбулаторного состояния.
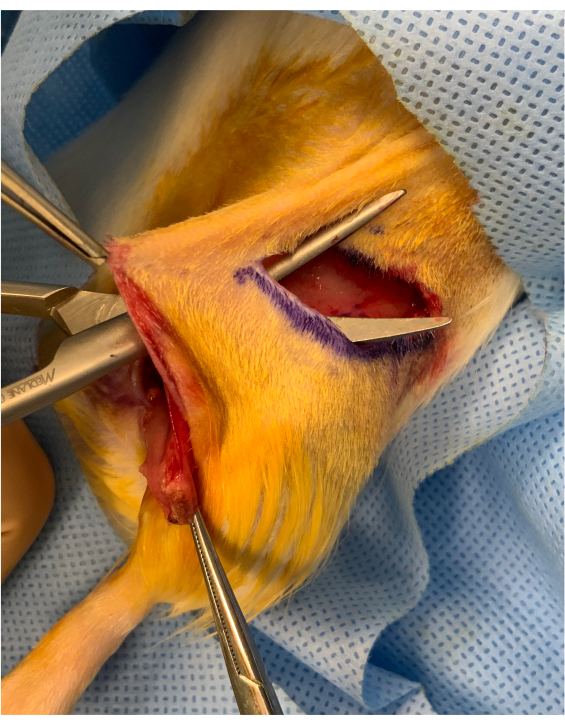
Рисунок 2:Периоперационное изображение перед врезки остеокожной конечности. Между паховым срезом и вставкой трансплантата над бедром сохраняется кожный мост примерно 1 см. Трансплантат помещается под мост, поддерживая его устойчивым для микрососудистого переноса. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Послеоперационный уход
- Наведите наблюдение за животным два раза в день в течение 72 часов, затем один раз в день до послеоперационного дня (POD) 7, а затем два раза в неделю.
ПРИМЕЧАНИЕ: Мониторинг должен быть адаптирован к состоянию животных и трансплантата (бледные глаза могут потребовать дополнительных жидкостей, окрашивание порфирином в качестве индикатора боли животных, аномальный цвет / температура трансплантата), и дальнейший уход должен быть обсужден с ветеринаром. Одиночное жилье требуется для крыс-реципиентов в течение всего периода исследования, чтобы избежать любого повреждения трансплантата. - Выполняйте обезболивание с подкожной инъекцией бупренорфина и/или нестероидного противовоспалительного препарата в соответствии с руководящими принципами IACUC.
- Оцените трансплантат и ежедневно выполняйте физический осмотр с помощью снимков с использованием одного и того же устройства.
ПРИМЕЧАНИЕ: Использование крема для удаления волос на коже трансплантата полезно для лучшей оценки цвета кожи трансплантата.
Результаты
В этом однооператорном исследовании было выполнено 30 сингенных гетеротопных частичных трансплантаций конечностей. Успех определялся на 21-й послеоперационный день как отсутствие неудачи ВКА или осложнений, требующих эвтаназии. Нормальная эволюция трансплантата представлена
Обсуждение
Ортотопические модели трансплантации конечностей у грызунов были описаны в литературе15,16,17; однако они требуют восстановления нервов, повторного скрепления мышц и идеального остеосинтеза бедренной кости, что может быть очень трудным...
Раскрытие информации
Авторы не раскрывают информацию.
Благодарности
Эта работа была поддержана Канцелярией помощника министра обороны по вопросам здравоохранения через Программу медицинских исследований, направляемую Конгрессом под номером премии. W81XWH-17-1-0680. Мнения, интерпретации, выводы и рекомендации являются мнениями авторов и не обязательно одобряются Министерством обороны.
Материалы
| Name | Company | Catalog Number | Comments |
| 24 GA angiocatheter | BD Insyte Autoguard | 381412 | |
| 4-0 suture Black monofilament non absorbable suture | Ethicon | 1667 | Used to suture the E-collar to the back of the neck |
| 4-0 suture Coated Vicryl Plus Antibacterial | Ethicon | VCP496 | |
| Adson Tissue Forceps, 11 cm, 1 x 2 Teeth with Tying Platform | ASSI | ASSI.ATK26426 | |
| Bipolar cords | ASSI | 228000C | |
| Black Polyamide Monofilament USP 10-0, 4 mm 3/8c | AROSurgical | T04A10N07-13 | Used to perform the microvascular anastomoses |
| Buprenorphine HCl | Pharmaceutical, Inc | 42023-179-01 | |
| Dilating Forceps | Fine science tools (FST) | 18131-12 | |
| Dissecting Scissors 15 cm, Round Handle 8 mm diameter, Straight Slender Tapered Blade 7 mm, Lipshultz Pattern | ASSI | ASSI.SAS15RVL | |
| Double Micro Clamps 5.5 x 1.5 mm | Fine science tools (FST) | 18040-22 | |
| Elizabethan collar | Braintree Scientific | EC-R1 | |
| Forceps 13.5 cm long, Flat Handle, 9 mm wide Straight Tips 0.1 mm diameter (x2) | ASSI | ASSI.JFL31 | |
| Halsey Micro Needle Holder | Fine science tools (FST) | 12500-12 | |
| Heparin Lock Flush Solution, USP, 100 units/mL | BD PosiFlush | 306424 | |
| Isoflurane | Patterson Veterinary | 14043-704-06 | |
| Jewelers Bipolar Forceps Non Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Lone Star Elastic Stays | CooperSurgical | 3314-8G | Used to retract the inguinal ligament for femoral vessels dissection |
| Lone Star Self-Retaining Retractors | CooperSurgical | 3301G | |
| Micro-Mosquito Hemostats | Fine science tools (FST) | 13010-12 | Used to retract the inguinal fat pad distally |
| Needle Holder, 15 cm Round Handle, 8 mm diameter, Superfine Curved Jaw 0.2 mm tip diameter, without lock | ASSI | ASSI.B1582 | |
| Nylon Suture Black Monolfilament 8-0, 6.5 mm 3/8c | Ethilon | 2808G | Used to ligate collateral branches on the femoral vessels |
| Offset Bone Nippers | Fine science tools (FST) | 16101-10 | |
| S&T Vascular Clamps 5.5 x 1.5 mm | Fine science tools (FST) | 00398-02 | |
| Walton scissors | Fine science tools (FST) | 14077-09 |
Ссылки
- Lanteiri, L., et al. Feasibility, reproducibility, risks and benefits of face transplantation: a prospective study of outcomes. American Journal of Transplantation. 11 (2), 367-378 (2011).
- Park, S. H., Eun, S. C., Kwon, S. T. Hand transplantation: current status and immunologic obstacles. Experimental and Clinical Transplantation. 17 (1), 97-104 (2019).
- Cetrulo, C. L., et al. Penis transplantation: first US experience. Annals of Surgery. 267 (5), 983-988 (2018).
- Grajek, M., et al. First complex allotransplantation of neck organs: larynx, trachea, pharynx, esophagus, thyroid, parathyroid glands, and anterior cervical wall: a case report. Annals of Surgery. 266 (2), 19-24 (2017).
- Pribaz, J. J., Caterson, E. J. Evolution and limitations of conventional autologous reconstruction of the head and neck. Journal of Craniofacial Surgery. 24 (1), 99-107 (2013).
- Lipson, R. A., et al. Vascularized limb transplantation in the rat. I. Results with syngeneic grafts. Transplantation. 35 (4), 293-299 (1983).
- Lipson, R. A., et al. Vascularized limb transplantation in the rat. II. Results with allogeneic grafts. Transplantation. 35 (4), 300-304 (1983).
- Adamson, L. A., et al. A modified model of hindlimb osteomyocutaneous flap for the study of tolerance to composite tissue allografts. Microsurgery. 27 (7), 630-636 (2007).
- Arav, A., Friedman, O., Natan, Y., Gur, E., Shani, N. Rat hindlimb cryopreservation and transplantation: a step toward "organ banking". American Journal of Transplantation. 17 (11), 2820-2828 (2017).
- Gok, E., et al. Development of an ex-situ limb perfusion system for a rodent model. ASAIO Journal. 65 (2), 167-172 (2019).
- Gok, E., Rojas-Pena, A., Bartlett, R. H., Ozer, K. Rodent skeletal muscle metabolomic changes associated with static cold storage. Transplantation Proceedings. 51 (3), 979-986 (2019).
- Brandacher, G., Grahammer, J., Sucher, R., Lee, W. P. Animal models for basic and translational research in reconstructive transplantation. Birth Defects Research. Part C, Embryo Today. 96 (1), 39-50 (2012).
- Fleissig, Y., et al. Modified heterotopic hindlimb osteomyocutaneous flap model in the rat for translational vascularized composite allotransplantation research. Journal of Visualized Experiments: JoVE. (146), e59458 (2019).
- Ulusal, A. E., Ulusal, B. G., Hung, L. M., Wei, F. C. Heterotopic hindlimb allotransplantation in rats: an alternative model for immunological research in composite-tissue allotransplantation. Microsurgery. 25 (5), 410-414 (2005).
- Jang, Y., Park, Y. E., Yun, C. W., Kim, D. H., Chung, H. The vest-collar as a rodent collar to prevent licking and scratching during experiments. Lab Anim. 50 (4), 296-304 (2016).
- Kern, B., et al. A novel rodent orthotopic forelimb transplantation model that allows for reliable assessment of functional recovery resulting from nerve regeneration. American Journal of Transplantation. 17 (3), 622-634 (2017).
- Perez-Abadia, G., et al. Low-dose immunosuppression in a rat hind-limb transplantation model. Transplant International. 16 (12), 835-842 (2003).
- Sucher, R., et al. Orthotopic hind-limb transplantation in rats. Journal of Visualized Experiments. (41), e2022 (2010).
- Fleissig, Y. Y., Beare, J. E., LeBlanc, A. J., Kaufman, C. L. Evolution of the rat hind limb transplant as an experimental model of vascularized composite allotransplantation: Approaches and advantages. SAGE Open Medicine. 8, 2050312120968721 (2020).
- Lindboe, C. F., Presthus, J. Effects of denervation, immobilization and cachexia on fibre size in the anterior tibial muscle of the rat. Acta Neuropathologica. 66 (1), 42-51 (1985).
- Nazzal, J. A., Johnson, T. S., Gordon, C. R., Randolph, M. A., Lee, W. P. Heterotopic limb allotransplantation model to study skin rejection in the rat. Microsurgery. 24 (6), 448-453 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены