このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ラットにおける部分的な異所性後肢移植モデル
* これらの著者は同等に貢献しました
要約
本論文は、ラットにおける部分的な異所性骨髄性骨切りばん移植プロトコルと、中期的なフォローアップにおけるその潜在的な結果を提示する。
要約
血管化複合同種移植(VCA)は、複雑な組織欠損後の自家外科的可能性のない患者にとって最も先進的な再建オプションを表す。顔と手の移植は、失踪した患者の生活を変え、新しい美的で機能的な社会的器官を与えました。有望な結果にもかかわらず、VCAは生涯にわたる免疫抑制の併存疾患および感染性合併症のために依然として不全である。ラットは、免疫経路と移植片拒絶メカニズムを調査する インビボ 研究のための理想的な動物モデルです。ラットはまた、灌流および凍結保存研究を含む新規複合組織移植片保存技術にも広く使用されている。ラットのVCAに使用されるモデルは、術後の罹患率と死亡率が低く、再現性、信頼性、効率的でなければなりません。異所性四肢移植手順はこれらの基準を満たし、整形性肢移植よりも容易に行うことができます。げっ歯類の微小外科モデルを習得するには、マイクロサージャストと動物ケアにおける確かな経験が必要です。本明細書では、ラットにおける部分的な異形性骨筋切裂フラップ移植、術後の転帰、および潜在的合併症の予防手段の信頼性と再現性モデルが報告されている。
概要
過去20年間、VCAは顔1、上肢切断2、陰茎3、その他の複雑な組織欠損4、5を含む重度の欠損に苦しむ患者のための革命的な治療法として進化してきました。しかし、生涯にわたる免疫抑制の結果は、依然としてこれらの複雑な再建手術のより広範な適用を妨げている。拒絶反応防止戦略を改善するには、基礎研究が不可欠です。VCA保存時間の増加は、移植物流を改善し、ドナープールを増やすためにも不可欠です(VCAドナーは、皮膚のトーン、解剖学的サイズ、性別を含む固体臓器提供者よりも多くの基準を満たす必要があります)。この文脈において、ラット四肢移植は、同種移植片6、7、新規耐性誘導プロトコル8、および保存研究9、10、11の免疫拒絶反応に関する研究で広く使用されている。したがって、これらのVCAモデルは、VCA翻訳研究のために習得する重要な要素です。
骨筋皮折れはラット8、12、13、14でVCAを研究する信頼性の高いモデルとして文献に記載されている。異形性外接合体全四肢移植は移植片機能の長期評価を可能にするが、術後の罹患率および死亡率14の上昇に伴う時間のかかる処置である。対照的に、異所性肢移植モデルは機能しないが、VCAに関する再現性のある研究を可能にする。術後の結果は、ラットVCA移植研究の開始前に確実に予想することができる。本研究は、ラットにおける部分的な異所性骨髄皮下フラップ移植モデルを報告し、3週間のフォローアップ期間中に術中および術後に起こり得る頻繁な結果および合併症を含む。
プロトコル
すべての動物は、実験動物のケアと使用のためのNIHガイドに従って人道的ケアを受けました。施設動物のケアと使用委員会(IACUCプロトコル2017N000184)と動物ケアと使用レビューオフィス(ACURO)は、すべての動物プロトコルを承認しました。全ての実験に対して、近親交配オスルイスラット(250〜400g)を用いた。
1. 手術
- イオブルラン吸入を使用してルイスラットを麻酔します。誘導室で5%イオブルランで麻酔を誘発し、呼吸コーンを通して1.5〜3%のイオブルラン吸入で麻酔を維持する。
- 生存手順で手術前に眼潤滑剤を塗布する。手術部位を剃り、脱毛クリームで治療し、スクラブし、滅菌ドレープでドレープします。
- 切開前および処置中に定期的につま先ピンチテストで全麻酔を確認します。全手順を通して心臓と呼吸の速度を監視します。すべての手術のために、無菌の器具、消耗品、ドレープ、手袋を使用して、無菌状態を維持します。手順に使用する計測器のリストについては、 材料表 を参照してください。
2. ドナー権利部分後肢調達
- 脚の遠位 3 分の 1 で足首の上の皮膚の周回切開を行います。
- 双極鉗子を用いて、伏在性動脈および大窩動脈の末端枝を骨格化し、焼灼する。発送し、脛骨が露出するまで胃腸、ソレウス、脛骨前、上腕二頭筋の筋肉を遮断する。
- 右のりぐるしで2.5cmの切開を行います。りうるう脂肪パッドを解剖し、遠ざけ、大腿骨の血管を露出させる。魚のフックレトラクターを使用して、イングイナル靭帯とクランプ鉗子を把握して、インジナル脂肪パッドを遠位に保持します。
注: このイングイナル脂肪パッドは、部分的な四肢の収穫に含まれる。 - 大腿血管を解剖し、マーフィーの枝(通常、りんぐりと上皮枝の中間に位置する深部筋側副枝)を個別化し、8-0でリゲートするナイロンネクタイ。
- ドナーラットを100 IU/kgヘパリンでヘパリン化し、27.5G針を使用して陰茎の側側静脈に注入する。
- 股関節の周りの皮膚切開を完了します。
- 双極鉗子を用いて二頭筋大腿筋及び臀部の表面筋を焼灼する。大腿骨の中枢で坐骨神経を焼灼して切る。大腿骨を後腿骨の頂上のレベルで近位に露出する。
注:内転筋と四頭筋は調達から取り残されます。ノミネートペディクルは保存されます。 - りぎりの靭帯のレベルで8/0ナイロンの結びつきを持つ大腿血管をリゲート。合字のすぐ下の大腿動脈に動脈管を行い、24Gの血管カテーテルを挿入できるように拡張する。
- ペディクルの下に残りの筋肉を焼灼して切断し、大腿骨の前側を露出させる。
- 骨カッターを使用して脛骨と大腿骨を、それぞれ可能な限り近位および遠位(中長)に切ります。
- ヘパリン生理食い (100 IU/mL) の 2 mL で部分後肢を洗い流して、明確な静脈流出を得る。微小血管移動まで滅菌ガーゼに氷の上に保管する(図1)。
- 動物が全身麻酔下にある間、動物が生命の兆候を示さないまで(呼吸運動も心拍もない)まで、興奮によって安楽死を行う。

図1:ラット部分後肢採取 24Gの血管カスが大腿動脈に挿入され、異所性微小血管移動の準備が整う。 この図の大きなバージョンを表示するには、ここをクリックしてください。
3. 受け取り手術
- 切開前に、首の後ろを剃り、ブプレノルフィン0.01-0.05mg/kgを皮下に投与する。ラットを加熱パッドの上の上のサピーヌの位置に置きます。
- 右のりぐるしに2.5cmの切開を行います。うっとりした脂肪パッドを解剖し、遠位にリクライニングして大腿骨の血管を露出させる。フックを使用して、イングイナル靭帯とクランプ鉗子を引き込み、イングイナル脂肪パッドを遠位に保持します。
- 大腿骨の血管を解剖し、マーフィーの枝を個別化し、8/0ナイロンタイでリゲートします。
- 8/0ナイロンタイを使用して、上頭血管の上に両方の容器をリゲートします。近似クランプを近位に配置し、容器の端部を拡張します。ヘパリン生理食糸ですすい。
- 腰の上の左側面に切開を行い、皮下の折り目に皮下トンネルを持つ皮下ポケットを作成します。
注:インセット切開は、動物が正常な後肢運動を維持することを確実にするために、股関節の動きの範囲の上に作られています。さらに、移植片の差し込みと微小血管移動部位との間に切妻架橋を保つことで、移植片の固定性を向上できる(図2)。 - 微小血管移動のために、部分的な四肢の近位部分と皮下脂肪パッドを皮下トンネルに入れる。10/0ナイロン縫合糸を使用して静脈および動脈性アナストモーゼを行います。両方の近似クランプを取り外し、四肢の再血管化を観察する。両血管に対して「搾乳試験」を行い、各吻合の愛知を評価する。
注:静脈吻合には通常8~9本の縫合糸が必要で、動脈吻合では平均6縫合糸が必要です。 - 移植した四肢の内側側に縦方向皮膚切開を行い、移植片を挿入する。移植片の余分な皮膚を取り除き、吸収可能な4/0縫合糸を使用して別々の縫合糸とランニング縫合糸で創傷を閉じます。
- 移植された四肢のイングイナル脂肪パッドと2つの別々の吸収性縫合糸を使用してレシピエントを合わせて、微小血管性アナストモーセの最後の検査の後、最後の最後の端に歯深い折り目を閉じる。
注:インギナル脂肪パッドは、アナストモーゼの上に脂肪の保護層を追加し、移植片とそのペディクルの安全な位置を確保するためにしっかりと縫合されています。細心の注意を払った閉鎖は創傷治癒に適している。また、創傷からの残留出血を防ぎ、自己突然変異のリスクを減少させる。 - 周術期出血量に応じて、1-3 mLの生理食糸で皮下に水分損失を補償する。
- 動物の首の周りにエリザベスカラーを置き、正しい位置にそれを維持するために皮膚に2つの緩い縫合糸を適用します。
- イオブルラン吸入を停止し、完全に意識し、歩行するまで、温暖化パッド上で動物を継続的に監視します。
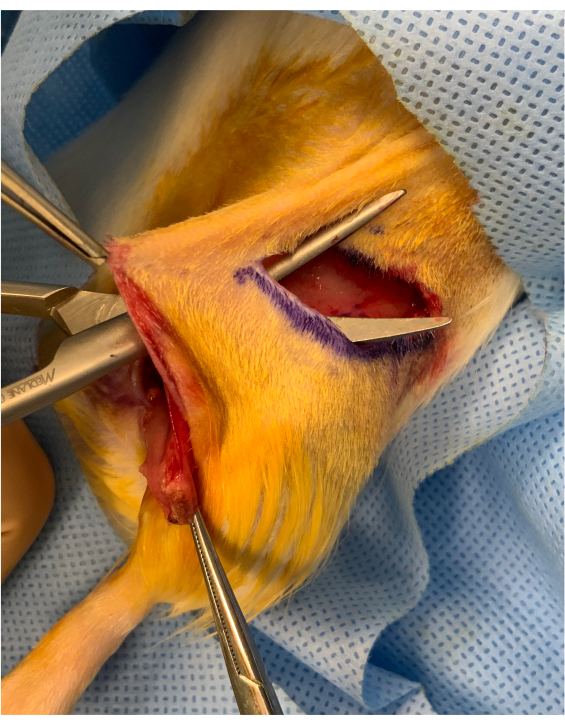
図2:骨筋皮切四肢の発症前の周術期画像 約1cmの切開ブリッジは、りとり折り目の切開と股関節上部の移植片の差との間に保存されます。移植片は橋の下に置かれ、微小血管移動のために安定した状態を保つ。 この図の大きなバージョンを表示するには、ここをクリックしてください。
4. 術後ケア
- 動物を1日2回72時間監視し、術後日(POD)7まで1日1回、週に2回監視する。
注:モニタリングは、動物や移植片の状態に調整する必要があります(淡い目は、動物の痛みの指標として補充液、ポルフィリン染色、異常な移植片の色/温度を必要とする可能性があります)、獣医とさらなる注意を検討する必要があります。単一のハウジングは、移植片への損傷を避けるために、研究期間中にレシピエントラットに必要とされる。 - IACUC ガイドラインに従ってブプレノルフィンおよび/または非ステロイド抗炎症薬の皮下注射で鎮痛を行う.
- 移植片を評価し、同じ装置を使用して写真を使用して毎日身体検査を行います。
注:移植片の皮膚に脱毛クリームを使用すると、移植の皮膚の色をよりよく評価するのに役立ちます。
結果
本単一オペレータ研究では、30の異質性異重性局所的な四肢移植が行われた。成功は術後21日目にVCA障害または安楽死を必要とする合併症の欠如として定義された。移植片の正常な進化は 図3に示されている。レシピエントにおける部分的な四肢調達および移植片の差し込みのための平均持続時間は、それぞれ35と105分であった。平均虚血時間は105分であった。フォロー?...
ディスカッション
げっ歯類における異形肢移植モデルは文献15,16,17に記載されている。しかし、彼らは神経修復、筋肉の再付着、および非常に困難なステップである大腿骨の完璧な骨合成を必要とします。これらのモデルはまた、げっ歯類14におけるより高い罹患率および死亡率と関連しており、特に移植後肢の正常な機?...
開示事項
著者は開示を持っていません。
謝辞
この作品は、賞No.の下で議会主導の医学研究プログラムを通じて保健問題担当国防次官補室によって支援されました。W81XWH-17-1-0680.意見、解釈、結論、および勧告は著者のものであり、必ずしも国防総省によって承認されるとは限りません。
資料
| Name | Company | Catalog Number | Comments |
| 24 GA angiocatheter | BD Insyte Autoguard | 381412 | |
| 4-0 suture Black monofilament non absorbable suture | Ethicon | 1667 | Used to suture the E-collar to the back of the neck |
| 4-0 suture Coated Vicryl Plus Antibacterial | Ethicon | VCP496 | |
| Adson Tissue Forceps, 11 cm, 1 x 2 Teeth with Tying Platform | ASSI | ASSI.ATK26426 | |
| Bipolar cords | ASSI | 228000C | |
| Black Polyamide Monofilament USP 10-0, 4 mm 3/8c | AROSurgical | T04A10N07-13 | Used to perform the microvascular anastomoses |
| Buprenorphine HCl | Pharmaceutical, Inc | 42023-179-01 | |
| Dilating Forceps | Fine science tools (FST) | 18131-12 | |
| Dissecting Scissors 15 cm, Round Handle 8 mm diameter, Straight Slender Tapered Blade 7 mm, Lipshultz Pattern | ASSI | ASSI.SAS15RVL | |
| Double Micro Clamps 5.5 x 1.5 mm | Fine science tools (FST) | 18040-22 | |
| Elizabethan collar | Braintree Scientific | EC-R1 | |
| Forceps 13.5 cm long, Flat Handle, 9 mm wide Straight Tips 0.1 mm diameter (x2) | ASSI | ASSI.JFL31 | |
| Halsey Micro Needle Holder | Fine science tools (FST) | 12500-12 | |
| Heparin Lock Flush Solution, USP, 100 units/mL | BD PosiFlush | 306424 | |
| Isoflurane | Patterson Veterinary | 14043-704-06 | |
| Jewelers Bipolar Forceps Non Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Lone Star Elastic Stays | CooperSurgical | 3314-8G | Used to retract the inguinal ligament for femoral vessels dissection |
| Lone Star Self-Retaining Retractors | CooperSurgical | 3301G | |
| Micro-Mosquito Hemostats | Fine science tools (FST) | 13010-12 | Used to retract the inguinal fat pad distally |
| Needle Holder, 15 cm Round Handle, 8 mm diameter, Superfine Curved Jaw 0.2 mm tip diameter, without lock | ASSI | ASSI.B1582 | |
| Nylon Suture Black Monolfilament 8-0, 6.5 mm 3/8c | Ethilon | 2808G | Used to ligate collateral branches on the femoral vessels |
| Offset Bone Nippers | Fine science tools (FST) | 16101-10 | |
| S&T Vascular Clamps 5.5 x 1.5 mm | Fine science tools (FST) | 00398-02 | |
| Walton scissors | Fine science tools (FST) | 14077-09 |
参考文献
- Lanteiri, L., et al. Feasibility, reproducibility, risks and benefits of face transplantation: a prospective study of outcomes. American Journal of Transplantation. 11 (2), 367-378 (2011).
- Park, S. H., Eun, S. C., Kwon, S. T. Hand transplantation: current status and immunologic obstacles. Experimental and Clinical Transplantation. 17 (1), 97-104 (2019).
- Cetrulo, C. L., et al. Penis transplantation: first US experience. Annals of Surgery. 267 (5), 983-988 (2018).
- Grajek, M., et al. First complex allotransplantation of neck organs: larynx, trachea, pharynx, esophagus, thyroid, parathyroid glands, and anterior cervical wall: a case report. Annals of Surgery. 266 (2), 19-24 (2017).
- Pribaz, J. J., Caterson, E. J. Evolution and limitations of conventional autologous reconstruction of the head and neck. Journal of Craniofacial Surgery. 24 (1), 99-107 (2013).
- Lipson, R. A., et al. Vascularized limb transplantation in the rat. I. Results with syngeneic grafts. Transplantation. 35 (4), 293-299 (1983).
- Lipson, R. A., et al. Vascularized limb transplantation in the rat. II. Results with allogeneic grafts. Transplantation. 35 (4), 300-304 (1983).
- Adamson, L. A., et al. A modified model of hindlimb osteomyocutaneous flap for the study of tolerance to composite tissue allografts. Microsurgery. 27 (7), 630-636 (2007).
- Arav, A., Friedman, O., Natan, Y., Gur, E., Shani, N. Rat hindlimb cryopreservation and transplantation: a step toward "organ banking". American Journal of Transplantation. 17 (11), 2820-2828 (2017).
- Gok, E., et al. Development of an ex-situ limb perfusion system for a rodent model. ASAIO Journal. 65 (2), 167-172 (2019).
- Gok, E., Rojas-Pena, A., Bartlett, R. H., Ozer, K. Rodent skeletal muscle metabolomic changes associated with static cold storage. Transplantation Proceedings. 51 (3), 979-986 (2019).
- Brandacher, G., Grahammer, J., Sucher, R., Lee, W. P. Animal models for basic and translational research in reconstructive transplantation. Birth Defects Research. Part C, Embryo Today. 96 (1), 39-50 (2012).
- Fleissig, Y., et al. Modified heterotopic hindlimb osteomyocutaneous flap model in the rat for translational vascularized composite allotransplantation research. Journal of Visualized Experiments: JoVE. (146), e59458 (2019).
- Ulusal, A. E., Ulusal, B. G., Hung, L. M., Wei, F. C. Heterotopic hindlimb allotransplantation in rats: an alternative model for immunological research in composite-tissue allotransplantation. Microsurgery. 25 (5), 410-414 (2005).
- Jang, Y., Park, Y. E., Yun, C. W., Kim, D. H., Chung, H. The vest-collar as a rodent collar to prevent licking and scratching during experiments. Lab Anim. 50 (4), 296-304 (2016).
- Kern, B., et al. A novel rodent orthotopic forelimb transplantation model that allows for reliable assessment of functional recovery resulting from nerve regeneration. American Journal of Transplantation. 17 (3), 622-634 (2017).
- Perez-Abadia, G., et al. Low-dose immunosuppression in a rat hind-limb transplantation model. Transplant International. 16 (12), 835-842 (2003).
- Sucher, R., et al. Orthotopic hind-limb transplantation in rats. Journal of Visualized Experiments. (41), e2022 (2010).
- Fleissig, Y. Y., Beare, J. E., LeBlanc, A. J., Kaufman, C. L. Evolution of the rat hind limb transplant as an experimental model of vascularized composite allotransplantation: Approaches and advantages. SAGE Open Medicine. 8, 2050312120968721 (2020).
- Lindboe, C. F., Presthus, J. Effects of denervation, immobilization and cachexia on fibre size in the anterior tibial muscle of the rat. Acta Neuropathologica. 66 (1), 42-51 (1985).
- Nazzal, J. A., Johnson, T. S., Gordon, C. R., Randolph, M. A., Lee, W. P. Heterotopic limb allotransplantation model to study skin rejection in the rat. Microsurgery. 24 (6), 448-453 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved