È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Modello di trapianto parziale di arti posteriori eterotopiche nei ratti
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo documento presenta un protocollo di trapianto di lembi osteomiocutaneo eterotopico parziale nei ratti e i suoi potenziali risultati nel follow-up a medio termine.
Abstract
Gli allotrapianti compositi vascolarizzati (VCA) rappresentano l'opzione di ricostruzione più avanzata per i pazienti senza possibilità chirurgiche autologhe dopo un difetto tissutale complesso. I trapianti di viso e mano hanno cambiato la vita dei pazienti sfigurati, dando loro un nuovo organo sociale estetico e funzionale. Nonostante i risultati promettenti, la VCA è ancora sottoperformata a causa delle comorbidità di immunosoppressione per tutta la vita e delle complicanze infettive. Il ratto è un modello animale ideale per studi in vivo che studiano le vie immunologiche e i meccanismi di rigetto dell'innesto. I ratti sono anche ampiamente utilizzati in nuove tecniche di conservazione dell'innesto di tessuto composito, compresi gli studi di perfusione e crioconservazione. I modelli utilizzati per la VCA nei ratti devono essere riproducibili, affidabili ed efficienti con bassa morbilità e mortalità postoperatoria. Le procedure di trapianto di arti eterotopici soddisfano questi criteri e sono più facili da eseguire rispetto ai trapianti di arti ortotopici. Padroneggiare i modelli microchirurgici dei roditori richiede una solida esperienza nella microchirurgia e nella cura degli animali. Qui è riportato un modello affidabile e riproducibile di trapianto parziale eterotopico di lembi osteomiocutanei nei ratti, gli esiti postoperatori e i mezzi di prevenzione di potenziali complicanze.
Introduzione
Negli ultimi due decenni, VCA si è evoluto come un trattamento rivoluzionario per i pazienti che soffrono di grave deturpazione tra cui viso1, amputazioni degli arti superiori2, pene3e altri difetti tissutali complessi4,5. Tuttavia, le conseguenze dell'immunosoppressione per tutta la vita ostacolano ancora un'applicazione più ampia di questi complessi interventi chirurgici ricostruttivi. La ricerca di base è fondamentale per migliorare le strategie anti-rigetto. Aumentare il tempo di conservazione del VCA è anche essenziale per migliorare la logistica del trapianto e aumentare il pool di donatori (poiché i donatori di VCA devono soddisfare più criteri rispetto ai donatori di organi solidi, tra cui tono della pelle, dimensioni anatomiche, sesso). In questo contesto, i trapianti di arti di ratto sono ampiamente utilizzati negli studi sul rigetto immunitario degli alloinnesti6,7,nuovi protocolli di induzione della tolleranza8e studi di conservazione9,10,11. Quindi, questi modelli VCA sono un elemento chiave da padroneggiare per la ricerca traslazionale VCA.
I lembi osteomiocutanei sono stati descritti in letteratura come modelli affidabili per studiare la VCA nei ratti8,12,13,14. Sebbene i trapianti ortotopici di arti interi consentano una valutazione a lungo termine della funzione dell'innesto, è una procedura che richiede tempo associata a tassi di morbilità e mortalità postoperatori più elevati14. Al contrario, i modelli di trapianto di arti eterotopici non sono funzionali, ma consentono studi riproducibili su VCA. Gli esiti postoperatori possono essere anticipati in modo affidabile prima dell'inizio di uno studio di trapianto di VCA su ratto. Questo studio riporta un modello di trapianto di lembo osteomiocutaneo eterotopico parziale nel ratto che include frequenti possibili esiti e complicanze che possono insorgere intra-operatoriamente e postoperatoriamente durante un periodo di follow-up di tre settimane.
Protocollo
Tutti gli animali hanno ricevuto cure umane in conformità con la Guida NIH per la cura e l'uso degli animali da laboratorio. L'Institutional Animal Care and Use Committee (IACUC-protocollo 2017N000184) e l'Animal Care and Use Review Office (ACURO) hanno approvato tutti i protocolli sugli animali. Ratti Lewis maschi consanguinei (250-400 g) sono stati utilizzati per tutti gli esperimenti.
1. Chirurgia
- Anestetizzare i ratti lewis usando l'inalazione di isoflurano. Indurre l'anestesia con il 5% di isoflurano nella camera di induzione e mantenere l'anestesia con l'inalazione di isoflurano all'1,5-3% attraverso un cono respiratorio.
- Applicare lubrificante per gli occhi prima dell'intervento chirurgico nelle procedure di sopravvivenza. Rasare il sito chirurgico, trattare con crema depilatoria, scrub e drappeggio con tende sterili.
- Confermare l'anestesia totale con un test del pizzico della punta prima dell'incisione e regolarmente durante la procedura. Monitorare la frequenza cardiaca e respiratoria durante l'intera procedura. Per tutti gli interventi chirurgici, mantenere condizioni sterili utilizzando strumenti sterili, forniture, tende e guanti. Vedere la Tabella dei materiali per l'elenco degli strumenti utilizzati per le procedure.
2. Approvvigionamento parziale dell'arto posteriore del diritto del donatore
- Fai un'incisione circonferenziale della pelle sopra la caviglia al terzo distale della gamba.
- Scheletrare e cauterizzare l'arteria safena e il ramo terminale dell'arteria poplitea usando una pinna bipolare. Cauterizzare e tagliare i muscoli gastrocnemio, soleo, tibiale anteriore e bicipite femorale fino a quando l'osso tibiale non è esposto.
- Fai un'incisione di 2,5 cm nella piega inguinale destra. Sezionare il cuscinetto di grasso inguinale e ritrarlo distalmente per esporre i vasi femorali. Utilizzare un divaricatore a un amo per afferrare il legamento inguinale e una pinza di serraggio per tenere il cuscinetto di grasso inguinale distalmente.
NOTA BENE: Il cuscinetto di grasso inguinale è incluso nella raccolta dell'arto parziale. - Sezionare i vasi femorali, individualizzare i rami di Murphy (rami collaterali muscolari profondi di solito situati a metà strada tra il legamento inguinale e il ramo epigastrico) e ligate con 8-0 cravatte in nylon.
- Eparina al ratto donatore con 100 UI/kg di eparina, iniettata nella vena dorsale del pene utilizzando un ago da 27,5 G.
- Completare l'incisione cutanea intorno all'anca.
- Cauterizzare i muscoli bicipiti femorali e glutei superficiali usando una pinna bipolare. Cauterizzare e tagliare il nervo sciatico a metà lunghezza del femore. Esporre il femore prossimalmente a livello della cresta femorale posteriore.
NOTA: i muscoli dell'adduttore e del quadricipite sono lasciati fuori dall'approvvigionamento. Il peduncole innominato è conservato. - Vasi femorali ligate con fascette in nylon 8/0 a livello del legamento inguinale. Eseguire un'arteriotomia sull'arteria femorale appena sotto la legatura e dilatarsi per consentire l'inserimento di un angiocatetere da 24 G.
- Cauterizzare e tagliare il muscolo rimanente sotto il peduncolare, esponendo il lato anteriore del femore.
- Tagliare la tibia e il femore usando un tagliaosse il più vicino possibile e distalmente, rispettivamente (media lunghezza).
- Lavare l'arto posteriore parziale con 2 mL di eparina salina (100 UI/mL) per ottenere un chiaro deflusso venoso. Conservare sul ghiaccio in una garza sterile fino al trasferimento microvascolare (Figura 1).
- Mentre l'animale è in anestesia generale, eseguire l'eutanasia per dissanguamento fino a quando l'animale non mostra alcun segno di vita (nessun movimento respiratorio e nessun battito cardiaco).

Figura 1: Ratto parziale arti posteriori raccolti. Un angiocate 24 G viene inserito nell'arteria femorale, pronto per il trasferimento microvascolare eterotopico. Fare clic qui per visualizzare una versione più grande di questa figura.
3. Chirurgia del ricevente
- Prima dell'incisione, radersi la parte posteriore del collo e somministrare buprenorfina 0,01-0,05 mg / kg per via sottocutanea. Posizionare il ratto in posizione supina su una piastra riscaldante.
- Fai un'incisione di 2,5 cm nella piega inguinale destra. Sezionare il cuscinetto di grasso inguinale e reclinarlo distalmente per esporre i vasi femorali. Utilizzare un gancio per ritrarre il legamento inguinale e una pinza di serraggio per tenere il cuscinetto di grasso inguinale distalmente.
- Seziona i vasi femorali, individualizza i rami di Murphy e ligate con fascette di nylon 8/0.
- Ligate entrambi i vasi sopra i vasi epigastrici utilizzando fascette di nylon 8/0. Posizionare i morsetti dell'approssimazione prossimale e dilatare le estremità del vaso; risciacquare con eparina salina.
- Fai un'incisione sul fianco sinistro sopra l'anca e crea una tasca sottocutanea con un tunnel sottocutaneo alla piega inguinale.
NOTA: L'incisione dell'inserto viene eseguita al di sopra della gamma di movimento dell'anca per garantire che l'animale mantenga un normale movimento degli arti posteriori. Inoltre, mantenere un ponte cutaneo tra l'inserto dell'innesto e il sito di trasferimento microvascolare consente una migliore fissazione dell'innesto (Figura 2). - Posizionare la parte prossimale dell'arto parziale e il cuscinetto di grasso inguinale attraverso il tunnel sottocutaneo per il trasferimento microvascolare. Eseguire anastomosi venose e arteriose utilizzando suture di nylon 10/0. Rimuovere entrambi i morsetti dell'approssimante e osservare la rivascolarizzazione dell'arto. Eseguire un "test di mungitura" su entrambi i vasi per valutare la pervietà di ciascuna anastomosi.
NOTA: Otto o nove suture sono solitamente necessarie per l'anastomosi venosa, 6 suture in media per l'anastomosi arteriosa. - Fare un'incisione cutanea longitudinale sul lato mediale dell'arto trapiantato e inserire l'innesto. Rimuovere la pelle in eccesso dell'innesto e chiudere la ferita con suture separate e una sutura in esecuzione utilizzando suture 4/0 assorbibili.
- Suturare insieme i cuscinetti di grasso inguinale dell'arto trapiantato e del ricevente utilizzando due suture assorbibili separate e chiudere la piega inguinale alla fine dopo un ultimo controllo delle anastomosi microvascolari.
NOTA: i cuscinetti di grasso inguinale vengono suturati strettamente per aggiungere uno strato protettivo di grasso sopra le anastomosi e garantire una posizione sicura dell'innesto e del suo peduncolo. Una chiusura meticolosa è migliore per la guarigione delle ferite; previene anche il sanguinamento residuo dalla ferita e diminuisce il rischio di automutilazione. - Compensare la perdita di liquidi per via sottocutanea con 1-3 ml di soluzione salina in base alla quantità di sanguinamento perioperatorio.
- Posizionare un collare elisabettiano attorno al collo dell'animale e applicare 2 punti di sutura sciolti sulla pelle per mantenerla nella posizione corretta.
- Fermare l'inalazione di isoflurano e monitorare continuamente l'animale su un cuscinetto riscaldante fino a quando non è completamente cosciente e ambulatoriale.
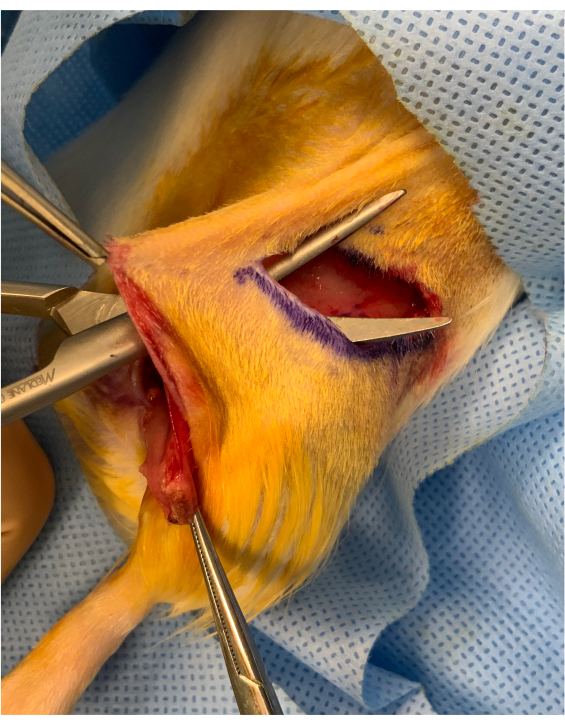
Figura 2: Immagine perioperatoria prima dell'incasso dell'arto osteomiocutaneo. Un ponte cutaneo di circa 1 cm è conservato tra l'incisione della piega inguinale e l'inserto dell'innesto sopra l'anca. L'innesto viene posto sotto il ponte, mantenendolo stabile per il trasferimento microvascolare. Fare clic qui per visualizzare una versione più grande di questa figura.
4. Cura postoperatoria
- Monitorare l'animale due volte al giorno per 72 ore, poi una volta al giorno fino al giorno postoperatorio (POD) 7 e poi due volte a settimana.
NOTA: il monitoraggio deve essere adattato alle condizioni dell'animale e dell'innesto (gli occhi pallidi potrebbero richiedere liquidi supplementari, colorazione della porfirina come indicatore del dolore animale, colore / temperatura anormale dell'innesto) e ulteriori cure devono essere discusse con il veterinario. È necessario un singolo alloggiamento per i ratti riceventi durante l'intero periodo di studio per evitare danni all'innesto. - Eseguire l'analgesia con iniezione sottocutanea di buprenorfina e/o farmaco antinfiammatorio non steroideo secondo le linee guida IACUC.
- Valutare l'innesto ed eseguire quotidianamente l'esame fisico con le immagini utilizzando lo stesso dispositivo.
NOTA: L'uso della crema per la depilazione sulla pelle dell'innesto è utile per valutare meglio il colore della pelle del trapianto.
Risultati
In questo studio a operatore singolo, sono stati eseguiti 30 trapianti di arti parziali eterotopici singenici. Il successo è stato definito al giorno 21 postoperatorio come l'assenza di fallimento del VCA o complicazioni che richiedono l'eutanasia. La normale evoluzione dell'innesto è rappresentata in Figura 3. La durata media per l'approvvigionamento parziale dell'arto e l'innesto nel ricevente sono stati rispettivamente di 35 e 105 minuti; il tempo medio di ischemia è stato di 105 min. ...
Discussione
Modelli di trapianto ortotopico di arti nei roditori sono stati descritti in letteratura15,16,17; tuttavia, richiedono una riparazione nervosa, un riattaccamento muscolare e una perfetta osteosintesi del femore, che può essere un passaggio molto difficile. Questi modelli sono anche associati a un più alto tasso di morbilità e mortalità neiroditori 14, specialmente nel follow-up a breve termine in quan...
Divulgazioni
Gli autori non hanno divulgazioni.
Riconoscimenti
Questo lavoro è stato sostenuto dall'Ufficio dell'Assistente Segretario alla Difesa per gli Affari Sanitari attraverso il Programma di Ricerca Medica Diretto dal Congresso sotto il Premio No. W81XWH-17-1-0680. Opinioni, interpretazioni, conclusioni e raccomandazioni sono quelle degli autori e non sono necessariamente approvate dal Dipartimento della Difesa.
Materiali
| Name | Company | Catalog Number | Comments |
| 24 GA angiocatheter | BD Insyte Autoguard | 381412 | |
| 4-0 suture Black monofilament non absorbable suture | Ethicon | 1667 | Used to suture the E-collar to the back of the neck |
| 4-0 suture Coated Vicryl Plus Antibacterial | Ethicon | VCP496 | |
| Adson Tissue Forceps, 11 cm, 1 x 2 Teeth with Tying Platform | ASSI | ASSI.ATK26426 | |
| Bipolar cords | ASSI | 228000C | |
| Black Polyamide Monofilament USP 10-0, 4 mm 3/8c | AROSurgical | T04A10N07-13 | Used to perform the microvascular anastomoses |
| Buprenorphine HCl | Pharmaceutical, Inc | 42023-179-01 | |
| Dilating Forceps | Fine science tools (FST) | 18131-12 | |
| Dissecting Scissors 15 cm, Round Handle 8 mm diameter, Straight Slender Tapered Blade 7 mm, Lipshultz Pattern | ASSI | ASSI.SAS15RVL | |
| Double Micro Clamps 5.5 x 1.5 mm | Fine science tools (FST) | 18040-22 | |
| Elizabethan collar | Braintree Scientific | EC-R1 | |
| Forceps 13.5 cm long, Flat Handle, 9 mm wide Straight Tips 0.1 mm diameter (x2) | ASSI | ASSI.JFL31 | |
| Halsey Micro Needle Holder | Fine science tools (FST) | 12500-12 | |
| Heparin Lock Flush Solution, USP, 100 units/mL | BD PosiFlush | 306424 | |
| Isoflurane | Patterson Veterinary | 14043-704-06 | |
| Jewelers Bipolar Forceps Non Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Lone Star Elastic Stays | CooperSurgical | 3314-8G | Used to retract the inguinal ligament for femoral vessels dissection |
| Lone Star Self-Retaining Retractors | CooperSurgical | 3301G | |
| Micro-Mosquito Hemostats | Fine science tools (FST) | 13010-12 | Used to retract the inguinal fat pad distally |
| Needle Holder, 15 cm Round Handle, 8 mm diameter, Superfine Curved Jaw 0.2 mm tip diameter, without lock | ASSI | ASSI.B1582 | |
| Nylon Suture Black Monolfilament 8-0, 6.5 mm 3/8c | Ethilon | 2808G | Used to ligate collateral branches on the femoral vessels |
| Offset Bone Nippers | Fine science tools (FST) | 16101-10 | |
| S&T Vascular Clamps 5.5 x 1.5 mm | Fine science tools (FST) | 00398-02 | |
| Walton scissors | Fine science tools (FST) | 14077-09 |
Riferimenti
- Lanteiri, L., et al. Feasibility, reproducibility, risks and benefits of face transplantation: a prospective study of outcomes. American Journal of Transplantation. 11 (2), 367-378 (2011).
- Park, S. H., Eun, S. C., Kwon, S. T. Hand transplantation: current status and immunologic obstacles. Experimental and Clinical Transplantation. 17 (1), 97-104 (2019).
- Cetrulo, C. L., et al. Penis transplantation: first US experience. Annals of Surgery. 267 (5), 983-988 (2018).
- Grajek, M., et al. First complex allotransplantation of neck organs: larynx, trachea, pharynx, esophagus, thyroid, parathyroid glands, and anterior cervical wall: a case report. Annals of Surgery. 266 (2), 19-24 (2017).
- Pribaz, J. J., Caterson, E. J. Evolution and limitations of conventional autologous reconstruction of the head and neck. Journal of Craniofacial Surgery. 24 (1), 99-107 (2013).
- Lipson, R. A., et al. Vascularized limb transplantation in the rat. I. Results with syngeneic grafts. Transplantation. 35 (4), 293-299 (1983).
- Lipson, R. A., et al. Vascularized limb transplantation in the rat. II. Results with allogeneic grafts. Transplantation. 35 (4), 300-304 (1983).
- Adamson, L. A., et al. A modified model of hindlimb osteomyocutaneous flap for the study of tolerance to composite tissue allografts. Microsurgery. 27 (7), 630-636 (2007).
- Arav, A., Friedman, O., Natan, Y., Gur, E., Shani, N. Rat hindlimb cryopreservation and transplantation: a step toward "organ banking". American Journal of Transplantation. 17 (11), 2820-2828 (2017).
- Gok, E., et al. Development of an ex-situ limb perfusion system for a rodent model. ASAIO Journal. 65 (2), 167-172 (2019).
- Gok, E., Rojas-Pena, A., Bartlett, R. H., Ozer, K. Rodent skeletal muscle metabolomic changes associated with static cold storage. Transplantation Proceedings. 51 (3), 979-986 (2019).
- Brandacher, G., Grahammer, J., Sucher, R., Lee, W. P. Animal models for basic and translational research in reconstructive transplantation. Birth Defects Research. Part C, Embryo Today. 96 (1), 39-50 (2012).
- Fleissig, Y., et al. Modified heterotopic hindlimb osteomyocutaneous flap model in the rat for translational vascularized composite allotransplantation research. Journal of Visualized Experiments: JoVE. (146), e59458 (2019).
- Ulusal, A. E., Ulusal, B. G., Hung, L. M., Wei, F. C. Heterotopic hindlimb allotransplantation in rats: an alternative model for immunological research in composite-tissue allotransplantation. Microsurgery. 25 (5), 410-414 (2005).
- Jang, Y., Park, Y. E., Yun, C. W., Kim, D. H., Chung, H. The vest-collar as a rodent collar to prevent licking and scratching during experiments. Lab Anim. 50 (4), 296-304 (2016).
- Kern, B., et al. A novel rodent orthotopic forelimb transplantation model that allows for reliable assessment of functional recovery resulting from nerve regeneration. American Journal of Transplantation. 17 (3), 622-634 (2017).
- Perez-Abadia, G., et al. Low-dose immunosuppression in a rat hind-limb transplantation model. Transplant International. 16 (12), 835-842 (2003).
- Sucher, R., et al. Orthotopic hind-limb transplantation in rats. Journal of Visualized Experiments. (41), e2022 (2010).
- Fleissig, Y. Y., Beare, J. E., LeBlanc, A. J., Kaufman, C. L. Evolution of the rat hind limb transplant as an experimental model of vascularized composite allotransplantation: Approaches and advantages. SAGE Open Medicine. 8, 2050312120968721 (2020).
- Lindboe, C. F., Presthus, J. Effects of denervation, immobilization and cachexia on fibre size in the anterior tibial muscle of the rat. Acta Neuropathologica. 66 (1), 42-51 (1985).
- Nazzal, J. A., Johnson, T. S., Gordon, C. R., Randolph, M. A., Lee, W. P. Heterotopic limb allotransplantation model to study skin rejection in the rat. Microsurgery. 24 (6), 448-453 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon