É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Modelo de transplante de hindlimb heterotópico parcial em ratos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este artigo apresenta um protocolo de transplante de retalho osteomyocutâneo heterotópico em ratos e seus resultados potenciais no acompanhamento a médio prazo.
Resumo
As alotransplantações compostas vascularizadas (VCA) representam a opção de reconstrução mais avançada para pacientes sem possibilidades cirúrgicas autólogas após um defeito complexo tecidual. Os transplantes de rosto e mão mudaram a vida dos pacientes desfigurados, dando-lhes um novo órgão social estético e funcional. Apesar dos resultados promissores, o VCA ainda é pouco executado devido a comorbidades de imunossupressão ao longo da vida e complicações infecciosas. O rato é um modelo animal ideal para estudos in vivo que investigam vias imunológicas e mecanismos de rejeição de enxertos. Ratos também são amplamente utilizados em novas técnicas de preservação de enxerto de tecido composto, incluindo estudos de perfusão e criopreservação. Os modelos utilizados para VCA em ratos devem ser reprodutíveis, confiáveis e eficientes com baixa morbidade e mortalidade pós-operatória. Os procedimentos heterotópicos de transplante de membros preenchem esses critérios e são mais fáceis de realizar do que transplantes ortotópicos de membros. Dominar modelos microcirúrgicos de roedores requer experiência sólida em microcirurgia e cuidados com animais. Aqui é relatado um modelo confiável e reprodutível de transplante de retalhos heterotópicos parciais em ratos, os desfechos pós-operatórios e os meios de prevenção de possíveis complicações.
Introdução
Nas últimas duas décadas, o VCA evoluiu como um tratamento revolucionário para pacientes que sofrem desfiguração grave, incluindo face1, amputações de membros superiores2,peniano3e outros defeitos complexos do tecido4,5. No entanto, as consequências da imunossupressão ao longo da vida ainda dificultam uma aplicação mais ampla dessas complexas cirurgias reconstrutivas. Pesquisas básicas são cruciais para melhorar as estratégias anti-rejeição. O aumento do tempo de preservação do VCA também é essencial para melhorar a logística de transplante e aumentar o pool de doadores (já que os doadores de VCA devem preencher mais critérios do que doadores de órgãos sólidos, incluindo tom de pele, tamanho anatômico, gênero). Nesse contexto, os transplantes de membros de ratos são amplamente utilizados em estudos sobre a rejeição imune de atores6,7, novos protocolos de indução de tolerância8e estudos de preservação9,10,11. Assim, esses modelos VCA são um elemento-chave para dominar a pesquisa translacional VCA.
Retalhos osteomyocutâneos têm sido descritos na literatura como modelos confiáveis para estudar VCA em ratos8,12,13,14. Embora os transplantes ortotópicos de membros inteiros permitam uma avaliação a longo prazo da função do enxerto, é um procedimento demorado associado a maiores taxas de morbidade e mortalidade pós-operatórias14. Em contraste, os modelos heterotópicos de transplante de membros não são funcionais, mas permitem estudos reprodutíveis sobre VCA. Os resultados pós-operatórios podem ser antecipados de forma confiável antes do início de um estudo de transplante de VCA de ratos. Este estudo relata um modelo de transplante de retalho osteomyocutâneo heterotópico no rato que inclui desfechos e complicações possíveis frequentes que podem surgir intra-operatóriamente e no pós-operatório durante um período de seguimento de três semanas.
Protocolo
Todos os animais receberam cuidados humanos de acordo com o Guia do NIH para o Cuidado e Uso de Animais de Laboratório. O Comitê Institucional de Cuidados e Uso de Animais (IACUC-protocol 2017N000184) e o Escritório de Revisão de Cuidados e Uso animal (ACURO) aprovaram todos os protocolos animais. Ratos machos de raça Lewis (250-400 g) foram usados para todos os experimentos.
1. Cirurgia
- Anestesiar os ratos de Lewis usando inalação de isoflurano. Induzir anestesia com 5% de isoflurane na câmara de indução, e manter anestesia com 1,5-3% de inalação de isoflurane através de um cone respiratório.
- Aplique lubrificante ocular antes da cirurgia em procedimentos de sobrevivência. Raspe o local cirúrgico, trate com creme depilatório, esfregue e drape com cortinas estéreis.
- Confirme a anestesia total com um teste de beliscão do dedo do dedo antes da incisão e regularmente durante o procedimento. Monitore as frequências cardíacas e respiratórias durante todo o procedimento. Para todas as cirurgias, mantenha condições estéreis usando instrumentos estéreis, suprimentos, cortinas e luvas. Consulte a Tabela de Materiais para a lista de instrumentos utilizados para os procedimentos.
2. Aquisição parcial de hindlimb parcial do doador
- Faça uma incisão circunferencial da pele acima do tornozelo no terço distal da perna.
- Esqueleto e cauterizar a artéria safena e o ramo terminal da artéria popliteal usando fórceps bipolares. Cauterize e corte os músculos gastrocnemius, soleus, tibialis anterior e bíceps femoris até que o osso tibial seja exposto.
- Faça uma incisão de 2,5 cm na linha inguinal direita. Disseque a almofada de gordura inguinal e retrate-a distally para expor os vasos femorais. Use um retrátil de anzol para agarrar o ligamento inguinal e fixar fórceps para segurar a almofada de gordura inguinal distally.
NOTA: A almofada de gordura inguinal está incluída na colheita do membro parcial. - Disseque os vasos femorais, individualize os ramos de Murphy (ramos colaterais musculares profundos geralmente localizados no meio do ligamento inguinal e do ramo epigástrico), e ligadura com 8-0 laços de nylon.
- Heparinize o rato doador com 100 UI/kg de heparina, injetada na veia dorsal peniana usando uma agulha de 27,5 G.
- Complete a incisão da pele ao redor do quadril.
- Cauterize os músculos femoris bíceps e glúteos superficiales usando fórceps bipolares. Cauterize e corte o nervo ciático no comprimento médio do fêmur. Exponha o fêmur proximalmente ao nível da crista femoral posterior.
NOTA: Os músculos adutor e quadríceps ficam de fora da aquisição. O pedículo innominado está preservado. - Vasos femorais ligantes com laços de nylon 8/0 ao nível do ligamento inguinal. Realize uma arteriotomia na artéria femoral logo abaixo da ligadura e dilate para permitir a inserção de um angio-cateter de 24 G.
- Cauterize e corte o músculo restante sob o pedículo, expondo o lado anterior do fêmur.
- Corte a tíbia e o fêmur usando um cortador ósseo o mais proximicamente e distally possível, respectivamente (comprimento médio).
- Lave a retalho parcial com 2 mL de solução salina de heparina (100 UI/mL) para obter uma saída venosa clara. Armazenar no gelo em uma gaze estéril até a transferência microvascular(Figura 1).
- Enquanto o animal está sob anestesia geral, realize a eutanásia por exsanguinação até que o animal não mostre nenhum sinal de vida (nenhum movimento respiratório e nenhum batimento cardíaco).

Figura 1: Perna traseira parcial do rato colhida. Um angiocato de 24 G é inserido na artéria femoral, pronto para transferência microvascular heterotópica. Clique aqui para ver uma versão maior desta figura.
3. Cirurgia de receptor
- Antes da incisão, raspe a parte de trás do pescoço e administre buprenorfina 0,01-0,05 mg/kg subcutânea. Coloque o rato em uma posição supina em uma almofada de aquecimento.
- Faça uma incisão de 2,5 cm na linha inguinal direita. Disseque a almofada de gordura inguinal e recline-a distally para expor os vasos femorais. Use um gancho para retrair o ligamento inguinal e os fórceps de fixação para segurar a almofada de gordura inguinal distally.
- Disseca os vasos femorais, individualize os ramos de Murphy e ligante com laços de nylon 8/0.
- Ligate ambas as naves acima dos vasos epigástricos usando laços de nylon 8/0. Coloque grampos aproximadores proximicamente e extremidades do vaso dilato; enxágüe com soro fisiológico de heparina.
- Faça uma incisão no flanco esquerdo acima do quadril, e crie um bolso subcutâneo com um túnel subcutâneo para o vinco inguinal.
NOTA: A incisão de entrada é feita acima da faixa de movimento do quadril para garantir que o animal mantenha um movimento de escalada traseira normal. Além disso, manter uma ponte cutânea entre o inset do enxerto e o local de transferência microvascular permite uma melhor fixação do enxerto(Figura 2). - Coloque a parte proximal do membro parcial e a almofada de gordura inguinal através do túnel subcutâneo para transferência microvascular. Realize anastomoses venosos e arteriais usando suturas de nylon 10/0. Remova os dois grampos aproximadores e observe a revascularização do membro. Realize um "teste de ordenha" em ambos os vasos para avaliar a patência de cada anastomose.
NOTA: Oito a nove suturas são geralmente necessárias para anastomose venosa, 6 suturas em média para anastomose arterial. - Faça uma incisão longitudinal na pele do lado medial do membro transplantado, e insira o enxerto. Remova o excesso de pele do enxerto e feche a ferida com suturas separadas e uma sutura em execução usando suturas absorventes 4/0.
- Sutura juntar as almofadas de gordura inguinal do membro transplantado e o receptor usando duas suturas absorvíveis separadas, e fechar o vinco inguinal na extremidade após um último check-up das anastomoses microvasculares.
NOTA: As almofadas de gordura inguinais são suturadas firmemente para adicionar uma camada protetora de gordura acima dos anastomoses e garantir uma posição segura do enxerto e seu pedículo. Um fechamento meticuloso é melhor para a cicatrização de feridas; também previne sangramento residual da ferida e diminui o risco de automutilação. - Compensar a perda de fluido subcutânea com 1-3 mL de soro fisiológico de acordo com a quantidade de sangramento perioperatório.
- Coloque uma coleira elizabetano ao redor do pescoço do animal, e aplique 2 suturas soltas na pele para mantê-la na posição correta.
- Pare a inalação de isoflurano e monitore o animal continuamente em uma almofada de aquecimento até totalmente consciente e ambulatorial.
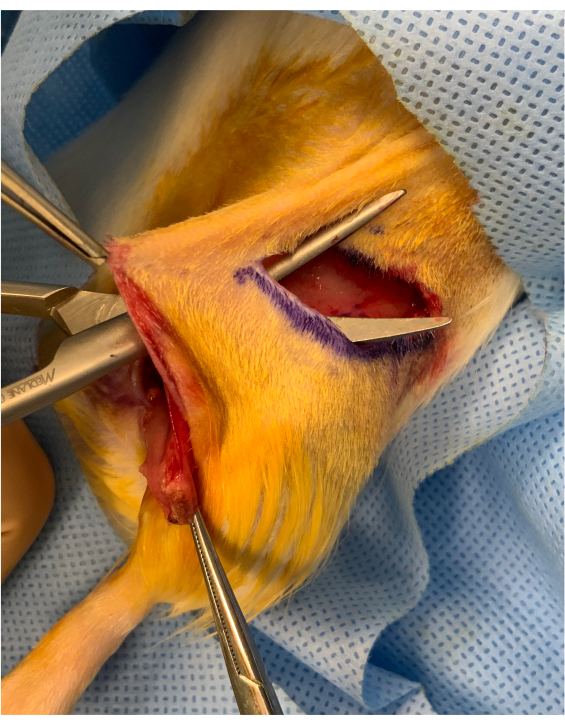
Figura 2: Imagem perioperatória antes do início do membro osteomyocutâneo. Uma ponte cutânea de aproximadamente 1 cm é preservada entre a incisão do vinco inguinal e o inset do enxerto acima do quadril. O enxerto é colocado sob a ponte, mantendo-o estável para transferência microvascular. Clique aqui para ver uma versão maior desta figura.
4. Cuidados pós-operatórios
- Monitore o animal duas vezes por dia durante 72 horas, depois uma vez por dia até o pós-operatório (POD) 7 e, em seguida, duas vezes por semana.
NOTA: O monitoramento deve ser ajustado à condição animal e enxerto (olhos pálidos podem exigir fluidos suplementares, manchas porfiliais como indicador de dor animal, cor/temperatura anormal do enxerto), e mais cuidados devem ser discutidos com o veterinário. É necessária uma única moradia para os ratos beneficiários durante todo o período de estudo para evitar qualquer dano ao enxerto. - Realize analgesia com injeção subcutânea de buprenorfina e/ou anti-inflamatório não esteroide de acordo com as diretrizes da IACUC.
- Avalie o enxerto e realize exame físico diariamente com imagens usando o mesmo dispositivo.
NOTA: O uso de creme de depilação na pele do enxerto é útil para avaliar melhor a cor da pele do transplante.
Resultados
Neste estudo de operador único, foram realizados 30 transplantes de membros parciais heterotópicos sintéricos. O sucesso foi definido no pós-operatório 21 como a ausência de falha do VCA ou complicações que requerem eutanásia. A evolução normal do enxerto está representada na Figura 3. A duração média para aquisição parcial de membros e inset de enxerto no receptor foi de 35 e 105 min, respectivamente; a média de isquemia foi de 105 min. Durante o acompanhamento, ocorreram ...
Discussão
Modelos ortotópicos de transplante de membros em roedores foram descritos na literatura15,16,17; no entanto, eles requerem uma reparação nervosa, recolocação muscular, e uma osteossíntese perfeita do fêmur, o que pode ser um passo muito difícil. Esses modelos também estão associados a uma maior taxa de morbidade e mortalidade em roedores14, especialmente no seguimento de curto prazo, pois a recu...
Divulgações
Os autores não têm revelações.
Agradecimentos
Este trabalho foi apoiado pelo Escritório do Secretário Adjunto de Defesa para Assuntos de Saúde através do Programa de Pesquisa Médica Dirigido pelo Congresso sob o Prêmio Nº. W81XWH-17-1-0680. Opiniões, interpretações, conclusões e recomendações são dos autores e não são necessariamente endossadas pelo Departamento de Defesa.
Materiais
| Name | Company | Catalog Number | Comments |
| 24 GA angiocatheter | BD Insyte Autoguard | 381412 | |
| 4-0 suture Black monofilament non absorbable suture | Ethicon | 1667 | Used to suture the E-collar to the back of the neck |
| 4-0 suture Coated Vicryl Plus Antibacterial | Ethicon | VCP496 | |
| Adson Tissue Forceps, 11 cm, 1 x 2 Teeth with Tying Platform | ASSI | ASSI.ATK26426 | |
| Bipolar cords | ASSI | 228000C | |
| Black Polyamide Monofilament USP 10-0, 4 mm 3/8c | AROSurgical | T04A10N07-13 | Used to perform the microvascular anastomoses |
| Buprenorphine HCl | Pharmaceutical, Inc | 42023-179-01 | |
| Dilating Forceps | Fine science tools (FST) | 18131-12 | |
| Dissecting Scissors 15 cm, Round Handle 8 mm diameter, Straight Slender Tapered Blade 7 mm, Lipshultz Pattern | ASSI | ASSI.SAS15RVL | |
| Double Micro Clamps 5.5 x 1.5 mm | Fine science tools (FST) | 18040-22 | |
| Elizabethan collar | Braintree Scientific | EC-R1 | |
| Forceps 13.5 cm long, Flat Handle, 9 mm wide Straight Tips 0.1 mm diameter (x2) | ASSI | ASSI.JFL31 | |
| Halsey Micro Needle Holder | Fine science tools (FST) | 12500-12 | |
| Heparin Lock Flush Solution, USP, 100 units/mL | BD PosiFlush | 306424 | |
| Isoflurane | Patterson Veterinary | 14043-704-06 | |
| Jewelers Bipolar Forceps Non Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Lone Star Elastic Stays | CooperSurgical | 3314-8G | Used to retract the inguinal ligament for femoral vessels dissection |
| Lone Star Self-Retaining Retractors | CooperSurgical | 3301G | |
| Micro-Mosquito Hemostats | Fine science tools (FST) | 13010-12 | Used to retract the inguinal fat pad distally |
| Needle Holder, 15 cm Round Handle, 8 mm diameter, Superfine Curved Jaw 0.2 mm tip diameter, without lock | ASSI | ASSI.B1582 | |
| Nylon Suture Black Monolfilament 8-0, 6.5 mm 3/8c | Ethilon | 2808G | Used to ligate collateral branches on the femoral vessels |
| Offset Bone Nippers | Fine science tools (FST) | 16101-10 | |
| S&T Vascular Clamps 5.5 x 1.5 mm | Fine science tools (FST) | 00398-02 | |
| Walton scissors | Fine science tools (FST) | 14077-09 |
Referências
- Lanteiri, L., et al. Feasibility, reproducibility, risks and benefits of face transplantation: a prospective study of outcomes. American Journal of Transplantation. 11 (2), 367-378 (2011).
- Park, S. H., Eun, S. C., Kwon, S. T. Hand transplantation: current status and immunologic obstacles. Experimental and Clinical Transplantation. 17 (1), 97-104 (2019).
- Cetrulo, C. L., et al. Penis transplantation: first US experience. Annals of Surgery. 267 (5), 983-988 (2018).
- Grajek, M., et al. First complex allotransplantation of neck organs: larynx, trachea, pharynx, esophagus, thyroid, parathyroid glands, and anterior cervical wall: a case report. Annals of Surgery. 266 (2), 19-24 (2017).
- Pribaz, J. J., Caterson, E. J. Evolution and limitations of conventional autologous reconstruction of the head and neck. Journal of Craniofacial Surgery. 24 (1), 99-107 (2013).
- Lipson, R. A., et al. Vascularized limb transplantation in the rat. I. Results with syngeneic grafts. Transplantation. 35 (4), 293-299 (1983).
- Lipson, R. A., et al. Vascularized limb transplantation in the rat. II. Results with allogeneic grafts. Transplantation. 35 (4), 300-304 (1983).
- Adamson, L. A., et al. A modified model of hindlimb osteomyocutaneous flap for the study of tolerance to composite tissue allografts. Microsurgery. 27 (7), 630-636 (2007).
- Arav, A., Friedman, O., Natan, Y., Gur, E., Shani, N. Rat hindlimb cryopreservation and transplantation: a step toward "organ banking". American Journal of Transplantation. 17 (11), 2820-2828 (2017).
- Gok, E., et al. Development of an ex-situ limb perfusion system for a rodent model. ASAIO Journal. 65 (2), 167-172 (2019).
- Gok, E., Rojas-Pena, A., Bartlett, R. H., Ozer, K. Rodent skeletal muscle metabolomic changes associated with static cold storage. Transplantation Proceedings. 51 (3), 979-986 (2019).
- Brandacher, G., Grahammer, J., Sucher, R., Lee, W. P. Animal models for basic and translational research in reconstructive transplantation. Birth Defects Research. Part C, Embryo Today. 96 (1), 39-50 (2012).
- Fleissig, Y., et al. Modified heterotopic hindlimb osteomyocutaneous flap model in the rat for translational vascularized composite allotransplantation research. Journal of Visualized Experiments: JoVE. (146), e59458 (2019).
- Ulusal, A. E., Ulusal, B. G., Hung, L. M., Wei, F. C. Heterotopic hindlimb allotransplantation in rats: an alternative model for immunological research in composite-tissue allotransplantation. Microsurgery. 25 (5), 410-414 (2005).
- Jang, Y., Park, Y. E., Yun, C. W., Kim, D. H., Chung, H. The vest-collar as a rodent collar to prevent licking and scratching during experiments. Lab Anim. 50 (4), 296-304 (2016).
- Kern, B., et al. A novel rodent orthotopic forelimb transplantation model that allows for reliable assessment of functional recovery resulting from nerve regeneration. American Journal of Transplantation. 17 (3), 622-634 (2017).
- Perez-Abadia, G., et al. Low-dose immunosuppression in a rat hind-limb transplantation model. Transplant International. 16 (12), 835-842 (2003).
- Sucher, R., et al. Orthotopic hind-limb transplantation in rats. Journal of Visualized Experiments. (41), e2022 (2010).
- Fleissig, Y. Y., Beare, J. E., LeBlanc, A. J., Kaufman, C. L. Evolution of the rat hind limb transplant as an experimental model of vascularized composite allotransplantation: Approaches and advantages. SAGE Open Medicine. 8, 2050312120968721 (2020).
- Lindboe, C. F., Presthus, J. Effects of denervation, immobilization and cachexia on fibre size in the anterior tibial muscle of the rat. Acta Neuropathologica. 66 (1), 42-51 (1985).
- Nazzal, J. A., Johnson, T. S., Gordon, C. R., Randolph, M. A., Lee, W. P. Heterotopic limb allotransplantation model to study skin rejection in the rat. Microsurgery. 24 (6), 448-453 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados