Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Modelo de trasplante parcial de extremidades posteriores heterotópicas en ratas
* Estos autores han contribuido por igual
En este artículo
Resumen
Este trabajo presenta un protocolo de trasplante de colgajo osteomiocutáneo heterotópico parcial en ratas y sus posibles resultados en el seguimiento a medio plazo.
Resumen
Los alotrasplantes compuestos vascularizados (ACV) representan la opción de reconstrucción más avanzada para pacientes sin posibilidades quirúrgicas autólogas después de un defecto tisular complejo. Los trasplantes de cara y mano han cambiado la vida de los pacientes, dándoles un nuevo órgano social estético y funcional. A pesar de los resultados prometedores, el ACV sigue teniendo un rendimiento inferior debido a las comorbilidades de inmunosupresión de por vida y las complicaciones infecciosas. La rata es un modelo animal ideal para estudios in vivo que investigan vías inmunológicas y mecanismos de rechazo del injerto. Las ratas también se utilizan ampliamente en nuevas técnicas de preservación de injertos de tejido compuesto, incluidos los estudios de perfusión y criopreservación. Los modelos utilizados para el ACV en ratas deben ser reproducibles, fiables y eficientes con baja morbilidad y mortalidad postoperatoria. Los procedimientos de trasplante de extremidades heterotópicas cumplen con estos criterios y son más fáciles de realizar que los trasplantes de extremidades ortotópicas. Dominar los modelos microquirúrgicos de roedores requiere una sólida experiencia en microcirugía y cuidado de animales. Aquí se informa un modelo confiable y reproducible de trasplante parcial de colgajo osteomiocutáneo heterotópico en ratas, los resultados postoperatorios y los medios de prevención de posibles complicaciones.
Introducción
En las últimas dos décadas, VCA ha evolucionado como un tratamiento revolucionario para pacientes que sufren desfiguración severa, incluyendo cara1,amputaciones de miembros superiores2,pene3y otros defectos tisulares complejos4,5. Sin embargo, las consecuencias de la inmunosupresión de por vida aún dificultan una aplicación más amplia de estas complejas cirugías reconstructivas. La investigación básica es crucial para mejorar las estrategias contra el rechazo. Aumentar el tiempo de preservación de VCA también es esencial para mejorar la logística de trasplante y aumentar el grupo de donantes (ya que los donantes de VCA deben cumplir con más criterios que los donantes de órganos sólidos, incluido el tono de piel, el tamaño anatómico y el género). En este contexto, los trasplantes de extremidades de rata son ampliamente utilizados en estudios sobre el rechazo inmune de los aloinjertos6,7,nuevos protocolos de inducción de tolerancia8y estudios de preservación9,10,11. Por lo tanto, estos modelos de VCA son un elemento clave para dominar la investigación traslacional de VCA.
Los colgajos osteomiocutáneos han sido descritos en la literatura como modelos fiables para estudiar el ACV enratas 8,12,13,14. Aunque los trasplantes ortotópicos de extremidades enteras permiten la evaluación a largo plazo de la función del injerto, es un procedimiento que consume mucho tiempo asociado con mayores tasas de morbilidad y mortalidad postoperatoria14. Por el contrario, los modelos heterotópicos de trasplante de extremidades no son funcionales, pero permiten estudios reproducibles sobre el ACV. Los resultados postoperatorios se pueden anticipar de manera confiable antes del inicio de un estudio de trasplante de ACV en rata. Este estudio informa un modelo de trasplante de colgajo osteomiocutáneo heterotópico parcial en la rata que incluye posibles resultados frecuentes y complicaciones que pueden surgir intraoperatoria y postoperatoriamente durante un período de seguimiento de tres semanas.
Protocolo
Todos los animales recibieron atención humana de acuerdo con la Guía de los NIH para el Cuidado y Uso de Animales de Laboratorio. El Comité Institucional de Cuidado y Uso de Animales (protocolo IACUC 2017N000184) y la Oficina de Revisión de Cuidado y Uso de Animales (ACURO) aprobaron todos los protocolos de animales. Se utilizaron ratas Lewis macho endogámicas (250-400 g) para todos los experimentos.
1. Cirugía
- Anestesiar a las ratas Lewis usando inhalación de isoflurano. Inducir anestesia con isoflurano al 5% en la cámara de inducción, y mantener la anestesia con inhalación de isoflurano al 1,5-3% a través de un cono respiratorio.
- Aplique lubricante para los ojos antes de la cirugía en los procedimientos de supervivencia. Afeitarse el sitio quirúrgico, tratar con crema depilatoria, exfoliar y cubrir con cortinas estériles.
- Confirme la anestesia total con una prueba de pellizco del dedo del pie antes de la incisión y regularmente durante el procedimiento. Controle las frecuencias cardíacas y respiratorias durante todo el procedimiento. Para todas las cirugías, mantenga condiciones estériles mediante el uso de instrumentos, suministros, cortinas y guantes estériles. Consulte la Tabla de materiales para la lista de instrumentos utilizados para los procedimientos.
2. Adquisición parcial de las extremidades posteriores del derecho del donante
- Haga una incisión circunferencial de la piel por encima del tobillo en el tercio distal de la pierna.
- Esqueletizar y cauterizar la arteria safena y la rama terminal de la arteria poplítea utilizando fórceps bipolares. Cauterizar y cortar los músculos gastrocnemio, sóleo, tibial anterior y bíceps femoral hasta que el hueso tibial quede expuesto.
- Haga una incisión de 2,5 cm en el pliegue inguinal derecho. Diseccionar la almohadilla de grasa inguinal y retraerla distalmente para exponer los vasos femorales. Use un retractor de anzuelo para agarrar el ligamento inguinal y pinzas de sujeción para sostener la almohadilla de grasa inguinal distalmente.
NOTA: La almohadilla de grasa inguinal se incluye en la cosecha de la extremidad parcial. - Diseccionar los vasos femorales, individualizar las ramas de Murphy (ramas colaterales musculares profundas generalmente ubicadas a medio camino entre el ligamento inguinal y la rama epigástrica) y ligar con 8-0 corbatas de nylon.
- Heparinizar la rata donante con 100 UI/kg de heparina, inyectada en la vena dorsal del pene con una aguja de 27,5 G.
- Complete la incisión en la piel alrededor de la cadera.
- Cauterizar los músculos bíceps femoral y glúteo superficial utilizando fórceps bipolares. Cauterizar y cortar el nervio ciático a la mitad de la longitud del fémur. Exponer el fémur proximalmente a nivel de la cresta femoral posterior.
NOTA: Los músculos aductores y cuádriceps se dejan fuera de la adquisición. Se conserva el pedículo innominado. - Ligar los vasos femorales con lazos de nylon 8/0 a nivel del ligamento inguinal. Realice una arteriotomía en la arteria femoral justo debajo de la ligadura y dilate para permitir la inserción de un angiocatéter de 24 G.
- Cauterizar y cortar el músculo restante debajo del pedículo, exponiendo el lado anterior del fémur.
- Corte la tibia y el fémur con un cortador de huesos lo más proximal y distalmente posible, respectivamente (longitud media).
- Enjuague la extremidad posterior parcial con 2 ml de solución salina de heparina (100 UI/ml) para obtener una salida venosa clara. Conservar en hielo en una gasa estéril hasta la transferencia microvascular (Figura 1).
- Mientras el animal esté bajo anestesia general, realice la eutanasia por exsanguinación hasta que el animal no muestre signos de vida (sin movimiento respiratorio y sin latidos cardíacos).

Figura 1: Rata parcial de las extremidades posteriores cosechadas. Se inserta un angiocato de 24 G en la arteria femoral, listo para la transferencia microvascular heterotópica. Haga clic aquí para ver una versión más grande de esta figura.
3. Cirugía del receptor
- Antes de la incisión, afeitarse la parte posterior del cuello y administrar buprenorfina 0.01-0.05 mg/kg por vía subcutánea. Coloque la rata en posición supina sobre una almohadilla térmica.
- Haga una incisión de 2,5 cm en el pliegue inguinal derecho. Diseccionar la almohadilla de grasa inguinal y reclinarla distalmente para exponer los vasos femorales. Use un gancho para retraer el ligamento inguinal y pinzas de sujeción para sostener la almohadilla de grasa inguinal distalmente.
- Diseccionar los vasos femorales, individualizar las ramas de Murphy y ligar con lazos de nylon 8/0.
- Ligar ambos vasos por encima de los vasos epigástricos usando lazos de nylon 8/0. Coloque las abrazaderas del aproximador proximalmente y dilate los extremos de los vasos; enjuague con solución salina de heparina.
- Haga una incisión en el flanco izquierdo por encima de la cadera y cree una bolsa subcutánea con un túnel subcutáneo hasta el pliegue inguinal.
NOTA: La incisión insertada se realiza por encima del rango de movimiento de la cadera para garantizar que el animal mantenga un movimiento normal de las extremidades posteriores. Además, mantener un puente cutáneo entre el recuadro del injerto y el sitio de transferencia microvascular permite una mejor fijación del injerto (Figura 2). - Coloque la parte proximal de la extremidad parcial y la almohadilla de grasa inguinal a través del túnel subcutáneo para la transferencia microvascular. Realizar anastomosis venosas y arteriales utilizando suturas de nylon 10/0. Retire ambas pinzas de aproximación y observe la revascularización de la extremidad. Realizar una "prueba de ordeño" en ambos vasos para evaluar la permeabilidad de cada anastomosis.
NOTA: De ocho a nueve suturas suelen ser necesarias para la anastomosis venosa, 6 suturas en promedio para la anastomosis arterial. - Haga una incisión longitudinal en la piel en el lado medial de la extremidad trasplantada e inserte el injerto. Retire el exceso de piel del injerto y cierre la herida con suturas separadas y una sutura en ejecución con suturas absorbibles 4/0.
- Suturar juntos las almohadillas de grasa inguinal de la extremidad trasplantada y el receptor usando dos suturas absorbibles separadas, y cerrar el pliegue inguinal al final después de un último chequeo de las anastomosis microvasculares.
NOTA: Las almohadillas de grasa inguinal se suturan herméticamente para agregar una capa protectora de grasa sobre las anastomosis y garantizar una posición segura del injerto y su pedículo. Un cierre meticuloso es mejor para la cicatrización de heridas; también previene el sangrado residual de la herida y disminuye el riesgo de automutilación. - Compensar la pérdida de líquido por vía subcutánea con 1-3 ml de solución salina según la cantidad de sangrado perioperatorio.
- Coloque un collar isabelino alrededor del cuello del animal y aplique 2 suturas sueltas a la piel para mantenerla en la posición correcta.
- Detenga la inhalación de isoflurano y controle al animal continuamente en una almohadilla de calentamiento hasta que esté completamente consciente y ambulatorio.
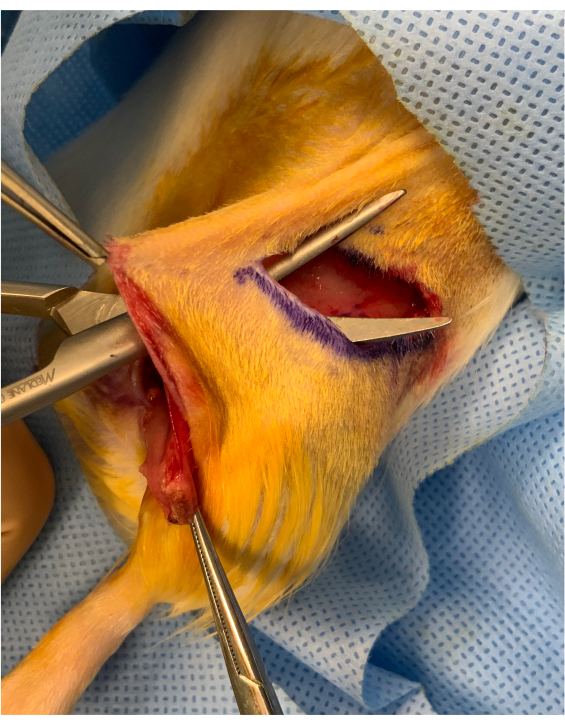
Figura 2: Imagen perioperatoria antes del recuadro de la extremidad osteomiocutánea. Se conserva un puente cutáneo de aproximadamente 1 cm entre la incisión del pliegue inguinal y el recuadro del injerto por encima de la cadera. El injerto se coloca debajo del puente, manteniéndolo estable para la transferencia microvascular. Haga clic aquí para ver una versión más grande de esta figura.
4. Cuidados postoperatorios
- Monitoree al animal dos veces al día durante 72 horas, luego una vez al día hasta el día postoperatorio (POD) 7, y luego dos veces por semana.
NOTA: El monitoreo debe ajustarse a la condición del animal y del injerto (los ojos pálidos pueden requerir líquidos suplementarios, tinción de porfirina como indicador de dolor animal, color / temperatura anormal del injerto), y se debe discutir el cuidado adicional con el veterinario. Se requiere una vivienda única para las ratas receptoras durante todo el período de estudio para evitar cualquier daño al injerto. - Realizar analgesia con inyección subcutánea de buprenorfina y/o fármaco antiinflamatorio no esteroideo según las directrices de la IACUC.
- Evalúe el injerto y realice un examen físico diariamente con imágenes utilizando el mismo dispositivo.
NOTA: El uso de crema depilación en la piel del injerto es útil para evaluar mejor el color de la piel del trasplante.
Resultados
En este estudio de operador único, se realizaron 30 trasplantes parciales de extremidades heterotópicas singénicas. El éxito se definió en el día 21 postoperatorio como la ausencia de fracaso del ACV o complicaciones que requieren eutanasia. La evolución normal del injerto se representa en la Figura 3. La duración media de la obtención parcial de la extremidad y el recuadro del injerto en el receptor fue de 35 y 105 min, respectivamente; el tiempo medio de isquemia fue de 105 min. D...
Discusión
En la literatura se han descrito modelos de trasplante ortotópico de extremidades en roedores15,16,17; sin embargo, requieren una reparación nerviosa, reinserción muscular y una osteosíntesis perfecta del fémur, lo que puede ser un paso muy difícil. Estos modelos también se asocian con una mayor tasa de morbilidad y mortalidad en roedores14,especialmente en el seguimiento a corto plazo ya que la re...
Divulgaciones
Los autores no tienen revelaciones.
Agradecimientos
Este trabajo fue apoyado por la Oficina del Subsecretario de Defensa para Asuntos de Salud a través del Programa de Investigación Médica Dirigida por el Congreso bajo el Premio No. W81XWH-17-1-0680. Las opiniones, interpretaciones, conclusiones y recomendaciones son las de los autores y no están necesariamente respaldadas por el Departamento de Defensa.
Materiales
| Name | Company | Catalog Number | Comments |
| 24 GA angiocatheter | BD Insyte Autoguard | 381412 | |
| 4-0 suture Black monofilament non absorbable suture | Ethicon | 1667 | Used to suture the E-collar to the back of the neck |
| 4-0 suture Coated Vicryl Plus Antibacterial | Ethicon | VCP496 | |
| Adson Tissue Forceps, 11 cm, 1 x 2 Teeth with Tying Platform | ASSI | ASSI.ATK26426 | |
| Bipolar cords | ASSI | 228000C | |
| Black Polyamide Monofilament USP 10-0, 4 mm 3/8c | AROSurgical | T04A10N07-13 | Used to perform the microvascular anastomoses |
| Buprenorphine HCl | Pharmaceutical, Inc | 42023-179-01 | |
| Dilating Forceps | Fine science tools (FST) | 18131-12 | |
| Dissecting Scissors 15 cm, Round Handle 8 mm diameter, Straight Slender Tapered Blade 7 mm, Lipshultz Pattern | ASSI | ASSI.SAS15RVL | |
| Double Micro Clamps 5.5 x 1.5 mm | Fine science tools (FST) | 18040-22 | |
| Elizabethan collar | Braintree Scientific | EC-R1 | |
| Forceps 13.5 cm long, Flat Handle, 9 mm wide Straight Tips 0.1 mm diameter (x2) | ASSI | ASSI.JFL31 | |
| Halsey Micro Needle Holder | Fine science tools (FST) | 12500-12 | |
| Heparin Lock Flush Solution, USP, 100 units/mL | BD PosiFlush | 306424 | |
| Isoflurane | Patterson Veterinary | 14043-704-06 | |
| Jewelers Bipolar Forceps Non Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Lone Star Elastic Stays | CooperSurgical | 3314-8G | Used to retract the inguinal ligament for femoral vessels dissection |
| Lone Star Self-Retaining Retractors | CooperSurgical | 3301G | |
| Micro-Mosquito Hemostats | Fine science tools (FST) | 13010-12 | Used to retract the inguinal fat pad distally |
| Needle Holder, 15 cm Round Handle, 8 mm diameter, Superfine Curved Jaw 0.2 mm tip diameter, without lock | ASSI | ASSI.B1582 | |
| Nylon Suture Black Monolfilament 8-0, 6.5 mm 3/8c | Ethilon | 2808G | Used to ligate collateral branches on the femoral vessels |
| Offset Bone Nippers | Fine science tools (FST) | 16101-10 | |
| S&T Vascular Clamps 5.5 x 1.5 mm | Fine science tools (FST) | 00398-02 | |
| Walton scissors | Fine science tools (FST) | 14077-09 |
Referencias
- Lanteiri, L., et al. Feasibility, reproducibility, risks and benefits of face transplantation: a prospective study of outcomes. American Journal of Transplantation. 11 (2), 367-378 (2011).
- Park, S. H., Eun, S. C., Kwon, S. T. Hand transplantation: current status and immunologic obstacles. Experimental and Clinical Transplantation. 17 (1), 97-104 (2019).
- Cetrulo, C. L., et al. Penis transplantation: first US experience. Annals of Surgery. 267 (5), 983-988 (2018).
- Grajek, M., et al. First complex allotransplantation of neck organs: larynx, trachea, pharynx, esophagus, thyroid, parathyroid glands, and anterior cervical wall: a case report. Annals of Surgery. 266 (2), 19-24 (2017).
- Pribaz, J. J., Caterson, E. J. Evolution and limitations of conventional autologous reconstruction of the head and neck. Journal of Craniofacial Surgery. 24 (1), 99-107 (2013).
- Lipson, R. A., et al. Vascularized limb transplantation in the rat. I. Results with syngeneic grafts. Transplantation. 35 (4), 293-299 (1983).
- Lipson, R. A., et al. Vascularized limb transplantation in the rat. II. Results with allogeneic grafts. Transplantation. 35 (4), 300-304 (1983).
- Adamson, L. A., et al. A modified model of hindlimb osteomyocutaneous flap for the study of tolerance to composite tissue allografts. Microsurgery. 27 (7), 630-636 (2007).
- Arav, A., Friedman, O., Natan, Y., Gur, E., Shani, N. Rat hindlimb cryopreservation and transplantation: a step toward "organ banking". American Journal of Transplantation. 17 (11), 2820-2828 (2017).
- Gok, E., et al. Development of an ex-situ limb perfusion system for a rodent model. ASAIO Journal. 65 (2), 167-172 (2019).
- Gok, E., Rojas-Pena, A., Bartlett, R. H., Ozer, K. Rodent skeletal muscle metabolomic changes associated with static cold storage. Transplantation Proceedings. 51 (3), 979-986 (2019).
- Brandacher, G., Grahammer, J., Sucher, R., Lee, W. P. Animal models for basic and translational research in reconstructive transplantation. Birth Defects Research. Part C, Embryo Today. 96 (1), 39-50 (2012).
- Fleissig, Y., et al. Modified heterotopic hindlimb osteomyocutaneous flap model in the rat for translational vascularized composite allotransplantation research. Journal of Visualized Experiments: JoVE. (146), e59458 (2019).
- Ulusal, A. E., Ulusal, B. G., Hung, L. M., Wei, F. C. Heterotopic hindlimb allotransplantation in rats: an alternative model for immunological research in composite-tissue allotransplantation. Microsurgery. 25 (5), 410-414 (2005).
- Jang, Y., Park, Y. E., Yun, C. W., Kim, D. H., Chung, H. The vest-collar as a rodent collar to prevent licking and scratching during experiments. Lab Anim. 50 (4), 296-304 (2016).
- Kern, B., et al. A novel rodent orthotopic forelimb transplantation model that allows for reliable assessment of functional recovery resulting from nerve regeneration. American Journal of Transplantation. 17 (3), 622-634 (2017).
- Perez-Abadia, G., et al. Low-dose immunosuppression in a rat hind-limb transplantation model. Transplant International. 16 (12), 835-842 (2003).
- Sucher, R., et al. Orthotopic hind-limb transplantation in rats. Journal of Visualized Experiments. (41), e2022 (2010).
- Fleissig, Y. Y., Beare, J. E., LeBlanc, A. J., Kaufman, C. L. Evolution of the rat hind limb transplant as an experimental model of vascularized composite allotransplantation: Approaches and advantages. SAGE Open Medicine. 8, 2050312120968721 (2020).
- Lindboe, C. F., Presthus, J. Effects of denervation, immobilization and cachexia on fibre size in the anterior tibial muscle of the rat. Acta Neuropathologica. 66 (1), 42-51 (1985).
- Nazzal, J. A., Johnson, T. S., Gordon, C. R., Randolph, M. A., Lee, W. P. Heterotopic limb allotransplantation model to study skin rejection in the rat. Microsurgery. 24 (6), 448-453 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados