需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用蛋白毒性应激器治疗大 肠杆菌 后蛋白质聚合物的提取和可视化
摘要
本协议描述了用蛋白质毒性抗菌素治疗后从 大肠杆 菌中提取和可溶性蛋白质的提取和可视化。遵循此程序,可以对不同细菌菌株和/或治疗之间的 体内 蛋白质聚合形成进行定性比较。
摘要
生物体暴露于环境和细胞压力中通常会导致蛋白质平衡的破坏,并可能导致蛋白质聚集。细菌细胞中蛋白质聚合物的积累可导致细胞表型行为发生重大变化,包括生长速率、抗应力和毒性降低。对这些压力源介质表型的检查存在几个实验程序。本文描述了一种优化的检测方法,用于使用含银抗菌素治疗后,从不同的 大肠杆 菌菌株中提取和可溶性蛋白质的提取和可视化。众所周知,这种化合物会产生活性氧物种,并导致广泛的蛋白质聚集。
该方法结合了从治疗和未经处理的细胞中分离出的蛋白质聚合物和可溶性蛋白质的离心分离,以及随后通过硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)和库马西染色进行分离和可视化。这种方法简单、快速,允许对不同 大肠杆菌 株中的蛋白质聚合形成进行定性比较。该方法具有广泛的应用,包括研究其他蛋白质抗菌素对多种细菌 体内 蛋白质聚合的影响的可能性。此外,该协议可用于识别有助于增强对蛋白毒物质抵抗力的基因。凝胶带可用于后续识别特别容易聚集的蛋白质。
引言
细菌不可避免地会受到无数的环境压力,包括低pH值(例如, 在哺乳动物胃)1,2,活性氧和氯物种(ROS/RCS)(例如,在噬菌细胞氧化爆裂期间)3,4,5,温度升高(如在温泉或热休克期间)6,7,和几个有效的抗菌剂(例如,AGXX用于本协议)8。蛋白质特别容易受到这些压力源的影响,暴露会引发蛋白质的无/误折叠,然后播种聚合。所有生物体都采用保护系统,使它们能够处理蛋白质误折叠9。然而,严重的压力会压倒蛋白质质量控制机制,破坏蛋白质的二级和/或三级结构,最终使蛋白质失活。因此,蛋白质聚合物会严重损害细菌生长和生存、抗压和毒性所需的关键细胞功能。因此,关注蛋白质聚合及其在细菌中的后果的研究是一个相关的课题,因为它对传染病控制的潜在影响。
热诱导蛋白的展开和聚合通常是可逆的7。相比之下,其他蛋白质毒性应激,如氧化应激,可以通过氧化特定的氨基酸侧链导致蛋白质脱/误折叠,并最终导致蛋白质聚合4,从而导致不可逆转的蛋白质改变。压力诱导的不溶性蛋白质聚合物的形成,在分子伴奏及其在酵母和细菌11、12、13中的保护作用的背景下得到了广泛的研究。已经发布了几种协议,利用各种生化技术对不溶性蛋白质聚合物14、15、16、17进行分离和分析。现有协议主要用于研究热休克和/或分子伴郎鉴定后的细菌蛋白聚合。虽然这些协议肯定是该领域的一个进步,但在实验程序中存在一些重大不便,因为它们需要(i)高达 10 L14、17、(ii)复杂的物理干扰过程,包括使用细胞干扰器、法国印刷机和/或声波14、15、17或(iii)耗时的重复 洗涤和孵化步骤15,16,17。
本文描述了一个经过修改的协议,旨在解决以前方法的局限性,并允许分析在治疗后与蛋白毒抗菌表面涂层在两种不同的Escherichia大肠杆菌菌株中形成的蛋白质聚合量。涂层由金属银(Ag)和鲁西尼(鲁)组成,以抗坏血酸为条件,其抗菌活性是通过产生活性氧物种8、18来实现的。以下是细菌培养物与抗菌化合物治疗后的准备的详细描述,以及两种大肠杆菌菌株暴露后蛋白质聚集状态的比较,这些菌株具有明显的易感性,可增加抗菌素的浓度。所述方法价格低廉、速度快且可重复,可用于研究其他蛋白质化合物中的蛋白质聚合。此外,可以修改协议,以分析特定基因缺失对各种不同细菌中的蛋白质聚合的影响。
研究方案
1. 大肠杆菌 株MG1655和CFT073应激处理
- 接种5mL的利生肉汤(LB)介质,分别与单菌群的共生 大肠杆菌 株MG1655和尿病原性 大肠杆菌 (UPEC)菌株CFT073,并在37°C和300 rpm孵育为14-16小时(过夜)。
注: 大肠杆菌 CFT073是一种人类病原体。CFT073 的处理必须在生物安全 2 级认证实验室中采取适当的生物安全措施。 - 将每个菌株稀释成500 mL烧瓶,含有70 mL的3-(N-形态)丙烷硫酸(MOPS)-葡萄糖(MOPS-g)(表1)介质,以600纳米(OD600)值0.1的光学密度。在 37 °C 和 300 rpm 下孵育,直到达到中日阶段(OD600 = 0.5-0.55)。
- 将每个培养物的 20 mL 转移到三个预热 125 mL 烧瓶中,在 37 °C 和 300 rpm 下孵育 2 分钟。
注:由于需要及时处理样品,每次处理不超过 6 种文化。 - 在浓度为 2 毫克/兆升的 MOPS-g 介质中准备抗菌化合物溶液。将抗菌剂添加到每个培养物中,以达到指示的浓度。对于未经处理的控制,添加 MOPS-g 介质所需的体积。
注:涡流2毫克/mL抗菌溶液,使复合颗粒均匀分布,避免沉降。 - 在 37 °C 和 300 rpm 下孵育文化 45 分钟。
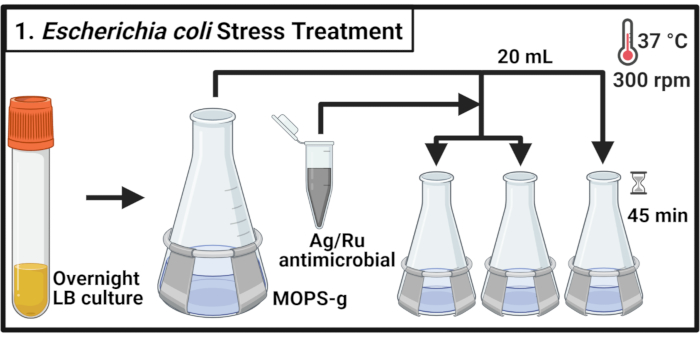
图1:大肠杆菌应激治疗。细菌培养物生长在MOPS-g中,并在达到中原位阶段时用含银的抗菌剂的指示浓度进行处理。缩写: Lb = 利生肉汤;阿格鲁 = 银质铀;MOPS-g = 3-(N -形态)丙烷硫酸(MOPS)-葡萄糖。请单击此处查看此图的较大版本。
2. 收集细菌细胞样本
- 经过45分钟的压力治疗,确定每个培养品的OD600。 对于每个样品,通过离心采集相当于 4 mL OD600 = 1 15 mL 离心机管的细胞,在 3,000 × g 和 4 °C 下进行 15 分钟。
- 完全去除超高分子,在50微升的冰冷裂解缓冲器(表1)中重新使用细胞颗粒。在冰上孵化样品30分钟。
注:此裂解步骤降解多蒂多糖层。始终使用新准备的裂解缓冲器。 - 将样品转移到 1.7 mL 微中心管中。冻结在 -80 °C,直到进一步使用。
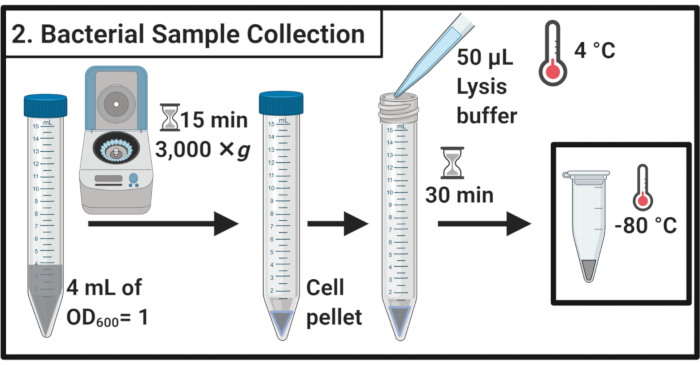
图2:细菌样品采集。 细胞样本通过离心采集,在裂解缓冲器中重新保存,然后在 -80 °C 下储存 。
3. 提取不溶性蛋白质聚合物
- 在冰上解冻样品。
注:冷冻-解冻周期有助于细胞裂解。 - 加入360微升的冰冷缓冲器A(表1),通过管道轻轻混合。
注:渗透性休克也会导致细胞裂解。 - 将样品转移到 2 mL 微中心管中,其中含有 ±200 μL 的 0.5 毫米玻璃珠。在 8 °C 的热混合器中孵育 30 分钟,在 1,400 rpm 时摇晃。
注:此步骤会导致细胞物理中断。蛋白酶抑制剂可用于最大限度地减少蛋白质降解。中断可在 4 °C 下执行。 请注意,据报道,使用玻璃珠会诱发酵母19中一小部分蛋白质的聚合。 - 在冰上孵育5分钟,不摇晃,以解决玻璃珠。将 200 μL 的细胞解酯转移到 1.7 mL 微中心管中。
注意:避免玻璃珠的转移。 - 离心机在 16,000 × g 和 4 °C 20 分钟。收集含有可溶性蛋白质的超高纳坦,然后继续到第 4 节。
- 使用移液器在 200 μL 的冰冷缓冲器 A (表 1)中重新使用颗粒。离心机在 16,000 × g 和 4 °C 20 分钟。小心地完全取出超高超。
- 加入200微升的冰冷缓冲B(见 表1 和 材料表),并小心地通过管道重新使用颗粒。
注:非离子洗涤剂溶解膜蛋白。 - 在 16,000 × 克 和 4 °C 下重复离心 20 分钟。小心地取出超高等。
- 通过管道将颗粒重新悬浮在 200 μL 的冷缓冲器 A (表 1)中。离心机在 16,000 × g 和 4 °C 20 分钟。完全去除超高纳特。
- 将颗粒重新消耗在 100 μL 的 1 倍减少 SDS 样品缓冲器 (表 1)中,并在热混合器中在 95 °C 下煮沸 5 分钟。
- 将样品存储在 -20 °C 下,以便稍后继续或立即加载 SDS 聚丙烯酰胺凝胶以进行分离。
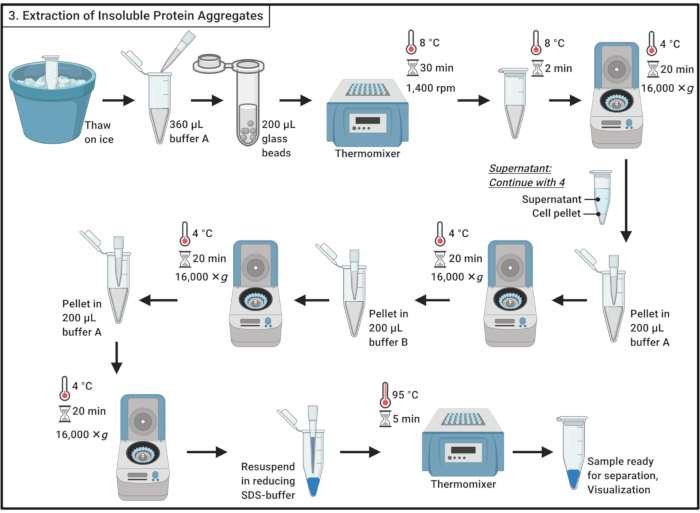
图3:提取不溶性蛋白质聚合物。 蛋白质聚合物的提取涉及一系列步骤,包括细胞破坏、蛋白质聚合物与可溶性蛋白质分离、膜蛋白的溶解和洗涤。缩写: SDS = 硫酸钠。 请单击此处查看此图的较大版本。
4. 可溶性蛋白质样品制备
- 将 1 卷 100% 三氯乙酸 (TCA) 与 3.6 步的 4 卷可溶性蛋白质样品混合。
注:处理TCA需要烟罩和个人防护设备以及经过批准的废物处理程序。 - 在 4 °C 下孵育 10 分钟,以允许蛋白质沉淀。
注:白色沉淀将很快出现。 - 离心沉淀在 21,000 × g 和 4 °C 5 分钟,并删除超高。用 200 μL 冰冷丙酮清洗颗粒,以去除细胞碎片。离心机在 21,000 × g 和 4 °C 5 分钟,并删除超高纳特。在第 4.3 步中重复这些操作,总共三次。
- 将带开盖的微中心管放在 37 °C 的热混合器中,从颗粒中取出剩余的丙酮。
注:孵化超过5分钟可能会降低蛋白质颗粒的溶解性。 - 加入 100 μL 的 1 倍减少 SDS 缓冲器 (表 1),并完全溶解颗粒。在 95 °C 下将样品煮 5 分钟。
- 将样品存放在 -20 °C 下,以便稍后或立即加载 SDS 聚丙烯酰胺凝胶以进行分离。
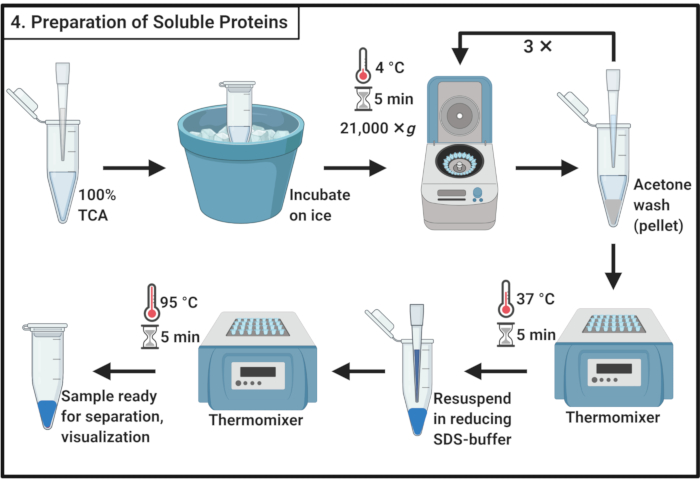
图4:可溶性蛋白质的制备。 可溶性蛋白质的制备涉及三氯乙酸的沉淀步骤和冰冷丙酮的反复清洗。缩写:TCA = 三氯乙酸;SDS = 硫酸钠。 请单击此处查看此图的较大版本。
5. 使用 SDS-PAGE 分离和可视化提取的蛋白质聚合物
- 准备 12% SDS 聚丙烯酰胺凝胶。
- 对于两个分离的凝胶,移液器 5.1 mL 的双蒸馏水 (ddH2O), 3.75 mL 的 Tris-HCl (pH 8.8), 7.5 mL 的 20% (w/v) SDS, 6 mL 的 30% 丙烯酰胺/双丙烯酰胺 (29:1) 溶液, 75 mL 的 10% w/v 氨化物说服酸盐, 和 10 mL 的四甲基二胺 (TEMED) 到 15 mL 离心机管中,轻轻混合,而不会引入气泡。使用玻璃板内的 1 mL 管道倒入凝胶,使上部 2 厘米没有混合物。在分离凝胶顶部添加 70% 乙醇,并允许两层之间均匀接口。
- 分离凝胶聚合后,通过管道 1.535 mL 的 ddH2O、625 mL 的 Tris-HCl (pH 6.8)、12.5 mL 的 20% (w/v) SDS 来准备堆叠凝胶, 335 mL 30% 丙烯酰胺/二丙烯酰胺 (29:1) 溶液, 12.5 mL 的 10% w/v 氨化铵说服酸盐, 和 2.5 mL 的 TEMED.从分离凝胶中取出乙醇并加入堆叠凝胶溶液。插入一个梳子,用所需的口袋数量,而无需引入气泡。允许聚合20-30分钟。
- 将每个样品和蛋白质梯子的 4 μL 装载到单独的油井中,并在 Tris-Glycine 运行缓冲器 (表 1)中运行凝胶,在室温下 45 分钟。
注意:当溴酚带即将从凝胶中迁移时,停止凝胶。 - 在预热的费尔班克斯溶液 A (表 1)中将凝胶弄脏 30 分钟。
- 在预热费尔班克斯解决方案 D (表 1)中装饰凝胶, 直到摇杆上所需的背景 (例如, 过夜) 。
图5:蛋白质分离和可视化。 样品由 SDS-PAGE 分离,由库马西染色可视化。缩写: SDS-PAGE = 钠二甲酸酯-聚丙烯酰胺凝胶电泳。 请单击此处查看此图的较大版本。
结果
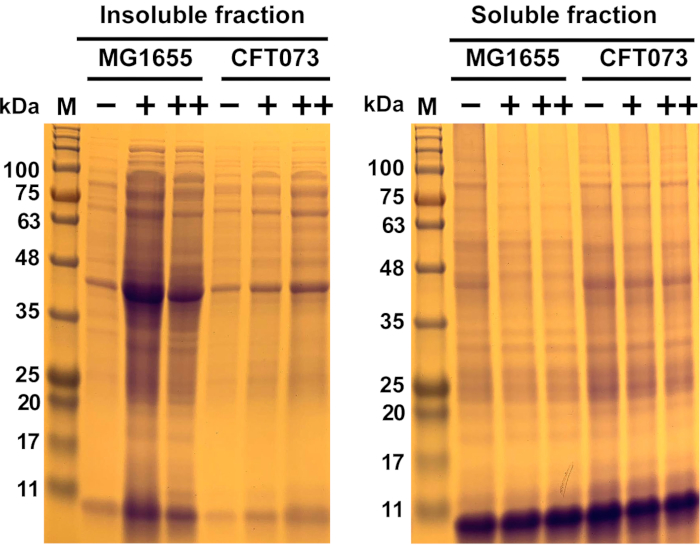
图6:大肠杆菌株MG1655和UGEC菌株CFT073中抗菌诱导蛋白聚合的代表性结果。大肠杆菌株MG1655和CFT073生长在37°C和300 rpm至OD600= 0.5-0.55在MOPS-g介质之前,他们处理与指示浓度 (-, 0毫克/毫升;+,175毫克/毫升;+,200毫克/毫升)的抗菌剂45分钟。可溶?...
讨论
本协议描述了一种优化的方法,用于分析蛋白质聚合形成后,处理不同的大肠杆菌菌株与蛋白质毒性抗菌剂。该协议允许同时从经过治疗和未经治疗的大肠杆菌细胞中提取不溶性和可溶性蛋白质分数。与现有的蛋白质聚合分离方案相比,从细胞14,15,16,20,这种方法有几个优点:(一...
披露声明
作者没有什么可透露的。
致谢
这项工作得到了伊利诺伊州立大学生物科学学院启动基金、伊利诺伊州立大学新学院倡议赠款和NIAID赠款R15AI164585(J.-U.)的支持。D.).G.M.A.得到了伊利诺伊州立大学本科研究支持计划(对G.M.A.)的支持。K. P. H. 得到了德国学术交流服务局 (DAAD) 提供的 RISE 研究金的支持。作者感谢来自大科技维特里布斯有限公司的乌韦·兰道博士和卡斯滕·迈耶博士提供了AGXX粉末。图1、图2、图3、图4和图5是用生物扳机生成的。
材料
| Name | Company | Catalog Number | Comments |
| Chemicals/Reagents | |||
| Acetone | Fisher Scientific | 67-64-1 | |
| 30% Acrylamide/Bisacrylamide solution 29:1 | Bio-Rad | 1610156 | |
| Ammonium persulfate | Millipore Sigma | A3678-100G | |
| Benzonase nuclease | Sigma | E1014-5KU | |
| Bluestain 2 Protein ladder, 5-245 kDa | GoldBio | P008-500 | |
| β-mercaptoethanol | Millipore Sigma | M6250-100ML | |
| Bromophenol blue | GoldBio | B-092-25 | |
| Coomassie Brilliant Blue R-250 | MP Biomedicals LLC | 821616 | |
| D-Glucose | Millipore Sigma | G8270-1KG | |
| D-Sucrose | Acros Organics | 57-50-1 | |
| Ethylenediamine tetra acetic acid (EDTA) | Sigma-Aldrich | SLBT9686 | |
| Glacial Acetic acid | Millipore Sigma | ARK2183-1L | |
| Glycerol, 99% | Sigma-Aldrich | G5516-1L | |
| Glycine | GoldBio | G-630-1 | |
| Hydrochloric acid, ACS reagent | Sigma-Aldrich | 320331-2.5L | |
| Isopropanol (2-Propanol) | Sigma | 402893-2.5L | |
| LB broth (Miller) | Millipore Sigma | L3522-1KG | |
| LB broth with agar (Miller) | Millipore Sigma | L2897-1KG | |
| Lysozyme | GoldBio | L-040-25 | |
| 10x MOPS Buffer | Teknova | M2101 | |
| Nonidet P-40 | Thomas Scientific | 9036-19-5 | |
| Potassium phosphate, dibasic | Sigma-Aldrich | P3786-1KG | |
| Potassium phosphate, monobasic | Acros Organics | 7778-77-0 | |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771-500G | |
| Tetramethylethylenediamine (TEMED) | Millipore Sigma | T9281-50ML | |
| Thiamine | Sigma-Aldrich | T4625-100G | |
| 100% Trichloroacetic acid | Millipore Sigma | T6399-100G | |
| Tris base | GoldBio | T-400-1 | |
| Material/Equipment | |||
| Centrifuge tubes (15 mL) | Alkali Scientific | JABG-1019 | |
| Erlenmeyer flask (125 mL) | Carolina | 726686 | |
| Erlenmeyer flask (500 mL) | Carolina | 726694 | |
| Freezer: -80 °C | Fisher Scientific | ||
| Glass beads (0.5 mm) | BioSpec Products | 1107-9105 | |
| Microcentrifuge | Hermle | Z216MK | |
| Microcentriguge tubes (1.7 mL) | VWR International | 87003-294 | |
| Microcentriguge tubes (2.0 mL) | Axygen Maxiclear Microtubes | MCT-200-C | |
| Plastic cuvettes | Fischer Scientific | 14-377-012 | |
| Power supply | ThermoFisher Scientific | EC105 | |
| Rocker | Alkali Scientific | RS7235 | |
| Shaking incubator (37 °C) | Benchmark Scientific | ||
| Small glass plate | Bio-Rad | 1653311 | |
| Spacer plates (1 mm) | Bio-Rad | 1653308 | |
| Spectrophotometer | Thermoscientific | 3339053 | |
| Tabletop centrifuge for 15 mL centrifuge tubes | Beckman-Coulter | ||
| Vertical gel electrophoresis chamber | Bio-Rad | 1658004 | |
| Vortexer | Fisher Vortex Genie 2 | 12-812 | |
| Thermomixer | Benchmark Scientific | H5000-HC | |
| 10 well comb | Bio-Rad | 1653359 |
参考文献
- Dahl, J. -. U., et al. HdeB functions as an acid-protective chaperone in bacteria. Journal of Biological Chemistry. 290 (1), 65-75 (2015).
- Foit, L., George, J. S., Zhang, B. W., Brooks, C. L., Bardwell, J. C. A. Chaperone activation by unfolding. Proceedings of the National Academy of Sciences of the United States of America. 110 (14), 1254-1262 (2013).
- Sultana, S., Foti, A., Dahl, J. -. U. Bacterial defense systems against the neutrophilic oxidant hypochlorous acid. Infection and Immunity. 88 (7), 00964 (2020).
- Dahl, J. -. U., Gray, M. J., Jakob, U. Protein quality control under oxidative stress conditions. Journal of Molecular Biology. 427 (7), 1549-1563 (2015).
- Groitl, B., Dahl, J. -. U., Schroeder, J. W., Jakob, U. Pseudomonas aeruginosa defense systems against microbicidal oxidants. Molecular Microbiology. 106 (3), 335-350 (2017).
- Casadevall, A. Thermal restriction as an antimicrobial function of fever. PLoS Pathogens. 12 (5), 1005577 (2016).
- Richter, K., Haslbeck, M., Buchner, J. The heat shock response: life on the verge of death. Molecular Cell. 40 (2), 253-266 (2010).
- Van Loi, V., Busche, T., Preuß, T., Kalinowski, J., Bernhardt, J. The AGXX ® antimicrobial coating causes a thiol-specific oxidative stress response and protein S-bacillithiolation in Staphylococcus aureus. Frontiers in Microbiology. 9, 3037 (2018).
- Anfinsen, C. B., Scheraga, H. A. Experimental and theoretical aspects of protein folding. Advances in Protein Chemistry. 29, 205-300 (1975).
- Schramm, F. D., Schroeder, K., Jonas, K. Protein aggregation in bacteria. FEMS Microbiology Reviews. 44 (1), 54-72 (2020).
- Tomoyasu, T., Mogk, A., Langen, H., Goloubinoff, P., Bukau, B. Genetic dissection of the roles of chaperones and proteases in protein folding and degradation in the Escherichia coli cytosol. Molecular Microbiology. 40 (2), 397-413 (2001).
- Gray, M. J., et al. Polyphosphate is a primordial chaperone. Molecular Cell. 53 (5), 689-699 (2014).
- Weids, A. J., Ibstedt, S., Tamás, M. J., Grant, C. M. Distinct stress conditions result in aggregation of proteins with similar properties. Scientific Reports. 6, 24554 (2016).
- Mogk, A., et al. Identification of thermolabile Escherichia coli proteins: prevention and reversion of aggregation by DnaK and ClpB. EMBO Journal. 18 (24), 6934-6949 (1999).
- Fay, A., Glickman, M. S. An essential nonredundant role for mycobacterial DnaK in native protein folding. PLoS Genetics. 10 (7), 1004516 (2014).
- Schramm, F. D., Heinrich, K., Thüring, M., Bernhardt, J., Jonas, K. An essential regulatory function of the DnaK chaperone dictates the decision between proliferation and maintenance in Caulobacter crescentus. PLoS Genetics. 13 (12), 1007148 (2017).
- Maisonneuve, E., Fraysse, L., Moinier, D., Dukan, S. Existence of abnormal protein aggregates in healthy Escherichia coli cells. Journal of Bacteriology. 190 (3), 887-893 (2008).
- Heiss, A., Freisinger, B., Held-Föhn, E. Enhanced antibacterial activity of silver-ruthenium coated hollow microparticles. Biointerphases. 12 (5), (2017).
- Papnayotou, I., Sun, B., Roth, A. F., Davis, N. G. Protein aggregation induced during glass bead lysis of yeast. Yeast. 27 (10), 801-816 (2010).
- Chuang, S. E., Blattner, F. R. Characterization of twenty-six new heat shock genes of Escherichia coli. Journal of Bacteriology. 175 (16), 5242-5252 (1993).
- Imlay, J. A. The molecular mechanisms and physiological consequences of oxidative stress: Lessons from a model bacterium. Nature Reviews Microbiology. 11 (7), 443-454 (2013).
- Mühlhofer, M., et al. The heat shock response in yeast maintains protein homeostasis by chaperoning and replenishing proteins. Cell Reports. 29 (13), 4593-4607 (2019).
- Chandrangsu, P., Rensing, C., Helmann, J. D. Metal homeostasis and resistance in bacteria. Nature Reviews Microbiology. 15, 338-350 (2017).
- Stevens, M., et al. HSP60/10 chaperonin systems are inhibited by a variety of approved drugs, natural products, and known bioactive molecules. Bioorganic and Medicinal Chemistry Letters. 29 (9), 1106-1112 (2019).
- Schramm, F. D., Schroeder, K., Alvelid, J., Testa, I., Jonas, K. Growth-driven displacement of protein aggregates along the cell length ensures partitioning to both daughter cells in Caulobacter crescentus. Molecular Microbiology. 111 (6), 1430-1448 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。