A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מיצוי והדמיה של אגרגטים חלבון לאחר טיפול של Escherichia coli עם מתח פרוטאוטוקסי
In This Article
Summary
פרוטוקול זה מתאר את החילוץ והדמיון של חלבונים מצטברים ומסיסים מ Escherichia coli לאחר טיפול עם מיקרוביאלית פרוטאוטוקסית. בעקבות הליך זה מאפשרת השוואה איכותית של היווצרות צבירה של חלבון ב- vivo בזני חיידקים שונים ו/או בין טיפולים.
Abstract
החשיפה של אורגניזמים חיים ללחצים סביבתיים ותאיים גורמת לעתים קרובות לשיבושים בהומאוסטזיס של חלבונים ויכולה לגרום לצבירה של חלבונים. הצטברות של אגרגטים חלבון בתאי חיידקים יכול להוביל לשינויים משמעותיים בהתנהגות פנוטיפית הסלולר, כולל ירידה בשיעורי הצמיחה, עמידות ללחץ, וארס. קיימים מספר הליכים ניסיוניים לבדיקת פנוטיפים אלה בתיווך הלחץ. מאמר זה מתאר בדיקה ממוטבת להפקה והדמיה של חלבונים מצטברים ומסיסים מזני קולי שונים של אשריצ'יה לאחר טיפול במיקרוביאלית המכילה כסף-רותניום. תרכובת זו ידועה לייצר מינים חמצן תגובתי וגורם צבירת חלבון נרחבת.
השיטה משלבת הפרדה מבוססת צנטריפוגה של אגרגטים של חלבונים וחלבונים מסיסים מתאים מטופלים ולא מטופלים עם הפרדה והדמיה לאחר מכן על ידי נתרן דודזיל סולפט-פוליאקרילמיד ג'ל אלקטרופורזה (SDS-PAGE) וכתמים קומאסי. גישה זו פשוטה, מהירה, ומאפשרת השוואה איכותית של היווצרות צבירה של חלבונים בזני E. coli שונים. למתודולוגיה מגוון רחב של יישומים, כולל האפשרות לחקור את ההשפעה של מיקרוביאלים פרוטאוטוקסיים אחרים על צבירת חלבון ויו במגוון רחב של חיידקים. יתר על כן, הפרוטוקול יכול לשמש כדי לזהות גנים התורמים עמידות מוגברת לחומרים פרוטאוטוקסיים. רצועות ג'ל יכולות לשמש לזיהוי מאוחר יותר של חלבונים הנוטים במיוחד לצבירה.
Introduction
חיידקים חשופים באופן בלתי נמנע לאינספור לחצים סביבתיים, כולל רמת כוח נמוכה (למשל, בקיבה היונקית)1,2, מינים תגובתיים של חמצן וכלור (ROS/RCS) (למשל, במהלך התפרצות חמצונית בפגוציטים)3,4,5, טמפרטורות גבוהות (למשל, במעיינות חמים או במהלך הלם חום)6,7, וכמה מיקרוביאלים חזקים (למשל, AGXX המשמש בפרוטוקול זה)8. חלבונים פגיעים במיוחד לכל אחד מגורשי הלחץ האלה, וחשיפה יכולה לעורר חלבון un-/misfolding כי אז צבירת זרעים. כל האורגניזמים משתמשים במערכות הגנה המאפשרות להם להתמודד עם תקלות חלבון9. עם זאת, מתח חמור יכול להציף את מכונות בקרת איכות החלבון ולשבש את המבנה המשני ו /או שלישוני של חלבונים, אשר בסופו של דבר מנטרל חלבונים. כתוצאה מכך, אגרגטים של חלבונים עלולים לפגוע קשות בתפקודים תאיים קריטיים הנדרשים לצמיחה והישרדות חיידקים, עמידות ללחץ וארס10. לכן, מחקר המתמקד בצבירה של חלבונים והשלכותיו בחיידקים הוא נושא רלוונטי בשל השפעתו הפוטנציאלית על בקרת מחלות זיהומיות.
חלבון המושרה בחום מתפתח וצבירה הם לעתים קרובות הפיכים7. לעומת זאת, לחצים פרוטאוטוקסיים אחרים, כגון עקה חמצונית, יכולים לגרום לשינויים בלתי הפיכים בחלבון באמצעות חמצון של שרשראות צד ספציפיות של חומצות אמינו וכתוצאה מכך חלבון un-/misfolding, ובסופו של דבר, צבירת חלבון4. היווצרות הנגרמת על ידי מתח של אגרגטים חלבון מסיס נחקר בהרחבה בהקשר של מלווים מולקולריים ותפקודי המגן שלהם שמרים וחיידקים11,12,13. כמה פרוטוקולים פורסמו המשתמשים במגוון טכניקות ביוכימיות לבידוד וניתוח של אגרגטים חלבון מסיסים14,15,16,17. הפרוטוקולים הקיימים שימשו בעיקר לחקר צבירת חלבונים חיידקיים על הלם חום ו / או זיהוי של מלווים מולקולריים. בעוד פרוטוקולים אלה בהחלט היו התקדמות לתחום, יש כמה אי נוחות גדולה בהליכים הניסיוניים כי הם דורשים (i) נפח תרבית חיידקים גדולה של עד 10 L14,17, (ii) תהליכי שיבוש פיזיים מסובכים, כולל שימוש משבשי תאים, עיתונות צרפתית, ו / או sonication14,15,17, או (iii) זמן רב חוזר שטיפה ודגרה שלבים15,16,17.
מאמר זה מתאר פרוטוקול שונה שמטרתו לטפל במגבלות הגישות הקודמות ומאפשר ניתוח של כמות אגרגלי החלבון שנוצרו בשני זני קולי שונים של Escherichia לאחר טיפול בציפוי משטח מיקרוביאלי פרוטאוטוקסי. הציפוי מורכב מתכת כסף (Ag) ורותניום (Ru) מותנה בחומצה אסקורבית, ופעילותו מיקרוביאלית מושגת על ידי הדור של מיני חמצן תגובתי8,18. להלן תיאור מפורט של הכנת תרבית החיידקים לאחר הטיפול בתרכובת האנטי מיקרוביאלית והשוואה של מצב צבירת החלבון עם חשיפה של שני זני E. coli עם פרופילי רגישות ברורים להגברת הריכוז של מיקרוביאלית. השיטה המתוארת היא זולה, מהירה וניתן לשחזור וניתן להשתמש בה כדי לחקור צבירת חלבונים בנוכחות תרכובות פרוטאוטוקסיות אחרות. בנוסף, ניתן לשנות את הפרוטוקול כדי לנתח את ההשפעה שיש למחיקות גנים ספציפיות על צבירת חלבונים במגוון חיידקים שונים.
Protocol
1. טיפול בלחץ של זני E. coli MG1655 ו- CFT073
- לחסן 5 מ"ל של מרק ליזוגני (LB) בינוני עם מושבה אחת של זן E. coli commensal MG1655 ו זן E. coli (UPEC) זן uropathogenic (UPEC), בהתאמה, ודגרה עבור 14-16 שעות (לילה) ב 37 °C (7 °F) ו 300 סל"ד.
הערה: Escherichia coli CFT073 הוא פתוגן אנושי. הטיפול ב- CFT073 חייב להתבצע עם אמצעי בטיחות ביולוגית מתאימים במעבדה מוסמכת ברמת בטיחות ביולוגית 2. - לדלל כל זן לתוך בקבוקון 500 מ"ל המכיל 70 מ"ל של 3-(N-morpholino)propanesulfonic חומצה פרופנסולפונית (MOPS)-גלוקוז (MOPS-g) (טבלה 1) בינוני לצפיפות אופטית ב 600 ננומטר (OD600) ערךשל 0.1. דגירה ב 37 °C (300 סל"ד עד לשלב אמצע היומן הוא הגיע (OD600 = 0.5-0.55).
- העבר 20 מ"ל מכל תרבות לשלושה צלוחיות 125 מ"ל לפני המלחמה ודגרה ב 37 °C (7 °F) ו 300 סל"ד במשך 2 דקות.
הערה: כאשר נדרש עיבוד בזמן של הדגימות, לטפל לא יותר מ 6 תרבויות בכל פעם. - הכן פתרון תרכובת מיקרוביאלית ב MOPS-g בינוני בריכוז של 2 מ"ג/ מ"ל. הוסף את האנטי מיקרוביאלית לכל תרבות כדי להגיע לריכוזים שצוינו. עבור הפקד שלא טופל, הוסף את אמצעי האחסון הנדרש של אמצעי MOPS-g.
הערה: מערבולת פתרון 2 מ"ג / מ"ל מיקרוביאלית כדי לאפשר הפצה שווה של החלקיקים המורכבים ולהימנע משקעים. - לדגור על התרבויות במשך 45 דקות ב 37 °C (7 °F) ו 300 סל"ד.
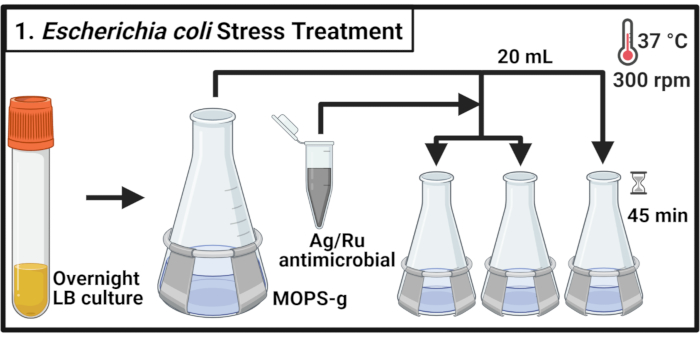
איור 1: טיפול הלחץ של אשריצ'יה קולי. תרביות חיידקים גדלות ב- MOPS-g ומטופלות בריכוזים המצוינים של האנטי מיקרוביאלית המכילה כסף-רותניום כאשר מגיעים לשלב אמצע היומן. קיצורים: LB = מרק ליסוגניה; Ag-Ru = כסף-רותניום; MOPS-g = 3-(N-morpholino)חומצה פרופנסולפונית (MOPS)-גלוקוז. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
2. איסוף דגימות תאי חיידקים
- לאחר 45 דקות של טיפול בלחץ, לקבוע את OD600 של כל תרבות. עבור כל מדגם, תאי קציר שווה ערך 4 מ"ל של OD600 = 1 ב 15 mL צינורות צנטריפוגה על ידי צנטריפוגה במשך 15 דקות ב 3,000 × גרם ו 4 °C (5 °F).
- הסר לחלוטין את supernatant ו resuspend כדורי התא ב 50 μL של חיץ תמה קר כקרח(טבלה 1). לדגור את הדגימות במשך 30 דקות על קרח.
הערה: שלב תמוגה זה משפיל את שכבת הפפטידוגיקן. השתמש תמיד במאגר תמיסת מוכן טרי. - העבר את הדגימות לתוך 1.7 מ"ל צינורות microcentrifuge. יש להקפיא ב-80 מעלות צלזיוס עד לשימוש נוסף.
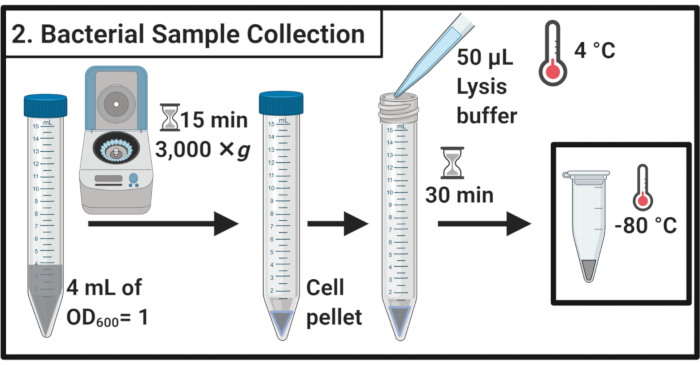
איור 2: אוסף דגימות חיידקים. דגימות תאים נקצרים על ידי צנטריפוגה ו resuspended במאגר תמוגה ואחריו אחסון ב -80 °C.please לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
3. חילוץ אגרגטים של חלבונים מסיסים
- להפשיר דגימות על קרח.
הערה: מחזור הפשרת ההקפאה תורם לתסיסת תאים. - הוסף 360 μL של חוצץ קר כקרח A (טבלה 1) ומערבבים בעדינות על ידי pipetting.
הערה: ההלם האוסמוטי יתרום גם לתסיסת תאים. - העבר את המדגם לצינור microcentrifuge 2 מ"ל המכיל ~ 200 μL של חרוזי זכוכית 0.5 מ"מ. דגירה במשך 30 דקות ב 8 °C (8 °F) תרמומיקסר עם רועד ב 1,400 סל"ד.
הערה: שלב זה גורם להפרעה הפיזית של התא. מעכב פרוטאז יכול לשמש כדי למזער את השפלת החלבון. ההפרעה יכולה להתבצע ב 4 °C (5 °F). שים לב כי השימוש חרוזי זכוכית דווח כדי לגרום לצבירה של תת קבוצה קטנה של חלבונים שמרים19. - דגירה במשך 5 דקות על קרח מבלי לרעוד כדי ליישב את חרוזי הזכוכית. העבר 200 μL של lysate התא לתוך 1.7 מ"ל צינורות microcentrifuge.
הערה: הימנע מהעברת חרוזי הזכוכית. - צנטריפוגה ב 16,000 × גרם ו 4 °C (50 °F) במשך 20 דקות. אסוף את supernatant, אשר מכיל חלבונים מסיסים, ולהמשיך סעיף 4.
- resuspend הכדור ב 200 μL של חוצץ קר כקרח A (טבלה 1) באמצעות pipette. צנטריפוגה ב 16,000 × גרם ו 4 °C (50 °F) במשך 20 דקות. הסר בזהירות את סופר-טבעי לגמרי.
- הוסף 200 μL של חוצץ קר כקרח B (ראה טבלה 1 ואת טבלת החומרים) בזהירות respened הכדור על ידי pipetting.
הערה: חומר הניקוי הלא-יוני סולוביליזה של חלבון הממברנה. - חזור על צנטריפוגה ב 16,000 × גרם ו 4 °C (50 °F) במשך 20 דקות. הסר בזהירות את סופר-טבעי.
- resuspend הכדור ב 200 μL של חוצץ קר A (טבלה 1) על ידי pipetting. צנטריפוגה ב 16,000 × גרם ו 4 °C (50 °F) במשך 20 דקות. הסר לחלוטין את סופר-טבעי.
- Resuspend הכדור ב 100 μL של 1x הפחתת SDS חוצץ מדגם(טבלה 1)ולהרתיח במשך 5 דקות ב 95 °C (5 °F) תרמומיקסר.
- יש לאחסן את המדגם ב- -20 °C כדי להמשיך מאוחר יותר או לטעון מיד על ג'ל פוליאקרילמיד SDS להפרדה.
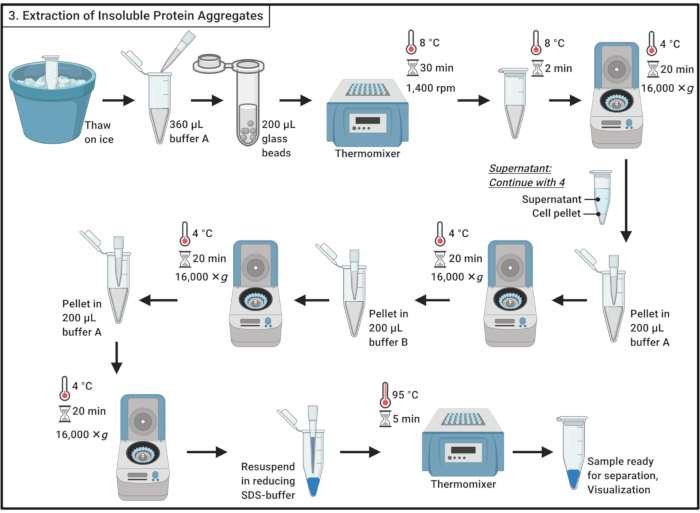
איור 3: הפקת אגרגטים של חלבונים מסיסים. הפקת אגרגטים של חלבונים כרוכה בשורה של צעדים כולל הפרעה לתאים, הפרדת צבירי חלבון מחלבונים מסיסים, סולוביליזציה של חלבונים ממברנה, ושטיפה. קיצור: SDS = נתרן דודסיל סולפט. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
4. הכנת דגימת חלבון מסיס
- יש לערבב נפח אחד של 100% חומצה טריכלורואצטית (TCA) עם 4 כרכים של דגימת חלבון מסיס משלב 3.6.
הערה: טיפול ב- TCA דורש מכסה מנוע אדים וציוד מגן אישי והליך סילוק פסולת מאושר. - דגירה במשך 10 דקות ב 4 °C (5 °F) כדי לאפשר משקעים חלבון.
הערה: משקעים לבנים יופיעו בקרוב מאוד. - צנטריפוגה כדי לזרז ב 21,000 × גרם ו 4 °C (5 °F) במשך 5 דקות ולהסיר את supernatant. לשטוף את הכדור עם 200 μL של אצטון קר כקרח כדי להסיר פסולת הסלולר. צנטריפוגה ב 21,000 × גרם ו 4 °C (5 °F) במשך 5 דקות ולהסיר את supernatant. חזור על פעולות אלה בשלב 4.3 בסך הכל שלוש פעמים.
- מניחים את צינורות microcentrifuge עם מכסים פתוחים תרמומיקסר ב 37 °C (37 °F) כדי להסיר את האצטון הנותר מן הכדור.
הערה: דגירה של יותר מ 5 דקות עשוי להפחית את המסיסות של כדורי חלבון. - הוסף 100 μL של 1x הפחתת מאגר SDS (טבלה 1) ולהמיס לחלוטין את הכדור. מרתיחים את המדגם במשך 5 דקות ב 95 °C (70 °F).
- יש לאחסן דגימה ב- -20 °C כדי להמשיך מאוחר יותר או לטעון מיד על ג'ל פולאקרילמיד SDS להפרדה.
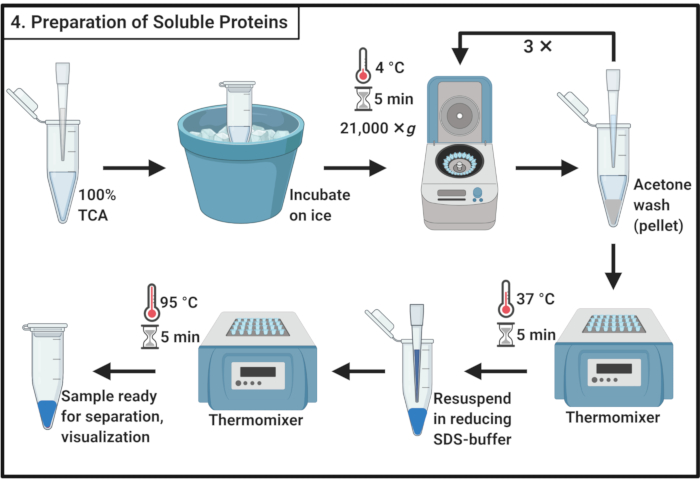
איור 4: הכנת חלבונים מסיסים. הכנת חלבון מסיס כרוכה צעד משקעים עם חומצה טריכלורואצטית ושטיפה חוזרת ונשנית עם אצטון קר כקרח. קיצורים: TCA = חומצה טריכלורואצטית; SDS = נתרן דודסיל סולפט. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
5. הפרדה והדמיה של אגרגטים של חלבונים שחולצו באמצעות SDS-PAGE
- הכינו ג'ל SDS-polyacrylamide 12%.
- עבור שני ג'לים מפרידים, pipette 5.1 מ"ל של מים מזוקקים כפולים (ddH2O), 3.75 מ"ל של Tris-HCl (pH 8.8), 7.5 מ"ל של 20% (w/v) SDS, 6 מ"ל של 30% אקרילאמיד/ביסאקרילמיד (29:1) פתרון, 75 מ"ל של 10% w/v אמוניום אסולפט, ו-10 מ"ל של טטרמתילאתיל-דיאמין (TEMED) לתוך צינור צנטריפוגה של 15 מ"ל ומערבבים בעדינות מבלי להכניס בועות אוויר. יוצקים את הג'ל באמצעות צינור 1 מ"ל בתוך לוחות הזכוכית, משאיר את העליון 2 ס"מ ללא התערובת. מוסיפים 70% אתנול על גבי הג'ל המפריד ומאפשרים ממשק אחיד בין שתי השכבות.
- לאחר פילמור של ג'ל ההפרדה, להכין את ג'ל לערום על ידי pipetting 1.535 מ"ל של ddH2O, 625 מ"ל של פתרון Tris-HCl (pH 6.8), 12.5 מ"ל של 20% (w /v) SDS, 335 מ"ל של 30% אקרילאמיד / ביסאקרילמיד (29:1) פתרון, 12.5 מ"ל של 10% w / v אמוניום persulfate, ו 2.5 מ"ל של TEMED. הסר את האתנול מן הג'לים המפרידים ולהוסיף את פתרון ג'ל לערום. הכנס מסרק עם מספר הכיסים הרצוי מבלי להציג בועות אוויר. אפשר פילמור במשך 20-30 דקות.
- טען 4 μL של כל דגימה וסולם חלבונים לתוך בארות נפרדות ולהפעיל את הג'ל (ים) חוצץ ריצה טריס-גליצין(טבלה 1)ב 144 V במשך 45 דקות בטמפרטורת החדר.
הערה: עצור את הג'ל כאשר הלהקה bromophenol עומד לנדוד מתוך הג'ל. - מכתים את הג'ל בפתרון פיירבנקס מחמם מראש A(טבלה 1)למשך 30 דקות על רוקר.
- צבע את הג'ל בפתרון פיירבנקס מחמם מראש D(טבלה 1)עד לרקע הרצוי (למשל, בן לילה) על רוקר.
איור 5: הפרדת חלבונים והדמיה. הדגימות מופרדות על-ידי SDS-PAGE ומומזות על-ידי כתמי קומאסי. קיצור: SDS-PAGE = נתרן דודסיל סולפט-פוליאקרילמיד ג'ל אלקטרופורזה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
תוצאות
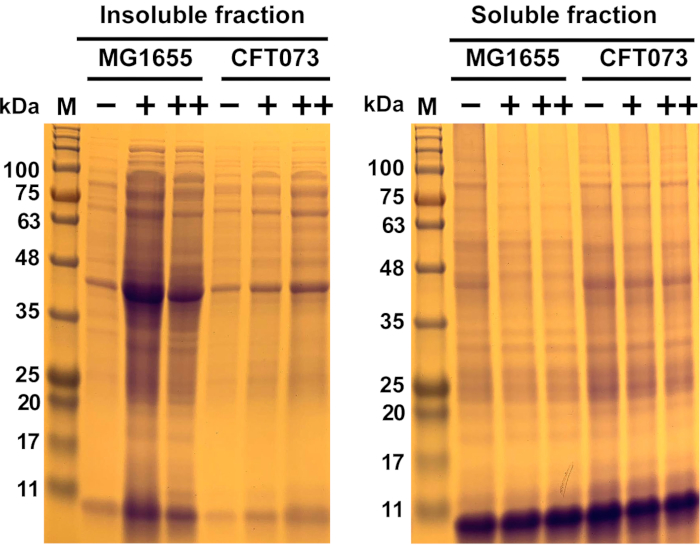
איור 6: תוצאות מייצגות של צבירת חלבונים הנגרמת על ידי מיקרוביאלית בזן קולי Escherichia commensal MG1655 וזן UPEC CFT073. זני E. coli MG1655 ו- CFT073 גדלו ב 37 °C ו 300 סל"ד כדי OD600= 0.5-0.55 במדיה MOPS-g לפני שהם טופלו עם הריכ...
Discussion
פרוטוקול זה מתאר מתודולוגיה ממוטבת לניתוח היווצרות צבירה של חלבונים לאחר טיפול בזני E. coli שונים עם מיקרוביאלית פרוטאוטוקסית. הפרוטוקול מאפשר מיצוי סימולטני של שברי חלבון בלתי מסיסים ותאי E. coli מטופלים ולא מטופלים. בהשוואה לפרוטוקולים הקיימים לבידוד צבירה של חלבונים מתאים
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי קרנות הסטארט-אפ של בית הספר למדעי הביולוגיה של אוניברסיטת אילינוי, מענק יוזמת הפקולטה החדשה של אוניברסיטת אילינוי, ומענק NIAID R15AI164585 (ל- J.-U. D.). G.M.A. נתמך על ידי תוכנית התמיכה במחקר לתואר ראשון באוניברסיטת אילינוי (ל- G.M.A.). K. P. H. נתמך על ידי מלגת RISE שסופקה על ידי שירות חילופי האקדמיה הגרמנית (DAAD). המחברים מודים לד"ר אוו לנדאו וד"ר קרסטן מאייר מ-Largentech Vertriebs GmbH על אספקת אבקת AGXX. איור 3 , איור 4 ואיור 5 נוצרו עם Biorender.
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals/Reagents | |||
| Acetone | Fisher Scientific | 67-64-1 | |
| 30% Acrylamide/Bisacrylamide solution 29:1 | Bio-Rad | 1610156 | |
| Ammonium persulfate | Millipore Sigma | A3678-100G | |
| Benzonase nuclease | Sigma | E1014-5KU | |
| Bluestain 2 Protein ladder, 5-245 kDa | GoldBio | P008-500 | |
| β-mercaptoethanol | Millipore Sigma | M6250-100ML | |
| Bromophenol blue | GoldBio | B-092-25 | |
| Coomassie Brilliant Blue R-250 | MP Biomedicals LLC | 821616 | |
| D-Glucose | Millipore Sigma | G8270-1KG | |
| D-Sucrose | Acros Organics | 57-50-1 | |
| Ethylenediamine tetra acetic acid (EDTA) | Sigma-Aldrich | SLBT9686 | |
| Glacial Acetic acid | Millipore Sigma | ARK2183-1L | |
| Glycerol, 99% | Sigma-Aldrich | G5516-1L | |
| Glycine | GoldBio | G-630-1 | |
| Hydrochloric acid, ACS reagent | Sigma-Aldrich | 320331-2.5L | |
| Isopropanol (2-Propanol) | Sigma | 402893-2.5L | |
| LB broth (Miller) | Millipore Sigma | L3522-1KG | |
| LB broth with agar (Miller) | Millipore Sigma | L2897-1KG | |
| Lysozyme | GoldBio | L-040-25 | |
| 10x MOPS Buffer | Teknova | M2101 | |
| Nonidet P-40 | Thomas Scientific | 9036-19-5 | |
| Potassium phosphate, dibasic | Sigma-Aldrich | P3786-1KG | |
| Potassium phosphate, monobasic | Acros Organics | 7778-77-0 | |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771-500G | |
| Tetramethylethylenediamine (TEMED) | Millipore Sigma | T9281-50ML | |
| Thiamine | Sigma-Aldrich | T4625-100G | |
| 100% Trichloroacetic acid | Millipore Sigma | T6399-100G | |
| Tris base | GoldBio | T-400-1 | |
| Material/Equipment | |||
| Centrifuge tubes (15 mL) | Alkali Scientific | JABG-1019 | |
| Erlenmeyer flask (125 mL) | Carolina | 726686 | |
| Erlenmeyer flask (500 mL) | Carolina | 726694 | |
| Freezer: -80 °C | Fisher Scientific | ||
| Glass beads (0.5 mm) | BioSpec Products | 1107-9105 | |
| Microcentrifuge | Hermle | Z216MK | |
| Microcentriguge tubes (1.7 mL) | VWR International | 87003-294 | |
| Microcentriguge tubes (2.0 mL) | Axygen Maxiclear Microtubes | MCT-200-C | |
| Plastic cuvettes | Fischer Scientific | 14-377-012 | |
| Power supply | ThermoFisher Scientific | EC105 | |
| Rocker | Alkali Scientific | RS7235 | |
| Shaking incubator (37 °C) | Benchmark Scientific | ||
| Small glass plate | Bio-Rad | 1653311 | |
| Spacer plates (1 mm) | Bio-Rad | 1653308 | |
| Spectrophotometer | Thermoscientific | 3339053 | |
| Tabletop centrifuge for 15 mL centrifuge tubes | Beckman-Coulter | ||
| Vertical gel electrophoresis chamber | Bio-Rad | 1658004 | |
| Vortexer | Fisher Vortex Genie 2 | 12-812 | |
| Thermomixer | Benchmark Scientific | H5000-HC | |
| 10 well comb | Bio-Rad | 1653359 |
References
- Dahl, J. -. U., et al. HdeB functions as an acid-protective chaperone in bacteria. Journal of Biological Chemistry. 290 (1), 65-75 (2015).
- Foit, L., George, J. S., Zhang, B. W., Brooks, C. L., Bardwell, J. C. A. Chaperone activation by unfolding. Proceedings of the National Academy of Sciences of the United States of America. 110 (14), 1254-1262 (2013).
- Sultana, S., Foti, A., Dahl, J. -. U. Bacterial defense systems against the neutrophilic oxidant hypochlorous acid. Infection and Immunity. 88 (7), 00964 (2020).
- Dahl, J. -. U., Gray, M. J., Jakob, U. Protein quality control under oxidative stress conditions. Journal of Molecular Biology. 427 (7), 1549-1563 (2015).
- Groitl, B., Dahl, J. -. U., Schroeder, J. W., Jakob, U. Pseudomonas aeruginosa defense systems against microbicidal oxidants. Molecular Microbiology. 106 (3), 335-350 (2017).
- Casadevall, A. Thermal restriction as an antimicrobial function of fever. PLoS Pathogens. 12 (5), 1005577 (2016).
- Richter, K., Haslbeck, M., Buchner, J. The heat shock response: life on the verge of death. Molecular Cell. 40 (2), 253-266 (2010).
- Van Loi, V., Busche, T., Preuß, T., Kalinowski, J., Bernhardt, J. The AGXX ® antimicrobial coating causes a thiol-specific oxidative stress response and protein S-bacillithiolation in Staphylococcus aureus. Frontiers in Microbiology. 9, 3037 (2018).
- Anfinsen, C. B., Scheraga, H. A. Experimental and theoretical aspects of protein folding. Advances in Protein Chemistry. 29, 205-300 (1975).
- Schramm, F. D., Schroeder, K., Jonas, K. Protein aggregation in bacteria. FEMS Microbiology Reviews. 44 (1), 54-72 (2020).
- Tomoyasu, T., Mogk, A., Langen, H., Goloubinoff, P., Bukau, B. Genetic dissection of the roles of chaperones and proteases in protein folding and degradation in the Escherichia coli cytosol. Molecular Microbiology. 40 (2), 397-413 (2001).
- Gray, M. J., et al. Polyphosphate is a primordial chaperone. Molecular Cell. 53 (5), 689-699 (2014).
- Weids, A. J., Ibstedt, S., Tamás, M. J., Grant, C. M. Distinct stress conditions result in aggregation of proteins with similar properties. Scientific Reports. 6, 24554 (2016).
- Mogk, A., et al. Identification of thermolabile Escherichia coli proteins: prevention and reversion of aggregation by DnaK and ClpB. EMBO Journal. 18 (24), 6934-6949 (1999).
- Fay, A., Glickman, M. S. An essential nonredundant role for mycobacterial DnaK in native protein folding. PLoS Genetics. 10 (7), 1004516 (2014).
- Schramm, F. D., Heinrich, K., Thüring, M., Bernhardt, J., Jonas, K. An essential regulatory function of the DnaK chaperone dictates the decision between proliferation and maintenance in Caulobacter crescentus. PLoS Genetics. 13 (12), 1007148 (2017).
- Maisonneuve, E., Fraysse, L., Moinier, D., Dukan, S. Existence of abnormal protein aggregates in healthy Escherichia coli cells. Journal of Bacteriology. 190 (3), 887-893 (2008).
- Heiss, A., Freisinger, B., Held-Föhn, E. Enhanced antibacterial activity of silver-ruthenium coated hollow microparticles. Biointerphases. 12 (5), (2017).
- Papnayotou, I., Sun, B., Roth, A. F., Davis, N. G. Protein aggregation induced during glass bead lysis of yeast. Yeast. 27 (10), 801-816 (2010).
- Chuang, S. E., Blattner, F. R. Characterization of twenty-six new heat shock genes of Escherichia coli. Journal of Bacteriology. 175 (16), 5242-5252 (1993).
- Imlay, J. A. The molecular mechanisms and physiological consequences of oxidative stress: Lessons from a model bacterium. Nature Reviews Microbiology. 11 (7), 443-454 (2013).
- Mühlhofer, M., et al. The heat shock response in yeast maintains protein homeostasis by chaperoning and replenishing proteins. Cell Reports. 29 (13), 4593-4607 (2019).
- Chandrangsu, P., Rensing, C., Helmann, J. D. Metal homeostasis and resistance in bacteria. Nature Reviews Microbiology. 15, 338-350 (2017).
- Stevens, M., et al. HSP60/10 chaperonin systems are inhibited by a variety of approved drugs, natural products, and known bioactive molecules. Bioorganic and Medicinal Chemistry Letters. 29 (9), 1106-1112 (2019).
- Schramm, F. D., Schroeder, K., Alvelid, J., Testa, I., Jonas, K. Growth-driven displacement of protein aggregates along the cell length ensures partitioning to both daughter cells in Caulobacter crescentus. Molecular Microbiology. 111 (6), 1430-1448 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved