JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
프로테오독성 스트레스로 대장균 치료 후 단백질 골재의 추출 및 시각화
요약
이 프로토콜은 프로테오독성 항균제로 치료 한 후 대장균에서 집계 및 수용성 단백질의 추출 및 시각화를 설명합니다. 이 절차에 따라 다른 세균성 균주 및 /또는 치료 사이에 생체 내에서 단백질 골집 형성의 질적 비교를 할 수 있습니다.
초록
환경 및 세포 스트레스에 살아있는 유기체의 노출은 수시로 단백질 항상성에 있는 중단을 일으키는 원인이 되고 단백질 응집귀귀착될 수 있습니다. 세균성 세포에 있는 단백질 응집체의 축적은 성장 비율, 응력 저항 및 독성에 있는 감소를 포함하여 세포 표현성 행동에 있는 중요한 변경으로 이끌어 낼 수 있습니다. 이러한 스트레스 매개 표현형의 검사를 위한 몇몇 실험적인 절차가 존재합니다. 이 논문은 은 루테늄 함유 항균제로 치료 후 다른 대장균 균주에서 골재 및 수용성 단백질의 추출 및 시각화에 최적화된 분석서를 설명합니다. 이 화합물은 반응성 산소 종을 생성하고 광범위한 단백질 응집을 일으키는 것으로 알려져 있습니다.
이 방법은 치료 및 처리되지 않은 세포로부터 단백질 골재 및 용해성 단백질의 원심분리 계 분리를 나트륨 도데실 황산염-폴리아크라이아미드 젤 전기포진(SDS-PAGE) 및 쿠마시 염색에 의한 후속 분리 및 시각화와 결합한다. 이 접근법은 간단하고 빠르며, 다른 대장균 균주에서 단백질 골체 형성의 질적 비교를 허용합니다. 방법론은 광범위한 박테리아에서 생체 내 단백질 응집에 대한 다른 프로테오독성 항균제의 영향을 조사할 수 있는 가능성을 포함하여 광범위한 응용 분야가 있습니다. 더욱이, 프로토콜은 프로테오독성 물질에 대한 저항증가에 기여하는 유전자를 식별하는 데 사용될 수 있다. 젤 밴드는 특히 응집되기 쉬운 단백질의 후속 식별에 사용할 수 있습니다.
서문
박테리아는 필연적으로 환경 스트레스의 무수한에 노출, 낮은 pH(예를 들어, 포유류 위장)1,2,반응성 산소 및 염소 종(ROS/RCS) (예를 들어, 식신구의 산화 파열 중)3,4,5,높은 온도(예를 들어, 온천 또는 열 충격 시)6,7,및 몇 가지 강력한 항균(예를 들어, 이프로토콜)및 몇 가지 강력한 항균(예를 들어, 이 규약) 및 몇 가지 강력한 항균(예를 들어, 이 에 사용됨) 단백질은 이러한 스트레스에 특히 취약하며, 노출은 단백질을 분리/오도하여 다음 씨앗 응집을 유발할 수 있습니다. 모든 유기체는 단백질 잘못 접는9에대처할 수 있는 보호 시스템을 사용합니다. 그러나, 가혹한 긴장은 단백질 질 관리 기계를 압도하고 궁극적으로 단백질을 비활성화하는 단백질의 이차 및/또는 삼차 구조를 방해할 수 있습니다. 결과적으로, 단백질 응집체는 세균성 성장 및 생존, 스트레스 저항 및 독성10에필요한 중요한 세포 기능을 심각하게 손상시킬 수 있다. 따라서, 단백질 집계및 박테리아에 있는 그것의 결과에 집중하는 연구는 전염병 통제에 그것의 잠재적인 충격 때문에 관련 주제입니다.
열 유도 단백질 전개 및 응집은 종종 가역7. 대조적으로, 산화 스트레스와 같은 다른 프로테오독성 응력은 특정 아미노산 사이드 체인의 산화를 통해 돌이킬 수 없는 단백질 변형을 유발하여 단백질을 비/오폴딩시키고, 결국 단백질 응집4를초래할 수 있다. 응력 유발 단백질 골재의 형성은 효모 및 박테리아11,12,13에서분자 보호자 및 보호 기능의 맥락에서 광범위하게 연구되고있다. 여러 프로토콜은 용해성 단백질 골재의 격리 및 분석을 위한 다양한 생화학적 기술을 활용하는 것으로14,15,16,17을공표되었다. 기존 프로토콜은 주로 열 충격 및/또는 분자 보호자의 식별시 세균성 단백질 응집체를 연구하는 데 사용되었습니다. 이러한 프로토콜은 확실히 필드에 발전되었지만, 세포 파괴기, 프랑스 언론 및/또는 초음파처리14,15,17또는 (iii) 시간 반복의 사용을 포함하여 (i) 최대 10 L14,17, (ii) 복잡한 물리적 중단 과정의 큰 세균 배양 부피를 필요로하기 때문에 실험 적 절차에 몇 가지 주요 불편이 있다. 세탁 및 인큐베이션 단계15,16,17.
본 논문은 이전 접근법의 한계를 해결하는 것을 목표로 하는 수정된 프로토콜을 설명하고 프로테오독성 항균 표면 코팅으로 치료 후 두 가지 다른 대장균 균주에서 형성된 단백질 골재의 양을 분석할 수 있게 한다. 코팅은 금속-은(Ag)과 루테늄(Ru)으로 구성되며, 아스코르브산으로 조절되며, 그 항균 활성은 반응성 산소 종8,18의생성에 의해 달성된다. 본명 에서 항균 화합물을 가진 치료 후 세균 배양의 제조에 대한 상세한 설명과 뚜렷한 감수성 프로파일을 가진 두 개의 대장균 균주의 노출 시 단백질 응집 상태의 비교가 항균제의 농도를 증가시키는 것이다. 설명된 방법은 저렴하고 빠르며 재현가능하며 다른 프로테오독성 화합물이 있는 상태에서 단백질 응집을 연구하는 데 사용될 수 있다. 또한, 프로토콜은 다양한 상이한 박테리아에서 특정 유전자 삭제가 단백질 응집에 미치는 영향을 분석하도록 수정될 수 있다.
프로토콜
1. 대장균 균주 MG1655 및 CFT073의 스트레스 치료
- 리소게니 국물 (LB) 배지의 접종 5 mL 는 대장균 균주 MG1655 및 비뇨기요법 대장균 (UPEC) 균주 CFT073의 단일 콜로니를 가진 배지, 각각 37 °C 및 300 rpm에서 14-16 h (하룻밤)에 대한 배양.
참고: 대장균 CFT073은 인간 병원체입니다. CFT073의 처리는 생물 안전 수준-2 인증 실험실에서 적절한 생물 안전 조치를 통해 수행해야 합니다. - 각 균주는 3-(N-morpholino)의 프로판설포닉산(MOPS)-포도당(MOPS-g)의 70mL를 함유한 500mL 플라스크로 희석(표1)600nm(OD600)값에서 광학 밀도에 중간을 한다. 중간 로그 단계에 도달할 때까지 37°C 및 300 rpm에서 배양한다(OD600 = 0.5-0.55).
- 각 배양20mL를 3개의 예온125mL 플라스크로 옮기고 37°C, 300rpm에서 2분 동안 배양한다.
참고: 시료의 적시 처리가 필요하므로 한 번에 6배 이하의 배양식을 처리하지 않습니다. - 2 mg/mL의 농도에서 MOPS-g 배지에서 항균 화합물 용액을 준비합니다. 표시된 농도에 도달하기 위해 각 배양에 항균을 추가합니다. 처리되지 않은 컨트롤의 경우 필요한 양의 MOPS-g 배지를 추가합니다.
참고: 화합물 입자의 균등한 분포를 허용하고 침전을 피하기 위해 2 mg/mL 항균 용액을 소용돌이. - 37°C및 300rpm에서 45분 동안 배양합니다.
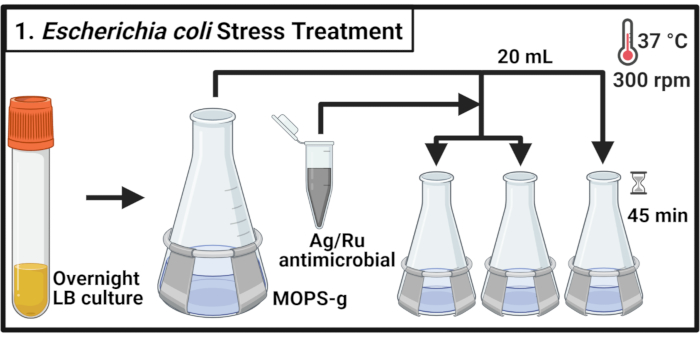
그림 1: 대장균 스트레스 치료. 세균 배양은 MOPS-g에서 재배되고 중간 로그 상에 도달하면 은 루테늄 함유 항균제의 표시 농도로 처리된다. 약어: LB = 리소제니 국물; Ag-Ru = 실버 루테늄; MOPS-g = 3-(N-모르폴리노)프로파네설포닉산(MOPS)-포도당. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 세균 세포 샘플 수집
- 45분 의 스트레스 치료 후 각 배양의 OD600을 결정합니다. 각 샘플에 대해, 수확 세포는 4mL의 OD600 = 15mL 원심분리기 튜브에서 1에 3,000 × g 및 4°C에서 15분 동안 원심분리에 의해 1에 해당한다.
- 상체를 완전히 제거하고 얼음 냉기 용해 버퍼(표 1)의50 μL에서 세포 펠릿을 다시 분리합니다. 얼음에 30 분 동안 샘플을 배양.
참고: 이 리시스 단계는 펩티도글리칸 층을 저하시다. 항상 갓 준비된 용해 버퍼를 사용하십시오. - 샘플을 1.7mL 마이크로센심심분리기 튜브로 옮기습니다. 추가 사용이 될 때까지 -80 °C에서 동결하십시오.
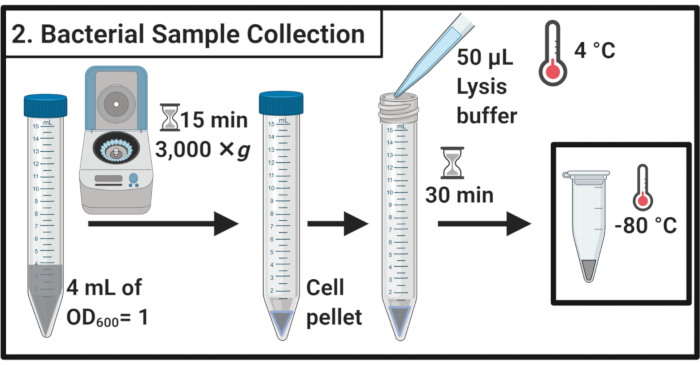
그림 2: 세균 샘플 수집. 셀 샘플은 원심분리에 의해 수확되고 리시스 버퍼에서 다시 리시 버퍼로 재장매되고 -80 °C에서 저장하십시오.
3. 용해성 단백질 응집체 추출
- 얼음에 샘플을 해동.
참고: 동결 해동 주기는 세포 용해에 기여합니다. - 얼음 차가운 버퍼 A(표 1)의360 μL을 추가하고 파이펫팅하여 부드럽게 섞습니다.
참고: 삼투압 쇼크는 세포 리시스에도 영향을 줄 것입니다. - 샘플을 0.5mm 유리 구슬의 ~200 μL을 함유한 2mL 마이크로센심심분리기 튜브로 이송합니다. 1,400 rpm에서 흔들리는 열믹서에서 8 °C에서 30 분 동안 배양하십시오.
참고: 이 단계는 셀의 물리적 중단을 초래합니다. 프로테아제 억제제는 단백질 분해를 최소화하는 데 사용될 수 있다. 중단은 4°C에서 수행될 수 있다. 유리 구슬의 사용은 효모(19)에서단백질의 작은 부분 집합의 응집을 유도하기 위해보고되었다. - 유리 구슬을 정착시키기 위해 흔들리지 않고 얼음에 5 분 동안 배양하십시오. 셀 리세이트 200 μL을 1.7mL 마이크로센심분리기 튜브로 옮기습니다.
참고: 유리 구슬의 전송을 피하십시오. - 원심분리기는 16,000× g, 4°C에서 20분 동안. 수용성 단백질을 포함하는 상체를 수집하고 섹션 4로 진행하십시오.
- 파이펫을 사용하여 200 μL의 얼음 냉간 버퍼A(표 1)에서펠릿을 다시 중단합니다. 원심분리기는 16,000× g, 4°C에서 20분 동안. 신중하게 완전히 상체를 제거합니다.
- 얼음 냉간 버퍼 B 200 μL(표 1 및 재료 표참조)을 추가하고 파이펫팅으로 펠릿을 조심스럽게 재보페수합니다.
참고: 비이온 세제는 막 단백질을 용해시킵니다. - 원심분리를 16,000× g, 4°C에서 20분 동안 반복한다. 상체를 조심스럽게 제거합니다.
- 페펫팅에 의해 200 μL의 냉완충제A(표 1)에서펠릿을 다시 놓습니다. 원심분리기는 16,000× g, 4°C에서 20분 동안. 상체를 완전히 제거합니다.
- 1x의 100 μL에서 펠릿을 재연하여 SDS 샘플버퍼(표 1)를감소시키고 써모믹서에서 95°C에서 5분간 끓입니다.
- 샘플을 -20°C에 저장하여 분리를 위해 SDS 폴리아크라이글라미드 젤에 나중에 또는 즉시 로드합니다.
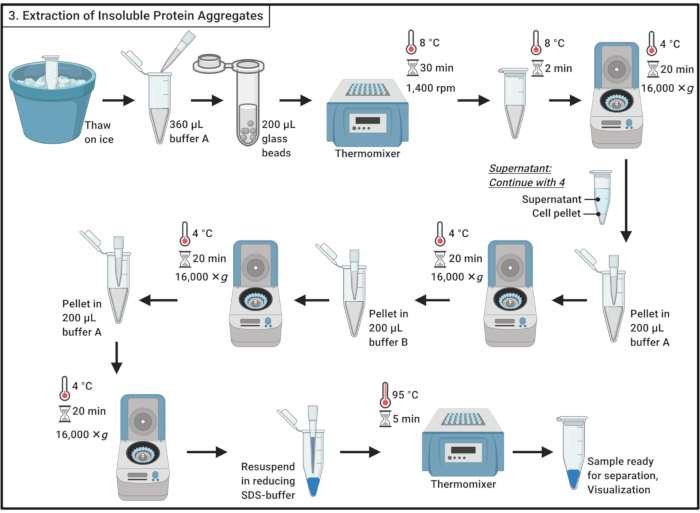
그림 3: 용해성 단백질 골재의 추출. 단백질 응집체의 추출은 세포 중단, 수용성 단백질에서 단백질 응집물의 분리, 막 단백질의 용해성 및 세척을 포함하여 일련의 단계를 포함합니다. 약어: SDS = 나트륨 도데실 황산염. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 수용성 단백질 샘플 준비
- 100% 트리클로로아세트산(TCA)의 1부피를 3.6단계에서 수용성 단백질 샘플 4부와 혼합한다.
참고: TCA를 처리하려면 연기 후드와 개인 보호 장비 및 승인된 폐기물 처리 절차가 필요합니다. - 단백질 강수량을 허용하기 위해 4 °C에서 10 분 동안 배양하십시오.
참고: 백색 침전제가 곧 나타납니다. - 원심분리기는 21,000× g및 4°C에서 5분 동안 침전시키고 상체를 제거한다. 200μL의 얼음-차가운 아세톤으로 펠릿을 세척하여 셀룰러 이물질을 제거합니다. 원심분리기는 21,000× g및 4°C에서 5분 동안 상복부를 제거한다. 총 3단계에서 이러한 작업을 총 세 번 반복합니다.
- 37°C의 써모믹서에 열린 뚜껑이 있는 마이크로센심분리기 튜브를 배치하여 펠릿에서 나머지 아세톤을 제거합니다.
참고: 5분 이상의 배큐베이션은 단백질 펠릿의 용해도를 감소시킬 수 있다. - SDS버퍼(표 1)를줄이고 펠릿을 완전히 용해시키는 1x의 100 μL을 추가합니다. 95°C에서 5분간 시료를 끓입니다.
- 샘플을 -20°C에 저장하여 분리를 위해 SDS 폴리아크라이글라미드 젤에 나중에 또는 즉시 로드합니다.
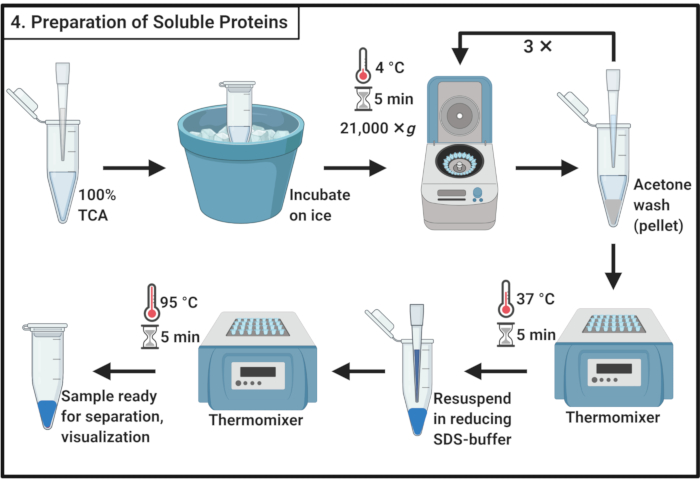
그림 4: 용해성 단백질의 준비. 수용성 단백질의 준비는 삼열산과 함께 강수 단계를 포함하고 얼음 차가운 아세톤으로 반복세척한다. 약어: TCA = 트리클로로아세트산; SDS = 나트륨 도데실 황산염. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. SDS-PAGE를 사용하여 추출된 단백질 골재의 분리 및 시각화
- 12% SDS-폴리아크라이알라미드 젤을 준비합니다.
- 두 개의 분리 젤의 경우, 파이펫 5.1 mL의 이중 증류수 (ddH2O), 3.75 mL 의 Tris-HCl (pH 8.8), 7.5 mL 20 % (w /v) SDS, 6mL 의 30% 아크릴아미드/비사크라이엘라미드(29:1) 용액, 75mL w/v 암모늄 감산, 10mL의 테트라메틸레틸렌디아민(TEMED)을 15mL 원심분리튜브에 넣고 공기버블을 도입하지 않고 부드럽게 섞는다. 유리 판 내 1mL 파이프를 사용하여 젤을 붓고 혼합물의 상부 2cm를 자유롭게 둡니다. 분리 젤 의 상단에 70 % 에탄올을 추가하고 두 층 사이의 균일 한 인터페이스를 허용합니다.
- 분리 겔의 중합 후, ddH2O의 1.535 mL을 배관하여 스태킹 젤을 준비, 625mL 의 Tris-HCl (pH 6.8), 12.5 mL 20 % (w / v) SDS, 335 mL 30 % 아크릴 아미드 / 비사 크라이 라미드 (29:1) 용액, 12.5 mL 12.5 mL 10% w / v 암몬늄 persul. 분리 젤에서 에탄올을 제거하고 스태킹 젤 용액을 추가합니다. 기포를 도입하지 않고 원하는 포켓 수의 빗을 삽입합니다. 20-30 분 동안 중합을 허용하십시오.
- 각 시료와 단백질 사다리의 4 μL을 별도의 우물에 적재하고 실온에서 45분 동안 트리스-글리신 러닝버퍼(표 1)에서젤을 실행합니다.
참고: 브로모페놀 밴드가 젤에서 마이그레이션하려고 할 때 젤을 중지합니다. - 젤을 전예 페어뱅크스 솔루션A(표 1)에서로커에서 30분 동안 염색합니다.
- 미리 워진 페어뱅크스 용액D(표 1)에서원하는 배경(예: 하룻밤)까지 로커에서 젤을 탈색한다.
그림 5: 단백질 분리 및 시각화. 샘플은 SDS-PAGE로 분리되고 Coomassie 염색에 의해 시각화됩니다. 약어: SDS-PAGE = 나트륨 도데딜 황산염-폴리아크라이알라미드 젤 전기포고증. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
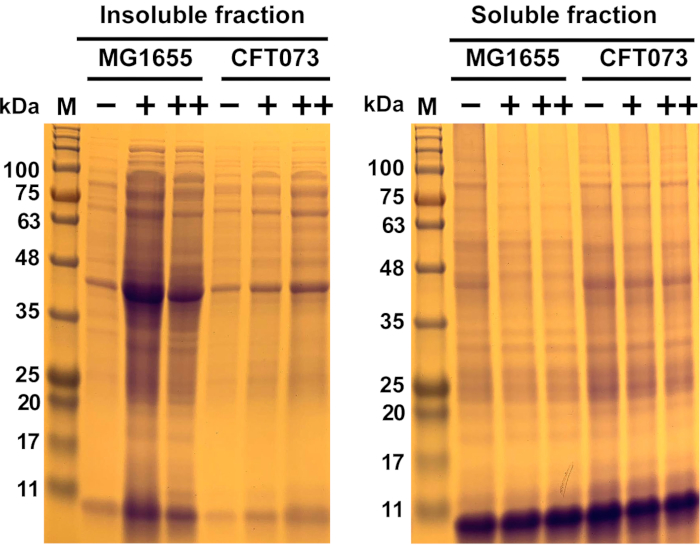
도 6: 대장균 균주 MG1655 및 UPEC 균주 CFT073에서 항균 유도 단백질 응집의 대표적인 결과. 대장균 균주 MG1655 및 CFT073은 37°C및 300 rpm에서 OD600= 0.5-0.55로 성장한 후 MOPS-g 미디어에서 표시 농도(-, 0 mg/mL; +, 175 mg/mL; +, +, 200 mg/mL; ++, 200 mg/mL)의 항균으로 치료하였...
토론
이 프로토콜은 프로테오독성 항균제로 상이한 대장균 균주를 치료한 후 단백질 골체 형성을 분석하기 위한 최적화된 방법론을 설명한다. 이 프로토콜은 치료 및 치료되지 않은 대장균 세포로부터 불용성 및 용해성 단백질 분획을 동시에 추출할 수 있게 합니다. 세포로부터의 단백질 골재 절연을 위한 기존 프로토콜에 비해14,15,
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작품은 일리노이 주립 대학 생물 과학 스타트업 기금, 일리노이 주립 대학 뉴 교수 이니셔티브 그랜트, NIAID 보조금 R15AI164585 (J.U. D.). G.M.A.는 일리노이 주립 대학 학부 연구 지원 프로그램 (G.M.A.에 의해 지원되었다. K. P. H.는 독일 학술 교류 서비스(DAAD)에서 제공하는 RISE 펠로우십의 지원을 받았습니다. 저자는 AGXX 분말을 제공 에 대한 라지네텍 버트리브 GmbH에서 박사 우웨 란다우와 박사 카스텐 마이어 에게 감사드립니다. 그림 1, 도 2, 그림 3, 그림 4,그림 5는 바이오렌더로 생성되었다.
자료
| Name | Company | Catalog Number | Comments |
| Chemicals/Reagents | |||
| Acetone | Fisher Scientific | 67-64-1 | |
| 30% Acrylamide/Bisacrylamide solution 29:1 | Bio-Rad | 1610156 | |
| Ammonium persulfate | Millipore Sigma | A3678-100G | |
| Benzonase nuclease | Sigma | E1014-5KU | |
| Bluestain 2 Protein ladder, 5-245 kDa | GoldBio | P008-500 | |
| β-mercaptoethanol | Millipore Sigma | M6250-100ML | |
| Bromophenol blue | GoldBio | B-092-25 | |
| Coomassie Brilliant Blue R-250 | MP Biomedicals LLC | 821616 | |
| D-Glucose | Millipore Sigma | G8270-1KG | |
| D-Sucrose | Acros Organics | 57-50-1 | |
| Ethylenediamine tetra acetic acid (EDTA) | Sigma-Aldrich | SLBT9686 | |
| Glacial Acetic acid | Millipore Sigma | ARK2183-1L | |
| Glycerol, 99% | Sigma-Aldrich | G5516-1L | |
| Glycine | GoldBio | G-630-1 | |
| Hydrochloric acid, ACS reagent | Sigma-Aldrich | 320331-2.5L | |
| Isopropanol (2-Propanol) | Sigma | 402893-2.5L | |
| LB broth (Miller) | Millipore Sigma | L3522-1KG | |
| LB broth with agar (Miller) | Millipore Sigma | L2897-1KG | |
| Lysozyme | GoldBio | L-040-25 | |
| 10x MOPS Buffer | Teknova | M2101 | |
| Nonidet P-40 | Thomas Scientific | 9036-19-5 | |
| Potassium phosphate, dibasic | Sigma-Aldrich | P3786-1KG | |
| Potassium phosphate, monobasic | Acros Organics | 7778-77-0 | |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771-500G | |
| Tetramethylethylenediamine (TEMED) | Millipore Sigma | T9281-50ML | |
| Thiamine | Sigma-Aldrich | T4625-100G | |
| 100% Trichloroacetic acid | Millipore Sigma | T6399-100G | |
| Tris base | GoldBio | T-400-1 | |
| Material/Equipment | |||
| Centrifuge tubes (15 mL) | Alkali Scientific | JABG-1019 | |
| Erlenmeyer flask (125 mL) | Carolina | 726686 | |
| Erlenmeyer flask (500 mL) | Carolina | 726694 | |
| Freezer: -80 °C | Fisher Scientific | ||
| Glass beads (0.5 mm) | BioSpec Products | 1107-9105 | |
| Microcentrifuge | Hermle | Z216MK | |
| Microcentriguge tubes (1.7 mL) | VWR International | 87003-294 | |
| Microcentriguge tubes (2.0 mL) | Axygen Maxiclear Microtubes | MCT-200-C | |
| Plastic cuvettes | Fischer Scientific | 14-377-012 | |
| Power supply | ThermoFisher Scientific | EC105 | |
| Rocker | Alkali Scientific | RS7235 | |
| Shaking incubator (37 °C) | Benchmark Scientific | ||
| Small glass plate | Bio-Rad | 1653311 | |
| Spacer plates (1 mm) | Bio-Rad | 1653308 | |
| Spectrophotometer | Thermoscientific | 3339053 | |
| Tabletop centrifuge for 15 mL centrifuge tubes | Beckman-Coulter | ||
| Vertical gel electrophoresis chamber | Bio-Rad | 1658004 | |
| Vortexer | Fisher Vortex Genie 2 | 12-812 | |
| Thermomixer | Benchmark Scientific | H5000-HC | |
| 10 well comb | Bio-Rad | 1653359 |
참고문헌
- Dahl, J. -. U., et al. HdeB functions as an acid-protective chaperone in bacteria. Journal of Biological Chemistry. 290 (1), 65-75 (2015).
- Foit, L., George, J. S., Zhang, B. W., Brooks, C. L., Bardwell, J. C. A. Chaperone activation by unfolding. Proceedings of the National Academy of Sciences of the United States of America. 110 (14), 1254-1262 (2013).
- Sultana, S., Foti, A., Dahl, J. -. U. Bacterial defense systems against the neutrophilic oxidant hypochlorous acid. Infection and Immunity. 88 (7), 00964 (2020).
- Dahl, J. -. U., Gray, M. J., Jakob, U. Protein quality control under oxidative stress conditions. Journal of Molecular Biology. 427 (7), 1549-1563 (2015).
- Groitl, B., Dahl, J. -. U., Schroeder, J. W., Jakob, U. Pseudomonas aeruginosa defense systems against microbicidal oxidants. Molecular Microbiology. 106 (3), 335-350 (2017).
- Casadevall, A. Thermal restriction as an antimicrobial function of fever. PLoS Pathogens. 12 (5), 1005577 (2016).
- Richter, K., Haslbeck, M., Buchner, J. The heat shock response: life on the verge of death. Molecular Cell. 40 (2), 253-266 (2010).
- Van Loi, V., Busche, T., Preuß, T., Kalinowski, J., Bernhardt, J. The AGXX ® antimicrobial coating causes a thiol-specific oxidative stress response and protein S-bacillithiolation in Staphylococcus aureus. Frontiers in Microbiology. 9, 3037 (2018).
- Anfinsen, C. B., Scheraga, H. A. Experimental and theoretical aspects of protein folding. Advances in Protein Chemistry. 29, 205-300 (1975).
- Schramm, F. D., Schroeder, K., Jonas, K. Protein aggregation in bacteria. FEMS Microbiology Reviews. 44 (1), 54-72 (2020).
- Tomoyasu, T., Mogk, A., Langen, H., Goloubinoff, P., Bukau, B. Genetic dissection of the roles of chaperones and proteases in protein folding and degradation in the Escherichia coli cytosol. Molecular Microbiology. 40 (2), 397-413 (2001).
- Gray, M. J., et al. Polyphosphate is a primordial chaperone. Molecular Cell. 53 (5), 689-699 (2014).
- Weids, A. J., Ibstedt, S., Tamás, M. J., Grant, C. M. Distinct stress conditions result in aggregation of proteins with similar properties. Scientific Reports. 6, 24554 (2016).
- Mogk, A., et al. Identification of thermolabile Escherichia coli proteins: prevention and reversion of aggregation by DnaK and ClpB. EMBO Journal. 18 (24), 6934-6949 (1999).
- Fay, A., Glickman, M. S. An essential nonredundant role for mycobacterial DnaK in native protein folding. PLoS Genetics. 10 (7), 1004516 (2014).
- Schramm, F. D., Heinrich, K., Thüring, M., Bernhardt, J., Jonas, K. An essential regulatory function of the DnaK chaperone dictates the decision between proliferation and maintenance in Caulobacter crescentus. PLoS Genetics. 13 (12), 1007148 (2017).
- Maisonneuve, E., Fraysse, L., Moinier, D., Dukan, S. Existence of abnormal protein aggregates in healthy Escherichia coli cells. Journal of Bacteriology. 190 (3), 887-893 (2008).
- Heiss, A., Freisinger, B., Held-Föhn, E. Enhanced antibacterial activity of silver-ruthenium coated hollow microparticles. Biointerphases. 12 (5), (2017).
- Papnayotou, I., Sun, B., Roth, A. F., Davis, N. G. Protein aggregation induced during glass bead lysis of yeast. Yeast. 27 (10), 801-816 (2010).
- Chuang, S. E., Blattner, F. R. Characterization of twenty-six new heat shock genes of Escherichia coli. Journal of Bacteriology. 175 (16), 5242-5252 (1993).
- Imlay, J. A. The molecular mechanisms and physiological consequences of oxidative stress: Lessons from a model bacterium. Nature Reviews Microbiology. 11 (7), 443-454 (2013).
- Mühlhofer, M., et al. The heat shock response in yeast maintains protein homeostasis by chaperoning and replenishing proteins. Cell Reports. 29 (13), 4593-4607 (2019).
- Chandrangsu, P., Rensing, C., Helmann, J. D. Metal homeostasis and resistance in bacteria. Nature Reviews Microbiology. 15, 338-350 (2017).
- Stevens, M., et al. HSP60/10 chaperonin systems are inhibited by a variety of approved drugs, natural products, and known bioactive molecules. Bioorganic and Medicinal Chemistry Letters. 29 (9), 1106-1112 (2019).
- Schramm, F. D., Schroeder, K., Alvelid, J., Testa, I., Jonas, K. Growth-driven displacement of protein aggregates along the cell length ensures partitioning to both daughter cells in Caulobacter crescentus. Molecular Microbiology. 111 (6), 1430-1448 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유