Method Article
放线菌素D处理SiHa宫颈癌细胞中凋亡生物标志物的流式细胞术分析
摘要
细胞凋亡可以通过早期和晚期凋亡生物标志物的流式细胞术分析来表征。使用台式流式细胞仪分析放线菌素D处理后宫颈癌细胞系SiHa的凋亡生物标志物。
摘要
使用台式流式细胞仪在放线菌素D处理的SiHa宫颈癌细胞中研究了细胞凋亡生物标志物。在实验和对照培养物中测量细胞凋亡的早期生物标志物(膜联蛋白V和线粒体膜电位)和晚期生物标志物(半胱天冬酶3和7以及DNA损伤)。将培养物在37°C的加湿培养箱中用5%CO2孵育24小时。然后使用胰蛋白酶分离细胞并使用流式细胞术细胞计数测定计数。使用膜联蛋白V测定,线粒体电化学跨膜电位测定,半胱天冬酶3/7测定和DNA损伤测定进一步分析细胞的凋亡。本文概述了细胞凋亡和传统流式细胞术,并详细阐述了用于处理和分析SiHa细胞的流式细胞术方案。结果描述了阳性、阴性和次优实验数据。还讨论了使用该分析平台进行细胞凋亡流式细胞术分析的解释和注意事项。流式细胞术分析可准确测量细胞凋亡的早期和晚期生物标志物。
引言
细胞凋亡被归类为1型程序性细胞死亡1,确保细胞增殖和细胞死亡之间的平衡2。细胞凋亡在人类发育过程中、受伤后以及预防癌症等疾病至关重要3.内在和外在凋亡细胞死亡信号通路4引起连续的生化和形态学细胞内变化2,5,6。形态学凋亡特征可以通过显微镜鉴定,生化扰动可以通过生化测定分析,包括流式细胞术(FC)7。
用于识别细胞凋亡和了解相关细胞内机制的流式细胞术分析在过去二十年中迅速发展8。FC是一种科学方法,用于分析通过单通道或多通道激光器的流体中的细胞(图1)9,10,11。液体中的细胞通过流式细胞仪的流体系统使用流体动力学聚焦聚焦到单个文件中。当细胞通过激光时,光被散射或从细胞发射。散射光可以是向前方向(向前散射)或朝向侧面(侧散射),并分别提供有关细胞大小和细胞粒度或内部结构的信息。
此外,荧光试剂(例如荧光染料或用荧光团标记的抗体)可检测特定的表面或细胞内结构或分子。当激光激发荧光团时,以特定波长发射光。检测器(通常是光电倍增管)量化细胞样品的散射和发射光。检测器产生与光散射和荧光发射成比例的可量化电流。电子输出通过计算软件转换为数字信号,以根据细胞大小、细胞粒度和荧光团标记分子的相对细胞荧光9、12、13 识别细胞群。
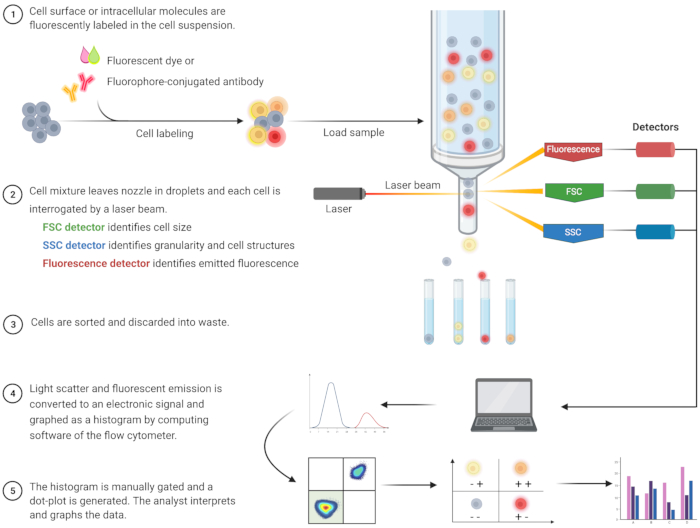
图 1:描述传统流式细胞术技术操作和工作流程的示意图。 用荧光试剂染色细胞并用激光探测。产生的荧光信号被检测并转换为电子输出,通过计算机软件和统计程序进一步数字化和分析。缩写:FSC = 前向散射;SSC = 侧向散射。 请点击此处查看此图的大图。
FC用于研究和健康诊断。FC在死灵生物学中的两个目标是阐明细胞死亡的分子和功能特性以及对各种细胞死亡模式的区分14,15,16,17,18。FC 应用包括细胞计数、细胞群分类、免疫表型、生物标志物检测(例如细胞凋亡生物标志物)、毒性研究和蛋白质工程12。此外,FC常用于健康诊断,以协助血液系统恶性肿瘤患者的诊断和监测。仪器、荧光团检测和检测器系统的进步正在扩大FC的应用,包括成像细胞术、质谱细胞术和光谱细胞术,具有更广泛的研究应用12。
细胞凋亡的流式细胞术分析比用于评估细胞健康的传统技术更具优势。FC可以快速且可重复地分析异质样品中的许多单细胞,以估计细胞凋亡3,5。FC能够在单个细胞的基础上提供细胞表型的定量信息,并避免批量分析,为细胞凋亡分析中使用的蛋白质印迹、酶联免疫吸附测定(ELISA)、荧光测定和分光光度法技术提供了卓越的灵敏度8,19。此外,与蛋白质印迹和ELISA的繁琐且重现性差的手动步骤相比,FC分析相对容易,这是有利的。因此,FC的可重复,准确和高通量分析有利于癌症研究20。
FC还允许同时分析健康和异常凋亡细胞群的细胞周期参数21。由于细胞凋亡是一个动态过程,不同的方法可以产生不同的结果,并且取决于收获细胞的时间点22。同时定量评估细胞表型的多个参数允许以高精度检测小亚群,例如,可以检测到低频率为0.01%的稀有细胞亚群23。多参数FC分析特别有用,因为凋亡死亡发生在凋亡连续体中不同点的细胞的早期和晚期生化变化谱上。例如,在凋亡细胞的FC分析中使用膜联蛋白V和碘化丙啶进行双重染色,可以对早期凋亡细胞,晚期凋亡细胞和死细胞进行分类24。在多个阶段准确检测细胞凋亡可避免错误分类和假阴性结果。因此,FC的多参数分析提高了检测细胞表型的整体特异性,并避免了对次要群体的错误分类。此外,通过FC进行细胞分选可以分离高纯度的细胞群以进行后续分析7。
FC的缺点包括使用悬浮细胞,这在组织分析中可能具有挑战性,因为组织分解成细胞可能会改变细胞功能19。此外,FC仪器设置、数据分析和分析报告缺乏标准化可能会导致结果19的变化,强调需要对FC操作员进行最佳培训,以执行、分析和报告数据。例如,FC区分真实凋亡碎片和凋亡细胞核的能力需要i)适当的采集设置,ii)使用校准磁珠鉴定二倍体DNA峰,以及iii)细胞特异性阴性和阳性细胞对照3。此外,多参数分析受到检测器数量的限制,需要执行最佳补偿以避免在使用多种荧光试剂时出现非特异性结果和荧光发射溢出25。仪器和荧光基团技术的进步使参数检测改进为30个参数12。
凋亡细胞死亡的鉴定并不总是简单的7,应考虑敏感和特异性的生物标志物。细胞死亡命名委员会(NCCD)建议使用多种测定来研究和量化细胞凋亡的过程26。还建议对经典细胞凋亡特征进行显微镜分析26 ,以确认细胞凋亡并避免假阳性结果7。跨越早期和晚期凋亡事件的四个主要生化特征是:(1)细胞膜不对称性丧失;(2)耗散线粒体膜电位(ΔΨm);(3)半胱天冬酶活化;(4)DNA损伤26.
在早期细胞凋亡期间,磷脂酰丝氨酸外化到外细胞膜27,并且可以通过用藻红蛋白27,28,29荧光标记的膜联蛋白V检测。此外,使用荧光 DNA 结合染料 7-氨基放线菌素 D (7-AAD) 进行双重染色可区分活细胞、晚期细胞凋亡细胞和死细胞。因此,早期凋亡细胞对膜联蛋白V染色呈阳性,对7-AAD染色呈阴性,而晚期凋亡细胞对两种染料均呈阳性染色24。
内在凋亡信号诱导线粒体膜电位(ΔΨm)耗散。破坏的ΔΨm导致早期促凋亡蛋白从线粒体膜间空间释放到细胞质中27,29,30。ΔΨm 的变化可以通过用带正电荷的亲脂性染料、四甲基罗丹明乙酯、TMRE 和 7-AAD 进行双重染色来评估。当膜电位高时,TMRE染料积聚在完整线粒体的内膜内。去极化线粒体显示荧光降低。具有极化线粒体(完整的线粒体膜)的活细胞TMRE染色呈阳性,7-AAD染色呈阴性。具有去极化线粒体的死细胞对TMRE呈阴性,对7-AAD31呈阳性。
半胱天冬酶是细胞内蛋白酶家族,当激活时,发出信号并执行细胞凋亡26,27。末端刽子手半胱天冬酶(3,6,7)影响晚期细胞凋亡29,32,33。半胱天冬酶-3和-7活性可以通过荧光标记的底物来测量,当裂解时,该底物与DNA结合并发出荧光信号。此外,可以通过用7-AAD染色来评估对细胞膜完整性的任何损害。凋亡细胞对DNA结合染料呈阳性染色,但对7-AAD呈阴性。晚期凋亡细胞和死细胞对两种染料染色呈阳性34。
晚期细胞凋亡的特征是DNA损伤27,29,35,这可以通过磷酸化共济失调扩张突变激酶(ATM)和组蛋白H2A.X进行评估。 双链DNA断裂(DSB)引起H2A.X.荧光标记的ATM和H2A抗体磷酸化。X可以确定DNA损伤。ATM 和 H2A 检测均为阴性。X表示没有DNA损伤,而两种染料的检测表明DNA36中存在双链断裂。
放线菌素D是细胞凋亡的有效诱导剂,通过与DNA结合阻断转录和翻译事件而起作用37。本研究旨在通过分析细胞凋亡的早期和晚期生物标志物来评估放线菌素D诱导SiHa细胞系中生化细胞凋亡。细胞凋亡的四种生化生物标志物评估了细胞凋亡级联反应中的顺序步骤,包括细胞膜不对称性丧失、线粒体膜电位变化、末端半胱天冬酶活化和 DNA 损伤。
研究方案
注意:本协议描述了使用在台式流式细胞仪上测量和分析的流式细胞术商业测定法进行细胞制备,细胞计数,细胞染色和分析放线菌素D处理的SiHa细胞的步骤(图2)。
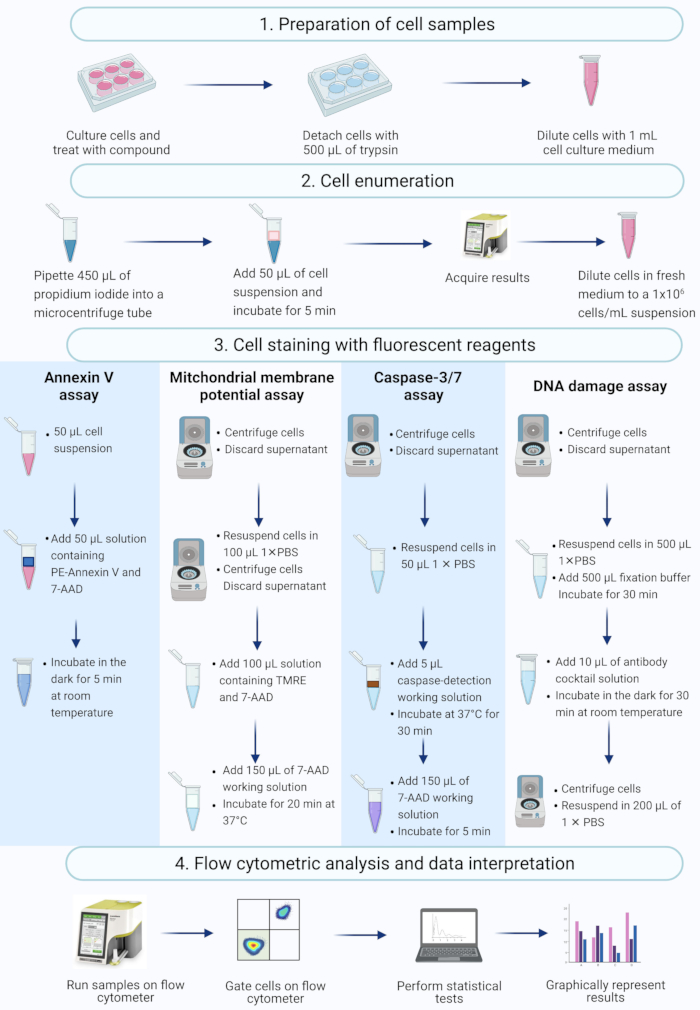
图 2:流式细胞术检测生化凋亡生物标志物的工作流程。 细胞按照方案步骤1.1中所述进行培养和处理。(1)培养细胞,(2)计数和(3)用荧光试剂染色,(4)通过台式流式细胞仪分析。数据被进一步门控,并进行统计分析。缩写:7-AAD = 7-氨基放线菌素 D;PBS = 磷酸盐缓冲盐水;PE = 藻红蛋白;TMRE = 四甲基罗丹明乙酯。 请点击此处查看此图的大图。
1. 流式细胞术的细胞培养和处理的制备
注意:确保在处理细胞培养物时遵循无菌技术。
- 在37°C的加湿CO 2环境中用5%CO2生长细胞培养物。在传代实验细胞之前,确保细胞培养物在母瓶中汇合约70%。
- 从烧瓶中取出培养基,用 1x 磷酸盐缓冲盐水 (PBS) 洗涤细胞,并加入 500 μL 胰蛋白酶以分离细胞。细胞开始变圆并从烧瓶中分离后,在工作台上猛烈敲击烧瓶的底部以分离细胞。然后在计数细胞之前加入约5mL补充有10%胎牛血清的新鲜培养基来中和胰蛋白酶。
- 在 6 孔细胞培养板中的 3 mL 细胞培养基中以 15,000 个细胞/mL 接种细胞。将培养板在37°C下用5%CO2 孵育过夜,以使细胞附着到孔底部。
- 分别用100ng / mL放线菌素D和培养基和溶剂对照用新鲜培养基和二甲基亚砜(DMSO)处理实验培养物24小时。将用过的培养基收集在 15 mL 管中,并用 1x PBS 洗涤细胞。此后,将 1x PBS 洗涤液加入试管中,然后将 500 μL 胰蛋白酶加入孔中。接下来,通过加入 5 mL 新鲜培养基来中和胰蛋白酶。
注意:(1)长时间的胰蛋白酶孵育或不完全中和可能会消化细胞并损害其细胞膜,这可能会扭曲结果。此外,它还可以改变细胞膜的不对称性,从而改变磷脂酰丝氨酸的可及性。(2)通过将去除的培养基以300 ×g 离心5分钟并将细胞重悬于新鲜培养基中,可以将分离并漂浮到表面的细胞包含在后续分析中。
2. 使用活力测定计数细胞
- 在微量离心管中移取450μL碘化丙啶。向微量离心管中加入 50 μL 细胞悬液。将试管在室温下孵育5分钟。通过流式细胞术计数细胞(参见第4节)。
- 在进行细胞凋亡测定之前,用细胞培养基将所有样品稀释至1×106 个细胞/ mL的浓度。
3. 流式细胞术细胞染色
注意:协议的这一部分不需要无菌条件。
- 使用膜联蛋白V检测磷脂酰丝氨酸外化
- 将 100 μL 细胞悬液加入微量离心管中。加入 100 μL 荧光偶联膜联蛋白 V 和 7-AAD 试剂的 1:1 混合物。在室温下孵育20分钟,避光。
- 线粒体膜去极化分析
- 以300× g 离心100μL细胞悬液5分钟,弃去上清液。
- 将细胞重悬于 1 mL 的 1x PBS 中,向每个样品中加入 100 μL TMRE 染色溶液,并通过轻柔的背移液混合悬浮液。
- 将细胞在37°C的潮湿CO2 环境中孵育20分钟。 用干净的铝箔包裹样品以防止光线照射。
注意:线粒体膜电位是一种功能标志物,对细胞环境的微小变化敏感。因此,样品应在相同的条件下孵育和测量(温度、pH和孵育开始与荧光测量之间的时间),以保持重现性)。另外,请注意,对样品的光保护不足会导致荧光团的光漂白,从而导致假的低发射荧光。 - 孵育后,向每个样品中加入 5 μL 7-AAD 染色溶液并混合。在室温下孵育5分钟,避光。
- 使用半胱天冬酶底物DEVD检测活化的末端半胱天冬酶-3和-7
注意:在进行此测定之前制备以下溶液。- 将DMSO中DEVD结合的DNA结合肽与无菌1x PBS的比例稀释至1:8的比例,制成半胱天冬酶检测工作溶液。将溶液储存在冰上或2-8°C,避光。
注意:每个样品将需要 5 μL 的该溶液。 - 将 2 μL 的 7-AAD 储备溶液加入 148 μL 的 1x PBS 中,制成 7-AAD 工作溶液。将溶液储存在冰上或2-8°C,避光。
注意:每个样品将需要 150 μL 的该溶液。 - 以300 × g离心50μL细胞悬液5分钟。弃去上清液。将细胞重悬于 50 μL 的 1x PBS 中,然后重悬 5 μL 半胱天冬酶检测工作溶液。充分混合。
- 松开管的盖子,在37°C的加湿CO2 环境中孵育30分钟,避光。向每个样品中加入 150 μL 的 7-AAD 工作溶液并混合。在室温下孵育5分钟,避光。
- 将DMSO中DEVD结合的DNA结合肽与无菌1x PBS的比例稀释至1:8的比例,制成半胱天冬酶检测工作溶液。将溶液储存在冰上或2-8°C,避光。
- 检测双链DNA断裂和总DNA损伤
- 以300 × g离心50μL细胞悬液5分钟。弃去上清液。
- 将细胞重悬于 500 μL 的 1x PBS 中。加入 500 μL 甲醛基固定缓冲液并混合。将样品在冰上孵育10分钟。
- 以300× g 离心5分钟,弃去上清液。将细胞重悬于微量离心管中的 90 μL 1x PBS 中。向微量离心管中加入 10 μL 抗体溶液。在室温下在黑暗中孵育30分钟。
- 加入 100 μL 的 1x PBS,并以 300 × g 离心 5 分钟。弃去上清液。将细胞重悬于 200 μL 的 1x PBS 中。
4. 在流式细胞仪上运行样品。
- 通过运行仪器的系统检查套件来验证流式细胞仪的分析性能。在所有检查完成并通过之前,不要继续运行示例。
- 通过浏览仪器上的预编程检测目录找到所需的检测,然后选择 运行检测。
- 在将样品加载到流式细胞仪上之前,通过轻轻的回移液混合样品。
注意:充分混合可确保细胞保持悬浮状态并防止细胞计数低。 - 首先,将阴性对照样品加载到流式细胞仪上,然后选择 运行(调整设置), 以便仪器开始吸液样品并提供检测到的事件的实时预览。有关仪器名称和详细信息 ,请参阅材料表 。
- 使用实时预览,调整荧光和细胞大小的阈值,并在细胞群周围绘制一个矩形门。拖动阈值标记以排除细胞碎片。选择 "下一步(设置运行状况配置文件) "以继续。
注意:了解单元格的大小很重要。拖动滑块并观察在实时预览中绘制检测到的事件的方式的变化,因为这将通知准确选择阈值。如果在此阶段未排除细胞碎片,则无法在采集后分析中将其清除。 - 点击并拖动象限标记以分离细胞群,以便仪器实时绘制检测到的事件。使用这些图来指导最终用户正确放置象限标记。选择 下一步(验证样品) 以继续,以便仪器显示设置摘要。查看设置后,选择" 下一步(验证设置) ",将这些设置应用于实验中的所有样本。
注意:仪器提供用于调整仪器设置的单元格的 2 分钟实时预览。如果此时限到期,仪器将释放样品,并且必须重复步骤4.2.2-4.2.4。取出样品并充分混合,然后重新加载并继续。 - 通过在细胞群周围绘制一个区域来门控细胞群。使用位于实时预览的 x 轴和 y 轴上的滑块调整荧光和细胞大小的阈值。将这些设置应用于实验中的所有样本。
- 通过轻轻反移液混合第一个样品,并将第一个样品加载到流式细胞仪上,然后选择 下一步。命名示例并选择"运行 " ,以便系统开始运行示例。
注意:仪器一次只能运行一个样品。 - 运行完所有样本后,通过为其指定适当的标题来保存实验。保存当前试验的设置,以便在将来的运行中检索(可选)。
- 在将样品加载到流式细胞仪上之前,通过轻轻的回移液混合样品。
5. 采集后分析
- 如果需要,在采集后对门或象限标记进行微调。
- 通过导航系统的文件浏览器找到需要调整的实验,然后打开实验。
- 点击绘图的缩略图预览以放大它。点击细胞门的左上角或右下角以调整门的尺寸。要调整象限标记,请点击垂直线和水平线的交点以按原样移动标记。要调整任一线条的角度,请点击该线条并拖动手柄。
- 根据需要调整标记(如前面的步骤4.1.3-4.1.4中所述),并通过选择 复选标记 图标,标记所有样品并选择 接受,将这些设置应用于实验中的所有样品。
6. 统计分析
- 一式三份运行测试,并使用 事后 Bonferroni 测试运行方差分析 (ANOVA),以评估处理样品和对照之间的显着差异。
注意:选择的统计检验取决于调查员和正在分析的变量。
结果
细胞计数和活力(图3)结果显示,样品中95.2%的细胞是活的,4.8%是死亡的。原始样品中的总细胞浓度为 6.20 x 106 个细胞/mL。
与对照组相比,膜联蛋白V和细胞死亡测定(图4)显示,与对照组相比,用100ng / mL放线菌素D处理的SiHa细胞中的凋亡细胞显着增加(p < 0.0001)。由于膜联蛋白V染色在早期细胞凋亡期间增加,这一发现表明100ng / mL放线菌素D诱导SiHa细胞凋亡。
线粒体电化学跨膜电位测定(图5)显示,放线菌素D、培养基对照和溶剂对照之间的细胞健康特征(活的、去极化和活的、去极化的和死的、死的)显著降低(p < 0.0001)。这些数据表明,100 ng/mL 放线菌素 D 诱导 SiHa 细胞中的线粒体去极化。
与对照组相比,半胱天冬酶3/7测定(图6)显示,与对照组相比,用100ng / mL放线菌素D处理的SiHa细胞中半胱天冬酶3和7的半胱天冬酶3和7显着(p < 0.0001)活化。这些发现表明,100 ng/mL放线菌素D诱导SiHa细胞凋亡。
DNA损伤测定(图7)显示,100 ng/mL放线菌素D显著(p < 0.0001)诱导DNA损伤标志物ATM和H2A。X,在SiHa细胞中。这一发现表明用放线菌素D处理的SiHa细胞的DNA损伤显着增加。
次优实验的结果(图8)证明了所有测定的分析考虑因素。细胞浓度会影响数据的准确性。 在图8A中,细胞计数低得令人无法接受。点图所有 4 个象限中的门控细胞群具有低信号强度。制造商优化了最终样品体积中 300-700 个细胞/μL 的检测。这个例子说明了使用制造商规定的正确样品浓度的重要性。
此外,高细胞浓度也会导致错误的结果(图8B)。培养基和实验培养物分别显示99.95%和100%的活细胞。两种检测的流速均超过制造商优化的100-500个细胞/μL浓度,需要使用1x检测缓冲液稀释以避免分析不准确。
在制备实验培养物期间应避免细胞聚集,因为它会因细胞大小指数增加而产生错误的结果,如膜联蛋白V测定所示。 图8C 显示了高细胞浓度超过制造商说明和细胞结块的双重问题,SiHa培养基对照中的细胞大小指数超过4证明了这一点。高细胞浓度表现为在培养基培养物中形成鲜红色细胞平面的细胞片,显示出不和谐的高凋亡细胞群。
如膜联蛋白V测定所示,长时间的培养物染色可导致蛋白质的非特异性结合并导致错误的结果。 图8D 显示了由于长时间染色而对培养基和实验培养物的类似结果。
样品处理不良、贴壁细胞长时间胰蛋白酶消化、洗涤步骤期间剧烈移液以及高速和长时间的离心步骤会导致细胞裂解和大量细胞碎片。 在图8E中,通过半胱天冬酶3/7测定分析的培养物显示细胞碎片增加,由小细胞大小指数(<2.2细胞大小指数)证明。因此,在制备用于数据采集的样品时应小心。
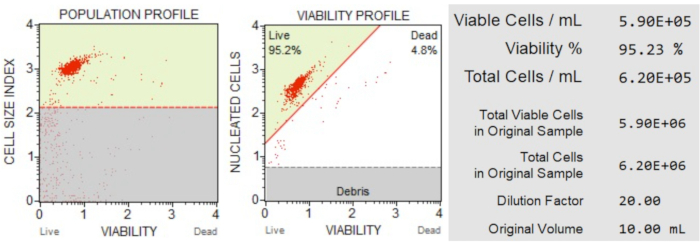
图3:细胞计数和活力测定。 种群概况将碎片与活细胞和死细胞分开。二维点图是门控的,并划分活细胞群和死细胞群。信息面板提供有关细胞计数、总活细胞百分比和样品中活细胞总数的定量数据。这些数据可用于标准化所有样品中的细胞计数,以进行后续的细胞凋亡分析。 请点击此处查看此图的大图。
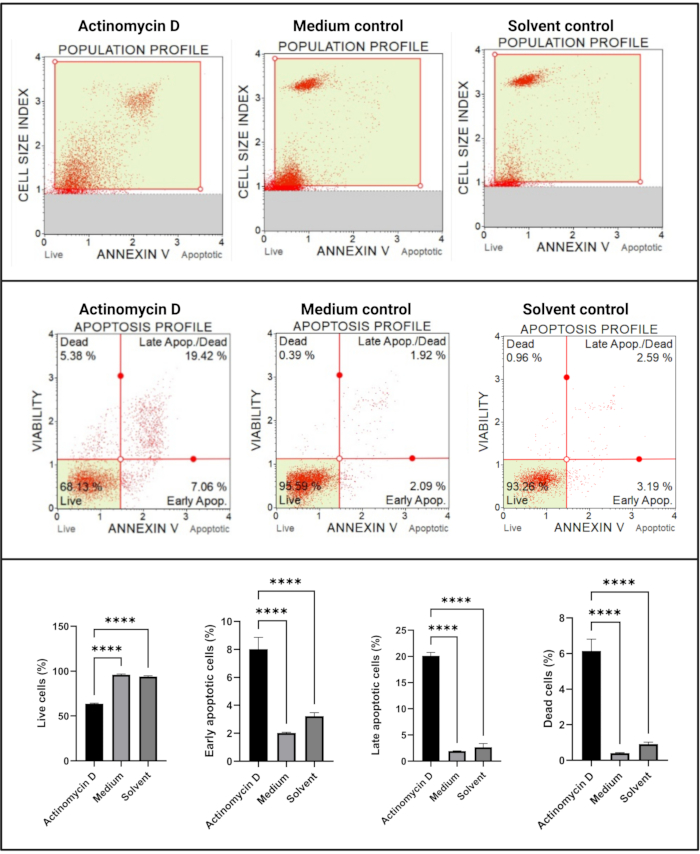
图4:膜联蛋白V测定。 所有样品均显示相同的门控参数,并且对每个亚群的统计分析显示用放线菌素D处理的细胞凋亡显着增加。所有测定均作为三个独立实验进行,每个实验一式三份测定。数据以平均值表示±SD,p < 0.05被认为具有统计学意义。p < 0.0001。 请点击此处查看此图的大图。
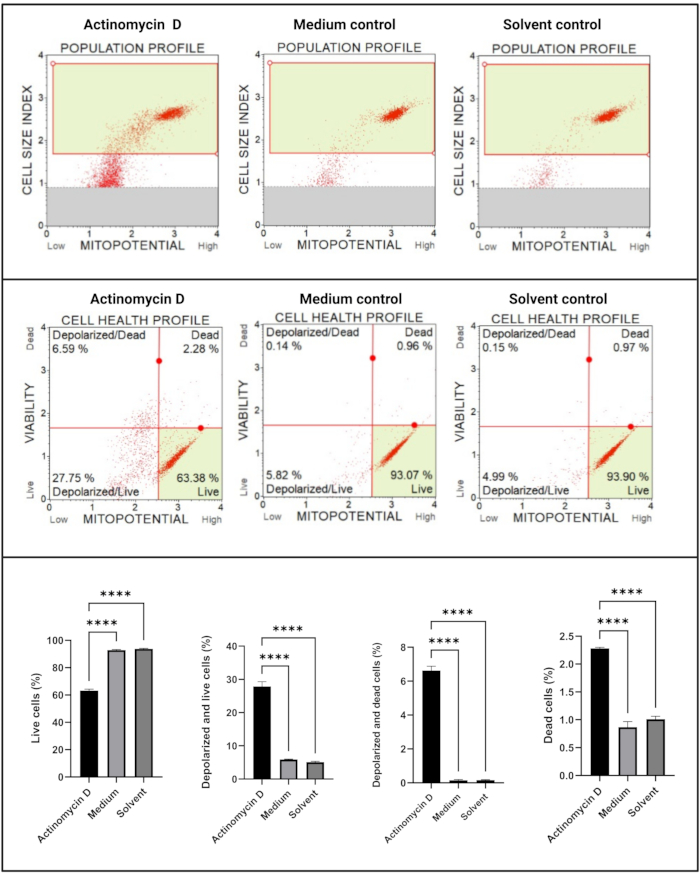
图5:线粒体电化学跨膜电位测定。 所有样品均显示相同的门控参数,并且对每个亚群的统计分析显示,用放线菌素D处理的细胞中线粒体膜电位存在显着扰动。所有测定均作为三个独立实验进行,每个实验一式三份测定。数据以平均值表示±SD,p < 0.05被认为具有统计学意义。p < 0.0001。 请点击此处查看此图的大图。
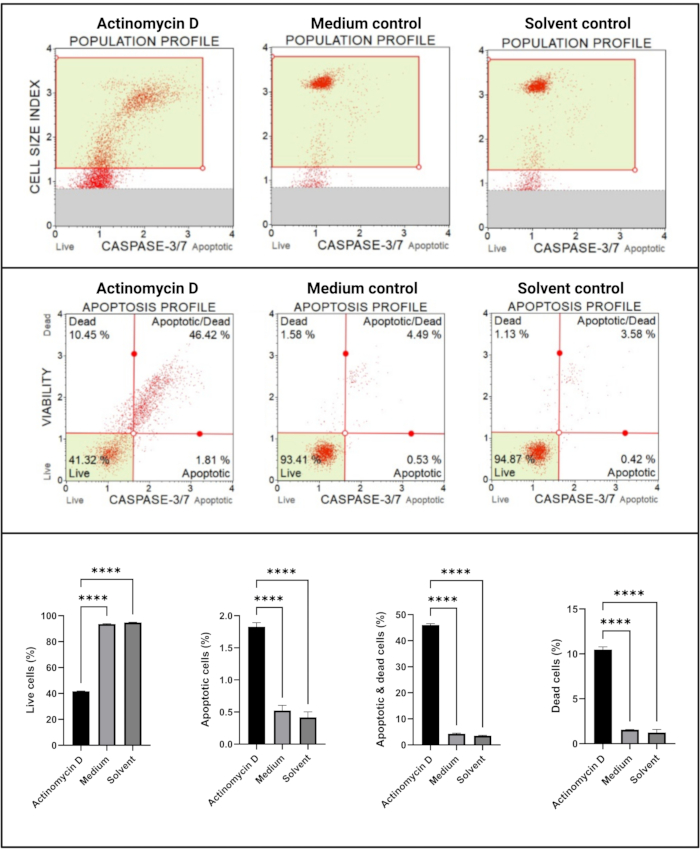
图6:半胱天冬酶3/7检测测定。 所有样品均显示相同的门控参数,并且对每个亚群的统计分析显示,用放线菌素D处理的细胞中半胱天冬酶3/7活性显着增加。所有测定均作为三个独立实验进行,每个实验一式三份测定。数据以平均值表示±SD,p < 0.05被认为具有统计学意义。p < 0.0001。 请点击此处查看此图的大图。
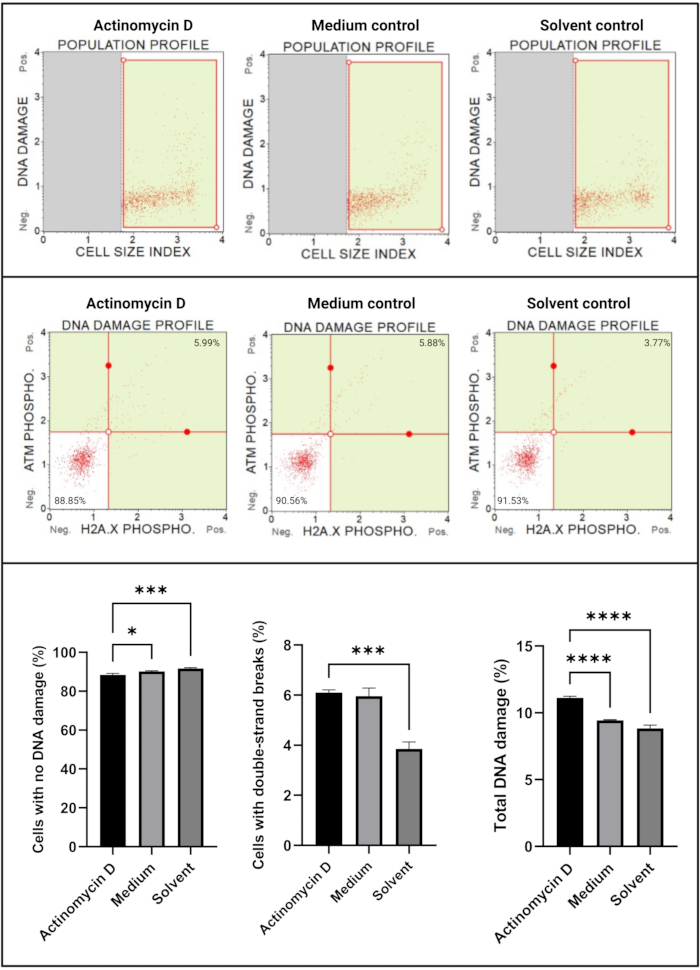
图7:DNA损伤测定。 所有样品均显示相同的门控参数,并且对每个亚群的统计分析显示,用放线菌素D处理的细胞中双链DNA损伤和总DNA损伤显着增加。所有测定均在三个独立实验中进行,每个实验一式三份测定。数据以平均值表示±SD,p < 0.05被认为具有统计学意义。* p < 0.05;< 0.001;p < 0.0001。 请点击此处查看此图的大图。
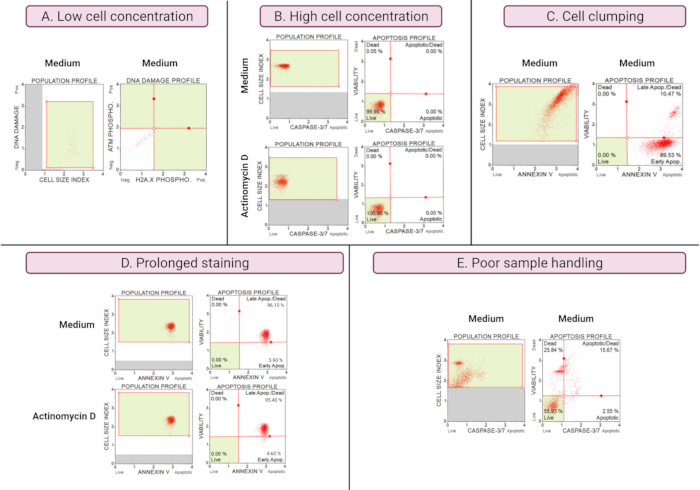
图8:次优实验条件产生较差的结果。 (A)细胞浓度低,(B)细胞浓度高,(C)细胞聚集和聚集明显,细胞大小指数高,(D)细胞样品长时间染色,两个样品的阳性染色增加,以及(E)细胞碎片增加明显导致样品处理不良(细胞大小指数<2.2)。 请点击此处查看此图的大图。
讨论
在这项研究中,FC分析的放线菌素D处理的SiHa细胞揭示了细胞凋亡的显着早期和晚期生物标志物。细胞制备、计数和染色的次优条件发现了不准确的结果,强调在进行FC时需要严格遵守制造商的说明。
这项通过早期和晚期生物标志物鉴定对细胞凋亡的研究符合NCCD关于调查细胞凋亡的指南1。放线菌素D处理的SiHa培养物显示出早期和晚期凋亡阶段的阳性生物标志物。膜联蛋白V/PI测定和线粒体通透性测定显示,放线菌素D分别诱导PS翻转模式和线粒体膜转变的耗散。一旦凋亡细胞达到线粒体扰动诱导的不归路点,终末半胱天冬酶就会被激活3,7。本研究中观察到的终末半胱天冬酶3和7的激活表明晚期细胞凋亡。此外,末端半胱天冬酶活化导致核小体间DNA切割和广泛的DNA片段化,这通常被报道为凝胶电泳观察到的阶梯模式28,38。
ATM和H2A的核损坏。X FC DNA 损伤测定显示 DNA 双链断裂和总 DNA 损伤。这些结果证实了实验培养物中经典的下游半胱天冬酶诱导的凋亡核损伤(核溢出和核溶解)。因此,使用多种流式细胞术生物标志物检测了细胞凋亡中的连续多阶段事件,并在凋亡早期和晚期准确且可重复地鉴定了细胞群。这些发现与放线菌素D在人类癌症治疗中的已知促凋亡特征一致37,39,40,41,并进一步支持在研究细胞凋亡的FC细胞培养实验中使用放线菌素D作为阳性对照。
本研究中细胞群的门控是通过阴性培养基和溶剂对照提供的,这些对照将凋亡细胞与健康细胞分开。或者,阳性和阴性对照的群体的混合物也可用于定义活细胞群和凋亡细胞群以设置细胞群门7,9。一旦定义和门控患病和健康的细胞状态,模板设置就可以应用于所有后续的实验和对照培养物。
严格遵守 FC 协议对于避免错误结果至关重要。在方案优化过程中,观察到以下问题:(1)低细胞浓度,(2)高细胞浓度,(3)细胞聚集,(4)长时间染色和(5)样品处理不良。这些问题可以通过严格遵守优化的协议要求来预防。这强调了FC获得准确数据所需的分析前和分析步骤的关键性质。在细胞制备过程中,必须小心进行胰蛋白酶消化、移液、离心和稀释。过度胰蛋白酶消化和剧烈移液可能分别导致细胞的化学和机械剪切。长时间和高速离心可能导致细胞分解和高细胞碎片计数。需要最佳细胞浓度以最大程度地减少细胞事件的错误采集。因此,应稀释原代细胞悬液以获得最佳细胞浓度。
此外,在处理样品时,必须注意防止细胞聚集和细胞碎裂,并确保细胞在分析过程中保持悬浮状态。防止细胞聚集的样品处理允许单层流细胞流动,防止仪器毛细管的机械堵塞,并抑制虚假的大细胞尺寸指数。另一个需要注意的是保护培养物免受光照,以避免光氧化和荧光团在测定中淬灭,以防止假阴性结果。必须注意确保在细胞的染色步骤和后续处理步骤中将光暴露最小。此外,由于蛋白质是非特异性染色的,延长免疫染色时间可能会导致假阳性结果。因此,遵守制造商规定的孵育染色期非常重要。
综上所述,FC可以准确检测细胞凋亡,区分细胞培养中的早晚期凋亡生物标志物。此外,技术的进步导致了台式流式细胞仪的制造,供非专业科学家研究细胞健康和复杂的细胞内信号通路。
披露声明
Luminex®公司提供了物品处理费。
致谢
该研究得到了国家研究基金会(NRF)和南非医学研究理事会(SAMRC)的资助。我们要感谢国家卫生实验室服务(NHLS)购买番石榴缪斯细胞分析仪。本出版物中的所有数字均采用 Biorender.com 创建。
材料
| Name | Company | Catalog Number | Comments |
| 6-well plates | Lasec | P1PLA044C-000006 | |
| Dimethyl Sulfoxide | Sigma-Aldrich | D8418 | |
| DMEM | ThermoFisher | 41966052 | |
| Glutamine | Sigma-Aldrich | P10-040500 | |
| Guava Muse Cell Analyzer | Luminex | 0500-3115 | |
| Microcentrifuge tubes/Eppendorf | Merck | EP0030122208-200EA | |
| Muse Annexin V kit | Merck | MCH100105 | |
| Muse Caspase-3/7 kit | Merck | MCH100108 | |
| Muse Count and Viability kit | Merck | MCH600103 | |
| Muse DNA Damage kit | Merck | MCH200107 | |
| Muse MitoPotential kit | Merck | MCH100110 | |
| PBS Buffer | ThermoFisher | 70013065 | |
| Pen-strep | Sigma-Aldrich | P4333 | |
| SiHa cells | ATCC | CRL-1550 | |
| T25 culture flasks | Sigma-Aldrich | C6231 | |
| Trypsin | Pan Biotech | P10-040500 |
参考文献
- Galluzzi, L., et al. Molecular mechanisms of cell death: Recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death and Differentiation. 25 (3), 486-541 (2018).
- Kerr, J. F., Wyllie, A. H., Currie, A. R. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. British journal of cancer. 26 (4), 239-257 (1972).
- Riccardi, C., Nicoletti, I. Analysis of apoptosis by propidium iodide staining and flow cytometry. Nature Protocols. 1 (3), 1458-1461 (2006).
- Edinger, A. L., Thompson, C. B. Death by design: apoptosis, necrosis and autophagy. Current Opinion in Cell Biology. 16 (6), 663-669 (2004).
- Arends, M. J., Morris, R. G., Wyllie, A. H. Apoptosis. The role of the endonuclease. The American journal of pathology. 136 (3), 593-608 (1990).
- Majno, G., Joris, I. Apoptosis, oncosis, and necrosis. An overview of cell death. Am J Pathol. 146 (1), 3-15 (1995).
- Darzynkiewicz, Z., Traganos, F., Al-Rubeai, M. . Apoptosis. , 33-73 (1998).
- Wlodkowic, D., Skommer, J., Darzynkiewicz, Z. Flow cytometry-based apoptosis detection. Methods in molecular biology. 559, 19-32 (2009).
- . Introduction to Flow Cytometry Basics Available from: https://www.bio-rad-antibodies.com/introduction-to-flow-cytometry.html (2021)
- Telford, W. G., Komoriya, A., Packard, B. Z. Detection of localized caspase activity in early apoptotic cells by laser scanning cytometry. Cytometry. 47 (2), 81-88 (2002).
- Castedo, M., et al. Quantitation of mitochondrial alterations associated with apoptosis. J Immunol Methods. 265 (1-2), 39-47 (2002).
- McKinnon, K. M. Flow Cytometry: An Overview. Current protocols in immunology. 120, 1-11 (2018).
- Macey, M. G. Flow cytometry: principles and clinical applications. Med Lab Sci. 45 (2), 165-173 (1988).
- Darzynkiewicz, Z., et al. Features of apoptotic cells measured by flow cytometry. Cytometry. 13 (8), 795-808 (1992).
- Darzynkiewicz, Z., et al. Cytometry in cell necrobiology: Analysis of apoptosis and accidental cell death (necrosis). Cytometry. 27 (1), 1-20 (1997).
- Ormerod, M. G. The study of apoptotic cells by flow cytometry. Leukemia. 12 (7), 1013-1025 (1998).
- van Engeland, M., Nieland, L. J., Ramaekers, F. C., Schutte, B., Reutelingsperger, C. P. Annexin V-affinity assay: a review on an apoptosis detection system based on phosphatidylserine exposure. Cytometry. 31 (1), 1-9 (1998).
- Vermes, I., Haanen, C., Reutelingsperger, C. Flow cytometry of apoptotic cell death. Journal of Immunological Methods. 243 (1), 167-190 (2000).
- Jahan-Tigh, R. R., Ryan, C., Obermoser, G., Schwarzenberger, K. Flow cytometry. J Invest Dermatol. 132 (10), 1-6 (2012).
- Lövborg, H., Gullbo, J., Larsson, R. Screening for apoptosis-classical and emerging techniques. Anti-cancer drugs. 16 (6), 593-599 (2005).
- Vorobjev, I. A., Barteneva, N. S. Multi-parametric imaging of cell heterogeneity in apoptosis analysis. Methods. 112, 105-123 (2017).
- Telford, W. G., Komoriya, A., Packard, B. Z. Multiparametric analysis of apoptosis by flow and image cytometry. Methods in molecular biology. 263, 141-160 (2004).
- Kagami, S., Rizzo, H. L., Lee, J. J., Koguchi, Y., Blauvelt, A. Circulating Th17, Th22, and Th1 cells are increased in psoriasis. J Invest Dermatol. 130 (5), 1373-1383 (2010).
- . Muse® Annexin V & Dead Cell Kit Available from: https://www.luminexcorp.com/muse-annexin-v-dead-cell-kit/ (2019)
- Roederer, M. Spectral compensation for flow cytometry: visualization artifacts, limitations, and caveats. Cytometry. 45 (3), 194-205 (2001).
- Kroemer, G., et al. Classification of cell death: recommendations of the Nomenclature Committee on Cell Death. Cell Death and Differentiation. 12 (2), 1463-1467 (2005).
- Apoptosis assays and markers guide. Abcam Available from: https://www.abcam.com/kits/apoptosis-assays (2021)
- Vermes, I., Haanen, C., Steffens-Nakken, H., Reutelingsperger, C. A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V. Journal of Immunological Methods. 184 (1), 39-51 (1995).
- Elmore, S. Apoptosis: A Review of Programmed Cell Death. Toxicologic Pathology. 35 (4), 495-516 (2007).
- Saelens, X., et al. Toxic proteins released from mitochondria in cell death. Oncogene. 23 (16), 2861-2874 (2004).
- Muse™ MitoPotential Kit User's Guide. Luminex Corporation Available from: https://www.luminexcorp.com/muse-mitopotential-kit (2013)
- McIlwain, D. R., Berger, T., Mak, T. W. Caspase functions in cell death and disease. Cold Spring Harbor Perspectives in Biology. 5 (4), 008656 (2013).
- Wigdal, S. S., Kirkland, R. A., Franklin, J. L., Haak-Frendscho, M. Cytochrome c release precedes mitochondrial membrane potential loss in cerebellar granule neuron apoptosis: lack of mitochondrial swelling. Journal of Neurochemistry. 82 (5), 1029-1038 (2002).
- Muse® Caspase-3/7 Kit. Luminex Corporation Available from: https://www.luminexcorp.com/muse-caspase-3-7-kit/#overview (2019)
- Häcker, G. The morphology of apoptosis. Cell and Tissue Research. 301 (1), 5-17 (2000).
- Muse® Multi-Color DNA Damage Kit User's Guide. Luminex Corporation Available from: https://www.luminexcorp.com/muse-multi-color-dna-damage-kit/#overview (2020)
- Kleeff, J., Kornmann, M., Sawhney, H., Korc, M. Actinomycin D induces apoptosis and inhibits growth of pancreatic cancer cells. International journal of cancer. 86 (3), 399-407 (2000).
- Wlodkowic, D., Skommer, J., Darzynkiewicz, Z. Cytometry of apoptosis. Historical perspective and new advances. Experimental oncology. 34 (3), 255-262 (2012).
- Szeberenyi, J. The effect of actinomycin D on RNA metabolism in human cells. Biochem Mol Biol Educ. 34 (1), 50-51 (2006).
- Ginell, S., Lessinger, L., Berman, H. M. The crystal and molecular structure of the anticancer drug actinomycin D--some explanations for its unusual properties. Biopolymers. 27 (5), 843-864 (1988).
- Hou, M. H., Robinson, H., Gao, Y. G., Wang, A. H. Crystal structure of actinomycin D bound to the CTG triplet repeat sequences linked to neurological diseases. Nucleic Acids Res. 30 (22), 4910-4917 (2002).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。