Method Article
Durchflusszytometrische Analyse von apoptotischen Biomarkern in Actinomycin-D-behandelten SiHa-Gebärmutterhalskrebszellen
In diesem Artikel
Zusammenfassung
Die Apoptose kann durch die durchflusszytometrische Analyse früher und später apoptotischer Biomarker charakterisiert werden. Die Zelllinie des Gebärmutterhalskrebses, SiHa, wurde nach Behandlung mit Actinomycin D mit einem Benchtop-Durchflusszytometer auf Apoptose-Biomarker untersucht.
Zusammenfassung
Apoptose-Biomarker wurden in Actinomycin-D-behandelten SiHa-Gebärmutterhalskrebszellen mit einem Benchtop-Durchflusszytometer untersucht. Frühe Biomarker (Annexin V und mitochondriales Membranpotential) und späte Biomarker (Caspasen 3 und 7 sowie DNA-Schäden) der Apoptose wurden in Versuchs- und Kontrollkulturen gemessen. Die Kulturen wurden für 24 Stunden in einem befeuchteten Inkubator bei 37 °C mit 5% CO2 inkubiert. Die Zellen wurden dann mit Trypsin abgetrennt und mit einem durchflusszytometrischen Zellzahltest gezählt. Die Zellen wurden mit einem Annexin-V-Assay, einem mitochondrialen elektrochemischen Transmembranpotential-Assay, einem Caspase-3/7-Assay und einem DNA-Schadensassay auf Apoptose analysiert. Dieser Artikel gibt einen Überblick über Apoptose und traditionelle Durchflusszytometrie und erarbeitet durchflusszytometrische Protokolle für die Verarbeitung und Analyse von SiHa-Zellen. Die Ergebnisse beschreiben positive, negative und suboptimale experimentelle Daten. Diskutiert werden auch die Interpretation und die Vorbehalte bei der Durchführung der durchflusszytometrischen Analyse der Apoptose unter Verwendung dieser analytischen Plattform. Die durchflusszytometrische Analyse ermöglicht eine genaue Messung von frühen und späten Biomarkern für Apoptose.
Einleitung
Die Apoptose, klassifiziert als Typ 1 programmierter Zelltod1, sorgt für ein Gleichgewicht zwischen Zellproliferation und Zelltod2. Apoptose ist während der menschlichen Entwicklung, nach Verletzungen und zur Vorbeugung von Krankheiten wie Krebs unerlässlich3. Intrinsische und extrinsische apoptotische Zelltod-Signalwege4 verursachen sequenzielle biochemische und morphologische intrazelluläre Veränderungen 2,5,6. Morphologische apoptotische Merkmale können mikroskopisch identifiziert werden, und die biochemische Störung kann durch biochemische Assays, einschließlich Durchflusszytometrie (FC)7, analysiert werden.
Die durchflusszytometrische Analyse zur Identifizierung von Apoptose und zum Verständnis der damit verbundenen intrazellulären Mechanismen hat in den letzten zwei Jahrzehnten zugenommen8. FC ist eine wissenschaftliche Methode, bei der Zellen in einer Flüssigkeit analysiert werden, die durch Ein- oder Mehrkanallaser geleitet wird (Abbildung 1)9,10,11. Die Zellen in der Flüssigkeit werden vom Fluidiksystem des Durchflusszytometers mittels hydrodynamischer Fokussierung in einer einzigen Datei fokussiert. Wenn Zellen den Laser passieren, wird Licht von den Zellen gestreut oder emittiert. Das Streulicht kann in Vorwärtsrichtung (Vorwärtsstreuung) oder zur Seite (Seitenstreuung) verlaufen und liefert Informationen über die Zellgröße bzw. Zellgranularität bzw. interne Strukturen.
Darüber hinaus detektieren fluoreszierende Reagenzien, wie fluoreszierende Farbstoffe oder mit Fluorophoren markierte Antikörper, spezifische Oberflächen- oder intrazelluläre Strukturen oder Moleküle. Wenn der Laser die Fluorophore anregt, wird Licht mit einer bestimmten Wellenlänge emittiert. Detektoren – in der Regel Photomultiplier-Röhren – quantifizieren das gestreute und emittierte Licht von Zellproben. Die Detektoren erzeugen einen quantifizierbaren Strom, der proportional zur Lichtstreuung und Fluoreszenzemission ist. Die elektronische Ausgabe wird von einer Computersoftware in digitale Signale umgewandelt, um Zellpopulationen auf der Grundlage von Zellgröße, Zellgranularität und der relativen Zellfluoreszenz von Fluorophor-markierten Molekülenzu identifizieren 9,12,13.
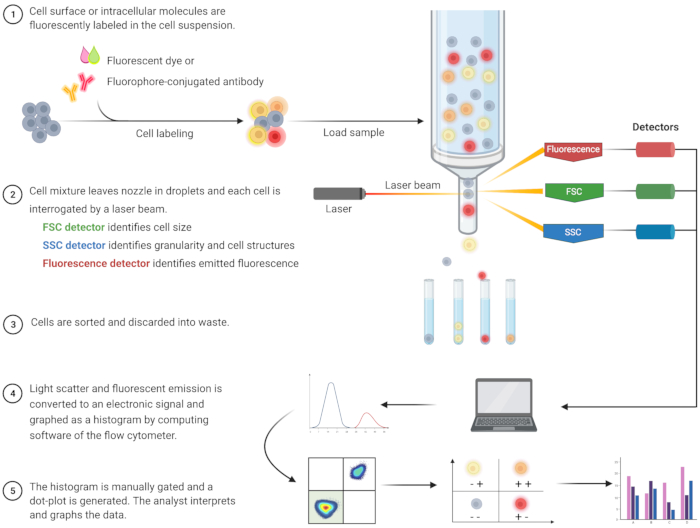
Abbildung 1: Schematische Darstellung der technischen Funktionsweise und des Arbeitsablaufs der traditionellen Durchflusszytometrie. Die Zellen werden mit fluoreszierenden Reagenzien gefärbt und mit einem Laser sondiert. Die erzeugten Fluoreszenzsignale werden detektiert und in einen elektronischen Ausgang umgewandelt, der durch Computersoftware und Statistikprogramme weiter digitalisiert und analysiert wird. Abkürzungen: FSC = Vorwärtsstreuung; SSC = seitliche Streuung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
FC wird sowohl in der Forschung als auch in der Gesundheitsdiagnostik eingesetzt. Die beiden Ziele von FC in der Nekrobiologie sind die Aufklärung molekularer und funktioneller Eigenschaften des Zelltods und die Unterscheidung verschiedener Zelltodmodi 14,15,16,17,18. Zu den Anwendungen von FC gehören die Zellzählung, die Sortierung von Zellpopulationen, die Immunphänotypisierung, der Nachweis von Biomarkern (z. B. Apoptose-Biomarker), Toxizitätsstudien und Protein-Engineering12. Darüber hinaus wird FC häufig in der Gesundheitsdiagnostik eingesetzt, um die Diagnose und Überwachung von Patienten mit hämatologischen Malignomen zu unterstützen. Fortschritte in der Instrumentierung, der Fluorophordetektion und den Detektorsystemen erweitern die FC-Anwendungen um bildgebende Zytometrie, Massenzytometrie und spektrale Zytometrie mit breiteren Forschungsanwendungen12.
Die durchflusszytometrische Analyse der Apoptose bietet Vorteile gegenüber herkömmlichen Techniken, die zur Beurteilung der Zellgesundheit verwendet werden. FC kann viele Einzelzellen in einer heterogenen Probe schnell und reproduzierbar analysieren, um die Apoptose abzuschätzen 3,5. Die Fähigkeit von FC, quantitative Informationen über Zellphänotypen auf individueller Zellbasis zu liefern und Massenanalysen zu vermeiden, bietet eine überlegene Sensitivität gegenüber Western Blotting, Enzyme-linked Immunosorbent Assays (ELISAs), Fluorometrie und Spektrophotometrietechniken, die bei der Analyse der Apoptose verwendet werden 8,19. Darüber hinaus ist die relative Einfachheit der FC-Analyse im Gegensatz zu den umständlichen und schlecht reproduzierbaren manuellen Schritten von Western Blots und ELISAs von Vorteil. Die reproduzierbare, genaue und Hochdurchsatzanalyse von FC ist daher in der Krebsforschung von Vorteil20.
FC ermöglicht auch die gleichzeitige Analyse von Zellzyklusparametern für gesunde und abnorme apoptotische Zellpopulationen21. Da es sich bei der Apoptose um einen dynamischen Prozess handelt, können verschiedene Methoden zu unterschiedlichen Ergebnissen führen und sind abhängig vom Zeitpunkt, zu dem die Zellen geerntet werden22. Die simultane quantitative Bewertung mehrerer Parameter des Zellphänotyps ermöglicht die Detektion kleinerer Subpopulationen mit hoher Genauigkeit, z.B. können seltene Zellsubpopulationen mit einer niedrigen Häufigkeit von 0,01% detektiert werden23. Die multiparametrische FC-Analyse ist besonders nützlich, da der apoptotische Tod entlang eines Spektrums früher und später biochemischer Veränderungen mit Zellen an verschiedenen Punkten entlang des apoptotischen Kontinuums auftritt. Beispielsweise ermöglicht die Verwendung der dualen Färbung mit Annexin V und Propidiumiodid in der FC-Analyse von apoptotischen Zellen die Kategorisierung von frühen apoptotischen Zellen, späten apoptotischen Zellen und toten Zellen24. Die genaue Erkennung der Apoptose in mehreren Stadien vermeidet Fehlklassifizierungen und falsch-negative Ergebnisse. Somit verbessert die multiparametrische Analyse durch FC die Gesamtspezifität des Nachweises von Zellphänotypen und vermeidet die Fehlklassifizierung kleinerer Populationen. Darüber hinaus ermöglicht die Zellsortierung mittels FC die Isolierung von Zellpopulationen mit hoher Reinheit für die anschließende Analyse7.
Der Nachteil von FC besteht in der Verwendung von Zellen in Suspension, was bei der Gewebeanalyse eine Herausforderung darstellen kann, da die Disaggregation von Gewebe in Zellen die Zellfunktion verändern kann19. Darüber hinaus kann die mangelnde Standardisierung der Einrichtung von FC-Geräten, der Datenanalyse und der Assay-Berichte zu Abweichungen bei den Ergebnissenführen 19, was die Notwendigkeit unterstreicht, FC-Bediener optimal für die Durchführung sowie Analyse und Berichterstellung von Daten zu schulen. Zum Beispiel erfordert die Fähigkeit von FC, echte apoptotische Trümmer von apoptotischen Kernen zu unterscheiden, i) geeignete Erfassungseinstellungen, ii) die Verwendung von Kalibrierungsperlen zur Identifizierung eines diploiden DNA-Peaks und iii) negative und positive Zellkontrollen, die zellspezifisch sind3. Darüber hinaus ist die multiparametrische Analyse durch die Anzahl der Detektoren begrenzt, und es muss eine optimale Kompensation durchgeführt werden, um unspezifische Ergebnisse und ein Übergreifen der Fluoreszenzemission bei Verwendung mehrerer fluoreszierender Reagenzienzu vermeiden 25. Fortschritte in der Geräte- und Fluorophortechnologie haben die Parametererkennung auf 30 Parameter verbessert12.
Die Identifizierung des apoptotischen Zelltods ist nicht immer einfach7, und empfindliche und spezifische Biomarker sollten in Betracht gezogen werden. Das Nomenklaturkomitee für Zelltod (NCCD) empfiehlt, mehr als einen Assay zu verwenden, um den Prozess der Apoptose zu untersuchen und zu quantifizieren26. Eine mikroskopische Analyse klassischer apoptotischer Merkmale26 wird ebenfalls empfohlen, um die Apoptose zu bestätigen und falsch-positive Ergebnisse zu vermeiden7. Vier biochemische Kardinalmerkmale, die frühe und späte apoptotische Ereignisse umfassen, sind (1) Verlust der Zellmembranasymmetrie; (2) Dissipation mitochondriales Membranpotential (ΔΨm); (3) Caspase-Aktivierung; und (4) DNA-Schäden26.
Während der frühen Apoptose wird Phosphatidylserin an die äußere Zellmembran 27 externalisiert und kann durch fluoreszenzmarkiertes Annexin V mit Phycoerythrin27,28,29 nachgewiesen werden. Darüber hinaus unterscheidet die duale Färbung mit dem fluoreszierenden DNA-bindenden Farbstoff 7-Aminoactinomycin D (7-AAD) lebende, spätapoptotische und tote Zellen. Daher färben früh-apoptotische Zellen positiv für Annexin V und negativ für 7-AAD, im Gegensatz zu spät-apoptotischen Zellen, die für beide Farbstoffe positiv anfärben24.
Intrinsische apoptotische Signale induzieren die Dissipation des mitochondrialen Membranpotentials (ΔΨm). Das gestörte ΔΨm bewirkt die Freisetzung früher pro-apoptotischer Proteine aus dem mitochondrialen Intermembranraum in das Zytosol27,29,30. Die Veränderung von ΔΨm kann durch duale Färbung mit dem positiv geladenen, lipophilen Farbstoff Tetramethylrhodaminethylester, TMRE und 7-AAD beurteilt werden. Der TMRE-Farbstoff reichert sich in der inneren Membran intakter Mitochondrien an, wenn das Membranpotential hoch ist. Depolarisierte Mitochondrien zeigen eine verminderte Fluoreszenz. Lebende Zellen mit polarisierten Mitochondrien (intakte mitochondriale Membran) färben sich positiv für TMRE und negativ für 7-AAD. Tote Zellen mit depolarisierten Mitochondrien färben sich negativ für TMRE und positiv für 7-AAD31.
Die Caspasen sind eine Familie intrazellulärer Proteasen, die, wenn sie aktiviert werden, Apoptose signalisieren und ausführen26,27. Die terminalen Henker-Caspasen (3,6,7) bewirken eine späte Apoptose 29,32,33. Caspase-3- und -7-Aktivitäten können mit einem fluoreszenzmarkierten Substrat gemessen werden, das beim Spalten an die DNA bindet und ein fluoreszierendes Signal aussendet. Darüber hinaus kann eine Beeinträchtigung der Integrität der Zellmembran durch Färbung mit 7-AAD beurteilt werden. Apoptotische Zellen färben sich positiv für den DNA-bindenden Farbstoff, aber negativ für 7-AAD. Spät-apoptotische und tote Zellen färben sich positiv für beide Farbstoffe34.
Die späte Apoptose ist durch DNA-Schädengekennzeichnet 27,29,35, die durch phosphorylierte Ataxiatelangieektasie, mutierte Kinase (ATM) und Histon H2A.X beurteilt werden können. Doppelsträngige DNA-Brüche (DSBs) verursachen die Phosphorylierung von H2A.X. Fluoreszenzmarkierte Antikörper gegen ATM und H2A. X kann DNA-Schäden feststellen. Negativer Nachweis von ATM und H2A. X weist auf keine DNA-Schäden hin, während der Nachweis beider Farbstoffe auf das Vorhandensein von Doppelstrangbrüchen in der DNAhinweist 36.
Actinomycin D ist ein starker Induktor der Apoptose und wirkt durch Bindung an die DNA, um Transkriptions- und Translationsereignisse zu blockieren37. Ziel dieser Studie war es, die durch Actinomycin D induzierte biochemische Apoptose in der SiHa-Zelllinie zu untersuchen, indem Biomarker für Apoptose im Früh- und Spätstadium analysiert wurden. Vier biochemische Biomarker der Apoptose untersuchten die aufeinanderfolgenden Schritte in der apoptotischen Kaskade, darunter den Verlust der Zellmembranasymmetrie, die Veränderung des mitochondrialen Membranpotentials, die Aktivierung terminaler Caspasen und DNA-Schäden.
Protokoll
HINWEIS: Dieses Protokoll beschreibt die Schritte der Zellvorbereitung, der Zellzählung, der Zellfärbung und der Analyse von mit Actinomycin D behandelten SiHa-Zellen unter Verwendung durchflusszytometrischer kommerzieller Assays, die auf einem Tisch-Durchflusszytometer gemessen und analysiert wurden (Abbildung 2).
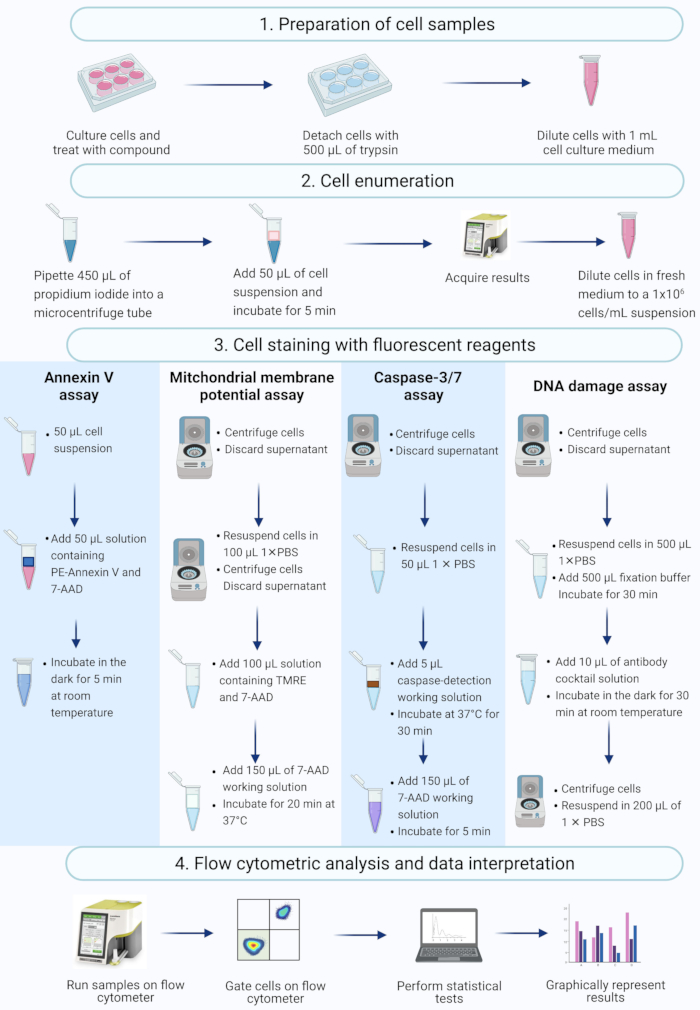
Abbildung 2: Workflow für den Nachweis biochemischer apoptotischer Biomarker mittels Durchflusszytometrie. Die Zellen werden kultiviert und behandelt, wie in Protokollschritt 1.1 beschrieben. (1) Die Zellen werden kultiviert, (2) gezählt und (3) mit fluoreszierenden Reagenzien gefärbt und (4) mit einem Tisch-Durchflusszytometer analysiert. Die Daten werden weiter abgegrenzt und statistisch analysiert. Abkürzungen: 7-AAD = 7-Aminoactinomycin D; PBS = phosphatgepufferte Kochsalzlösung; PE = Phycoerythrin; TMRE = Tetramethylrhodaminethylester. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
1. Vorbereitung der Zellkultur und Behandlungen für die Durchflusszytometrie
HINWEIS: Stellen Sie sicher, dass beim Umgang mit Zellkulturen eine aseptische Technik befolgt wird.
- Zellkulturen werden in einer befeuchteten CO 2 -Umgebung bei 37 °C mit 5 % CO2 gezüchtet. Stellen Sie sicher, dass die Zellkultur zu etwa 70 % im Mutterkolben konfluent ist, bevor Sie Zellen für Experimente passieren.
- Entfernen Sie das Medium aus dem Kolben, waschen Sie die Zellen mit 1x phosphatgepufferter Kochsalzlösung (PBS) und fügen Sie 500 μl Trypsin hinzu, um die Zellen abzulösen. Nachdem sich die Zellen zu runden beginnen und sich vom Kolben lösen, klopfen Sie den Boden des Kolbens scharf auf den Tisch, um die Zellen zu lösen. Neutralisieren Sie dann das Trypsin, indem Sie etwa 5 ml frisches Nährmedium hinzufügen, das mit 10% fötalem Kälberserum ergänzt ist, bevor Sie die Zellen zählen.
- Keimzellen mit 15.000 Zellen/ml in 3 ml Zellkulturmedium in einer 6-Well-Zellkulturplatte. Inkubieren Sie die Kulturplatten über Nacht bei 37 °C mit 5 % CO2 , um die Anhaftung der Zellen am Boden der Vertiefung zu ermöglichen.
- Die Versuchskulturen werden 24 h lang mit 100 ng/ml Actinomycin D und die Medium- und Lösungsmittelkontrollen mit frischem Nährmedium bzw. Dimethylsulfoxid (DMSO) behandelt. Sammeln Sie das verbrauchte Medium in einem 15-ml-Röhrchen und waschen Sie die Zellen mit 1x PBS. Geben Sie danach das 1x PBS-Waschmittel in das Röhrchen und geben Sie dann 500 μl Trypsin in die Vertiefung. Als nächstes neutralisieren Sie das Trypsin, indem Sie 5 ml frisches Nährmedium hinzufügen.
HINWEIS: (1) Eine verlängerte Trypsin-Inkubation oder eine unvollständige Neutralisation kann die Zellen verdauen und ihre Zellmembran beeinträchtigen, was die Ergebnisse verzerren kann. Darüber hinaus kann es auch die Asymmetrie der Zellmembran und damit die Zugänglichkeit zu Phosphatidylserin verändern. (2) Zellen, die sich abgelöst haben und an die Oberfläche geschwommen sind, können in die anschließende Analyse einbezogen werden, indem das entfernte Medium bei 300 × g für 5 min zentrifugiert und die Zellen in frischem Nährmedium resuspendiert werden.
2. Zählen von Zellen mit dem Viabilitätstest
- Pipettieren Sie 450 μl Propidiumiodid in ein Mikrozentrifugenröhrchen. Geben Sie 50 μl der Zellsuspension in das Mikrozentrifugenröhrchen. Inkubieren Sie das Röhrchen bei Raumtemperatur für 5 Minuten. Zählung der Zellen mittels Durchflusszytometrie (siehe Abschnitt 4).
- Verdünnen Sie alle Proben auf eine Konzentration von 1 × 106 Zellen/ml mit Zellkulturmedium, bevor Sie mit den Apoptose-Assays fortfahren.
3. Färben von Zellen für die Durchflusszytometrie
HINWEIS: Für diesen Teil des Protokolls sind keine sterilen Bedingungen erforderlich.
- Nachweis der Phosphatidylserin-Externalisierung mittels Annexin V
- Geben Sie 100 μl Zellsuspension in ein Mikrozentrifugenröhrchen. Fügen Sie 100 μl einer 1:1-Mischung aus fluoreszierendem konjugiertem Annexin V und 7-AAD-Reagenz hinzu. Bei Raumtemperatur 20 min lichtgeschützt inkubieren.
- Analyse der Depolarisation der mitochondrialen Membran
- 100 μl der Zellsuspension bei 300 × g für 5 min zentrifugieren und den Überstand verwerfen.
- Resuspendieren Sie die Zellen in 1 ml 1x PBS, fügen Sie jeder Probe 100 μl TMRE-Färbelösung hinzu und mischen Sie die Suspension durch sanftes Rückpipettieren.
- Inkubieren Sie die Zellen für 20 min in einer befeuchteten CO2 -Umgebung bei 37 °C. Wickeln Sie die Proben zum Schutz vor Licht in saubere Aluminiumfolie ein.
HINWEIS: Das mitochondriale Membranpotential ist ein funktioneller Marker, der empfindlich auf geringfügige Veränderungen in der Zellumgebung reagiert. Daher sollten die Proben unter identischen Bedingungen (Temperatur, pH-Wert und Zeit zwischen Beginn der Inkubation und Fluoreszenzmessung) inkubiert und gemessen werden, um die Reproduzierbarkeit zu gewährleisten. Beachten Sie auch, dass ein unzureichender Schutz der Proben vor Licht zu einer Photobleichung der Fluorophore führt, was zu einer fälschlicherweise niedrig emittierten Fluoreszenz führt. - Nach der Inkubation werden 5 μl der 7-AAD-Färbelösung zu jeder Probe gegeben und gemischt. 5 min bei Raumtemperatur lichtgeschützt inkubieren.
- Detektion von aktivierten terminalen Caspase-3 und -7 mit Caspasesubstrat DEVD
HINWEIS: Die folgenden Lösungen werden vor der Durchführung dieses Assays hergestellt.- Verdünnen Sie das DEVD-gebundene DNA-bindende Peptid in DMSO auf ein Verhältnis von 1:8 mit sterilem 1x PBS, um die Caspase-Detektionslösung zu erhalten. Lagern Sie die Lösung auf Eis oder bei 2-8 °C lichtgeschützt.
Anmerkungen: Für jede Probe werden 5 μl dieser Lösung benötigt. - Fügen Sie 2 μl einer 7-AAD-Stammlösung zu 148 μl 1x PBS hinzu, um die 7-AAD-Arbeitslösung herzustellen. Lagern Sie die Lösung auf Eis oder bei 2-8 °C lichtgeschützt.
Anmerkungen: Für jede Probe werden 150 μl dieser Lösung benötigt. - 50 μl der Zellsuspension für 5 min bei 300 × g zentrifugieren. Entsorgen Sie den Überstand. Resuspendieren Sie die Zellen in 50 μl 1x PBS, gefolgt von 5 μl der Caspase-Detektions-Arbeitslösung. Gründlich mischen.
- Lösen Sie die Kappe der Röhrchen und inkubieren Sie sie 30 min lang in einer befeuchteten CO2 -Umgebung bei 37 °C, geschützt vor Licht. Fügen Sie jeder Probe 150 μl der 7-AAD-Arbeitslösung hinzu und mischen Sie. 5 min bei Raumtemperatur lichtgeschützt inkubieren.
- Verdünnen Sie das DEVD-gebundene DNA-bindende Peptid in DMSO auf ein Verhältnis von 1:8 mit sterilem 1x PBS, um die Caspase-Detektionslösung zu erhalten. Lagern Sie die Lösung auf Eis oder bei 2-8 °C lichtgeschützt.
- Nachweis von DNA-Doppelstrangbrüchen und DNA-Gesamtschäden
- Zentrifugieren Sie 50 μl der Zellsuspension für 5 min bei 300 × g. Entsorgen Sie den Überstand.
- Resuspendieren Sie die Zellen in 500 μl 1x PBS. Fügen Sie 500 μl eines Fixierungspuffers auf Formaldehydbasis hinzu und mischen Sie. Inkubieren Sie die Proben 10 Minuten lang auf Eis.
- 5 min bei 300 × g zentrifugieren und den Überstand entsorgen. Resuspendieren Sie die Zellen in 90 μl 1x PBS in einem Mikrozentrifugenröhrchen. Geben Sie 10 μl der Antikörperlösung in das Mikrozentrifugenröhrchen. Bei Raumtemperatur 30 min im Dunkeln inkubieren.
- 100 μl 1x PBS zugeben und 5 min bei 300 × g zentrifugieren. Entsorgen Sie den Überstand. Resuspendieren Sie die Zellen in 200 μl 1x PBS.
4. Führen Sie die Proben auf dem Durchflusszytometer durch.
- Überprüfen Sie die analytische Leistung des Durchflusszytometers, indem Sie das System-Check-Kit des Geräts ausführen. Fahren Sie nicht mit dem Ausführen von Proben fort, bis alle Prüfungen abgeschlossen und bestanden sind.
- Suchen Sie den gewünschten Assay, indem Sie den Katalog der vorprogrammierten Assays auf dem Gerät durchsuchen und Assay ausführen auswählen.
- Mischen Sie die Probe, indem Sie sie vorsichtig zurückpipettieren, bevor Sie die Probe in das Durchflusszytometer laden.
Anmerkungen: Eine ausreichende Durchmischung stellt sicher, dass die Zellen in der Schwebe bleiben, und verhindert niedrige Zellzahlen. - Laden Sie zunächst eine Negativkontrollprobe in das Durchflusszytometer und wählen Sie Ausführen (Einstellungen anpassen), damit das Gerät mit dem Absaugen der Probe beginnt und eine Echtzeitvorschau der erkannten Ereignisse bietet. In der Materialtabelle finden Sie den Namen und die Details des Instruments.
- Passen Sie in der Live-Vorschau die Schwellenwerte für Fluoreszenz und Zellgröße an und zeichnen Sie ein rechteckiges Gate um die Zellpopulation. Ziehen Sie die Schwellenwertmarkierung, um zelluläre Trümmer auszuschließen. Wählen Sie Weiter (Integritätsprofil festlegen) aus, um fortzufahren.
HINWEIS: Es ist wichtig, die Größe der Zellen zu kennen. Ziehen Sie die Schieberegler und beobachten Sie Änderungen in der Darstellung erkannter Ereignisse in der Echtzeitvorschau, da dies eine genaue Auswahl der Schwellenwerte ermöglicht. Wenn Zelltrümmer in diesem Stadium nicht ausgeschlossen werden, können sie in den Analysen nach der Aufnahme nicht entfernt werden. - Tippen und ziehen Sie die Quadrantenmarkierungen, um die Zellpopulationen zu trennen und die erkannten Ereignisse in Echtzeit darzustellen. Verwenden Sie diese Diagramme, um den Endbenutzer bei der richtigen Platzierung der Quadrantenmarkierungen zu unterstützen. Wählen Sie Weiter (Proben überprüfen), um fortzufahren, damit das Gerät eine Zusammenfassung der Einstellungen anzeigt. Nachdem Sie die Einstellungen überprüft haben, wählen Sie Weiter (Einstellungen überprüfen) aus, um diese Einstellungen auf alle Stichproben innerhalb des Experiments anzuwenden.
HINWEIS: Das Instrument bietet eine 2-minütige Live-Vorschau der Zellen, die zum Anpassen der Einstellungen des Instruments verwendet werden. Nach Ablauf dieser Frist gibt das Gerät die Probe frei, und die Schritte 4.2.2-4.2.4 müssen wiederholt werden. Entnehmen Sie die Probe und mischen Sie sie gut, bevor Sie sie wieder einfüllen und fortfahren. - Sperren Sie eine Population von Zellen, indem Sie eine Region um die Zellpopulation zeichnen. Passen Sie die Schwellenwerte für Fluoreszenz und Zellengröße mit den Schiebereglern auf der x- und y-Achse der Live-Vorschau an. Wenden Sie diese Einstellungen auf alle Proben innerhalb des Experiments an.
- Mischen Sie die erste Probe durch vorsichtiges Rückpipettieren, laden Sie die erste Probe in das Durchflusszytometer und wählen Sie Weiter. Benennen Sie das Beispiel, und wählen Sie Ausführen aus, damit das System mit der Ausführung des Beispiels beginnt.
HINWEIS: Das Gerät kann jeweils nur ein Sample ausführen. - Wenn alle Beispiele ausgeführt wurden, speichern Sie das Experiment, indem Sie ihm einen geeigneten Titel geben. Speichern Sie die Einstellungen des aktuellen Experiments, um sie in zukünftigen Ausführungen abzurufen (optional).
- Mischen Sie die Probe, indem Sie sie vorsichtig zurückpipettieren, bevor Sie die Probe in das Durchflusszytometer laden.
5. Analyse nach der Akquisition
- Führen Sie bei Bedarf eine Feinabstimmung der Gates oder Quadrantenmarker nach der Erfassung durch.
- Suchen Sie das Experiment, das angepasst werden muss, indem Sie im Dateibrowser des Systems navigieren und das Experiment öffnen.
- Tippen Sie auf die Miniaturvorschau des Plots, um ihn zu vergrößern. Tippen Sie auf die obere linke oder untere rechte Ecke des Zellengates, um die Abmessungen des Gates anzupassen. Um die Quadrantenmarkierungen anzupassen, tippen Sie auf den Schnittpunkt der vertikalen und horizontalen Linien, um die Markierungen so zu verschieben, wie sie sind. Um den Winkel einer der beiden Linien anzupassen, tippen Sie auf die Linie und ziehen Sie den Griff.
- Passen Sie die Markierungen (wie zuvor in den Schritten 4.1.3 bis 4.1.4 beschrieben) wie gewünscht an und wenden Sie diese Einstellungen auf alle Proben im Experiment an, indem Sie das Häkchensymbol auswählen, alle Proben markieren und Akzeptieren auswählen.
6. Statistische Analyse
- Führen Sie Tests in dreifacher Ausführung durch und führen Sie eine Varianzanalyse (ANOVA) mit einem Post-hoc-Bonferroni-Test durch, um signifikante Unterschiede zwischen den behandelten Proben und den Kontrollen zu bewerten.
HINWEIS: Der gewählte statistische Test hängt vom Prüfer und den zu analysierenden Variablen ab.
Ergebnisse
Die Ergebnisse der Zellzahl und Viabilität (Abbildung 3) zeigten, dass 95,2 % der Zellen in der Probe lebend und 4,8 % tot waren. Die Gesamtzellkonzentration in der ursprünglichen Probe betrug 6,20 x 106 Zellen/ml.
Der Annexin-V- und Zelltod-Assay (Abbildung 4) zeigte einen signifikanten Anstieg (p < 0,0001) in apoptotischen Zellen in SiHa-Zellen, die mit 100 ng/ml Actinomycin-D behandelt wurden, im Vergleich zu den Kontrollen. Da die Annexin-V-Färbung in Zellen im Frühstadium der Apoptose erhöht ist, deutet dieser Befund darauf hin, dass 100 ng/ml Actinomycin-D die Apoptose in SiHa-Zellen induziert.
Der mitochondriale elektrochemische Transmembranpotential-Assay (Abbildung 5) zeigte eine signifikante Abnahme (p < 0,0001) der Zellgesundheitsprofile (lebend, depolarisiert und lebend, depolarisiert und tot, tot) zwischen Actinomycin-D, Mediumkontrolle und Lösungsmittelkontrolle. Diese Daten deuten darauf hin, dass 100 ng/ml Actinomycin-D die mitochondriale Depolarisation in SiHa-Zellen induziert.
Der Caspase-3/7-Assay (Abbildung 6) zeigte eine signifikante (p < 0,0001) Aktivierung der Caspasen 3 und 7 in SiHa-Zellen, die mit 100 ng/ml Actinomycin-D behandelt wurden, im Vergleich zu den Kontrollen. Diese Ergebnisse zeigen, dass 100 ng/ml Actinomycin-D die Apoptose in SiHa-Zellen induziert.
Der DNA-Schadenstest (Abbildung 7) zeigte, dass 100 ng/ml Actinomycin-D signifikant (p < 0,0001) DNA-Schadensmarker, ATM und H2A induzierte. X, in SiHa-Zellen. Dieser Befund deutet auf eine signifikante Zunahme der DNA-Schäden in SiHa-Zellen hin, die mit Actinomycin D behandelt wurden.
Die Ergebnisse suboptimaler Experimente (Abbildung 8) zeigen analytische Überlegungen über alle Assays hinweg. Die Zellkonzentration wirkt sich auf die Genauigkeit der Daten aus. In Abbildung 8A ist die Zellenzahl inakzeptabel niedrig. Die Gated-Cell-Populationen in allen 4 Quadranten des Punktdiagramms weisen eine geringe Signalintensität auf. Der Hersteller optimiert den Assay für 300-700 Zellen/μL im endgültigen Probenvolumen. Dieses Beispiel verdeutlicht, wie wichtig es ist, die richtige Probenkonzentration zu verwenden, die vom Hersteller vorgeschrieben ist.
Darüber hinaus führten auch hohe Zellkonzentrationen zu fehlerhaften Ergebnissen (Abbildung 8B). Mittlere und experimentelle Kulturen wiesen 99,95 % bzw. 100 % lebende Zellen auf. Die Flussrate für beide Assays übertraf die vom Hersteller optimierte Konzentration von 100-500 Zellen/μl und erforderte eine Verdünnung mit 1x Assay-Puffer, um eine ungenaue Analyse zu vermeiden.
Bei der Herstellung von Versuchskulturen sollte eine Zellverklumpung vermieden werden, da sie aufgrund erhöhter Zellgrößenindizes zu falschen Ergebnissen führt, wie im Annexin-V-Assay dargestellt. Abbildung 8C zeigt ein duales Problem einer hohen Zellkonzentration, die über die Anweisungen des Herstellers hinausgeht, und einer Verklumpung der Zellen, was durch Zellgrößenindizes von mehr als 4 in der SiHa-Mediumkontrolle belegt wird. Die hohe Zellkonzentration wird durch die Schichtung von Zellen veranschaulicht, die in mittleren Kulturen eine leuchtend rote Ebene von Zellen bilden, was diskordant hohe apoptotische Zellpopulationen zeigt.
Eine längere Färbung von Kulturen kann zu einer unspezifischen Bindung von Proteinen und zu falschen Ergebnissen führen, wie der Annexin-V-Assay zeigt. Abbildung 8D zeigt ähnliche Ergebnisse für mittlere und experimentelle Kulturen aufgrund längerer Färbung.
Schlechte Probenhandhabung, verlängerte Trypsinisierung adhärenter Zellen, intensives Pipettieren während der Waschschritte sowie Hochgeschwindigkeits- und Langstreckenzentrifugationsschritte verursachen Zelllyse und große Mengen an Zelltrümmern. In Abbildung 8E zeigen Kulturen, die mit dem Caspase 3/7-Assay analysiert wurden, einen erhöhten Zelltrümmer, der durch einen kleinen Zellgrößenindex (<2,2 Zellgrößenindex) belegt ist. Bei der Vorbereitung von Proben für die Datenerfassung ist daher Vorsicht geboten.
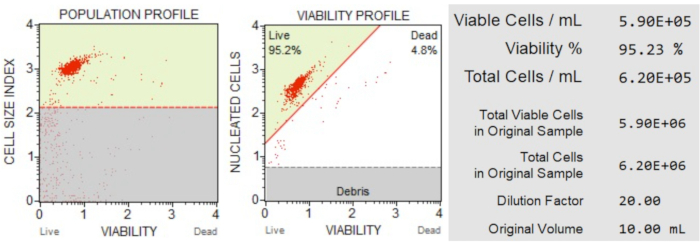
Abbildung 3: Zellzahl- und Viabilitätstest. Das Populationsprofil trennt Trümmer von lebenden und toten Zellen. Das zweidimensionale Punktdiagramm ist gated und unterteilt lebende und tote Zellpopulationen. Der Informationsbereich enthält quantitative Daten zur Zellzahl, zum Prozentsatz der insgesamt lebensfähigen Zellen und zur Gesamtzahl der lebensfähigen Zellen in der Stichprobe. Diese Daten können verwendet werden, um die Zellzahl in allen Proben für nachfolgende Apoptoseanalysen zu standardisieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
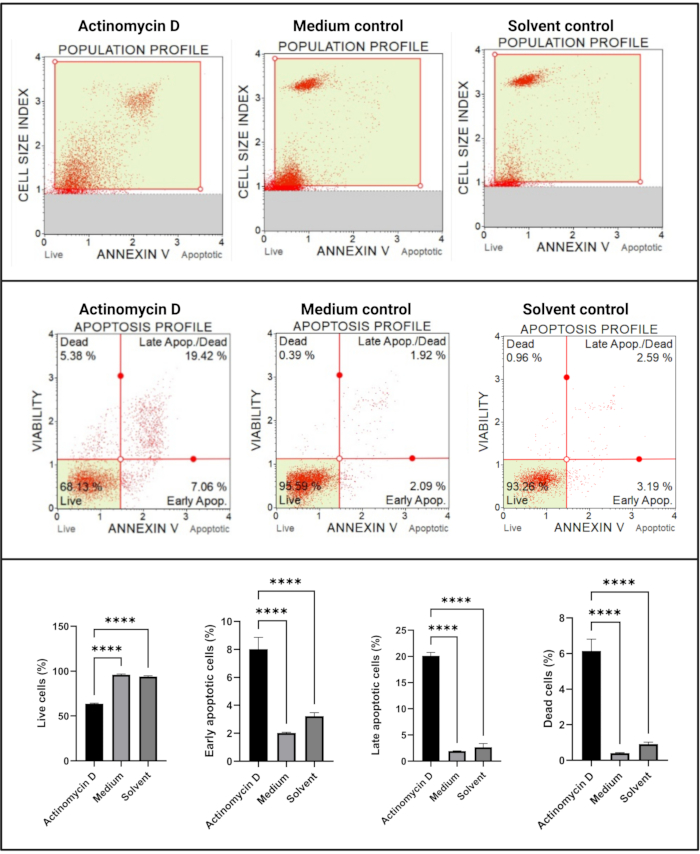
Abbildung 4: Annexin-V-Assay. Alle Proben zeigen identische Gating-Parameter, und die statistische Analyse jeder Subpopulation zeigt einen signifikanten Anstieg der Apoptose in Zellen, die mit Actinomycin D behandelt wurden. Alle Assays wurden als drei unabhängige Experimente durchgeführt, wobei jedes Experiment in dreifacher Ausfertigung durchgeführt wurde. Die Daten werden als Mittelwert ± SD dargestellt, und p < 0,05 wurde als statistisch signifikant angesehen. p < 0,0001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
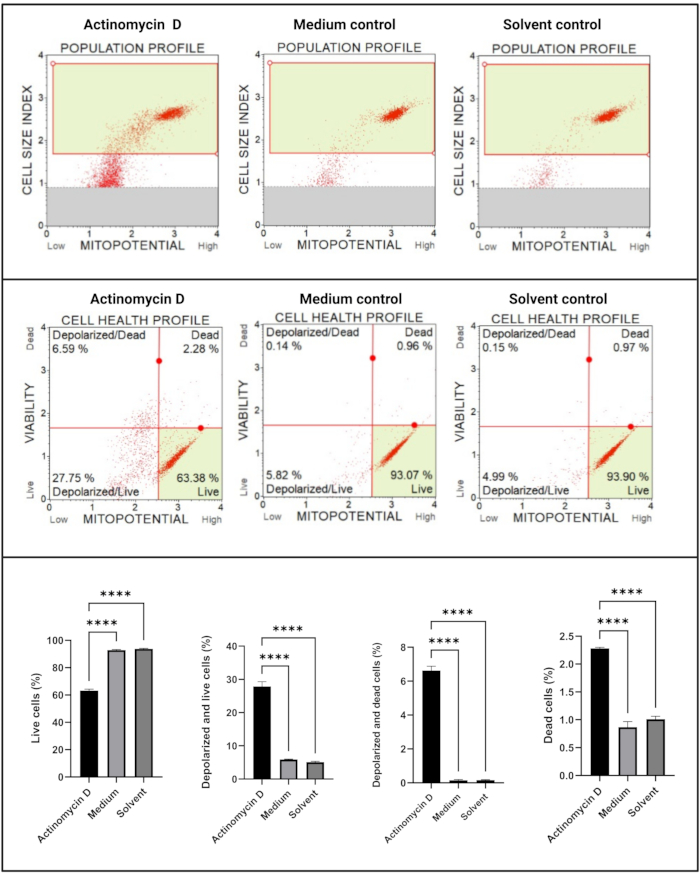
Abbildung 5: Mitochondrialer elektrochemischer Transmembranpotential-Assay. Alle Proben zeigen identische Gating-Parameter, und die statistische Analyse jeder Subpopulation zeigt eine signifikante Störung des mitochondrialen Membranpotentials in Zellen, die mit Actinomycin D behandelt wurden. Alle Assays wurden als drei unabhängige Experimente durchgeführt, wobei jedes Experiment in dreifacher Ausfertigung durchgeführt wurde. Die Daten werden als Mittelwert ± SD dargestellt, und p < 0,05 wurde als statistisch signifikant angesehen. p < 0,0001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
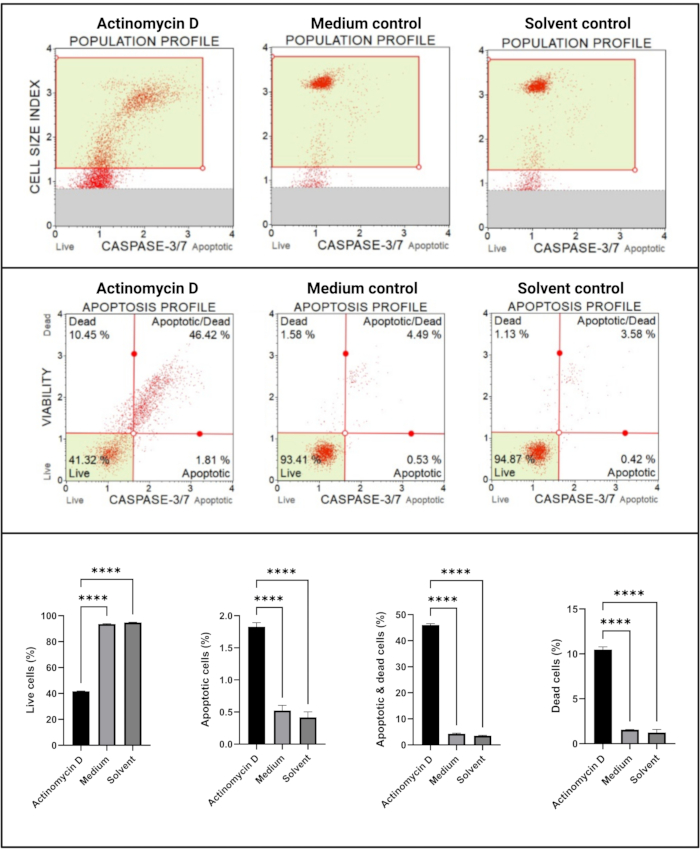
Abbildung 6: Caspase 3/7 Nachweisassay. Alle Proben zeigen identische Gating-Parameter, und die statistische Analyse jeder Subpopulation zeigt einen signifikanten Anstieg der Caspase 3/7-Aktivität in Zellen, die mit Actinomycin D behandelt wurden. Alle Assays wurden als drei unabhängige Experimente durchgeführt, wobei jedes Experiment in dreifacher Ausfertigung durchgeführt wurde. Die Daten werden als Mittelwert ± SD dargestellt, und p < 0,05 wurde als statistisch signifikant angesehen. p < 0,0001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
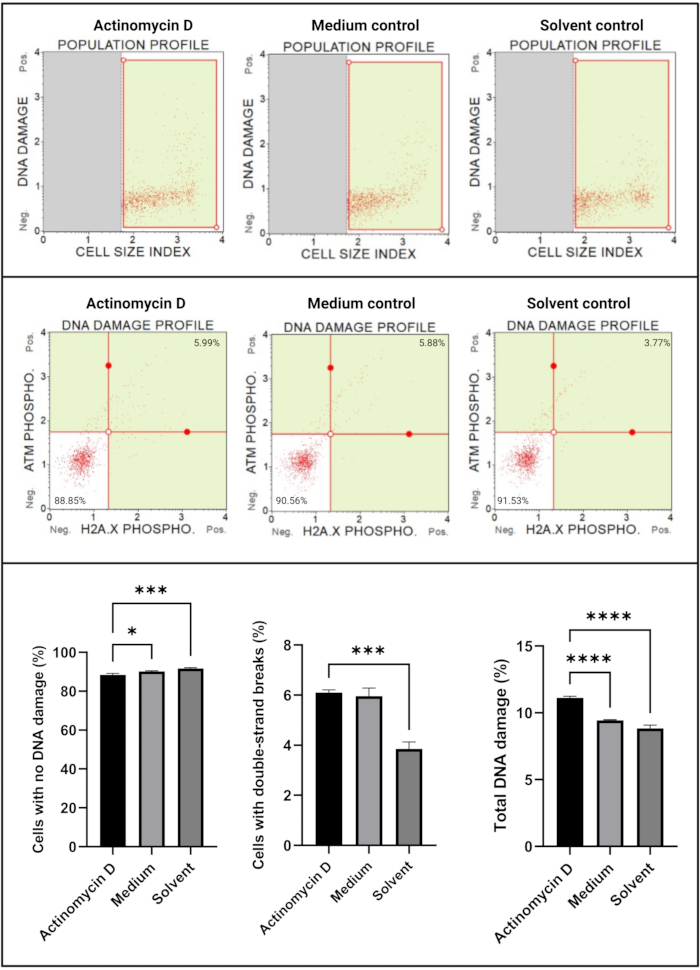
Abbildung 7: DNA-Schadenstest. Alle Proben zeigen identische Gating-Parameter, und die statistische Analyse jeder Subpopulation zeigt einen signifikanten Anstieg der Doppelstrang-DNA-Schäden und der Gesamt-DNA-Schäden in Zellen, die mit Actinomycin D behandelt wurden. Alle Analysen wurden in drei unabhängigen Experimenten durchgeführt, wobei jedes Experiment in dreifacher Ausfertigung durchgeführt wurde. Die Daten werden als Mittelwert ± SD dargestellt, und p < 0,05 wurde als statistisch signifikant angesehen. * p < 0,05; S. < 0,001; p < 0,0001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
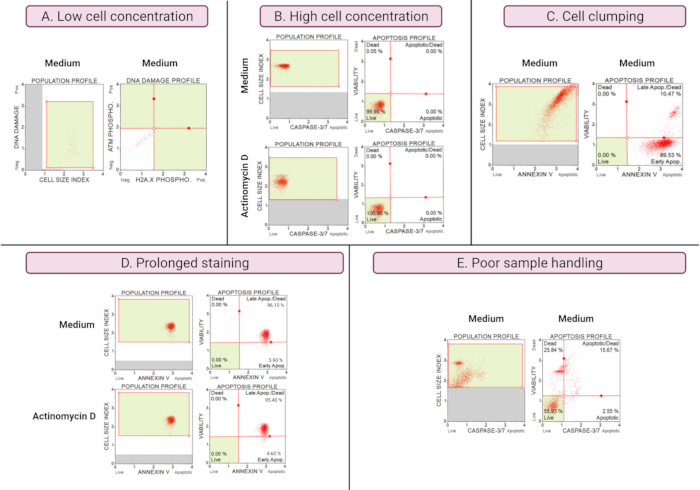
Abbildung 8: Suboptimale Versuchsbedingungen führen zu schlechten Ergebnissen. (A) Niedrige Konzentration von Zellen, (B) hohe Konzentration von Zellen, (C) Zellverklumpung und -aggregation durch hohen Zellgrößenindex, (D) verlängerte Färbung von Zellproben, die sich durch erhöhte positive Färbung in beiden Proben zeigt, und (E) schlechte Probenhandhabung, die sich durch erhöhte Zelltrümmer zeigt (Zellgrößenindex < 2,2). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
In dieser Studie zeigten Actinomycin-D-behandelte SiHa-Zellen, die von FC analysiert wurden, signifikante frühe und späte Biomarker für Apoptose. Suboptimale Bedingungen für die Zellvorbereitung, Zählung und Färbung führten zu ungenauen Ergebnissen, was die Notwendigkeit einer strikten Einhaltung der Anweisungen des Herstellers bei der Durchführung von FC unterstreicht.
Diese Untersuchung der Apoptose durch frühe und späte Identifizierung von Biomarkern entspricht den NCCD-Leitlinien1 zur Untersuchung der Apoptose. Actinomycin-D-behandelte SiHa-Kulturen zeigten positive Biomarker für frühe und späte apoptotische Stadien. Der Annexin V/PI Assay und der mitochondriale Permeabilitätstest zeigten, dass Actinomycin D ein PS-Flip-Muster bzw. eine Dissipation des mitochondrialen Membranübergangs induzierte. Sobald die apoptotischen Zellen den Punkt erreichen, an dem es kein Zurück mehr gibt, der durch eine mitochondriale Störung induziert wird, werden die terminalen Caspasen aktiviert 3,7. Die in dieser Studie beobachtete Aktivierung der terminalen Caspasen 3 und 7 deutet auf eine Apoptose im Spätstadium hin. Darüber hinaus führt die terminale Caspase-Aktivierung zu einer internukleosomalen DNA-Spaltung und einer ausgedehnten DNA-Fragmentierung, die klassischerweise als Stufenleitermuster beschrieben wurde, das durch Gelelektrophorese beobachtet wurde28,38.
Die nuklearen Schäden mit dem ATM und H2A. Der X FC DNA-Schadenstest zeigte Doppelstrangbrüche in der DNA und den Gesamtschaden der DNA. Diese Ergebnisse bestätigten klassische nachgeschaltete Caspase-induzierte apoptotische Kernschäden (Karyorrhexis und Karyorrlyse) in Versuchskulturen. Die Verwendung mehrerer durchflusszytometrischer Biomarker detektierte somit die sequentiellen mehrstufigen Ereignisse in der Apoptose und identifizierte Zellpopulationen in frühen und späten apoptotischen Stadien genau und reproduzierbar. Diese Ergebnisse stehen im Einklang mit den bekannten pro-apoptotischen Eigenschaften von Actinomycin D in der Krebsbehandlung beim Menschen 37,39,40,41 und unterstützen die Verwendung von Actinomycin D als Positivkontrolle in FC-Zellkulturexperimenten zur Untersuchung der Apoptose.
Das Gating von Zellpopulationen in dieser Studie wurde durch negative Medium- und Lösungsmittelkontrollen informiert, die apoptotische von gesunden Zellen trennten. Alternativ kann auch eine Mischung aus Populationen von Positiv- und Negativkontrollen verwendet werden, um lebende und apoptotische Zellpopulationen zu definieren, um Zellpopulationstore zu setzen 7,9. Sobald erkrankte und gesunde zelluläre Zustände definiert und kontrolliert sind, können die Vorlageneinstellungen auf alle nachfolgenden Versuchs- und Kontrollkulturen angewendet werden.
Die strikte Einhaltung des FC-Protokolls ist unerlässlich, um falsche Ergebnisse zu vermeiden. Während der Optimierung des Protokolls wurden die folgenden Probleme beobachtet: (1) niedrige Zellkonzentration, (2) hohe Zellkonzentration, (3) Zellverklumpung, (4) verlängerte Färbung und (5) schlechte Probenhandhabung. Diese Probleme können durch die strikte Einhaltung optimierter Protokollanforderungen vermieden werden. Dies unterstreicht die entscheidende Bedeutung präanalytischer und analytischer Schritte für FC, um genaue Daten zu erhalten. Während der Zellpräparation müssen Trypsinisierung, Pipettieren, Zentrifugieren und Verdünnen mit Vorsicht durchgeführt werden. Eine übermäßige Trypsinisierung und ein intensives Pipettieren können zu einer chemischen bzw. mechanischen Scherung der Zellen führen. Eine längere und schnelle Zentrifugation kann zu Zellabbau und einer hohen Anzahl von Zelltrümmern führen. Eine optimale Zellkonzentration ist erforderlich, um die fehlerhafte Erfassung von Zellereignissen zu minimieren. Daher sollten primäre Zellsuspensionen verdünnt werden, um eine optimale Zellkonzentration zu erhalten.
Darüber hinaus muss beim Umgang mit Proben darauf geachtet werden, dass Zellverklumpungen und Zellfragmentierung vermieden werden und sichergestellt wird, dass die Zellen während der Analyse in der Schwebe bleiben. Die Probenhandhabung, um ein Verklumpen der Zellen zu verhindern, ermöglicht den Fluss einzelner laminarer Zellen, verhindert eine mechanische Verstopfung der Kapillarschläuche des Geräts und dämpft falsche Indizes für große Zellgrößen. Ein weiterer Vorbehalt ist der Schutz der Kulturen vor Licht, um Photooxidation und Abschreckung der Fluorophore in den Assays zu vermeiden, um falsch-negative Ergebnisse zu vermeiden. Es muss darauf geachtet werden, dass beim Färbeschritt der Zellen und den nachfolgenden Verarbeitungsschritten eine minimale Lichtexposition gewährleistet ist. Darüber hinaus können verlängerte Immunfärbungszeiten zu falsch-positiven Ergebnissen führen, da Proteine unspezifisch gefärbt werden. Daher ist die Einhaltung der vom Hersteller vorgeschriebenen Inkubationsfärbezeiten wichtig.
Zusammenfassend lässt sich sagen, dass FC Apoptose genau nachweisen und zwischen frühen und späten Apoptose-Biomarkern in der Zellkultur unterscheiden kann. Darüber hinaus haben technologische Fortschritte zur Herstellung von Tisch-Durchflusszytometern für Laien geführt, um die Zellgesundheit und komplexe intrazelluläre Signalwege zu untersuchen.
Offenlegungen
Die Luminex® Corporation hat freundlicherweise die Artikelbearbeitungsgebühren zur Verfügung gestellt.
Danksagungen
Die Studie wurde von der National Research Foundation (NRF) und dem South African Medical Research Council (SAMRC) finanziell unterstützt. Wir bedanken uns beim National Health Laboratory Service (NHLS) für den Kauf des Guava Muse Cell Analyzers. Alle Abbildungen in dieser Publikation wurden mit Biorender.com erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 6-well plates | Lasec | P1PLA044C-000006 | |
| Dimethyl Sulfoxide | Sigma-Aldrich | D8418 | |
| DMEM | ThermoFisher | 41966052 | |
| Glutamine | Sigma-Aldrich | P10-040500 | |
| Guava Muse Cell Analyzer | Luminex | 0500-3115 | |
| Microcentrifuge tubes/Eppendorf | Merck | EP0030122208-200EA | |
| Muse Annexin V kit | Merck | MCH100105 | |
| Muse Caspase-3/7 kit | Merck | MCH100108 | |
| Muse Count and Viability kit | Merck | MCH600103 | |
| Muse DNA Damage kit | Merck | MCH200107 | |
| Muse MitoPotential kit | Merck | MCH100110 | |
| PBS Buffer | ThermoFisher | 70013065 | |
| Pen-strep | Sigma-Aldrich | P4333 | |
| SiHa cells | ATCC | CRL-1550 | |
| T25 culture flasks | Sigma-Aldrich | C6231 | |
| Trypsin | Pan Biotech | P10-040500 |
Referenzen
- Galluzzi, L., et al. Molecular mechanisms of cell death: Recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death and Differentiation. 25 (3), 486-541 (2018).
- Kerr, J. F., Wyllie, A. H., Currie, A. R. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. British journal of cancer. 26 (4), 239-257 (1972).
- Riccardi, C., Nicoletti, I. Analysis of apoptosis by propidium iodide staining and flow cytometry. Nature Protocols. 1 (3), 1458-1461 (2006).
- Edinger, A. L., Thompson, C. B. Death by design: apoptosis, necrosis and autophagy. Current Opinion in Cell Biology. 16 (6), 663-669 (2004).
- Arends, M. J., Morris, R. G., Wyllie, A. H. Apoptosis. The role of the endonuclease. The American journal of pathology. 136 (3), 593-608 (1990).
- Majno, G., Joris, I. Apoptosis, oncosis, and necrosis. An overview of cell death. Am J Pathol. 146 (1), 3-15 (1995).
- Darzynkiewicz, Z., Traganos, F., Al-Rubeai, M. . Apoptosis. , 33-73 (1998).
- Wlodkowic, D., Skommer, J., Darzynkiewicz, Z. Flow cytometry-based apoptosis detection. Methods in molecular biology. 559, 19-32 (2009).
- . Introduction to Flow Cytometry Basics Available from: https://www.bio-rad-antibodies.com/introduction-to-flow-cytometry.html (2021)
- Telford, W. G., Komoriya, A., Packard, B. Z. Detection of localized caspase activity in early apoptotic cells by laser scanning cytometry. Cytometry. 47 (2), 81-88 (2002).
- Castedo, M., et al. Quantitation of mitochondrial alterations associated with apoptosis. J Immunol Methods. 265 (1-2), 39-47 (2002).
- McKinnon, K. M. Flow Cytometry: An Overview. Current protocols in immunology. 120, 1-11 (2018).
- Macey, M. G. Flow cytometry: principles and clinical applications. Med Lab Sci. 45 (2), 165-173 (1988).
- Darzynkiewicz, Z., et al. Features of apoptotic cells measured by flow cytometry. Cytometry. 13 (8), 795-808 (1992).
- Darzynkiewicz, Z., et al. Cytometry in cell necrobiology: Analysis of apoptosis and accidental cell death (necrosis). Cytometry. 27 (1), 1-20 (1997).
- Ormerod, M. G. The study of apoptotic cells by flow cytometry. Leukemia. 12 (7), 1013-1025 (1998).
- van Engeland, M., Nieland, L. J., Ramaekers, F. C., Schutte, B., Reutelingsperger, C. P. Annexin V-affinity assay: a review on an apoptosis detection system based on phosphatidylserine exposure. Cytometry. 31 (1), 1-9 (1998).
- Vermes, I., Haanen, C., Reutelingsperger, C. Flow cytometry of apoptotic cell death. Journal of Immunological Methods. 243 (1), 167-190 (2000).
- Jahan-Tigh, R. R., Ryan, C., Obermoser, G., Schwarzenberger, K. Flow cytometry. J Invest Dermatol. 132 (10), 1-6 (2012).
- Lövborg, H., Gullbo, J., Larsson, R. Screening for apoptosis-classical and emerging techniques. Anti-cancer drugs. 16 (6), 593-599 (2005).
- Vorobjev, I. A., Barteneva, N. S. Multi-parametric imaging of cell heterogeneity in apoptosis analysis. Methods. 112, 105-123 (2017).
- Telford, W. G., Komoriya, A., Packard, B. Z. Multiparametric analysis of apoptosis by flow and image cytometry. Methods in molecular biology. 263, 141-160 (2004).
- Kagami, S., Rizzo, H. L., Lee, J. J., Koguchi, Y., Blauvelt, A. Circulating Th17, Th22, and Th1 cells are increased in psoriasis. J Invest Dermatol. 130 (5), 1373-1383 (2010).
- . Muse® Annexin V & Dead Cell Kit Available from: https://www.luminexcorp.com/muse-annexin-v-dead-cell-kit/ (2019)
- Roederer, M. Spectral compensation for flow cytometry: visualization artifacts, limitations, and caveats. Cytometry. 45 (3), 194-205 (2001).
- Kroemer, G., et al. Classification of cell death: recommendations of the Nomenclature Committee on Cell Death. Cell Death and Differentiation. 12 (2), 1463-1467 (2005).
- Apoptosis assays and markers guide. Abcam Available from: https://www.abcam.com/kits/apoptosis-assays (2021)
- Vermes, I., Haanen, C., Steffens-Nakken, H., Reutelingsperger, C. A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V. Journal of Immunological Methods. 184 (1), 39-51 (1995).
- Elmore, S. Apoptosis: A Review of Programmed Cell Death. Toxicologic Pathology. 35 (4), 495-516 (2007).
- Saelens, X., et al. Toxic proteins released from mitochondria in cell death. Oncogene. 23 (16), 2861-2874 (2004).
- Muse™ MitoPotential Kit User's Guide. Luminex Corporation Available from: https://www.luminexcorp.com/muse-mitopotential-kit (2013)
- McIlwain, D. R., Berger, T., Mak, T. W. Caspase functions in cell death and disease. Cold Spring Harbor Perspectives in Biology. 5 (4), 008656 (2013).
- Wigdal, S. S., Kirkland, R. A., Franklin, J. L., Haak-Frendscho, M. Cytochrome c release precedes mitochondrial membrane potential loss in cerebellar granule neuron apoptosis: lack of mitochondrial swelling. Journal of Neurochemistry. 82 (5), 1029-1038 (2002).
- Muse® Caspase-3/7 Kit. Luminex Corporation Available from: https://www.luminexcorp.com/muse-caspase-3-7-kit/#overview (2019)
- Häcker, G. The morphology of apoptosis. Cell and Tissue Research. 301 (1), 5-17 (2000).
- Muse® Multi-Color DNA Damage Kit User's Guide. Luminex Corporation Available from: https://www.luminexcorp.com/muse-multi-color-dna-damage-kit/#overview (2020)
- Kleeff, J., Kornmann, M., Sawhney, H., Korc, M. Actinomycin D induces apoptosis and inhibits growth of pancreatic cancer cells. International journal of cancer. 86 (3), 399-407 (2000).
- Wlodkowic, D., Skommer, J., Darzynkiewicz, Z. Cytometry of apoptosis. Historical perspective and new advances. Experimental oncology. 34 (3), 255-262 (2012).
- Szeberenyi, J. The effect of actinomycin D on RNA metabolism in human cells. Biochem Mol Biol Educ. 34 (1), 50-51 (2006).
- Ginell, S., Lessinger, L., Berman, H. M. The crystal and molecular structure of the anticancer drug actinomycin D--some explanations for its unusual properties. Biopolymers. 27 (5), 843-864 (1988).
- Hou, M. H., Robinson, H., Gao, Y. G., Wang, A. H. Crystal structure of actinomycin D bound to the CTG triplet repeat sequences linked to neurological diseases. Nucleic Acids Res. 30 (22), 4910-4917 (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten