Method Article
Проточный цитометрический анализ биомаркеров апоптоза в клетках рака шейки матки SiHa, обработанных актиномицином D
В этой статье
Резюме
Апоптоз может быть охарактеризован проточно-цитометрическим анализом ранних и поздних апоптотических биомаркеров. Клеточная линия рака шейки матки, SiHa, была проанализирована на биомаркеры апоптоза после лечения актиномицином D с использованием настольного проточного цитометра.
Аннотация
Биомаркеры апоптоза были исследованы в клетках рака шейки матки SiHa, обработанных актиномицином D, с использованием настольного проточного цитометра. Ранние биомаркеры (аннексин V и мембранный потенциал митохондрий) и поздние биомаркеры (каспазы 3 и 7 и повреждение ДНК) апоптоза были измерены в экспериментальных и контрольных культурах. Культуры инкубировали в течение 24 часов в увлажненном инкубаторе при 37 °C с содержаниемСО2 5%. Затем клетки отделяли с помощью трипсина и подсчитывали с помощью проточного цитометрического анализа количества клеток. Клетки были дополнительно проанализированы на апоптоз с использованием анализа Annexin V, анализа митохондриального электрохимического трансмембранного потенциала, анализа каспазы 3/7 и анализа повреждения ДНК. В этой статье представлен обзор апоптоза и традиционной проточной цитометрии, а также разработаны протоколы проточной цитетрии для обработки и анализа клеток SiHa. Результаты описывают положительные, отрицательные и субоптимальные экспериментальные данные. Также обсуждаются интерпретация и предостережения при проведении проточного цитометрического анализа апоптоза с использованием этой аналитической платформы. Проточный цитометрический анализ обеспечивает точное измерение ранних и поздних биомаркеров апоптоза.
Введение
Апоптоз, классифицируемый как запрограммированная гибель клеток 1 типа1, обеспечивает равновесие между пролиферацией клеток и гибельюклеток 2. Апоптоз необходим во время развития человека, после травмы и для профилактики таких заболеваний, как рак3. Внутренние и внешние сигнальные пути апоптотической гибели клеток4 вызывают последовательные биохимические и морфологические внутриклеточные изменения 2,5,6. Морфологические апоптотические особенности могут быть идентифицированы с помощью микроскопии, а биохимическое возмущение может быть проанализировано с помощью биохимических анализов, включая проточную цитометрию (FC)7.
Проточный цитометрический анализ для выявления апоптоза и понимания связанных с ним внутриклеточных механизмов получил широкое распространение за последние два десятилетия8. FC — это научная методология, которая анализирует клетки в жидкости, проходящей через одноканальные или многоканальные лазеры (рис. 1)9,10,11. Клетки в жидкости фокусируются в один файл с помощью флюидной системы проточного цитометра с использованием гидродинамической фокусировки. Когда клетки проходят через лазер, свет рассеивается или излучается клетками. Рассеянный свет может быть направлен в прямом направлении (прямое рассеяние) или в сторону (боковое рассеяние) и предоставляет информацию о размере ячейки, а также о зернистости ячейки или внутренних структурах соответственно.
Кроме того, флуоресцентные реагенты, такие как флуоресцентные красители или антитела, меченные флуорофорами, обнаруживают специфические поверхностные или внутриклеточные структуры или молекулы. Когда лазер возбуждает флуорофоры, свет излучается на определенной длине волны. Детекторы - обычно фотоэлектронные умножители - количественно определяют рассеянный и излучаемый свет от образцов клеток. Детекторы производят количественный ток, пропорциональный рассеянию света и флуоресцентному излучению. Электронный выход преобразуется в цифровые сигналы с помощью вычислительного программного обеспечения для идентификации клеточных популяций на основе размера клеток, клеточной зернистости и относительной клеточной флуоресценции меченных флуорофором молекул 9,12,13.
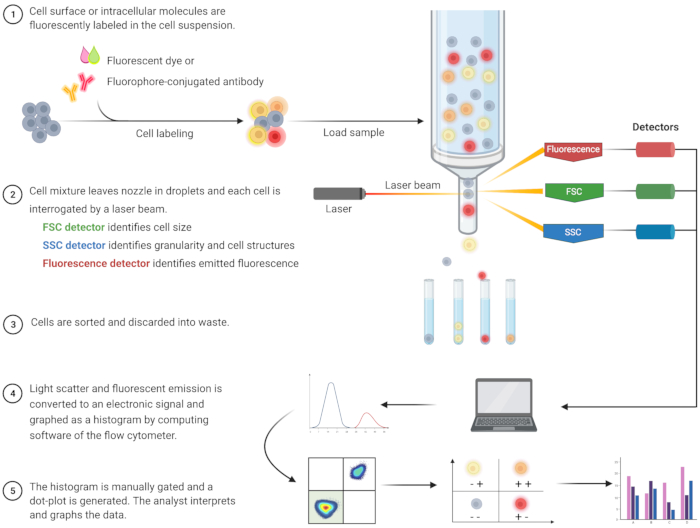
Рисунок 1: Схема, описывающая техническую работу и рабочий процесс традиционной проточной цитометрии. Клетки окрашивают флуоресцентными реагентами и зондируют лазером. Генерируемые флуоресцентные сигналы обнаруживаются и преобразуются в электронный выход, который далее оцифровывается и анализируется с помощью компьютерного программного обеспечения и статистических программ. Сокращения: FSC = прямой скаттер; SSC = боковой разброс. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
ФК используется как в исследованиях, так и в диагностике здоровья. Двумя целями ФК в некробиологии являются выяснение молекулярных и функциональных свойств клеточной гибели и различение различных способов клеточной гибели 14,15,16,17,18. Приложения FC включают подсчет клеток, сортировку клеточных популяций, иммунофенотипирование, обнаружение биомаркеров (например, биомаркеров апоптоза), исследования токсичности и белковую инженерию12. Кроме того, ФК обычно применяется для диагностики здоровья, чтобы помочь в диагностике и мониторинге пациентов с гематологическими злокачественными новообразованиями. Достижения в области контрольно-измерительных приборов, обнаружения флуорофоров и детекторных систем расширяют области применения ФК, включая визуализационную цитометрию, масс-цитометрию и спектральную цитометрию с более широкими исследовательскими приложениями12.
Проточный цитометрический анализ апоптоза дает преимущества по сравнению с традиционными методами, используемыми для оценки здоровья клеток. FC может быстро и воспроизводимо анализировать множество отдельных клеток в гетерогенной выборке для оценки апоптоза 3,5. Способность ФК предоставлять количественную информацию о фенотипах клеток на индивидуальной клеточной основе и избегать массового анализа обеспечивает превосходную чувствительность к вестерн-блоттингу, иммуноферментным анализам (ИФА), флуорометрии и спектрофотометрии, используемым при анализе апоптоза 8,19. Кроме того, относительная простота анализа ФК в отличие от громоздких и плохо воспроизводимых ручных этапов вестерн-блоттинга и ИФА является преимуществом. Таким образом, воспроизводимый, точный и высокопроизводительный анализ ФК полезен в исследованиях рака20.
FC также позволяет проводить одновременный анализ параметров клеточного цикла для здоровых и аномальных популяций апоптотических клеток21. Поскольку апоптоз является динамическим процессом, различные методы могут давать переменные результаты и зависят от момента сбора клеток22. Одновременная количественная оценка нескольких параметров фенотипа клеток позволяет с высокой точностью обнаруживать минорные субпопуляции, например, могут быть обнаружены редкие клеточные субпопуляции с низкой частотой 0,01%23. Многопараметрический анализ FC особенно полезен, поскольку апоптотическая смерть происходит по спектру ранних и поздних биохимических изменений с клетками в различных точках апоптотического континуума. Например, использование двойного окрашивания с использованием аннексина V и йодида пропидия в ФК-анализе апоптотических клеток позволяет классифицировать ранние апоптотические клетки, поздние апоптотические клетки и мертвые клетки24. Точное обнаружение апоптоза на нескольких стадиях позволяет избежать неправильной классификации и ложноотрицательных результатов. Таким образом, многопараметрический анализ методом ФК улучшает общую специфичность выявления фенотипов клеток и позволяет избежать неправильной классификации минорных популяций. Кроме того, сортировка клеток с помощью FC позволяет выделять клеточные популяции с высокой чистотой для последующего анализа7.
Недостатком ФК является использование клеток в суспензии, что может быть сложным при анализе тканей, поскольку дезагрегация ткани в клетки может изменить клеточную функцию19. Кроме того, отсутствие стандартизации настройки приборов FC, анализа данных и отчетов об анализе может привести к различиям в результатах19, что подчеркивает необходимость оптимального обучения операторов FC для выполнения, анализа и представления данных. Например, способность FC различать истинный апоптотический мусор от апоптотических ядер требует: i) правильных настроек сбора, ii) использования калибровочных шариков для идентификации пика диплоидной ДНК и iii) отрицательного и положительного клеточного контроля, которые являются клеточно-специфическими3. Кроме того, многопараметрический анализ ограничен количеством детекторов, и необходимо выполнить оптимальную компенсацию, чтобы избежать неспецифических результатов и распространения флуоресцентного излучения при использовании нескольких флуоресцентных реагентов25. Достижения в области приборов и флуорофорных технологий улучшили определение параметров до 30 параметров12.
Идентификация апоптотической гибели клеток не всегда проста7, и следует учитывать чувствительные и специфические биомаркеры. Номенклатурный комитет по клеточной смерти (NCCD) рекомендует использовать более одного анализа для изучения и количественной оценки процесса апоптоза26. Микроскопический анализ на классические апоптотические признаки26 также рекомендуется для подтверждения апоптоза и предотвращения ложноположительных результатов7. Четыре кардинальные биохимические особенности, которые охватывают ранние и поздние апоптотические события: (1) потеря асимметрии клеточной мембраны; (2) диссипативный мембранный потенциал митохондрий (ΔΨm); (3) активация каспазы; и (4) повреждение ДНК26.
Во время раннего апоптоза фосфатидилсерин экстернализуется на наружную клеточную мембрану 27 и может быть обнаружен с помощью флуоресцентно меченного Annexin V фикоэритрином27,28,29. Кроме того, двойное окрашивание флуоресцентным ДНК-связывающим красителем, 7-аминоактиномицином D (7-AAD), различает живые, позднеапоптотические и мертвые клетки. Таким образом, раннеапоптотические клетки окрашиваются положительно для аннексина V и отрицательно для 7-AAD, в отличие от позднеапоптотических клеток, которые окрашиваются положительно для обоих красителей24.
Внутренние апоптотические сигналы индуцируют диссипацию потенциала митохондриальной мембраны (ΔΨm). Нарушенный ΔΨm вызывает высвобождение ранних проапоптотических белков из митохондриального межмембранного пространства в цитозоль27,29,30. Изменение ΔΨm можно оценить путем двойного окрашивания положительно заряженным липофильным красителем, этиловым эфиром тетраметилродамина, TMRE и 7-AAD. Краситель TMRE накапливается во внутренней мембране интактных митохондрий, когда мембранный потенциал высок. Деполяризованные митохондрии демонстрируют снижение флуоресценции. Живые клетки с поляризованными митохондриями (интактной митохондриальной мембраной) окрашиваются положительно для TMRE и отрицательно для 7-AAD. Мертвые клетки с деполяризованными митохондриями окрашиваются отрицательно для TMRE и положительно для 7-AAD31.
Каспазы представляют собой семейство внутриклеточных протеаз, которые при активации сигнализируют и выполняют апоптоз26,27. Конечные каспазы палача (3,6,7) оказывают влияние на поздний апоптоз 29,32,33. Активность каспазы-3 и -7 можно измерить с помощью флуоресцентно меченного субстрата, который при расщеплении связывается с ДНК и излучает флуоресцентный сигнал. Кроме того, любой компромисс с целостностью клеточной мембраны может быть оценен путем окрашивания 7-AAD. Апоптотические клетки окрашиваются положительно для ДНК-связывающего красителя, но отрицательно для 7-AAD. Позднеапоптотические и мертвые клетки окрашиваются положительно для обоих красителей34.
Поздний апоптоз характеризуется повреждениемДНК 27,29,35, которое можно оценить по фосфорилированной атаксиателангиэктазии, мутировавшей киназе (ATM) и гистону H2A.X. Двухцепочечные разрывы ДНК (DSB) вызывают фосфорилирование H2A.X. Флуоресцентно меченные антитела против ATM и H2A. X может определить повреждение ДНК. Отрицательное обнаружение как ATM, так и H2A. X указывает на отсутствие повреждений ДНК, в то время как обнаружение обоих красителей указывает на наличие двухцепочечных разрывов в ДНК36.
Актиномицин D является мощным индуктором апоптоза и действует путем связывания с ДНК, блокируя события транскрипции и трансляции37. Это исследование было направлено на оценку биохимического апоптоза, индуцированного актиномицином D в клеточной линии SiHa, путем анализа биомаркеров апоптоза на ранних и поздних стадиях. Четыре биохимических биомаркера апоптоза оценивали последовательные этапы апоптотического каскада, которые включали потерю асимметрии клеточной мембраны, изменение мембранного потенциала митохондрий, активацию терминальных каспаз и повреждение ДНК.
протокол
ПРИМЕЧАНИЕ: В этом протоколе описываются этапы подготовки клеток, подсчета клеток, окрашивания клеток и анализа клеток SiHa, обработанных актиномицином D, с использованием проточных цитометрических коммерческих анализов, измеренных и проанализированных на настольном проточном цитометре (рис. 2).
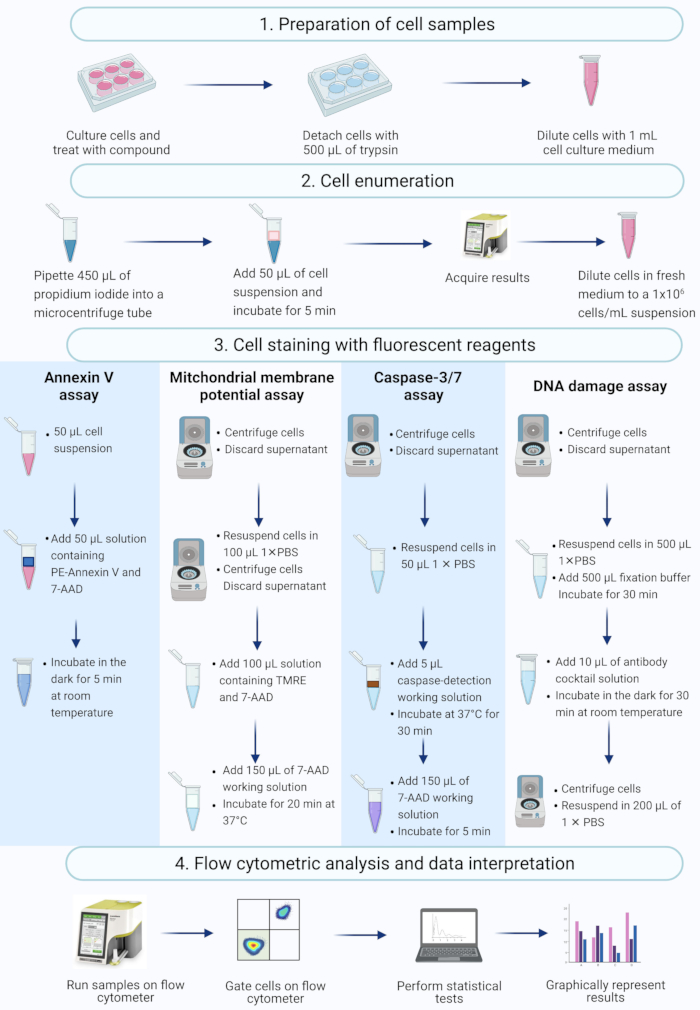
Рисунок 2: Рабочий процесс обнаружения биохимических апоптотических биомаркеров с помощью проточной цитометрии. Клетки культивируют и обрабатывают, как описано в протокольном шаге 1.1. (1) Клетки культивируют, (2) нумеруют и (3) окрашивают флуоресцентными реагентами и (4) анализируют настольным проточным цитометром. Данные дополнительно блокируются и статистически анализируются. Сокращения: 7-AAD = 7-аминоактиномицин D; PBS = фосфатно-буферный физиологический раствор; ПЭ = фикоэритрин; TMRE = этиловый эфир тетраметилродамина. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
1. Подготовка клеточной культуры и обработка проточной цитометрии
ПРИМЕЧАНИЕ: При работе с клеточными культурами соблюдайте асептическую технику.
- Выращивайте клеточные культуры в увлажненной среде CO 2 при 37 ° C с 5% CO2. Убедитесь, что клеточная культура примерно на 70% сливается с родительской колбой, прежде чем пропускать клетки для экспериментов.
- Удалите среду из колбы, промойте клетки 1x фосфатно-буферным физиологическим раствором (PBS) и добавьте 500 мкл трипсина, чтобы отделить клетки. После того, как ячейки начнут округляться и отделяться от колбы, резко постучите основанием колбы о скамейку, чтобы отсоединить ячейки. Затем нейтрализуют трипсин, добавляя примерно 5 мл свежей питательной среды, дополненной 10% сывороткой плодного теленка перед подсчетом клеток.
- Семенные клетки в концентрации 15 000 клеток/мл в 3 мл среды для культивирования клеток в 6-луночной тарелке для культивирования клеток. Инкубируйте культуральные пластины в течение ночи при 37 ° C с 5% CO2 , чтобы клетки могли прикрепиться ко дну лунки.
- Экспериментальные культуры обрабатывают 100 нг/мл актиномицина D, а среду и растворитель - свежей питательной средой и диметилсульфоксидом (ДМСО) соответственно в течение 24 ч. Соберите отработанную среду в пробирку объемом 15 мл и промойте ячейки 1x PBS. После этого добавьте 1x промывку PBS в пробирку, а затем добавьте 500 мкл трипсина в лунку. Далее нейтрализуют трипсин, добавив 5 мл свежей питательной среды.
ПРИМЕЧАНИЕ: (1) Длительная инкубация трипсина или неполная нейтрализация могут переварить клетки и скомпрометировать их клеточную мембрану, что может исказить результаты. Кроме того, он также может изменить асимметрию клеточной мембраны и, таким образом, доступность фосфатидилсерина. (2) Клетки, которые отделились и всплыли на поверхность, могут быть включены в последующий анализ путем центрифугирования удаленной среды при 300 × г в течение 5 мин и ресуспендирования клеток в свежей питательной среде.
2. Перечисление клеток с помощью анализа жизнеспособности
- Пипетка 450 мкл йодида пропидия в микроцентрифужной пробирке. Добавьте 50 мкл клеточной суспензии в микроцентрифужную пробирку. Инкубируйте пробирку при комнатной температуре в течение 5 минут. Перечислите клетки с помощью проточной цитометрии (см. раздел 4).
- Разбавьте все образцы до концентрации 1 × 106 клеток/мл питательной средой для клеток, прежде чем приступать к анализам апоптоза.
3. Окрашивание клеток для проточной цитометрии
ПРИМЕЧАНИЕ: Стерильные условия не требуются для этой части протокола.
- Обнаружение экстернализации фосфатидилсерина с использованием Annexin V
- Добавьте 100 мкл клеточной суспензии в микроцентрифужную пробирку. Добавьте 100 мкл смеси флуоресцентного конъюгированного аннексина V и реагента 7-AAD в соотношении 1:1. Инкубировать при комнатной температуре 20 мин, в защищенном от света месте.
- Анализ деполяризации митохондриальных мембран
- Центрифугу 100 мкл клеточной суспензии по 300 × г в течение 5 мин и выбрасывают надосадочную жидкость.
- Ресуспендируют клетки в 1 мл 1x PBS, добавляют 100 мкл окрашивающего раствора TMRE к каждому образцу и перемешивают суспензию путем осторожного обратного пипетирования.
- Инкубируйте клетки в течение 20 мин в увлажненной среде CO2 при 37 ° C. Заверните образцы в чистую алюминиевую фольгу для защиты от света.
ПРИМЕЧАНИЕ: Митохондриальный мембранный потенциал является функциональным маркером, чувствительным к незначительным изменениям клеточной среды. Поэтому образцы следует инкубировать и измерять в одинаковых условиях (температура, рН и время, прошедшее между началом инкубации и флуоресцентным измерением) для поддержания воспроизводимости). Кроме того, обратите внимание, что недостаточная защита образцов от света вызывает фотообесцвечивание флуорофоров, что приводит к ложно низкой излучаемой флуоресценции. - После инкубации добавьте 5 мкл окрашивающего раствора 7-AAD к каждому образцу и перемешайте. Выдерживать 5 мин при комнатной температуре, в защищенном от света месте.
- Детектирование активированных терминальных каспаз-3 и -7 с помощью каспазного субстрата DEVD
ПРИМЕЧАНИЕ: Перед проведением этого анализа готовят следующие растворы.- Разбавьте ДНК-связывающий пептид DEVD в ДМСО до соотношения 1:8 стерильным 1x PBS, чтобы получить рабочий раствор для обнаружения каспазы. Храните раствор на льду или при температуре 2-8 °C, защищенном от света.
ПРИМЕЧАНИЕ: Для каждого образца потребуется 5 мкл этого раствора. - Добавьте 2 мкл исходного раствора 7-AAD к 148 мкл 1x PBS, чтобы получить рабочий раствор 7-AAD. Храните раствор на льду или при температуре 2-8 °C, защищенном от света.
ПРИМЕЧАНИЕ: Для каждого образца потребуется 150 мкл этого раствора. - Центрифугу 50 мкл клеточной суспензии в течение 5 мин по 300 × г. Откажитесь от надосадочной жидкости. Ресуспендируют клетки в 50 мкл 1x PBS, а затем 5 мкл рабочего раствора для обнаружения каспазы. Тщательно перемешайте.
- Ослабьте крышку пробирок и инкубируйте в течение 30 мин в увлажненной среде CO2 при 37 ° C, защищенной от света. Добавьте 150 мкл рабочего раствора 7-AAD к каждому образцу и перемешайте. Выдерживать 5 мин при комнатной температуре, в защищенном от света месте.
- Разбавьте ДНК-связывающий пептид DEVD в ДМСО до соотношения 1:8 стерильным 1x PBS, чтобы получить рабочий раствор для обнаружения каспазы. Храните раствор на льду или при температуре 2-8 °C, защищенном от света.
- Обнаружение двухцепочечных разрывов ДНК и общего повреждения ДНК
- Центрифугу 50 мкл клеточной суспензии в течение 5 мин по 300 × г. Откажитесь от надосадочной жидкости.
- Ресуспендируют клетки в 500 мкл 1x PBS. Добавьте 500 мкл фиксирующего буфера на основе формальдегида и перемешайте. Инкубируйте образцы на льду в течение 10 минут.
- Центрифугу в течение 5 мин при 300 × г и выбросьте надосадочную жидкость. Ресуспендируют клетки в 90 мкл 1x PBS в микроцентрифужной пробирке. Добавьте 10 мкл раствора антитела в микроцентрифужную пробирку. Инкубировать при комнатной температуре 30 мин в темноте.
- Добавьте 100 мкл 1x PBS и центрифугу в течение 5 мин при 300 × г. Откажитесь от надосадочной жидкости. Ресуспендируют клетки в 200 мкл 1x PBS.
4. Запустите образцы на проточном цитометре.
- Проверьте аналитическую производительность проточного цитометра, запустив комплект для проверки системы прибора. Не приступайте к выполнению образцов до тех пор, пока все проверки не будут завершены и пройдены.
- Найдите нужный анализ, просмотрев каталог предварительно запрограммированных анализов на приборе, и выберите «Выполнить анализ».
- Перемешайте образец, осторожно запипетывая перед загрузкой образца в проточный цитометр.
ПРИМЕЧАНИЕ: Адекватное смешивание гарантирует, что клетки останутся во взвешенном состоянии, и предотвратит низкое количество клеток. - Сначала загрузите отрицательный контрольный образец в проточный цитометр и выберите «Выполнить» (настроить параметры), чтобы прибор начал аспирацию образца и обеспечил предварительный просмотр обнаруженных событий в режиме реального времени. Обратитесь к Таблице материалов для названия и деталей прибора.
- Используя предварительный просмотр в реальном времени, отрегулируйте пороговые значения флуоресценции и размера клеток и нарисуйте прямоугольные ворота вокруг популяции клеток. Перетащите маркер порога, чтобы исключить клеточный мусор. Нажмите кнопку "Далее" (задать профиль работоспособности), чтобы продолжить.
ПРИМЕЧАНИЕ: Важно знать размер ячеек. Перетащите ползунки и наблюдайте за изменениями в том, как обнаруженные события отображаются в предварительном просмотре в реальном времени, так как это поможет точно выбрать пороговые значения. Если клеточный мусор не исключен на этом этапе, он не может быть удален при анализе после приобретения. - Коснитесь и перетащите маркеры квадранта, чтобы разделить популяции клеток и чтобы прибор отображал обнаруженные события в режиме реального времени. Используйте эти графики, чтобы помочь конечному пользователю правильно разместить маркеры квадранта. Нажмите кнопку Next (Verify Samples), чтобы продолжить, чтобы прибор отобразил сводку настроек. Просмотрев параметры, нажмите кнопку Далее (проверить параметры), чтобы применить эти параметры ко всем образцам в эксперименте.
ПРИМЕЧАНИЕ: Прибор обеспечивает 2-минутный предварительный просмотр ячеек в реальном времени, используемых для настройки параметров прибора. Если этот срок истечет, прибор выпустит образец, и этапы 4.2.2-4.2.4 придется повторить. Извлеките образец и хорошо перемешайте, прежде чем перезагружать и продолжать. - Затворите популяцию ячеек, нарисовав область вокруг популяции ячеек. Отрегулируйте пороговые значения флуоресценции и размера ячеек с помощью ползунков, расположенных на осях X и Y предварительного просмотра в реальном времени. Примените эти параметры ко всем образцам в эксперименте.
- Смешайте первый образец с помощью осторожной обратной пипетки, загрузите первый образец в проточный цитометр и нажмите кнопку «Далее». Присвойте образцу имя и нажмите кнопку Выполнить , чтобы система начала его выполнение.
ПРИМЕЧАНИЕ: Прибор может работать только с одним образцом за раз. - После запуска всех образцов сохраните эксперимент, присвоив ему соответствующее название. Сохраните параметры текущего эксперимента для извлечения в будущих запусках (необязательно).
- Перемешайте образец, осторожно запипетывая перед загрузкой образца в проточный цитометр.
5. Анализ после приобретения
- При необходимости выполните тонкую настройку маркеров ворот или квадрантов после сбора.
- Найдите эксперимент, который нуждается в настройке, перейдя в системный файловый браузер, и откройте эксперимент.
- Нажмите на миниатюру предварительного просмотра графика, чтобы увеличить его. Нажмите на верхний левый или нижний правый углы ворот ячейки, чтобы настроить размеры ворот. Чтобы настроить маркеры квадранта, нажмите на пересечение вертикальных и горизонтальных линий, чтобы переместить маркеры в том виде, в котором они есть. Чтобы отрегулировать угол любой линии, нажмите на линию и перетащите маркер.
- Отрегулируйте маркеры (как описано ранее в шагах 4.1.3–4.1.4) по своему усмотрению и примените эти параметры ко всем образцам в эксперименте, щелкнув значок галочки , пометив все образцы и выбрав «Принять».
6. Статистический анализ
- Проведите тесты в трех экземплярах и проведите дисперсионный анализ (ANOVA) с помощью теста Бонферрони post-hoc для оценки значительных различий между обработанными образцами и контрольной группой.
ПРИМЕЧАНИЕ: Выбор статистического теста зависит от исследователя и анализируемых переменных.
Результаты
Результаты подсчета и жизнеспособности клеток (рис. 3) показали, что 95,2% клеток в образце были живыми, а 4,8% — мертвыми. Общая концентрация клеток в исходном образце составила 6,20 х 106 клеток/мл.
Анализ аннексина V и клеточной смерти (рис. 4) показал значительное увеличение (p < 0,0001) в апоптотических клетках в клетках SiHa, обработанных 100 нг/мл актиномицина D, по сравнению с контрольной группой. Поскольку окрашивание аннексина V увеличивается в клетках на ранней стадии апоптоза, это открытие свидетельствует о том, что 100 нг / мл актиномицина D индуцировали апоптоз в клетках SiHa.
Анализ митохондриального электрохимического трансмембранного потенциала (рис. 5) продемонстрировал значительное снижение (p < 0,0001) профилей здоровья клеток (живые, деполяризованные и живые, деполяризованные и мертвые, мертвые) между актиномицином D, контролем среды и контролем растворителя. Эти данные свидетельствуют о том, что 100 нг/мл актиномицина D индуцировали митохондриальную деполяризацию в клетках SiHa.
Анализ каспазы 3/7 (рис. 6) продемонстрировал значимую (p < 0,0001) активацию каспаз 3 и 7 в клетках SiHa, обработанных 100 нг/мл актиномицина D, по сравнению с контрольной группой. Эти данные показывают, что 100 нг / мл актиномицина D индуцировали апоптоз в клетках SiHa.
Анализ повреждения ДНК (рис. 7) показал, что 100 нг/мл актиномицина D достоверно (p < 0,0001) индуцировали маркеры повреждения ДНК, ATM и H2A. X, в ячейках SiHa. Это открытие свидетельствует о значительном увеличении повреждения ДНК в клетках SiHa, обработанных актиномицином D.
Результаты субоптимальных экспериментов (рис. 8) демонстрируют аналитические соображения по всем анализам. Концентрация клеток влияет на точность данных. На рисунке 8А количество ячеек недопустимо низкое. Закрытые клеточные популяции во всех 4 квадрантах точечного графика имеют низкую интенсивность сигнала. Производитель оптимизирует анализ для 300-700 клеток/мкл в конечном объеме образца. Этот пример иллюстрирует важность использования правильной концентрации пробы, предписанной производителем.
Кроме того, высокие концентрации в клетках также приводили к ошибочным результатам (рис. 8B). Средние и экспериментальные культуры показали 99,95% и 100% живых клеток соответственно. Скорость потока для обоих анализов превышала оптимизированную производителем концентрацию 100-500 клеток / мкл и требовала разбавления 1x буфером для анализа, чтобы избежать неточного анализа.
Следует избегать слипания клеток во время подготовки экспериментальных культур, поскольку это дает ложные результаты из-за увеличения индексов размера клеток, как показано в анализе Annexin V. На рисунке 8C показана двойная проблема: высокая концентрация клеток, превышающая инструкцию производителя, и слипание клеток, о чем свидетельствуют индексы размера ячеек, превышающие 4 в контроле среды SiHa. Высокая концентрация клеток иллюстрируется покрытием клеток, образующих ярко-красную плоскость клеток в средних культурах, демонстрируя диссонантно высокие популяции апоптотических клеток.
Длительное окрашивание культур может привести к неспецифическому связыванию белков и привести к ложным результатам, как показано анализом Annexin V. Рисунок 8D демонстрирует аналогичные результаты для средних и экспериментальных культур из-за длительного окрашивания.
Плохая обработка образцов, длительная трипсинизация адгезивных клеток, энергичное пипетирование на этапах промывки, а также высокоскоростные и длительные этапы центрифугирования вызывают лизис клеток и большое количество клеточного мусора. На рисунке 8E культуры, проанализированные с помощью анализа каспазы 3/7, демонстрируют повышенный клеточный дебрис, о чем свидетельствует малый индекс размера клеток (индекс размера клеток <2,2). Поэтому при подготовке образцов для сбора данных следует проявлять осторожность.
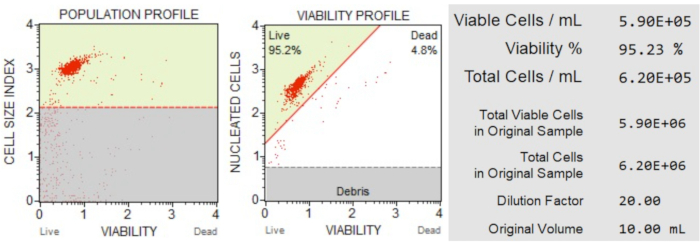
Рисунок 3: Количество клеток и анализ жизнеспособности. Популяционный профиль отделяет мусор от живых и мертвых клеток. Двумерный точечный график закрыт и разделяет популяции живых и мертвых клеток. Информационная панель предоставляет количественные данные о количестве клеток, проценте от общего количества жизнеспособных клеток и общем количестве жизнеспособных клеток в образце. Эти данные могут быть использованы для стандартизации количества клеток во всех образцах для последующего анализа апоптоза. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
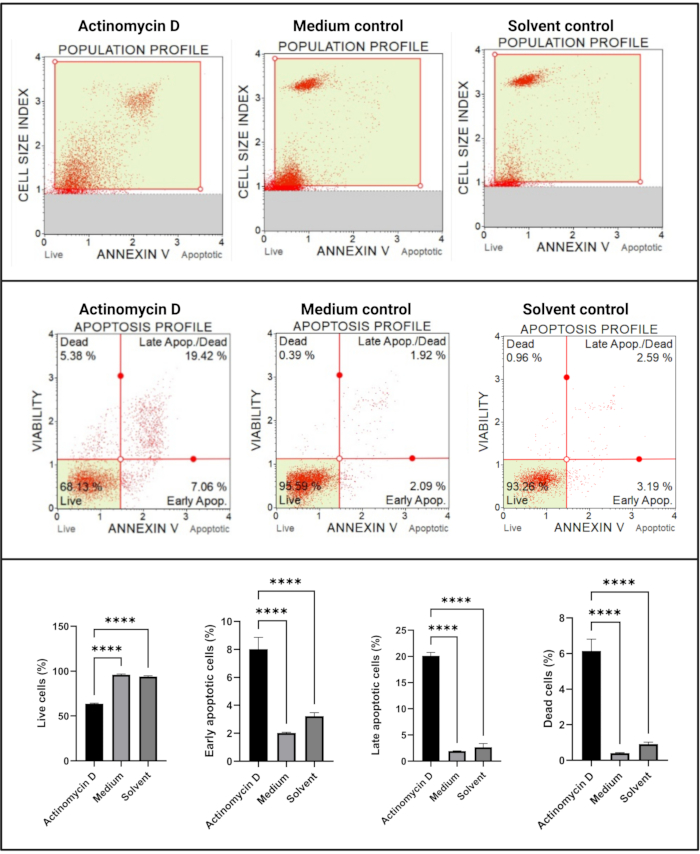
Рисунок 4: Анализ Annexin V. Все образцы показывают идентичные параметры стробирования, а статистический анализ каждой субпопуляции показывает значительное увеличение апоптоза в клетках, обработанных актиномицином D. Все анализы проводились как три независимых эксперимента, и каждый эксперимент анализировался в трех экземплярах. Данные представлены как средние ± SD, и p < 0,05 считался статистически значимым. p < 0,0001. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
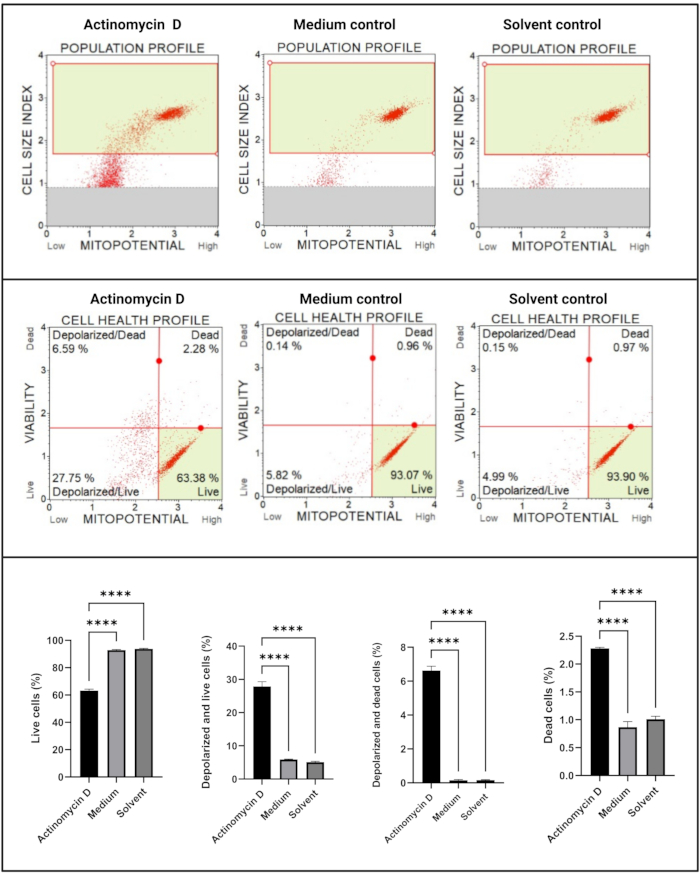
Рисунок 5: Анализ митохондриального электрохимического трансмембранного потенциала. Все образцы показывают идентичные параметры стробирования, а статистический анализ каждой субпопуляции выявляет значительное нарушение мембранного потенциала митохондрий в клетках, обработанных актиномицином D. Все анализы проводились как три независимых эксперимента, и каждый эксперимент анализировался в трех экземплярах. Данные представлены как средние ± SD, и p < 0,05 считался статистически значимым. p < 0,0001. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
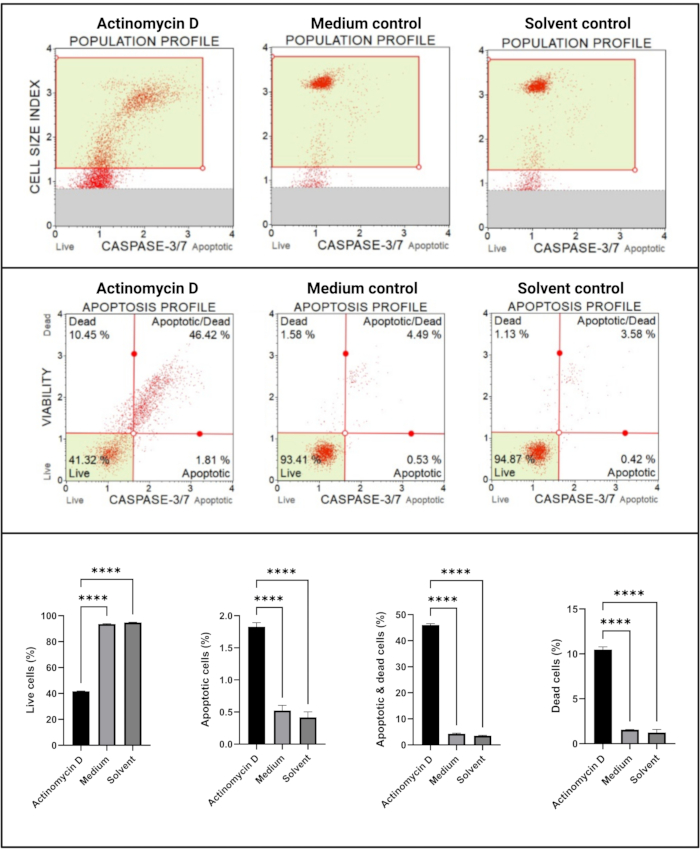
Рисунок 6: Анализ обнаружения каспазы 3/7. Все образцы показывают идентичные параметры стробирования, а статистический анализ каждой субпопуляции показывает значительное увеличение активности каспазы 3/7 в клетках, обработанных актиномицином D. Все анализы проводились как три независимых эксперимента, и каждый эксперимент анализировался в трех экземплярах. Данные представлены как средние ± SD, и p < 0,05 считался статистически значимым. p < 0,0001. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
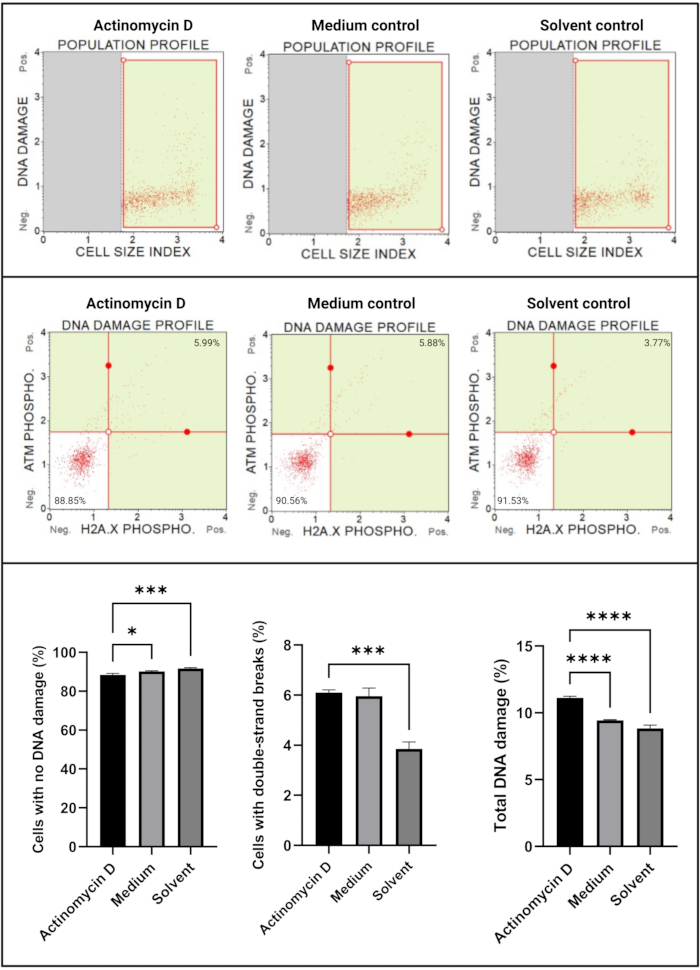
Рисунок 7: Анализ повреждений ДНК. Все образцы показывают идентичные параметры стробирования, а статистический анализ каждой субпопуляции показывает значительное увеличение двухцепочечного повреждения ДНК и общего повреждения ДНК в клетках, обработанных актиномицином D. Все анализы были проведены в трех независимых экспериментах, и каждый эксперимент был проанализирован в трех экземплярах. Данные представлены как средние ± SD, и p < 0,05 считался статистически значимым. * p < 0,05; p < 0,001; p < 0,0001. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
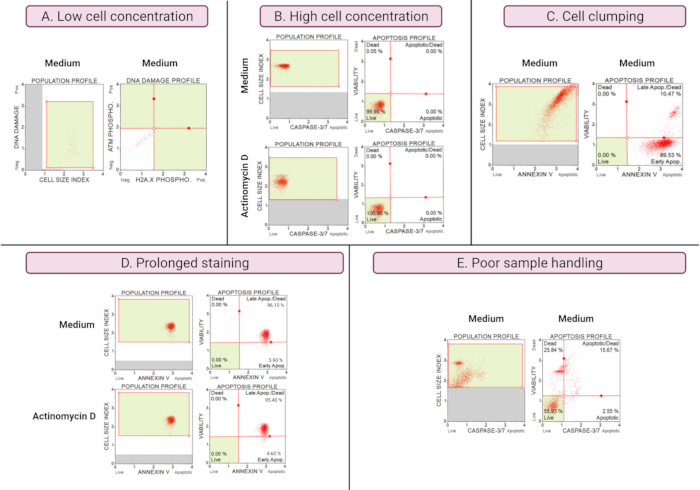
Рисунок 8: Неоптимальные условия эксперимента дают плохие результаты . (A) низкая концентрация клеток, (B) высокая концентрация клеток, (C) слипание и агрегация клеток, проявляющиеся в высоком индексе размера клеток, (D) длительное окрашивание образцов клеток, проявляющееся в увеличении положительного окрашивания в обоих образцах, и (E) плохая обработка образцов, проявляющаяся в увеличении клеточного мусора (индекс размера клеток < 2.2). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
В этом исследовании обработанные актиномицином D-клетки SiHa, проанализированные FC, выявили значительные ранние и поздние биомаркеры апоптоза. Неоптимальные условия подготовки, подсчета и окрашивания клеток выявили неточные результаты, подчеркнув необходимость строгого соблюдения инструкций производителя при выполнении ФК.
Это исследование апоптоза путем ранней и поздней идентификации биомаркеров соответствует рекомендациямNCCD 1 для исследования апоптоза. Культуры SiHa, обработанные актиномицином D, продемонстрировали положительные биомаркеры для ранних и поздних стадий апоптоза. Анализ аннексина V / PI и анализ митохондриальной проницаемости показали, что актиномицин D индуцировал PS-переворот и диссипацию перехода митохондриальной мембраны соответственно. Как только апоптотические клетки достигают точки невозврата, вызванной митохондриальным возмущением, концевые каспазы активируются 3,7. Активация концевых каспаз 3 и 7, наблюдаемая в этом исследовании, указывает на позднюю стадию апоптоза. Кроме того, активация терминальной каспазы вызывает межнуклеосомное расщепление ДНК и обширную фрагментацию ДНК, о которой классически сообщалось как паттерн стремянки, наблюдаемый при гель-электрофорезе28,38.
Ядерный урон с ATM и H2A. Анализ повреждения ДНК X FC показал двухцепочечные разрывы в ДНК и общее повреждение ДНК. Эти результаты подтвердили классическое нисходящее каспазо-индуцированное апоптотическое ядерное повреждение (кариорексис и кариорлиз) в экспериментальных культурах. Таким образом, использование множественных проточных цитометрических биомаркеров выявило последовательные многоступенчатые события в апоптозе и точно и воспроизводимо идентифицировало клеточные популяции на ранних и поздних стадиях апоптоза. Эти результаты согласуются с известными проапоптотическими особенностями актиномицина D при лечении рака у людей 37,39,40,41 и дополнительно подтверждают использование актиномицина D в качестве положительного контроля в экспериментах с культивированием клеток FC, исследующих апоптоз.
Стробирование клеточных популяций в этом исследовании было основано на отрицательной среде и контроле растворителей, которые отделяли апоптотические клетки от здоровых. В качестве альтернативы, смесь популяций положительного и отрицательного контроля также может быть использована для определения живых и апоптотических клеточных популяций для установки клеточных популяционных ворот 7,9. После того, как больные и здоровые клеточные состояния определены и закрыты, настройки шаблона могут быть применены ко всем последующим экспериментальным и контрольным культурам.
Строгое соблюдение протокола FC имеет важное значение, чтобы избежать ложных результатов. Во время оптимизации протокола наблюдались следующие проблемы: (1) низкая концентрация клеток, (2) высокая концентрация клеток, (3) слипание клеток, (4) длительное окрашивание и (5) плохая обработка образцов. Эти проблемы могут быть предотвращены путем строгого соблюдения оптимизированных требований протокола. Это подчеркивает важнейший характер преаналитических и аналитических шагов для получения точных данных ФК. Во время подготовки клеток трипсинизацию, пипетирование, центрифугирование и разведения необходимо проводить с осторожностью. Чрезмерная трипсинизация и энергичное пипетирование могут привести к химическому и механическому сдвигу клеток, соответственно. Длительное и высокоскоростное центрифугирование может привести к разрушению клеток и большому количеству клеточного мусора. Оптимальная концентрация клеток необходима, чтобы свести к минимуму неправильное получение клеточных событий. Поэтому первичные клеточные суспензии следует разбавлять для получения оптимальной концентрации клеток.
Кроме того, при работе с образцами необходимо соблюдать осторожность, чтобы предотвратить слипание клеток и фрагментацию клеток, а также следить за тем, чтобы клетки оставались во взвешенном состоянии во время анализа. Обработка образцов для предотвращения слипания клеток обеспечивает поток одиночных ламинарных клеток, предотвращает механическую закупорку капиллярной трубки прибора и ограничивает ложные большие индексы размера ячеек. Еще одним предостережением является защита культур от света, чтобы избежать фотоокисления и гашения флуорофоров в анализах, чтобы предотвратить ложноотрицательные результаты. Необходимо позаботиться о том, чтобы обеспечить минимальное воздействие света на этапе окрашивания клеток и последующих этапах обработки. Более того, длительное время иммуноокрашивания может привести к ложноположительным результатам, поскольку белки неспецифически окрашены. Поэтому важно соблюдать предписанные производителем инкубационные периоды окрашивания.
Таким образом, FC может точно обнаруживать апоптоз и различать биомаркеры раннего и позднего апоптоза в культуре клеток. Кроме того, достижения в области технологий привели к производству настольных проточных цитометров для ученых-неспециалистов для изучения здоровья клеток и сложных внутриклеточных сигнальных путей.
Раскрытие информации
Корпорация Luminex® любезно предоставила плату за обработку статьи.
Благодарности
Исследование было поддержано Национальным исследовательским фондом (NRF) и Южноафриканским советом медицинских исследований (SAMRC). Выражаем благодарность Национальной лабораторной службе здравоохранения (NHLS) за приобретение анализатора клеток Guava Muse. Все рисунки в этой публикации были созданы с Biorender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| 6-well plates | Lasec | P1PLA044C-000006 | |
| Dimethyl Sulfoxide | Sigma-Aldrich | D8418 | |
| DMEM | ThermoFisher | 41966052 | |
| Glutamine | Sigma-Aldrich | P10-040500 | |
| Guava Muse Cell Analyzer | Luminex | 0500-3115 | |
| Microcentrifuge tubes/Eppendorf | Merck | EP0030122208-200EA | |
| Muse Annexin V kit | Merck | MCH100105 | |
| Muse Caspase-3/7 kit | Merck | MCH100108 | |
| Muse Count and Viability kit | Merck | MCH600103 | |
| Muse DNA Damage kit | Merck | MCH200107 | |
| Muse MitoPotential kit | Merck | MCH100110 | |
| PBS Buffer | ThermoFisher | 70013065 | |
| Pen-strep | Sigma-Aldrich | P4333 | |
| SiHa cells | ATCC | CRL-1550 | |
| T25 culture flasks | Sigma-Aldrich | C6231 | |
| Trypsin | Pan Biotech | P10-040500 |
Ссылки
- Galluzzi, L., et al. Molecular mechanisms of cell death: Recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death and Differentiation. 25 (3), 486-541 (2018).
- Kerr, J. F., Wyllie, A. H., Currie, A. R. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. British journal of cancer. 26 (4), 239-257 (1972).
- Riccardi, C., Nicoletti, I. Analysis of apoptosis by propidium iodide staining and flow cytometry. Nature Protocols. 1 (3), 1458-1461 (2006).
- Edinger, A. L., Thompson, C. B. Death by design: apoptosis, necrosis and autophagy. Current Opinion in Cell Biology. 16 (6), 663-669 (2004).
- Arends, M. J., Morris, R. G., Wyllie, A. H. Apoptosis. The role of the endonuclease. The American journal of pathology. 136 (3), 593-608 (1990).
- Majno, G., Joris, I. Apoptosis, oncosis, and necrosis. An overview of cell death. Am J Pathol. 146 (1), 3-15 (1995).
- Darzynkiewicz, Z., Traganos, F., Al-Rubeai, M. . Apoptosis. , 33-73 (1998).
- Wlodkowic, D., Skommer, J., Darzynkiewicz, Z. Flow cytometry-based apoptosis detection. Methods in molecular biology. 559, 19-32 (2009).
- . Introduction to Flow Cytometry Basics Available from: https://www.bio-rad-antibodies.com/introduction-to-flow-cytometry.html (2021)
- Telford, W. G., Komoriya, A., Packard, B. Z. Detection of localized caspase activity in early apoptotic cells by laser scanning cytometry. Cytometry. 47 (2), 81-88 (2002).
- Castedo, M., et al. Quantitation of mitochondrial alterations associated with apoptosis. J Immunol Methods. 265 (1-2), 39-47 (2002).
- McKinnon, K. M. Flow Cytometry: An Overview. Current protocols in immunology. 120, 1-11 (2018).
- Macey, M. G. Flow cytometry: principles and clinical applications. Med Lab Sci. 45 (2), 165-173 (1988).
- Darzynkiewicz, Z., et al. Features of apoptotic cells measured by flow cytometry. Cytometry. 13 (8), 795-808 (1992).
- Darzynkiewicz, Z., et al. Cytometry in cell necrobiology: Analysis of apoptosis and accidental cell death (necrosis). Cytometry. 27 (1), 1-20 (1997).
- Ormerod, M. G. The study of apoptotic cells by flow cytometry. Leukemia. 12 (7), 1013-1025 (1998).
- van Engeland, M., Nieland, L. J., Ramaekers, F. C., Schutte, B., Reutelingsperger, C. P. Annexin V-affinity assay: a review on an apoptosis detection system based on phosphatidylserine exposure. Cytometry. 31 (1), 1-9 (1998).
- Vermes, I., Haanen, C., Reutelingsperger, C. Flow cytometry of apoptotic cell death. Journal of Immunological Methods. 243 (1), 167-190 (2000).
- Jahan-Tigh, R. R., Ryan, C., Obermoser, G., Schwarzenberger, K. Flow cytometry. J Invest Dermatol. 132 (10), 1-6 (2012).
- Lövborg, H., Gullbo, J., Larsson, R. Screening for apoptosis-classical and emerging techniques. Anti-cancer drugs. 16 (6), 593-599 (2005).
- Vorobjev, I. A., Barteneva, N. S. Multi-parametric imaging of cell heterogeneity in apoptosis analysis. Methods. 112, 105-123 (2017).
- Telford, W. G., Komoriya, A., Packard, B. Z. Multiparametric analysis of apoptosis by flow and image cytometry. Methods in molecular biology. 263, 141-160 (2004).
- Kagami, S., Rizzo, H. L., Lee, J. J., Koguchi, Y., Blauvelt, A. Circulating Th17, Th22, and Th1 cells are increased in psoriasis. J Invest Dermatol. 130 (5), 1373-1383 (2010).
- . Muse® Annexin V & Dead Cell Kit Available from: https://www.luminexcorp.com/muse-annexin-v-dead-cell-kit/ (2019)
- Roederer, M. Spectral compensation for flow cytometry: visualization artifacts, limitations, and caveats. Cytometry. 45 (3), 194-205 (2001).
- Kroemer, G., et al. Classification of cell death: recommendations of the Nomenclature Committee on Cell Death. Cell Death and Differentiation. 12 (2), 1463-1467 (2005).
- Apoptosis assays and markers guide. Abcam Available from: https://www.abcam.com/kits/apoptosis-assays (2021)
- Vermes, I., Haanen, C., Steffens-Nakken, H., Reutelingsperger, C. A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V. Journal of Immunological Methods. 184 (1), 39-51 (1995).
- Elmore, S. Apoptosis: A Review of Programmed Cell Death. Toxicologic Pathology. 35 (4), 495-516 (2007).
- Saelens, X., et al. Toxic proteins released from mitochondria in cell death. Oncogene. 23 (16), 2861-2874 (2004).
- Muse™ MitoPotential Kit User's Guide. Luminex Corporation Available from: https://www.luminexcorp.com/muse-mitopotential-kit (2013)
- McIlwain, D. R., Berger, T., Mak, T. W. Caspase functions in cell death and disease. Cold Spring Harbor Perspectives in Biology. 5 (4), 008656 (2013).
- Wigdal, S. S., Kirkland, R. A., Franklin, J. L., Haak-Frendscho, M. Cytochrome c release precedes mitochondrial membrane potential loss in cerebellar granule neuron apoptosis: lack of mitochondrial swelling. Journal of Neurochemistry. 82 (5), 1029-1038 (2002).
- Muse® Caspase-3/7 Kit. Luminex Corporation Available from: https://www.luminexcorp.com/muse-caspase-3-7-kit/#overview (2019)
- Häcker, G. The morphology of apoptosis. Cell and Tissue Research. 301 (1), 5-17 (2000).
- Muse® Multi-Color DNA Damage Kit User's Guide. Luminex Corporation Available from: https://www.luminexcorp.com/muse-multi-color-dna-damage-kit/#overview (2020)
- Kleeff, J., Kornmann, M., Sawhney, H., Korc, M. Actinomycin D induces apoptosis and inhibits growth of pancreatic cancer cells. International journal of cancer. 86 (3), 399-407 (2000).
- Wlodkowic, D., Skommer, J., Darzynkiewicz, Z. Cytometry of apoptosis. Historical perspective and new advances. Experimental oncology. 34 (3), 255-262 (2012).
- Szeberenyi, J. The effect of actinomycin D on RNA metabolism in human cells. Biochem Mol Biol Educ. 34 (1), 50-51 (2006).
- Ginell, S., Lessinger, L., Berman, H. M. The crystal and molecular structure of the anticancer drug actinomycin D--some explanations for its unusual properties. Biopolymers. 27 (5), 843-864 (1988).
- Hou, M. H., Robinson, H., Gao, Y. G., Wang, A. H. Crystal structure of actinomycin D bound to the CTG triplet repeat sequences linked to neurological diseases. Nucleic Acids Res. 30 (22), 4910-4917 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены