Method Article
アクチノマイシンD処理SiHa子宮頸癌細胞におけるアポトーシスバイオマーカーのフローサイトメトリー解析
要約
アポトーシスは、初期および後期のアポトーシスバイオマーカーのフローサイトメトリー分析によって特徴付けることができます。子宮頸がん細胞株SiHaを、卓上フローサイトメーターを用いてアクチノマイシンDで処理した後のアポトーシスバイオマーカーについて分析した。
要約
アクチノマイシンD処理SiHa子宮頸がん細胞におけるアポトーシスバイオマーカーをベンチトップフローサイトメーターを用いて調査した。アポトーシスの初期バイオマーカー(アネキシンVおよびミトコンドリア膜電位)および後期バイオマーカー(カスパーゼ3および7、およびDNA損傷)を実験培養および対照培養で測定した。培養物を加湿インキュベーター内で37°C、5%CO2で24時間インキュベートした。次いで、細胞をトリプシンを用いて剥離し、フローサイトメトリー細胞数アッセイを用いて列挙した。細胞は、アネキシンVアッセイ、ミトコンドリア電気化学的膜貫通電位アッセイ、カスパーゼ3/7アッセイ、およびDNA損傷アッセイを用いて、アポトーシスについてさらに分析されました。この記事では、アポトーシスと従来のフローサイトメトリーの概要を説明し、SiHa細胞を処理および分析するためのフローサイトメトリープロトコルについて詳しく説明します。結果は、ポジティブ、ネガティブ、および次善の実験データを示しています。また、この分析プラットフォームを使用してアポトーシスのフローサイトメトリー分析を実行する際の解釈と注意点についても説明します。フローサイトメトリー分析は、アポトーシスの初期および後期バイオマーカーの正確な測定を提供します。
概要
1型プログラム細胞死1に分類されるアポトーシスは、細胞増殖と細胞死2の間の平衡を保証します。アポトーシスは、人間の発達中、損傷後、および癌などの疾患の予防に不可欠です3。内因性および外因性のアポトーシス細胞死シグナル伝達経路4は、連続的な生化学的および形態学的細胞内変化を引き起こす2,5,6。形態学的アポトーシスの特徴は顕微鏡で特定でき、生化学的摂動はフローサイトメトリー(FC)7を含む生化学的アッセイで分析できます。
アポトーシスを同定し、関連する細胞内メカニズムを理解するためのフローサイトメトリー解析は、過去20年間で急増しています8。FCは、シングルまたはマルチチャンネルレーザーを通過する流体中の細胞を分析する科学的方法論です(図1)9,10,11。流体中の細胞は、流体力学的焦点合わせを用いてフローサイトメーターの流路系によって単一のファイルに集束される。細胞がレーザーを通過すると、光が散乱または細胞から放出されます。散乱光は、順方向(前方散乱)または側面方向(側方散乱)にすることができ、それぞれセルサイズ、セル粒度または内部構造に関する情報を提供します。
さらに、蛍光色素や蛍光色素で標識された抗体などの蛍光試薬は、特定の表面または細胞内の構造または分子を検出します。レーザーが蛍光色素を励起すると、特定の波長で光が放出されます。検出器(一般的に光電子増倍管)は、細胞サンプルからの散乱光と放出光を定量化します。検出器は、光散乱と蛍光放射に比例する定量化可能な電流を生成します。電子出力は、細胞サイズ、細胞粒度、および蛍光色素標識分子の相対的な細胞蛍光に基づいて細胞集団を識別するための計算ソフトウェアによってデジタル信号に変換されます9、12、13。
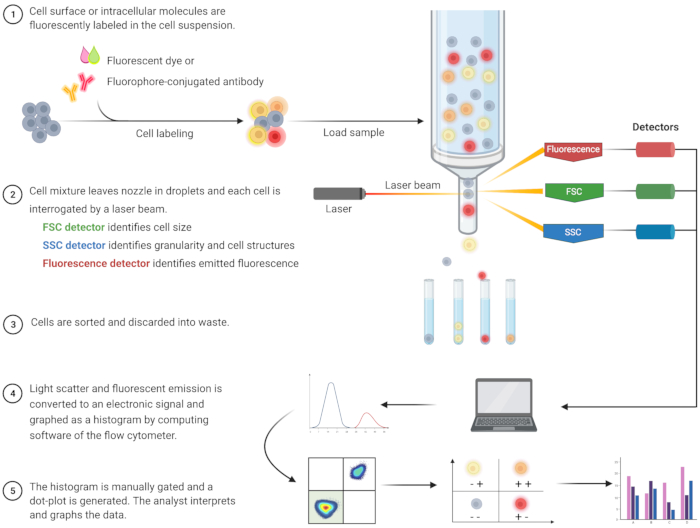
図1:従来のフローサイトメトリーの技術的操作とワークフローを説明する概略図。 細胞を蛍光試薬で染色し、レーザーでプローブします。生成された蛍光信号は検出され、電子出力に変換され、コンピュータソフトウェアと統計プログラムによってさらにデジタル化および分析されます。略語:FSC =前方散乱;SSC = 側方散乱。この図の拡大版を表示するには、ここをクリックしてください。
FCは、研究と健康診断の両方で使用されます。ネクロバイオロジーにおけるFCの2つの目標は、細胞死の分子的および機能的特性の解明と、細胞死のさまざまなモードの識別です14、15、16、17、18。FCアプリケーションには、細胞列挙、細胞集団のソーティング、イムノフェノタイピング、バイオマーカー検出(アポトーシスバイオマーカーなど)、毒性試験、およびタンパク質工学が含まれます12。さらに、FCは、血液悪性腫瘍患者の診断とモニタリングを支援するために、健康診断に一般的に適用されます。装置、蛍光色素検出、および検出器システムの進歩により、FCアプリケーションは、イメージングサイトメトリー、マスサイトメトリー、スペクトルサイトメトリーに拡大し、より広範な研究アプリケーションとなっています12。
アポトーシスのフローサイトメトリー分析は、細胞の健康状態の評価に使用される従来の技術よりも優れています。FCは、異種サンプル中の多くの単一細胞を迅速かつ再現性よく分析して、アポトーシスを推定することができます3,5。FCは、個々の細胞ベースで細胞表現型に関する定量的情報を提供し、バルク分析を回避する能力により、アポトーシスの分析に利用されるウェスタンブロッティング、酵素結合免疫吸着アッセイ(ELISA)、蛍光測定、および分光光度法技術に対して優れた感度を提供します8,19。さらに、ウェスタンブロットやELISAの煩雑で再現性の低い手動ステップとは対照的に、FC分析が比較的容易であるという利点があります。したがって、FCの再現性、正確性、およびハイスループット分析は、癌研究において有益です20。
FCはまた、健常および異常なアポトーシス細胞集団についての細胞周期パラメータの同時分析を可能にする21。アポトーシスは動的なプロセスであるため、さまざまな方法でさまざまな結果が得られ、細胞が採取される時点に依存します22。細胞表現型の複数のパラメータの同時定量的評価は、例えば、0.01%の低頻度の希少細胞サブセットを検出することができる23。マルチパラメトリックFC分析は、アポトーシス連続体に沿ったさまざまなポイントで細胞の初期および後期の生化学的変化のスペクトルに沿ってアポトーシス死が起こるため、特に有用です。例えば、アポトーシス細胞のFC分析において、アネキシンVおよびヨウ化プロピジウムを用いた二重染色の使用は、初期アポトーシス細胞、後期アポトーシス細胞、および死細胞の分類を可能にする24。複数の段階でアポトーシスを正確に検出することで、誤分類や偽陰性の結果を回避できます。したがって、FCによるマルチパラメトリック解析は、細胞表現型を検出する全体的な特異性を改善し、マイナー集団の誤分類を回避する。さらに、FCによる細胞ソーティングにより、その後の分析のために高純度の細胞集団を単離することができます7。
FCの欠点には、懸濁液中の細胞の使用が含まれますが、組織から細胞への分解は細胞機能を変化させる可能性があるため、組織分析では困難な場合があります19。さらに、FC機器のセットアップ、データ分析、およびアッセイレポートの標準化の欠如は、結果19にばらつきを引き起こす可能性があり、データを実行し、分析し、報告するためにFCオペレーターを最適にトレーニングする必要性を強調しています。例えば、FCが真のアポトーシス破片をアポトーシス核から識別する能力には、i)適切な取得設定、ii)二倍体DNAピークを同定するためのキャリブレーションビーズの使用、およびiii)細胞特異的な陰性および陽性細胞コントロールが必要です3。さらに、マルチパラメトリック解析は検出器の数によって制限され、複数の蛍光試薬25を使用する場合に蛍光発光の非特異的な結果やスピルオーバーを回避するために最適な補償を行う必要がある。装置と蛍光色素の技術の進歩により、パラメータ検出は30パラメータに向上しました12。
アポトーシス細胞死の同定は必ずしも単純ではなく7、高感度で特異的なバイオマーカーを検討する必要があります。細胞死に関する命名委員会(NCCD)は、アポトーシスのプロセスの研究と定量化に複数のアッセイを使用することを推奨しています26。古典的なアポトーシスの特徴26 の顕微鏡分析は、アポトーシスを確認し、偽陽性の結果を避けるためにも推奨されます7。初期および後期のアポトーシスイベントにまたがる4つの基本的な生化学的特徴は、(1)細胞膜の非対称性の喪失です。(2)散逸ミトコンドリア膜電位(ΔΨm);(3)カスパーゼ活性化;(4)DNA損傷26。
初期のアポトーシスの間、ホスファチジルセリンは外側細胞膜27に外在化され、フィコエリスリン27、28、29で蛍光標識されたアネキシンVによって検出することができる。さらに、蛍光DNA結合色素である7-アミノアクチノマイシンD(7-AAD)による二重染色により、生細胞、後期アポトーシス細胞、および死細胞が区別されます。したがって、初期アポトーシス細胞はアネキシンVに対して陽性で、7-AADに対して陰性であり、後期アポトーシス細胞とは対照的に、両方の色素に対して陽性に染色する24。
内因性アポトーシスシグナルは、ミトコンドリア膜電位(ΔΨm)の散逸を誘導する。破壊されたΔΨmは、ミトコンドリア膜間腔から細胞質ゾル27,29,30への初期のアポトーシス促進タンパク質の放出を引き起こす。ΔΨmの変化は、正に帯電した親油性色素、テトラメチルローダミンエチルエステル、TMRE、および7-AADによる二重染色によって評価できます。TMRE色素は、膜電位が高いと無傷のミトコンドリアの内膜内に蓄積します。脱分極ミトコンドリアは蛍光の減少を示します。分極ミトコンドリア(無傷のミトコンドリア膜)を有する生細胞は、TMREに対して陽性であり、7-AADに対して陰性に染色される。脱分極したミトコンドリアを有する死細胞は、TMREに対して陰性であり、7-AAD31に対して陽性である。
カスパーゼは細胞内プロテアーゼのファミリーであり、活性化されるとアポトーシスをシグナル伝達して実行します26,27。末期実行者カスパーゼ(3,6,7)は後期アポトーシス29,32,33に影響を及ぼす。カスパーゼ-3および-7活性は、切断されるとDNAに結合して蛍光シグナルを発する蛍光標識基質によって測定できます。さらに、細胞膜の完全性に対するいかなる妥協も、7-AADで染色することによって評価することができる。アポトーシス細胞は、DNA結合色素に対して陽性に染色しますが、7-AADに対して陰性に染色します。後期アポトーシス細胞および死細胞は、両方の色素34に対して陽性に染色する。
遅発性アポトーシスはDNA損傷27,29,35を特徴とし、これはリン酸化運動失調症変異キナーゼ(ATM)およびヒストンH2A.Xによって評価することができる。XはDNA損傷を決定することができます。ATMとH2Aの両方のネガティブ検出。XはDNA損傷がないことを示し、一方、両方の色素の検出はDNA36における二本鎖切断の存在を示す。
アクチノマイシンDはアポトーシスの強力な誘導物質であり、DNAに結合して転写および翻訳イベントをブロックすることによって作用します37。本研究は、SiHa細胞株におけるアクチノマイシンDによって誘導される生化学的アポトーシスを、アポトーシスの初期段階および後期段階のバイオマーカーを分析することによって評価することを目的とした。アポトーシスの4つの生化学的バイオマーカーは、細胞膜の非対称性の喪失、ミトコンドリア膜電位の変化、末端カスパーゼの活性化、およびDNA損傷を含むアポトーシスカスケードの連続したステップを評価しました。
プロトコル
注:このプロトコルでは、ベンチトップフローサイトメーターで測定および分析されたフローサイトメトリー商用アッセイを使用したアクチノマイシンD処理SiHa細胞の細胞調製、細胞列挙、細胞染色、および分析の手順について説明します(図2)。
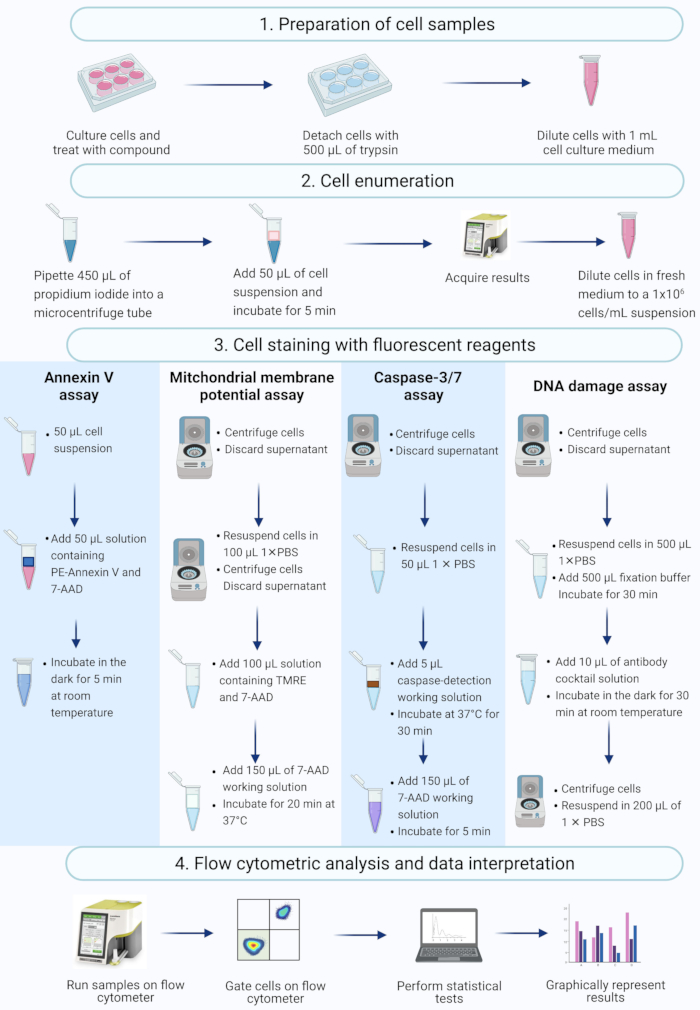
図2:フローサイトメトリーによる生化学的アポトーシスバイオマーカーの検出ワークフロー。 細胞は、プロトコルステップ1.1に記載されているように培養および処理されます。(1)細胞を培養し、(2)列挙し、(3)蛍光試薬で染色し、(4)ベンチトップフローサイトメーターで分析します。データはさらにゲートされ、統計的に分析されます。略語:7-AAD = 7-アミノアクチノマイシンD;PBS = リン酸緩衝生理食塩水;PE =フィコエリスリン;TMRE = テトラメチルローダミンエチルエステル。 この図の拡大版を表示するには、ここをクリックしてください。
1. 細胞培養の調製とフローサイトメトリー処理
注:細胞培養を取り扱う際には、無菌技術に従っていることを確認してください。
- 5%CO2を含む37°Cの加湿CO2環境で細胞培養物を増殖させます。実験のために細胞を継代する前に、細胞培養が親フラスコ内で約70%コンフルエントであることを確認してください。
- フラスコから培地を取り出し、1xリン酸緩衝生理食塩水(PBS)で細胞を洗浄し、500 μLのトリプシンを加えて細胞を剥離します。細胞が丸くなり、フラスコから外れ始めたら、フラスコの底をベンチに強くたたき、細胞を切り離します。次に、細胞をカウントする前に、10%ウシ胎児血清を添加した約5 mLの新鮮な培養液を加えてトリプシンを中和します。
- 6ウェル細胞培養プレート中の3 mLの細胞培養培地に15,000細胞/mLで細胞をシードします。培養プレートを5%CO2 で37°Cで一晩インキュベートし、細胞をウェルの底部に付着させます。
- 実験培養物を100 ng/mLアクチノマイシンDで処理し、培地と溶媒コントロールをそれぞれ新鮮な培地とジメチルスルホキシド(DMSO)で24時間処理します。使用済み培地を15 mLチューブに回収し、1x PBSで細胞を洗浄します。その後、1x PBS洗浄液をチューブに追加し、500 μLのトリプシンをウェルに追加します。次に、5 mLの新鮮な培養液を加えてトリプシンを中和します。
注:(1)長時間のトリプシンインキュベーションまたは不完全な中和は、細胞を消化して細胞膜を損傷し、結果を歪める可能性があります。さらに、それはまた、細胞膜の非対称性を変化させ、したがって、ホスファチジルセリンへのアクセス可能性を変化させる可能性がある。(2)剥離して表面に浮遊した細胞は、除去した培地を300 × g で5分間遠心分離し、細胞を新鮮な培地に再懸濁することにより、後続の分析に含めることができます。
2. 生存率アッセイを用いた細胞の列挙
- 450 μLのヨウ化プロピジウムをマイクロ遠心チューブにピペットで入れます。50 μLの細胞懸濁液をマイクロ遠心チューブに加えます。チューブを室温で5分間インキュベートします。フローサイトメトリーで細胞を列挙します(セクション4を参照)。
- アポトーシスアッセイに進む前に、細胞培養培地ですべてのサンプルを1 ×10 6 cells/mLの濃度に希釈してください。
3. フローサイトメトリーのための細胞の染色
注:プロトコルのこの部分には無菌状態は必要ありません。
- アネキシンVを用いたホスファチジルセリンの外部化の検出
- 100 μLの細胞懸濁液をマイクロ遠心チューブに加えます。蛍光標識アネキシンVおよび7-AAD試薬の1:1混合物100 μLを追加します。光から保護された室温で20分間インキュベートする。
- ミトコンドリア膜脱分極の解析
- 細胞懸濁液100 μLを300 × g で5分間遠心分離し、上清を廃棄します。
- 細胞を1 mLの1x PBSに再懸濁し、各サンプルに100 μLのTMRE染色溶液を加え、穏やかなバックピペッティングで懸濁液を混合します。
- 細胞を37°Cの加湿CO2 環境で20分間インキュベートします。 光から保護するために、サンプルをきれいなアルミホイルで包みます。
注:ミトコンドリア膜電位は、細胞環境の小さな変化に敏感な機能マーカーです。したがって、再現性を維持するために、サンプルは同一の条件(温度、pH、およびインキュベーション開始から蛍光測定までの経過時間)でインキュベートおよび測定する必要があります。また、サンプルを光から十分に保護しないと、蛍光色素の光退色が発生し、誤って低い蛍光を放出することに注意してください。 - インキュベーション後、各サンプルに5 μLの7-AAD染色溶液を加えて混合します。光から保護された室温で5分間インキュベートします。
- カスパーゼ基質DEVDを用いた活性化末端カスパーゼ-3および-7の検出
注:このアッセイを行う前に、以下の溶液を調製します。- DEVD結合DNA結合ペプチドを滅菌1x PBSでDMSOで1:8の比率に希釈して、カスパーゼ検出作業溶液を作ります。溶液を氷上または光から保護された2〜8°Cで保管してください。
注:各サンプルには5μLのこの溶液が必要です。 - 2 μLの7-AADストック溶液を148 μLの1x PBSに加えて、7-AAD作業溶液を作成します。溶液を氷上または光から保護された2〜8°Cで保管してください。
注:各サンプルには150μLのこの溶液が必要です。 - 50 μLの細胞懸濁液を300 × gで5分間遠心分離します。上清を捨てる。細胞を50 μLの1x PBSに再懸濁し、続いて5 μLのカスパーゼ検出作業溶液に再懸濁します。よく混ぜます。
- チューブのキャップを緩め、光から保護された37°Cの加湿CO2 環境で30分間インキュベートします。各サンプルに150 μLの7-AAD作業溶液を加えて混合します。光から保護された室温で5分間インキュベートします。
- DEVD結合DNA結合ペプチドを滅菌1x PBSでDMSOで1:8の比率に希釈して、カスパーゼ検出作業溶液を作ります。溶液を氷上または光から保護された2〜8°Cで保管してください。
- 二本鎖DNA切断および全DNA損傷の検出
- 50 μLの細胞懸濁液を300 × gで5分間遠心分離します。上清を捨てる。
- 細胞を500 μLの1x PBSに再懸濁します。500 μLのホルムアルデヒドベースの固定バッファーを加えて混合します。サンプルを氷上で10分間インキュベートします。
- 300 × g で5分間遠心分離し、上清を廃棄します。細胞をマイクロ遠心チューブ内の90 μLの1x PBSに再懸濁します。10 μLの抗体溶液をマイクロ遠心チューブに加えます。室温で暗所で30分間インキュベートします。
- 100 μLの1x PBSを添加し、300 × gで5分間遠心分離します。上清を捨てる。細胞を200 μLの1x PBSに再懸濁します。
4. フローサイトメーターでサンプルを実行します。
- フローサイトメーターの分析性能を検証するには、装置のシステムチェックキットを実行します。すべてのチェックが完了して合格するまで、サンプルの実行を続行しないでください。
- 装置で事前にプログラムされたアッセイのカタログを参照して目的のアッセイを見つけ、 Run Assayを選択します。
- サンプルをフローサイトメーターにロードする前に、ゆっくりとバックピペッティングしてサンプルを混合します。
注:適切な混合により、細胞が懸濁液のままになり、細胞数の減少が防止されます。 - まず、ネガティブコントロールサンプルをフローサイトメーターにロードし、 実行(設定の調整) を選択して、機器がサンプルの吸引を開始し、検出されたイベントのリアルタイムプレビューを提供するようにします。楽器名と詳細については、 材料表 を参照してください。
- ライブプレビューを使用して、蛍光と細胞サイズのしきい値を調整し、細胞集団の周囲に長方形のゲートを描画します。しきい値マーカーをドラッグして、細胞の破片を除外します。[ 次へ] (正常性プロファイルの設定) を選択して続行します。
注: セルのサイズを知ることは重要です。スライダーをドラッグして、検出されたイベントがリアルタイムプレビューにプロットされる方法の変化を観察すると、しきい値の正確な選択が通知されます。この段階で細胞の破片が除外されない場合、取得後の分析で除去することはできません。 - 象限マーカーをタップしてドラッグすると、細胞集団が分離され、検出されたイベントがリアルタイムでプロットされます。これらのプロットを使用して、象限マーカーの適切な配置についてエンドユーザーをガイドします。 次へ(サンプルの検証) を選択して続行し、機器に設定の概要を表示します。設定を確認したら、 [次へ (設定の確認)] を選択して、実験内のすべてのサンプルにこれらの設定を適用します。
注意: 機器は、機器の設定を調整するために使用されるセルの2分間のライブプレビューを提供します。この制限時間が経過すると、機器はサンプルを解放し、手順4.2.2〜4.2.4を繰り返す必要があります。サンプルを取り出し、よく混ぜてからリロードして続行します。 - セル集団の周囲に領域を描画して、細胞集団をゲートします。蛍光と細胞サイズのしきい値は、ライブプレビューのX軸とY軸にあるスライダーを使用して調整します。実験内のすべてのサンプルにこれらの設定を適用します。
- 最初のサンプルを穏やかにバックピペッティングして混合し、最初のサンプルをフローサイトメーターにロードして、[ 次へ]を選択します。サンプルに名前を付け、[ 実行 ] を選択して、システムがサンプルの実行を開始するようにします。
注:機器は一度に1つのサンプルしか実行できません。 - すべてのサンプルを実行したら、適切なタイトルを付けて実験を保存します。今後の実行で取得するために、現在の実験の設定を保存します (省略可能)。
- サンプルをフローサイトメーターにロードする前に、ゆっくりとバックピペッティングしてサンプルを混合します。
5. 買収後の分析
- 必要に応じて、集録後にゲートまたは象限マーカーの微調整を実行します。
- システムのファイル ブラウザーで調整が必要な実験を見つけ、実験を開きます。
- プロットのサムネイルプレビューをタップして拡大します。セルゲートの左上隅または右下隅をタップして、ゲートの寸法を調整します。象限マーカーを調整するには、垂直線と水平線の交点をタップして、マーカーをそのまま移動します。いずれかの線の角度を調整するには、線をタップしてハンドルをドラッグします。
- 必要に応じてマーカーを調整し (手順 4.1.3-4.1.4 で前述)、チェック マーク アイコンを選択し、すべてのサンプルを マーク して [ 承認] を選択して、これらの設定を実験内のすべてのサンプルに適用します。
6. 統計解析
- 三重検定を実行し、 事後 ボンフェローニ検定で分散分析(ANOVA)を実行して、処理したサンプルと対照の有意差を評価します。
注:選択する統計的検定は、調査員と分析対象の変数によって異なります。
結果
細胞数と生存率(図3)の結果は、サンプル中の細胞の95.2%が生きていて、4.8%が死んでいることを示しました。元のサンプルの総細胞濃度は6.20 x 106 細胞/ mLでした。
アネキシンVおよび細胞死アッセイ(図4)は、対照と比較して、100 ng/mLアクチノマイシンDで処理したSiHa細胞のアポトーシス細胞において有意な増加(p < 0.0001)を示しました。アネキシンV染色は初期段階のアポトーシス中に細胞内で増加するため、この知見は、100 ng/mLのアクチノマイシンDがSiHa細胞においてアポトーシスを誘導することを示唆しています。
ミトコンドリア電気化学的膜貫通電位アッセイ(図5)は、アクチノマイシンD、培地対照、および溶媒対照の間で、細胞健康プロファイル(生、脱分極および生、脱分極、および死、死)の有意な減少(p < 0.0001)を示しました。これらのデータは、100 ng/mLのアクチノマイシンDがSiHa細胞においてミトコンドリアの脱分極を誘導することを示唆しています。
カスパーゼ3/7アッセイ(図6)は、対照と比較して、100 ng/mLアクチノマイシンDで処理したSiHa細胞において、カスパーゼ3および7の有意な活性化(p < 0.0001)を示しました。これらの知見は、100 ng/mLのアクチノマイシンDがSiHa細胞においてアポトーシスを誘導したことを示している。
DNA損傷アッセイ(図7)は、100 ng / mLのアクチノマイシンDが有意に(p < 0.0001)DNA損傷マーカー、ATMおよびH2Aを誘導することを示しました。X、SiHa細胞で。この知見は、アクチノマイシンDで処理したSiHa細胞におけるDNA損傷の有意な増加を示唆している。
次善の実験結果(図8)は、すべてのアッセイにわたる分析上の考慮事項を示しています。細胞濃度はデータの精度に影響します。 図8Aでは、細胞数は許容できないほど低い。ドットプロットの4つの象限すべてのゲート細胞集団は、シグナル強度が低くなっています。メーカーは、最終サンプル量で300〜700細胞/μLのアッセイを最適化します。この例は、メーカーが規定する正しいサンプル濃度を使用することの重要性を示しています。
さらに、高い細胞濃度も誤った結果を引き起こした(図8B)。培地培養および実験培養では、それぞれ99.95%および100%の生細胞が実証されました。両方のアッセイの流速は、メーカーが最適化した100〜500細胞/μLの濃度を超えており、不正確な分析を避けるために1倍アッセイバッファーで希釈する必要がありました。
細胞凝集は、Annexin Vアッセイに示されているように、細胞サイズ指数の増加により誤った結果をもたらすため、実験培養の調製中は避ける必要があります。 図8C は、SiHa培地コントロールにおける細胞サイズ指数が4を超えることからも明らかなように、製造業者の指示を超える高い細胞濃度と細胞凝集という二重の問題を示しています。高い細胞濃度は、培地培養において細胞の明るい赤色面を形成する細胞のシート化によって示され、不一致に高いアポトーシス細胞集団を示しています。
培養物の長期染色は、タンパク質の非特異的結合をもたらし、Annexin Vアッセイによって実証されているように、誤った結果をもたらす可能性があります。 図8D は、長時間の染色による培地培養および実験培養における同様の結果を示す。
サンプルの取り扱いが不十分で、接着細胞のトリプシン処理が長引いており、洗浄ステップ中の激しいピペッティング、高速で長時間の遠心分離ステップでは、細胞溶解や大量の細胞破片が発生します。 図8Eにおいて、カスパーゼ3/7アッセイによって分析された培養物は、小さい細胞サイズ指数(<2.2細胞サイズ指数)によって証明される細胞破片の増加を示す。したがって、データ取得用のサンプルを準備するときは注意が必要です。
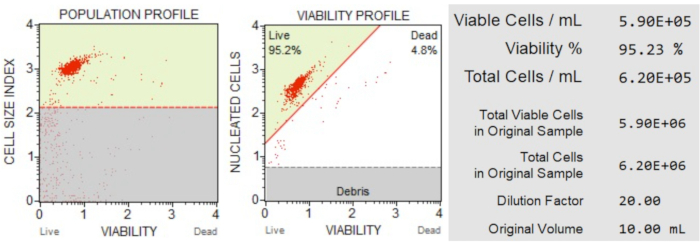
図3:細胞数および生存率アッセイ。 集団プロファイルは、生細胞と死細胞から破片を分離します。2次元ドットプロットはゲートされ、生細胞集団と死細胞集団を分割します。情報パネルには、細胞数、生細胞全体の割合、およびサンプル中の生細胞の総数に関する定量データが表示されます。これらのデータは、後続のアポトーシス解析のためにすべてのサンプルの細胞数を標準化するために使用できます。 この図の拡大版を表示するには、ここをクリックしてください。
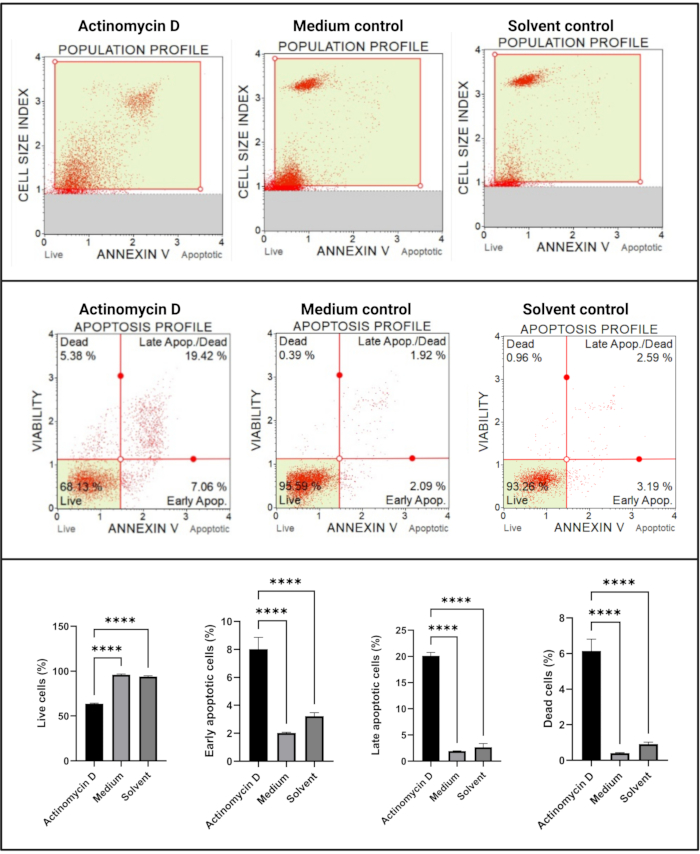
図4:アネキシンVアッセイ。 すべてのサンプルは同一のゲーティングパラメータを示し、各亜集団の統計分析により、アクチノマイシンDで処理された細胞のアポトーシスの有意な増加が明らかになりました。全てのアッセイは、3つの独立した実験として実施し、各実験を三連でアッセイした。データはSD±平均として提示され、p < 0.05は統計的に有意であると考えられた。p < 0.0001. この図の拡大版を表示するには、ここをクリックしてください。
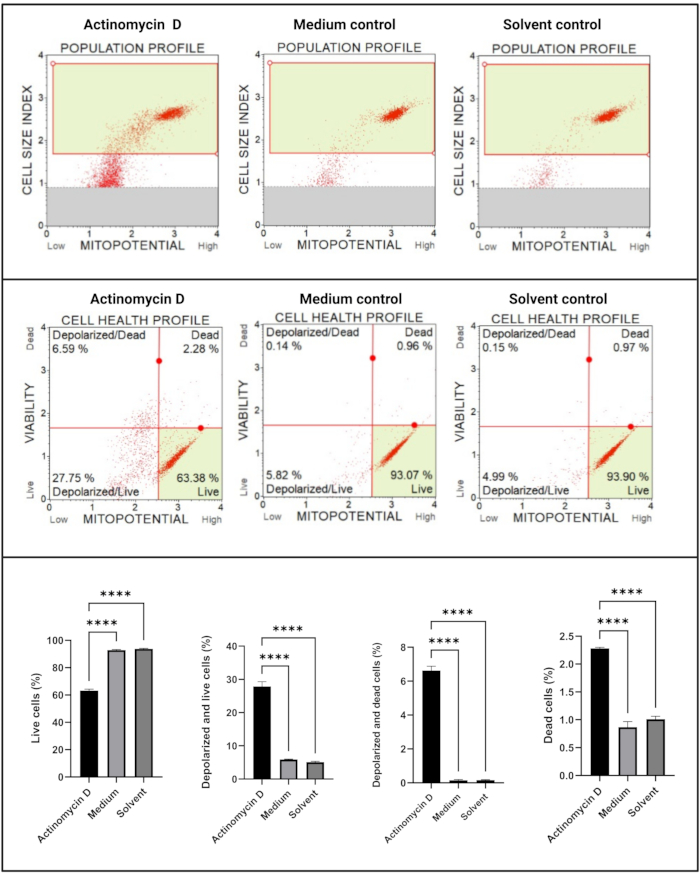
図5:ミトコンドリア電気化学的膜貫通電位アッセイ。 すべてのサンプルは同一のゲーティングパラメータを示し、各亜集団の統計分析により、アクチノマイシンDで処理された細胞のミトコンドリア膜電位の有意な摂動が明らかになります。全てのアッセイは、3つの独立した実験として実施し、各実験を三連でアッセイした。データはSD±平均として提示され、p < 0.05は統計的に有意であると考えられた。p < 0.0001. この図の拡大版を表示するには、ここをクリックしてください。
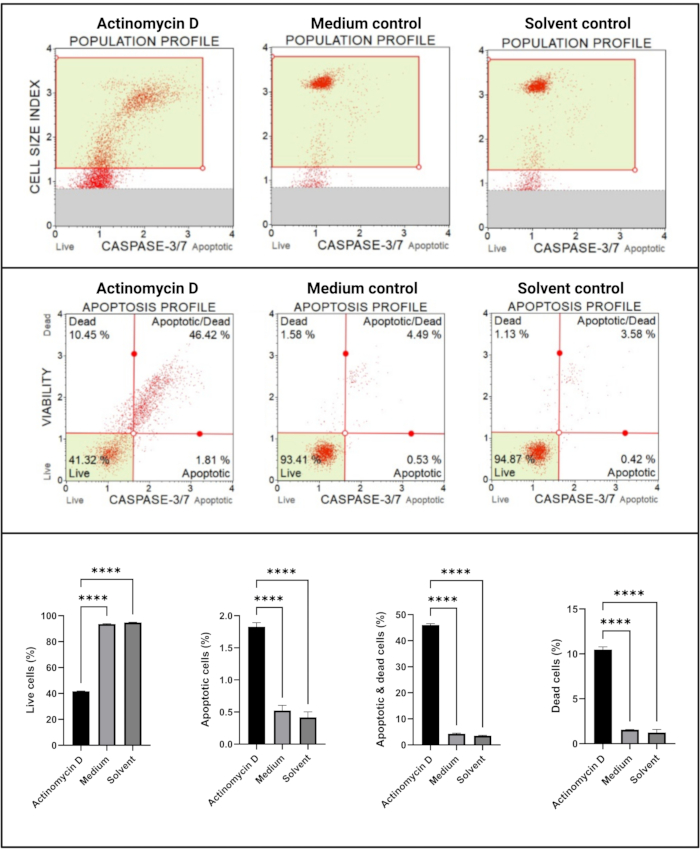
図6:カスパーゼ3/7検出アッセイ。 すべてのサンプルは同一のゲーティングパラメータを示し、各亜集団の統計分析により、アクチノマイシンDで処理された細胞におけるカスパーゼ3/7活性の有意な増加が明らかになりました。全てのアッセイは、3つの独立した実験として実施し、各実験を三連でアッセイした。データはSD±平均として提示され、p < 0.05は統計的に有意であると考えられた。p < 0.0001. この図の拡大版を表示するには、ここをクリックしてください。
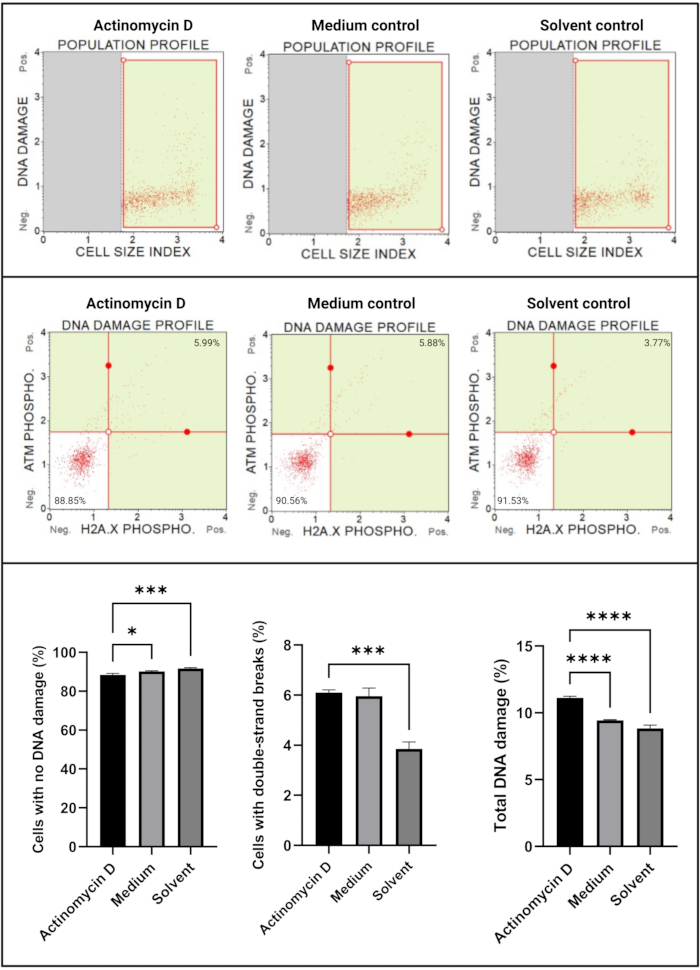
図7:DNA損傷アッセイ。 すべてのサンプルは同一のゲーティングパラメータを示し、各亜集団の統計分析により、アクチノマイシンDで処理された細胞における二本鎖DNA損傷および総DNA損傷の有意な増加が明らかになりました。全てのアッセイを3つの独立した実験で実施し、各実験を三連でアッセイした。データはSD±平均として提示され、p < 0.05は統計的に有意であると考えられた。* p < 0.05;p < 0.001;p < 0.0001. この図の拡大版を表示するには、ここをクリックしてください。
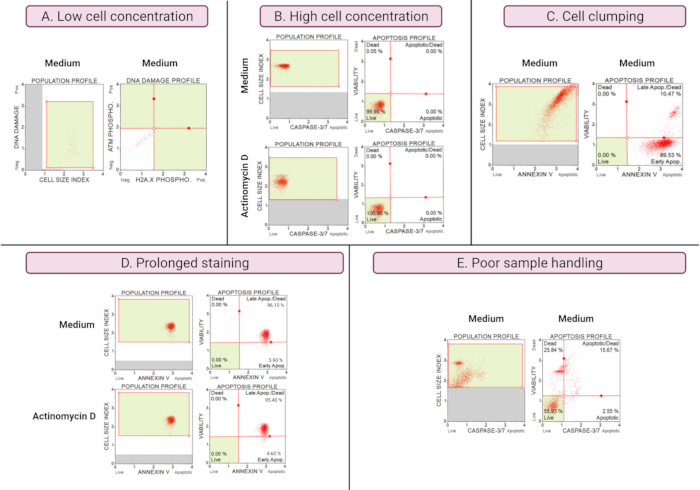
図8:最適でない実験条件では、悪い結果が得られます。 (A)低濃度の細胞、(B)高濃度の細胞、(C)高い細胞サイズ指数によって明らかな細胞凝集および凝集、(D)両方のサンプルにおける陽性染色の増加によって明らかな細胞サンプルの長期染色、および(E)細胞破片の増加によって明らかなサンプル取り扱い不良(細胞サイズ指数<2.2)。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
この研究では、FCによって分析されたアクチノマイシンD処理SiHa細胞は、アポトーシスの有意な初期および後期バイオマーカーを明らかにしました。細胞の調製、列挙、および染色の最適条件では、不正確な結果が特定され、FCを実行する際に製造元の指示を厳密に順守する必要性が強調されました。
早期および後期バイオマーカー同定によるアポトーシスのこの研究は、アポトーシスを調査するためのNCCDガイドライン1に準拠しています。アクチノマイシンD処理SiHa培養は、初期および後期のアポトーシス段階に対して陽性のバイオマーカーを示しました。アネキシンV/PIアッセイおよびミトコンドリア透過性アッセイは、アクチノマイシンDがそれぞれPSフリップパターンおよびミトコンドリア膜転移の散逸を誘導することを示した。アポトーシス細胞がミトコンドリア摂動によって誘導される戻り不能点に達すると、末端カスパーゼが活性化されます3,7。本研究で観察された末端カスパーゼ3および7の活性化は、後期アポトーシスを示す。さらに、末端カスパーゼの活性化は、ヌクレオソーム間DNA切断および広範なDNA断片化を引き起こし、これは古典的にゲル電気泳動によって観察されるステップラダーパターンとして報告されている28,38。
ATMとH2Aによる核の被害。X FC DNA損傷アッセイは、DNAおよび全DNA損傷の二本鎖切断を示した。これらの結果は、実験培養における古典的な下流カスパーゼ誘発アポトーシス核損傷(核狂および核硬化)を確認した。したがって、複数のフローサイトメトリーバイオマーカーを使用することで、アポトーシスにおける連続的な多段階イベントを検出し、初期および後期のアポトーシス段階で正確かつ再現性のある細胞集団を同定しました。これらの知見は、ヒトにおける癌治療におけるアクチノマイシンDの既知のアポトーシス促進性の特徴と一致しており37、39、40、41、さらに、アポトーシスを調査するFC細胞培養実験におけるポジティブコントロールとしてのアクチノマイシンDの使用を支持している。
この研究における細胞集団のゲーティングは、アポトーシスを健康な細胞から分離するネガティブな培地および溶媒コントロールによって知らされました。あるいは、ポジティブコントロールとネガティブコントロールの集団の混合物を使用して、細胞集団ゲート7、9を設定するために生細胞集団とアポトーシス細胞集団を定義することもできます。罹患細胞状態と健康な細胞状態を定義してゲートすると、テンプレート設定を後続のすべての実験培養および対照培養に適用できます。
誤った結果を避けるためには、FCプロトコルを厳守することが不可欠です。プロトコルの最適化中に、次の問題が観察されました:(1)低い細胞濃度、(2)高い細胞濃度、(3)細胞凝集、(4)長時間の染色、および(5)不十分なサンプル取り扱い。これらの問題は、最適化されたプロトコル要件を厳守することで防ぐことができます。これは、FCが正確なデータを取得するための分析前および分析ステップの重要な性質を強調しています。細胞調製中は、トリプシン処理、ピペッティング、遠心分離、および希釈を慎重に行う必要があります。過剰なトリプシン処理と激しいピペッティングは、それぞれ細胞の化学的および機械的せん断を引き起こす可能性があります。長時間の高速遠心分離は、細胞破壊や細胞破片数の増加につながる可能性があります。細胞イベントの誤った獲得を最小限に抑えるには、最適な細胞濃度が必要です。したがって、初代細胞懸濁液は、最適な細胞濃度を得るために希釈する必要があります。
さらに、サンプルを取り扱う際には、細胞の凝集や断片化を防ぎ、分析中に細胞が懸濁状態のままになるように注意する必要があります。細胞の凝集を防ぐためのサンプルハンドリングは、単一の層流細胞の流れを可能にし、装置のキャピラリーチューブの機械的閉塞を防ぎ、偽の大きな細胞サイズインデックスを抑制します。もう1つの注意点は、アッセイにおける蛍光色素の光酸化と消光を避けるために培養物を光から保護し、偽陰性の結果を防ぐことです。細胞の染色ステップおよびその後の処理ステップでの光曝露を最小限に抑えるように注意する必要があります。さらに、免疫染色時間を長くすると、タンパク質が非特異的に染色されるため、偽陽性の結果が生じる可能性があります。したがって、メーカーが規定したインキュベーション染色期間を順守することが重要です。
要約すると、FCはアポトーシスを正確に検出し、細胞培養における初期および後期アポトーシスバイオマーカーを区別することができる。さらに、技術の進歩により、専門家ではない科学者が細胞の健康状態と複雑な細胞内シグナル伝達経路を研究するためのベンチトップフローサイトメーターが製造されました。
開示事項
ルミネックス®株式会社は、物品加工料金を親切に提供しました。
謝辞
この研究は、国立研究財団(NRF)と南アフリカ医学研究評議会(SAMRC)によって財政的に支援されました。Guava Muse細胞分析装置の購入について、国民保健研究所サービス(NHLS)に感謝したいと思います。この出版物のすべての図は Biorender.com で作成されました。
資料
| Name | Company | Catalog Number | Comments |
| 6-well plates | Lasec | P1PLA044C-000006 | |
| Dimethyl Sulfoxide | Sigma-Aldrich | D8418 | |
| DMEM | ThermoFisher | 41966052 | |
| Glutamine | Sigma-Aldrich | P10-040500 | |
| Guava Muse Cell Analyzer | Luminex | 0500-3115 | |
| Microcentrifuge tubes/Eppendorf | Merck | EP0030122208-200EA | |
| Muse Annexin V kit | Merck | MCH100105 | |
| Muse Caspase-3/7 kit | Merck | MCH100108 | |
| Muse Count and Viability kit | Merck | MCH600103 | |
| Muse DNA Damage kit | Merck | MCH200107 | |
| Muse MitoPotential kit | Merck | MCH100110 | |
| PBS Buffer | ThermoFisher | 70013065 | |
| Pen-strep | Sigma-Aldrich | P4333 | |
| SiHa cells | ATCC | CRL-1550 | |
| T25 culture flasks | Sigma-Aldrich | C6231 | |
| Trypsin | Pan Biotech | P10-040500 |
参考文献
- Galluzzi, L., et al. Molecular mechanisms of cell death: Recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death and Differentiation. 25 (3), 486-541 (2018).
- Kerr, J. F., Wyllie, A. H., Currie, A. R. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. British journal of cancer. 26 (4), 239-257 (1972).
- Riccardi, C., Nicoletti, I. Analysis of apoptosis by propidium iodide staining and flow cytometry. Nature Protocols. 1 (3), 1458-1461 (2006).
- Edinger, A. L., Thompson, C. B. Death by design: apoptosis, necrosis and autophagy. Current Opinion in Cell Biology. 16 (6), 663-669 (2004).
- Arends, M. J., Morris, R. G., Wyllie, A. H. Apoptosis. The role of the endonuclease. The American journal of pathology. 136 (3), 593-608 (1990).
- Majno, G., Joris, I. Apoptosis, oncosis, and necrosis. An overview of cell death. Am J Pathol. 146 (1), 3-15 (1995).
- Darzynkiewicz, Z., Traganos, F., Al-Rubeai, M. . Apoptosis. , 33-73 (1998).
- Wlodkowic, D., Skommer, J., Darzynkiewicz, Z. Flow cytometry-based apoptosis detection. Methods in molecular biology. 559, 19-32 (2009).
- . Introduction to Flow Cytometry Basics Available from: https://www.bio-rad-antibodies.com/introduction-to-flow-cytometry.html (2021)
- Telford, W. G., Komoriya, A., Packard, B. Z. Detection of localized caspase activity in early apoptotic cells by laser scanning cytometry. Cytometry. 47 (2), 81-88 (2002).
- Castedo, M., et al. Quantitation of mitochondrial alterations associated with apoptosis. J Immunol Methods. 265 (1-2), 39-47 (2002).
- McKinnon, K. M. Flow Cytometry: An Overview. Current protocols in immunology. 120, 1-11 (2018).
- Macey, M. G. Flow cytometry: principles and clinical applications. Med Lab Sci. 45 (2), 165-173 (1988).
- Darzynkiewicz, Z., et al. Features of apoptotic cells measured by flow cytometry. Cytometry. 13 (8), 795-808 (1992).
- Darzynkiewicz, Z., et al. Cytometry in cell necrobiology: Analysis of apoptosis and accidental cell death (necrosis). Cytometry. 27 (1), 1-20 (1997).
- Ormerod, M. G. The study of apoptotic cells by flow cytometry. Leukemia. 12 (7), 1013-1025 (1998).
- van Engeland, M., Nieland, L. J., Ramaekers, F. C., Schutte, B., Reutelingsperger, C. P. Annexin V-affinity assay: a review on an apoptosis detection system based on phosphatidylserine exposure. Cytometry. 31 (1), 1-9 (1998).
- Vermes, I., Haanen, C., Reutelingsperger, C. Flow cytometry of apoptotic cell death. Journal of Immunological Methods. 243 (1), 167-190 (2000).
- Jahan-Tigh, R. R., Ryan, C., Obermoser, G., Schwarzenberger, K. Flow cytometry. J Invest Dermatol. 132 (10), 1-6 (2012).
- Lövborg, H., Gullbo, J., Larsson, R. Screening for apoptosis-classical and emerging techniques. Anti-cancer drugs. 16 (6), 593-599 (2005).
- Vorobjev, I. A., Barteneva, N. S. Multi-parametric imaging of cell heterogeneity in apoptosis analysis. Methods. 112, 105-123 (2017).
- Telford, W. G., Komoriya, A., Packard, B. Z. Multiparametric analysis of apoptosis by flow and image cytometry. Methods in molecular biology. 263, 141-160 (2004).
- Kagami, S., Rizzo, H. L., Lee, J. J., Koguchi, Y., Blauvelt, A. Circulating Th17, Th22, and Th1 cells are increased in psoriasis. J Invest Dermatol. 130 (5), 1373-1383 (2010).
- . Muse® Annexin V & Dead Cell Kit Available from: https://www.luminexcorp.com/muse-annexin-v-dead-cell-kit/ (2019)
- Roederer, M. Spectral compensation for flow cytometry: visualization artifacts, limitations, and caveats. Cytometry. 45 (3), 194-205 (2001).
- Kroemer, G., et al. Classification of cell death: recommendations of the Nomenclature Committee on Cell Death. Cell Death and Differentiation. 12 (2), 1463-1467 (2005).
- Apoptosis assays and markers guide. Abcam Available from: https://www.abcam.com/kits/apoptosis-assays (2021)
- Vermes, I., Haanen, C., Steffens-Nakken, H., Reutelingsperger, C. A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V. Journal of Immunological Methods. 184 (1), 39-51 (1995).
- Elmore, S. Apoptosis: A Review of Programmed Cell Death. Toxicologic Pathology. 35 (4), 495-516 (2007).
- Saelens, X., et al. Toxic proteins released from mitochondria in cell death. Oncogene. 23 (16), 2861-2874 (2004).
- Muse™ MitoPotential Kit User's Guide. Luminex Corporation Available from: https://www.luminexcorp.com/muse-mitopotential-kit (2013)
- McIlwain, D. R., Berger, T., Mak, T. W. Caspase functions in cell death and disease. Cold Spring Harbor Perspectives in Biology. 5 (4), 008656 (2013).
- Wigdal, S. S., Kirkland, R. A., Franklin, J. L., Haak-Frendscho, M. Cytochrome c release precedes mitochondrial membrane potential loss in cerebellar granule neuron apoptosis: lack of mitochondrial swelling. Journal of Neurochemistry. 82 (5), 1029-1038 (2002).
- Muse® Caspase-3/7 Kit. Luminex Corporation Available from: https://www.luminexcorp.com/muse-caspase-3-7-kit/#overview (2019)
- Häcker, G. The morphology of apoptosis. Cell and Tissue Research. 301 (1), 5-17 (2000).
- Muse® Multi-Color DNA Damage Kit User's Guide. Luminex Corporation Available from: https://www.luminexcorp.com/muse-multi-color-dna-damage-kit/#overview (2020)
- Kleeff, J., Kornmann, M., Sawhney, H., Korc, M. Actinomycin D induces apoptosis and inhibits growth of pancreatic cancer cells. International journal of cancer. 86 (3), 399-407 (2000).
- Wlodkowic, D., Skommer, J., Darzynkiewicz, Z. Cytometry of apoptosis. Historical perspective and new advances. Experimental oncology. 34 (3), 255-262 (2012).
- Szeberenyi, J. The effect of actinomycin D on RNA metabolism in human cells. Biochem Mol Biol Educ. 34 (1), 50-51 (2006).
- Ginell, S., Lessinger, L., Berman, H. M. The crystal and molecular structure of the anticancer drug actinomycin D--some explanations for its unusual properties. Biopolymers. 27 (5), 843-864 (1988).
- Hou, M. H., Robinson, H., Gao, Y. G., Wang, A. H. Crystal structure of actinomycin D bound to the CTG triplet repeat sequences linked to neurological diseases. Nucleic Acids Res. 30 (22), 4910-4917 (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved