Method Article
Análise por citometria de fluxo de biomarcadores apoptóticos em células de câncer cervical SiHa tratadas com Actinomicina D
Neste Artigo
Resumo
A apoptose pode ser caracterizada pela análise por citometria de fluxo de biomarcadores apoptóticos precoce e tardio. A linhagem celular de câncer cervical, SiHa, foi analisada para biomarcadores de apoptose após tratamento com Actinomicina D usando citômetro de fluxo de bancada.
Resumo
Biomarcadores de apoptose foram investigados em células de câncer cervical SiHa tratadas com actinomicina D usando um citômetro de fluxo de bancada. Biomarcadores precoces (anexina V e potencial de membrana mitocondrial) e biomarcadores tardios (caspases 3 e 7 e danos ao DNA) de apoptose foram medidos em culturas experimental e controle. As culturas foram incubadas por 24 horas em estufa umidificada a 37 °C com 5% de CO2. As células foram então destacadas com tripsina e enumeradas por citometria de fluxo. As células foram posteriormente analisadas para apoptose usando um ensaio de anexina V, um ensaio de potencial transmembrana eletroquímico mitocondrial, um ensaio de caspase 3/7 e um ensaio de danos ao DNA. Este artigo fornece uma visão geral da apoptose e citometria de fluxo tradicional, e elabora protocolos de citometria de fluxo para processamento e análise de células SiHa. Os resultados descrevem dados experimentais positivos, negativos e subótimos. Também são discutidas interpretações e ressalvas na realização da análise por citometria de fluxo da apoptose utilizando esta plataforma analítica. A análise por citometria de fluxo fornece uma medida precisa de biomarcadores precoces e tardios para apoptose.
Introdução
A apoptose, classificada como morte celular programadatipo 1, garante o equilíbrio entre proliferação e morte celular2. A apoptose é essencial durante o desenvolvimento humano, pós-lesão e para a prevenção de doenças como o câncer3. As vias de sinalização da morte celular apoptótica intrínseca e extrínseca4 causam alterações bioquímicas e morfológicas intracelulares sequenciais 2,5,6. As características apoptóticas morfológicas podem ser identificadas por microscopia, e a perturbação bioquímica pode ser analisada por ensaios bioquímicos, incluindo citometria de fluxo (FC)7.
A análise por citometria de fluxo para identificar a apoptose e entender os mecanismos intracelulares associados tem surgido nas últimas duas décadas8. A CF é uma metodologia científica que analisa células em um fluido que passa por lasers mono ou multicanais (Figura 1)9,10,11. As células do fluido são focalizadas em um único arquivo pelo sistema fluídico do citômetro de fluxo usando focalização hidrodinâmica. À medida que as células passam pelo laser, a luz é espalhada ou emitida pelas células. A luz espalhada pode estar na direção para frente (dispersão para frente) ou para o lado (dispersão lateral) e fornece informações sobre o tamanho da célula e granularidade da célula ou estruturas internas, respectivamente.
Além disso, reagentes fluorescentes, como corantes fluorescentes ou anticorpos marcados com fluoróforos, detectam estruturas ou moléculas específicas de superfície ou intracelulares. Quando o laser excita os fluoróforos, a luz é emitida em um comprimento de onda específico. Os detectores – geralmente tubos fotomultiplicadores – quantificam a luz espalhada e emitida a partir de amostras celulares. Os detectores produzem uma corrente quantificável que é proporcional à dispersão de luz e emissão de fluorescência. A saída eletrônica é convertida em sinais digitais por meio de um software computacional para identificar populações celulares com base no tamanho celular, granularidade celular e fluorescência relativa de moléculas marcadas com fluoróforos 9,12,13.
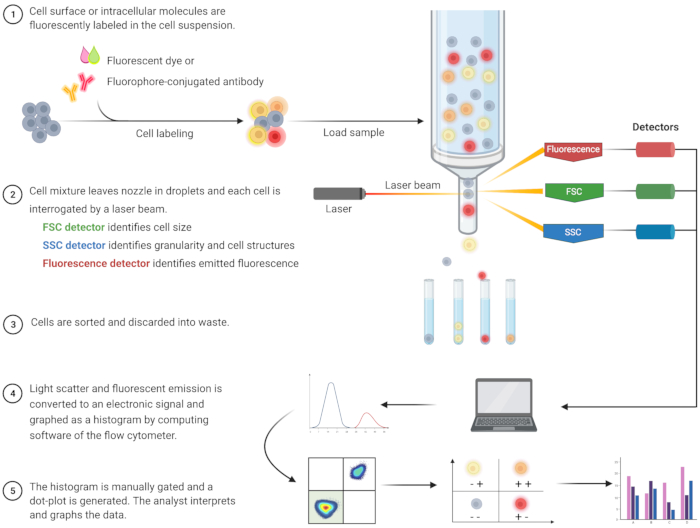
Figura 1: Esquema descrevendo o funcionamento técnico e o fluxo de trabalho da citometria de fluxo tradicional. As células são coradas com reagentes fluorescentes e sondadas por laser. Os sinais de fluorescência gerados são detectados e convertidos em uma saída eletrônica, que é posteriormente digitalizada e analisada por programas de computador e programas estatísticos. Abreviações: FSC = forward scatter; SSC = dispersão lateral. Clique aqui para ver uma versão maior desta figura.
FC é usado em pesquisa e diagnóstico de saúde. Os dois objetivos da CF em necrobiologia são a elucidação das propriedades moleculares e funcionais da morte celular e a discriminação dos vários modos de morte celular14,15,16,17,18. As aplicações da FC incluem enumeração celular, classificação de populações celulares, imunofenotipagem, detecção de biomarcadores (por exemplo, biomarcadores de apoptose), estudos de toxicidade e engenharia de proteínas12. Além disso, a CF é comumente aplicada em diagnósticos de saúde para auxiliar no diagnóstico e acompanhamento de pacientes com neoplasias hematológicas. Avanços em instrumentação, detecção de fluoróforos e sistemas de detectores estão expandindo as aplicações de FC para incluir citometria de imagem, citometria de massa e citometria espectral com aplicações de pesquisa maisamplas 12.
A análise por citometria de fluxo da apoptose oferece vantagens sobre as técnicas tradicionais utilizadas na avaliação da saúde celular. A CF pode analisar várias células isoladas em uma amostra heterogênea de forma rápida e reprodutível para estimar a apoptose 3,5. A capacidade da CF de fornecer informações quantitativas sobre fenótipos celulares em uma base celular individual, e evitar análises em massa, oferece sensibilidade superior às técnicas de Western blotting, ensaios imunoenzimáticos (ELISAs), fluorometria e espectrofotometria utilizadas na análise da apoptose 8,19. Além disso, a relativa facilidade da análise de CF em contraste com os passos manuais pesados e pouco reprodutíveis de Western blots e ELISAs é vantajosa. A análise reprodutível, precisa e de alto rendimento da CF é, portanto, benéfica na pesquisa do câncer20.
A CF também permite a análise simultânea de parâmetros do ciclo celular de populações de células apoptóticas saudáveis e anormais21. Como a apoptose é um processo dinâmico, diferentes métodos podem produzir resultados variáveis e são dependentes do momento em que as células são colhidas22. A avaliação quantitativa simultânea de múltiplos parâmetros do fenótipo celular permite a detecção de subpopulações menores com alta acurácia, por exemplo, subpopulações celulares raras com baixa frequência de 0,01% podem ser detectadas23. A análise multiparamétrica da CF é especialmente útil, pois a morte apoptótica ocorre ao longo de um espectro de alterações bioquímicas precoces e tardias com células em vários pontos ao longo do contínuo apoptótico. Por exemplo, o uso de dupla coloração usando anexina V e iodeto de propídio na análise de CF de células apoptóticas permite a categorização de células apoptóticas precoces, células apoptóticas tardias e célulasmortas24. A detecção precisa de apoptose em múltiplos estágios evita erros de classificação e resultados falso-negativos. Assim, a análise multiparamétrica por CF melhora a especificidade geral da detecção de fenótipos celulares e evita o erro de classificação de populações menores. Além disso, a triagem celular por CF permite o isolamento de populações celulares com alta pureza para posterioranálise7.
A desvantagem da CF inclui o uso de células em suspensão, o que pode ser desafiador na análise tecidual, pois a desagregação do tecido em células pode alterar a função celular19. Além disso, a falta de padronização da configuração do instrumento de CF, análise de dados e relatórios de ensaios pode causar variação nos resultados19, enfatizando a necessidade de treinamento otimizado dos operadores de CF para executar, analisar e relatar dados. Por exemplo, a capacidade da CF de discriminar debris apoptóticos verdadeiros de núcleos apoptóticos requer i) configurações de aquisição adequadas, ii) o uso de esferas de calibração para identificar um pico de DNA diploide e iii) controles celulares negativos e positivos que são específicos para células3. Além disso, a análise multiparamétrica é limitada pelo número de detectores, e compensações ótimas precisam ser realizadas para evitar resultados inespecíficos e transbordamento de emissão fluorescente ao usar múltiplos reagentes fluorescentes25. Os avanços na tecnologia de instrumentos e fluoróforos melhoraram a detecção de parâmetros para 30 parâmetros12.
A identificação da morte celular apoptótica nem sempre é simples7, e biomarcadores sensíveis e específicos devem ser considerados. O Comitê de Nomenclatura de Morte Celular (DCNT) recomenda que mais de um ensaio seja utilizado para estudar e quantificar o processo de apoptose26. A análise microscópica para características apoptóticas clássicas26 também é recomendada para confirmar a apoptose e evitar resultados falso-positivos7. Quatro características bioquímicas cardinais que abrangem eventos apoptóticos precoces e tardios são: (1) perda de assimetria da membrana celular; (2) potencial de membrana mitocondrial de dissipação (ΔΨm); (3) ativação de caspases; e (4) danos ao DNA26.
Durante a apoptose precoce, a fosfatidilserina é exteriorizada para a membrana celular externa 27 e pode ser detectada pela anexina V marcada fluorescentemente com ficoeritrina27,28,29. Além disso, a dupla coloração com o corante fluorescente ligante de DNA, 7-aminoactinomicina D (7-AAD), distingue células vivas, apoptóticas tardias e mortas. Portanto, as células apoptóticas precoces são positivas para a anexina V e negativas para o 7-AAD, em contraste com as células apoptóticas tardias, que são positivas para ambos os corantes24.
Sinais apoptóticos intrínsecos induzem a dissipação do potencial de membrana mitocondrial (ΔΨm). A ruptura do ΔΨm provoca a liberação precoce de proteínas pró-apoptóticas do espaço intermembrana mitocondrial para o citosol27,29,30. A alteração no ΔΨm pode ser avaliada pela dupla coloração com o corante lipofílico carregado positivamente, éster etílico tetrametilrodamina, TMRE e 7-AAD. O corante TMRE se acumula dentro da membrana interna das mitocôndrias intactas quando o potencial de membrana é alto. As mitocôndrias despolarizadas demonstram diminuição da fluorescência. Células vivas com mitocôndrias polarizadas (membrana mitocondrial intacta) coram positivo para TMRE e negativo para 7-AAD. Células mortas com mitocôndrias despolarizadas são negativas para TMRE e positivas para 7-AAD31.
As caspases são uma família de proteases intracelulares que, quando ativadas, sinalizam e executam a apoptose26,27. As caspases do executor terminal (3,6,7) afetam a apoptose tardia 29,32,33. As atividades da caspase-3 e -7 podem ser medidas por um substrato fluorescentemente marcado que, quando clivado, liga-se ao DNA e emite um sinal fluorescente. Além disso, qualquer comprometimento da integridade da membrana celular pode ser avaliado pela coloração com 7-AAD. As células apoptóticas são positivas para o corante ligante de DNA, mas negativas para 7-AAD. Células mortas e apoptóticas tardias são positivas para ambos os corantes34.
A apoptose tardia é caracterizada por danos ao DNA27,29,35, que podem ser avaliados por ataxiatelangiectasia fosforilada, quinase mutada (ATM) e histona H2A.X. Quebras de DNA de fita dupla (DSBs) causam fosforilação de H2A.X. Anticorpos fluorescentemente marcados contra ATM e H2A. X pode determinar danos no DNA. Detecção negativa de ATM e H2A. X indica ausência de danos ao DNA, enquanto a detecção de ambos os corantes indica a presença de quebras de fita dupla no DNA36.
A actinomicina D é um potente indutor de apoptose e age ligando-se ao DNA para bloquear eventos de transcrição e tradução37. Este estudo teve como objetivo avaliar a apoptose bioquímica induzida pela actinomicina D na linhagem celular SiHa, analisando biomarcadores de apoptose em estágio inicial e tardio. Quatro biomarcadores bioquímicos de apoptose avaliaram as etapas sequenciais da cascata apoptótica que incluíram perda de assimetria da membrana celular, alteração no potencial de membrana mitocondrial, ativação de caspases terminais e danos ao DNA.
Protocolo
NOTA: Este protocolo descreve as etapas na preparação celular, enumeração celular, coloração celular e análise de células SiHa tratadas com actinomicina D usando ensaios comerciais de citometria de fluxo medidos e analisados em um citômetro de fluxo de bancada (Figura 2).
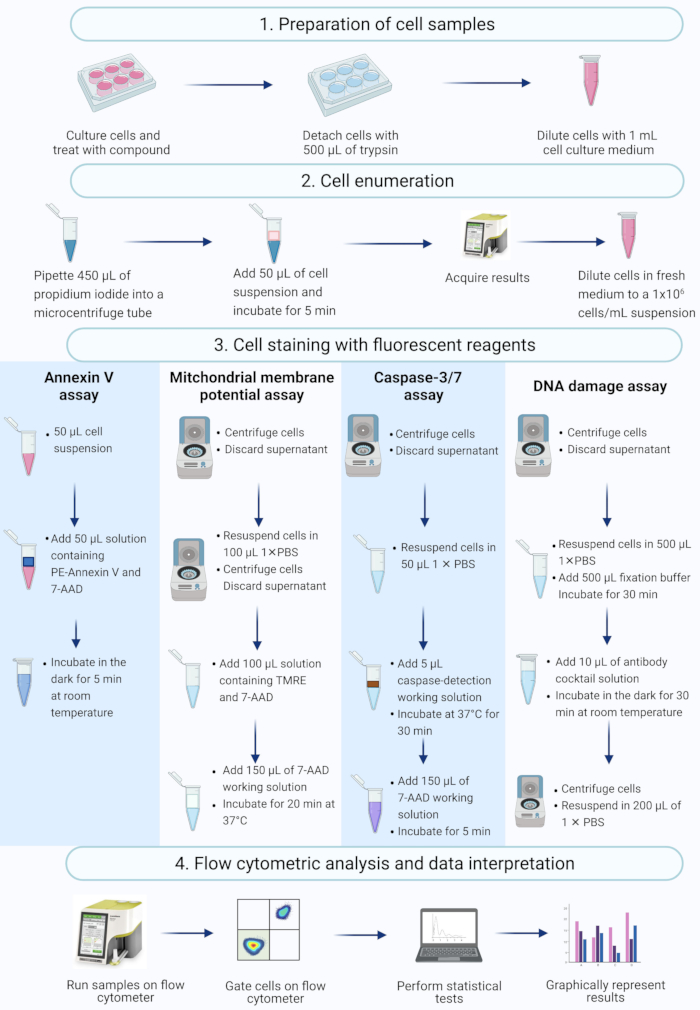
Figura 2: Fluxo de trabalho para a detecção de biomarcadores apoptóticos bioquímicos por citometria de fluxo. As células são cultivadas e tratadas conforme descrito na etapa 1.1 do protocolo. (1) As células são cultivadas, (2) enumeradas e (3) coradas com reagentes fluorescentes, e (4) analisadas por citômetro de fluxo de bancada. Os dados são analisados estatisticamente. Abreviações: 7-AAD = 7-aminoactinomicina D; PBS = solução salina tamponada com fosfato; PE = Ficoeritrina; TMRE = éster etílico de tetrametilrodamina. Clique aqui para ver uma versão maior desta figura.
1. Preparo de cultura celular e tratamentos para citometria de fluxo
NOTA: Certifique-se de que a técnica asséptica é seguida ao manusear culturas de células.
- Cultivar culturas celulares em ambiente de CO 2 umedecido a 37 °C com 5% de CO2. Certifique-se de que a cultura celular seja aproximadamente 70% confluente no frasco pai antes de passar as células para experimentos.
- Retire o meio do frasco, lave as células com 1x solução salina tamponada com fosfato (PBS) e adicione 500 μL de tripsina para desprender as células. Depois que as células começarem a arredondar e se desprender do frasco, bata bruscamente a base do frasco no banco para desprender as células. Em seguida, neutralizar a tripsina adicionando aproximadamente 5 mL de meio de cultura fresco suplementado com 10% de soro fetal de bezerro antes de contar as células.
- Células de sementes a 15.000 células/mL em 3 mL de meio de cultura celular em placa de cultura celular de 6 poços. Incubar as placas de cultura durante a noite a 37 °C com 5% de CO2 para permitir a fixação das células ao fundo do poço.
- Tratar as culturas experimentais com 100 ng/mL de actinomicina D e os controles meio e solvente com meio de cultura fresco e dimetilsulfóxido (DMSO), respectivamente, por 24 h. Recolher o meio gasto num tubo de 15 ml e lavar as células com 1x PBS. Em seguida, adicione a lavagem de 1x PBS ao tubo e, em seguida, adicione 500 μL de tripsina ao poço. Em seguida, neutralizar a tripsina adicionando 5 mL de meio de cultura fresco.
NOTA: (1) A incubação prolongada de tripsina ou a neutralização incompleta podem digerir as células e comprometer sua membrana celular, o que pode distorcer os resultados. Além disso, também pode alterar a assimetria da membrana celular e, assim, a acessibilidade à fosfatidilserina. (2) As células que se desprenderam e flutuaram para a superfície podem ser incluídas na análise subsequente centrifugando o meio removido a 300 × g por 5 min e ressuspendendo as células em meio de cultura fresco.
2. Enumeração de células utilizando o ensaio de viabilidade
- Pipetar 450 μL de iodeto de propídio em tubo de microcentrífuga. Adicionar 50 μL da suspensão celular ao tubo de microcentrífuga. Incubar o tubo à temperatura ambiente durante 5 min. Enumerar as células por citometria de fluxo (ver secção 4).
- Diluir todas as amostras para uma concentração de 1 × 106 células/mL com meio de cultura celular antes de prosseguir para os ensaios de apoptose.
3. Coloração de células para citometria de fluxo
NOTA: Condições estéreis não são necessárias para esta parte do protocolo.
- Detecção de externalização de fosfatidilserina usando Anexina V
- Adicionar 100 μL de suspensão celular num tubo de microcentrífuga. Adicionar 100 μL de uma mistura 1:1 de Anexina V conjugada fluorescente e reagente 7-AAD. Incubar à temperatura ambiente durante 20 minutos, protegido da luz.
- Análise da despolarização da membrana mitocondrial
- Centrifugar 100 μL da suspensão celular a 300 × g durante 5 min e eliminar o sobrenadante.
- Ressuspender as células em 1 mL de 1x PBS, adicionar 100 μL de solução corante TMRE a cada amostra e misturar a suspensão por retropipetagem suave.
- Incubar as células durante 20 min num ambiente de CO2 humidificado a 37 °C. Embrulhe as amostras em papel alumínio limpo para proteger da luz.
NOTA: O potencial de membrana mitocondrial é um marcador funcional que é sensível a pequenas alterações no ambiente celular. Portanto, as amostras devem ser incubadas e medidas em condições idênticas (temperatura, pH e tempo decorrido entre o início da incubação e a medição fluorescente) para manter a reprodutibilidade). Além disso, observe que a proteção inadequada das amostras contra a luz causa fotobranqueamento de fluoróforos, resultando em fluorescência falsamente baixa emitida. - Após a incubação, adicionar 5 μL da solução corante 7-AAD a cada amostra e misturar. Incubar durante 5 minutos à temperatura ambiente, protegido da luz.
- Detecção de caspase-3 e -7 terminais ativadas utilizando substrato de caspase DEVD
Observação : as seguintes soluções são preparadas antes de executar este ensaio.- Diluir o peptídeo ligante de DNA ligado ao DEVD em DMSO para uma proporção de 1:8 com 1x PBS estéril para tornar a solução de detecção de caspase funcional. Conservar a solução no gelo ou a 2-8 °C, protegida da luz.
NOTA: Cada amostra necessitará de 5 μL desta solução. - Adicione 2 μL de uma solução-mãe de 7-AAD a 148 μL de 1x PBS para tornar a solução de 7-AAD funcional. Conservar a solução no gelo ou a 2-8 °C, protegida da luz.
NOTA: Cada amostra necessitará de 150 μL desta solução. - Centrifugar 50 μL da suspensão celular durante 5 min a 300 × g. Descarte o sobrenadante. Ressuspender as células em 50 μL de 1x PBS, seguido por 5 μL da solução de trabalho de detecção de caspase. Homogeneizar.
- Soltar a tampa dos tubos e incubar por 30 min em ambiente umedecido de CO2 a 37 °C, protegido da luz. Adicionar 150 μL da solução de trabalho 7-AAD a cada amostra e misturar. Incubar durante 5 minutos à temperatura ambiente, protegido da luz.
- Diluir o peptídeo ligante de DNA ligado ao DEVD em DMSO para uma proporção de 1:8 com 1x PBS estéril para tornar a solução de detecção de caspase funcional. Conservar a solução no gelo ou a 2-8 °C, protegida da luz.
- Detecção de quebras de DNA de fita dupla e danos totais ao DNA
- Centrifugar 50 μL da suspensão celular durante 5 min a 300 × g. Descarte o sobrenadante.
- Ressuspender as células em 500 μL de 1x PBS. Adicionar 500 μL de um tampão de fixação à base de formaldeído e misturar. Incubar as amostras no gelo por 10 min.
- Centrifugar por 5 min a 300 × g e descartar o sobrenadante. Ressuspender as células em 90 μL de 1x PBS em um tubo de microcentrífuga. Adicionar 10 μL da solução de anticorpos ao tubo de microcentrífuga. Incubar à temperatura ambiente durante 30 minutos no escuro.
- Adicionar 100 μL de 1x PBS e centrifugar durante 5 min a 300 × g. Descarte o sobrenadante. Ressuspender as células em 200 μL de 1x PBS.
4. Executar amostras no citômetro de fluxo.
- Verifique o desempenho analítico do citômetro de fluxo executando o kit de verificação do sistema do instrumento. Não prossiga com amostras em execução até que todas as verificações sejam concluídas e aprovadas.
- Localize o ensaio desejado navegando pelo catálogo de ensaios pré-programados no instrumento e selecione Executar ensaio.
- Misturar a amostra por meio de uma pipetagem suave antes de carregar a amostra no citómetro de fluxo.
NOTA: A mistura adequada garante que as células permaneçam em suspensão e evita baixas contagens de células. - Primeiro, carregue uma amostra de controle negativo no citômetro de fluxo e selecione Executar (Ajustar configurações) para que o instrumento comece a aspirar a amostra e forneça uma visualização em tempo real dos eventos detectados. Consulte a Tabela de materiais para obter o nome e os detalhes do instrumento.
- Usando a visualização ao vivo, ajuste os limites de fluorescência e tamanho da célula e desenhe uma porta retangular ao redor da população celular. Arraste o marcador de limite para excluir detritos celulares. Selecione Avançar (Definir perfil de integridade) para continuar.
NOTA: É importante saber o tamanho das células. Arraste os controles deslizantes e observe as mudanças em como os eventos detectados são plotados na visualização em tempo real, pois isso informará uma seleção precisa dos limites. Se os detritos celulares não forem excluídos nesta fase, não poderão ser removidos nas análises pós-aquisição. - Toque e arraste os marcadores de quadrante para separar as populações de células e para que o instrumento plote os eventos detectados em tempo real. Use esses gráficos para orientar o usuário final sobre o posicionamento apropriado dos marcadores de quadrante. Selecione Avançar (Verificar amostras) para prosseguir para que o instrumento exiba um resumo das configurações. Depois de revisar as configurações, selecione Avançar (Verificar configurações) para aplicar essas configurações a todas as amostras do experimento.
NOTA: O instrumento fornece uma visualização ao vivo de 2 minutos das células usadas para ajustar as configurações do instrumento. Se esse prazo expirar, o instrumento liberará a amostra e as etapas 4.2.2-4.2.4 deverão ser repetidas. Retire a amostra e misture bem antes de recarregar e continuar. - Portar uma população de células desenhando uma região em torno da população de células. Ajuste os limites de fluorescência e tamanho da célula usando os controles deslizantes localizados nos eixos x e y da visualização ao vivo. Aplique essas configurações a todas as amostras do experimento.
- Misture a primeira amostra por meio de uma pipetagem suave e carregue a primeira amostra no citômetro de fluxo e selecione Avançar. Nomeie o exemplo e selecione Executar para que o sistema comece a executá-lo.
Observação : o instrumento só pode executar uma amostra por vez. - Depois que todas as amostras tiverem sido executadas, salve o experimento dando-lhe um título apropriado. Salve as configurações do experimento atual para recuperação em execuções futuras (opcional).
- Misturar a amostra por meio de uma pipetagem suave antes de carregar a amostra no citómetro de fluxo.
5. Análise pós-aquisição
- Se necessário, realize o ajuste fino dos portões ou marcadores de quadrante pós-aquisição.
- Localize o experimento que precisa de ajuste navegando no navegador de arquivos do sistema e abra o experimento.
- Toque na visualização em miniatura do enredo para ampliá-lo. Toque nos cantos superior esquerdo ou inferior direito do portão da cela para ajustar as dimensões do portão. Para ajustar os marcadores de quadrante, toque na intersecção das linhas verticais e horizontais para mover os marcadores como estão. Para ajustar o ângulo de qualquer linha, toque na linha e arraste a alça.
- Ajuste os marcadores (conforme descrito anteriormente nas etapas 4.1.3-4.1.4) conforme desejado e aplique essas configurações a todas as amostras do experimento selecionando o ícone de marca de seleção , marcando todas as amostras e selecionando Aceitar.
6. Análise estatística
- Executar testes em triplicata e executar uma análise de variância (ANOVA) com um teste post-hoc de Bonferroni para avaliar diferenças significativas entre as amostras tratadas e controles.
OBS: O teste estatístico de escolha depende do investigador e das variáveis analisadas.
Resultados
Os resultados de contagem e viabilidade celular (Figura 3) mostraram que 95,2% das células da amostra estavam vivas e 4,8% mortas. A concentração celular total na amostra original foi de 6,20 x 106 células/mL.
A Anexina V e o ensaio de morte celular (Figura 4) mostraram um aumento significativo (p < 0,0001) em células apoptóticas em células SiHa tratadas com 100 ng/mL de actinomicina D em comparação com os controles. Como a coloração de anexina V está aumentada nas células durante a apoptose em estágio inicial, esse achado sugere que 100 ng/mL de actinomicina D induziram apoptose em células SiHa.
O ensaio de potencial transmembrana eletroquímico mitocondrial (Figura 5) demonstrou uma diminuição significativa (p < 0,0001) nos perfis de saúde celular (vivo, despolarizado e vivo, despolarizado e morto, morto) entre actinomicina D, meio controle e controle solvente. Esses dados sugerem que 100 ng/mL de actinomicina D induziram despolarização mitocondrial em células SiHa.
O ensaio de caspase 3/7 (Figura 6) demonstrou ativação significativa (p < 0,0001) das caspases 3 e 7 em células SiHa tratadas com 100 ng/mL de actinomicina D em relação aos controles. Esses achados demonstram que 100 ng/mL de actinomicina D induziram apoptose em células SiHa.
O ensaio de danos ao DNA (Figura 7) mostrou que 100 ng/mL de actinomicina D induziram significativamente (p < 0,0001) marcadores de danos ao DNA, ATM e H2A. X, em células SiHa. Este achado sugere um aumento significativo no dano ao DNA em células SiHa tratadas com actinomicina D.
Os resultados de experimentos subótimos (Figura 8) demonstram considerações analíticas em todos os ensaios. A concentração celular afeta a precisão dos dados. Na Figura 8A, a contagem de células é inaceitavelmente baixa. As populações de células fechadas em todos os 4 quadrantes do dot plot têm baixa intensidade de sinal. O fabricante otimiza o ensaio para 300-700 células/μL no volume final da amostra. Este exemplo ilustra a importância de usar a concentração correta da amostra prescrita pelo fabricante.
Além disso, altas concentrações celulares também causaram resultados errôneos (Figura 8B). As culturas média e experimental demonstraram 99,95% e 100% de células vivas, respectivamente. A taxa de fluxo para ambos os ensaios excedeu a concentração otimizada do fabricante de 100-500 células/μL e exigiu diluição com 1x tampão de ensaio para evitar análises imprecisas.
A aglomeração celular deve ser evitada durante a preparação de culturas experimentais, uma vez que produz resultados falsos devido ao aumento dos índices de tamanho celular, como ilustrado no ensaio da Anexina V. A Figura 8C mostra um duplo problema de alta concentração celular que excede a instrução do fabricante e a aglomeração celular, como evidenciado por índices de tamanho de célula superiores a 4 no meio controle SiHa. A alta concentração celular é ilustrada pelo acasalamento das células formando um plano vermelho brilhante de células em culturas médias, demonstrando populações de células apoptóticas discordantemente altas.
A coloração prolongada das culturas pode resultar na ligação inespecífica de proteínas e resultar em resultados falsos, como demonstrado pelo ensaio da Anexina V. A Figura 8D demonstra resultados semelhantes para as culturas média e experimental devido à coloração prolongada.
O manuseio deficiente da amostra, a tripsinização prolongada das células aderentes, a pipetagem vigorosa durante as etapas de lavagem e as etapas de centrifugação prolongadas e de alta velocidade causam lise celular e altas quantidades de detritos celulares. Na Figura 8E, as culturas analisadas pelo ensaio da caspase 3/7 demonstram aumento de restos celulares evidenciado por um pequeno índice de tamanho celular (<2,2 cell size index). Portanto, deve-se ter cuidado ao preparar amostras para aquisição de dados.
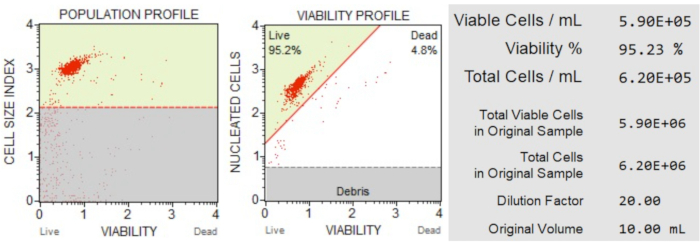
Figura 3: Contagem de células e ensaio de viabilidade. O perfil populacional separa detritos de células vivas e mortas. O gráfico de pontos bidimensional é fechado e divide as populações de células vivas e mortas. O painel de informações fornece dados quantitativos sobre a contagem de células, a porcentagem do total de células viáveis e o número total de células viáveis na amostra. Esses dados podem ser usados para padronizar a contagem de células em todas as amostras para análises subsequentes de apoptose. Clique aqui para ver uma versão maior desta figura.
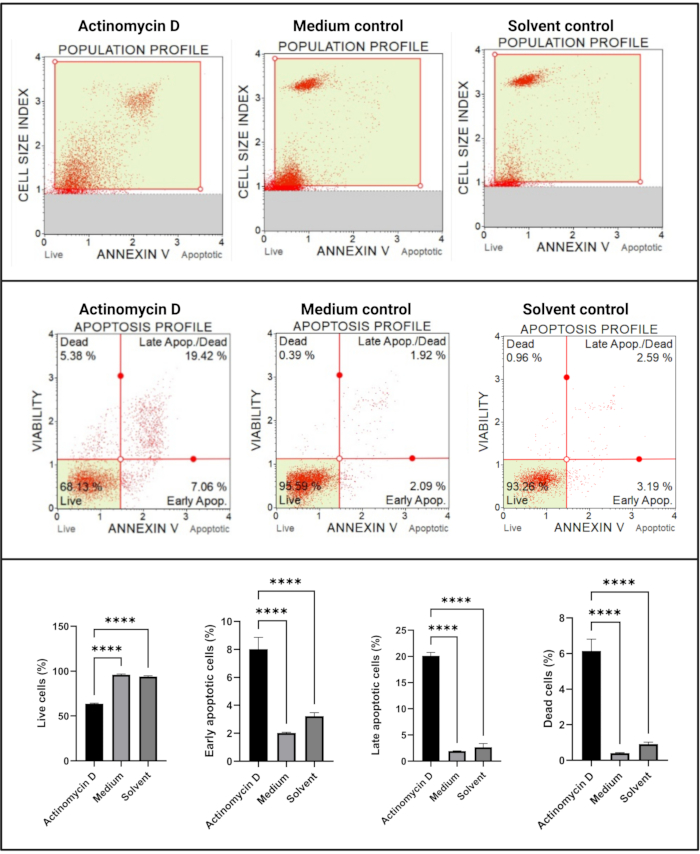
Figura 4: Ensaio anexo V. Todas as amostras apresentam parâmetros de sincronização idênticos, e a análise estatística de cada subpopulação revela um aumento significativo da apoptose em células tratadas com actinomicina D. Todos os ensaios foram realizados em três experimentos independentes, e cada experimento foi ensaiado em triplicata. Os dados são apresentados como média ± DP, sendo considerado estatisticamente significante p < 0,05. p < 0,0001. Clique aqui para ver uma versão maior desta figura.
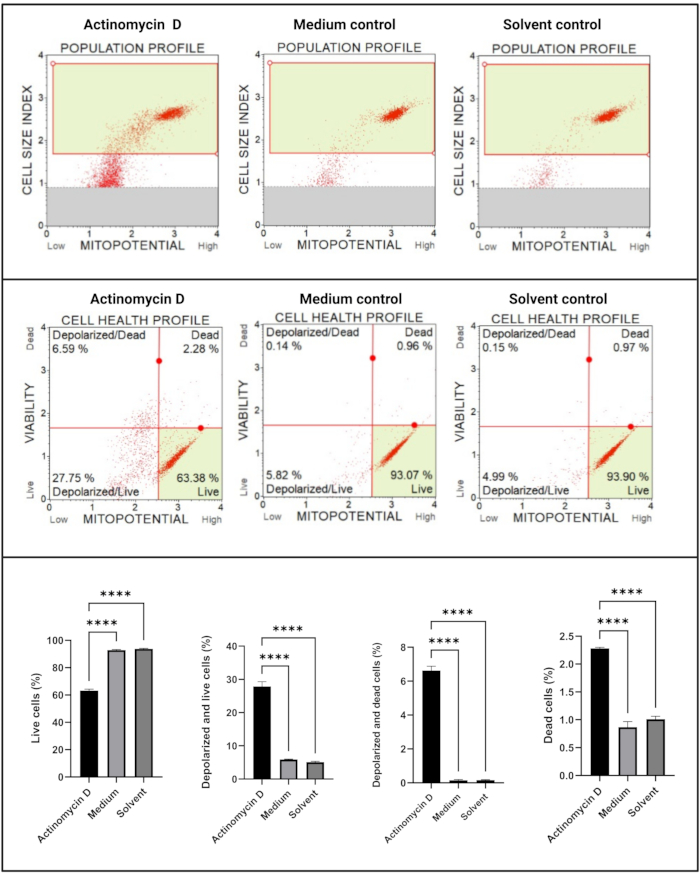
Figura 5: Ensaio eletroquímico de potencial transmembrana mitocondrial. Todas as amostras apresentam parâmetros de gating idênticos, e a análise estatística de cada subpopulação revela perturbação significativa no potencial de membrana mitocondrial em células tratadas com actinomicina D. Todos os ensaios foram realizados em três experimentos independentes, e cada experimento foi ensaiado em triplicata. Os dados são apresentados como média ± DP, sendo considerado estatisticamente significante p < 0,05. p < 0,0001. Clique aqui para ver uma versão maior desta figura.
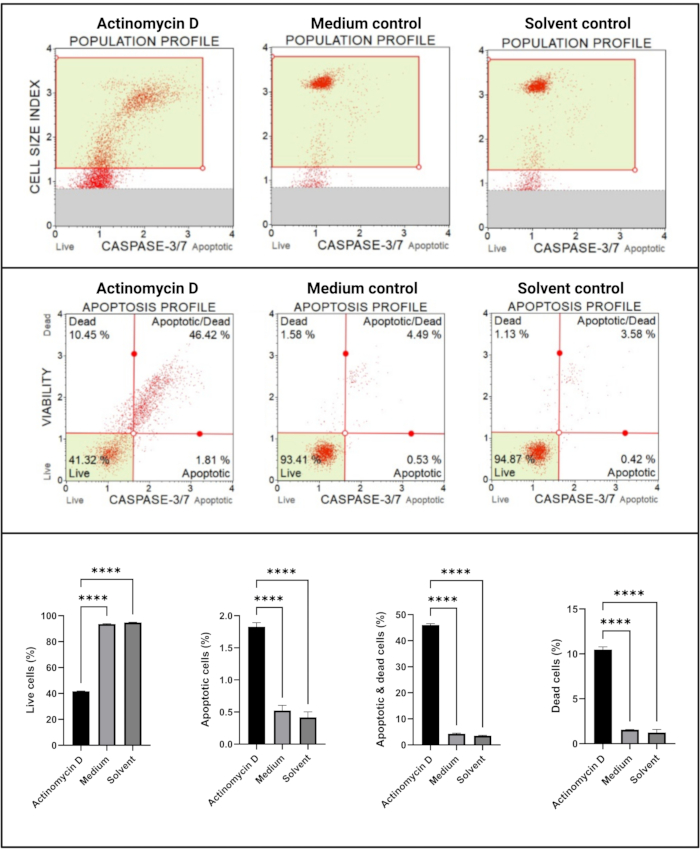
Figura 6: Ensaio de detecção de caspase 3/7. Todas as amostras apresentam parâmetros de gating idênticos, e a análise estatística de cada subpopulação revela um aumento significativo na atividade da caspase 3/7 em células tratadas com actinomicina D. Todos os ensaios foram realizados em três experimentos independentes, e cada experimento foi ensaiado em triplicata. Os dados são apresentados como média ± DP, sendo considerado estatisticamente significante p < 0,05. p < 0,0001. Clique aqui para ver uma versão maior desta figura.
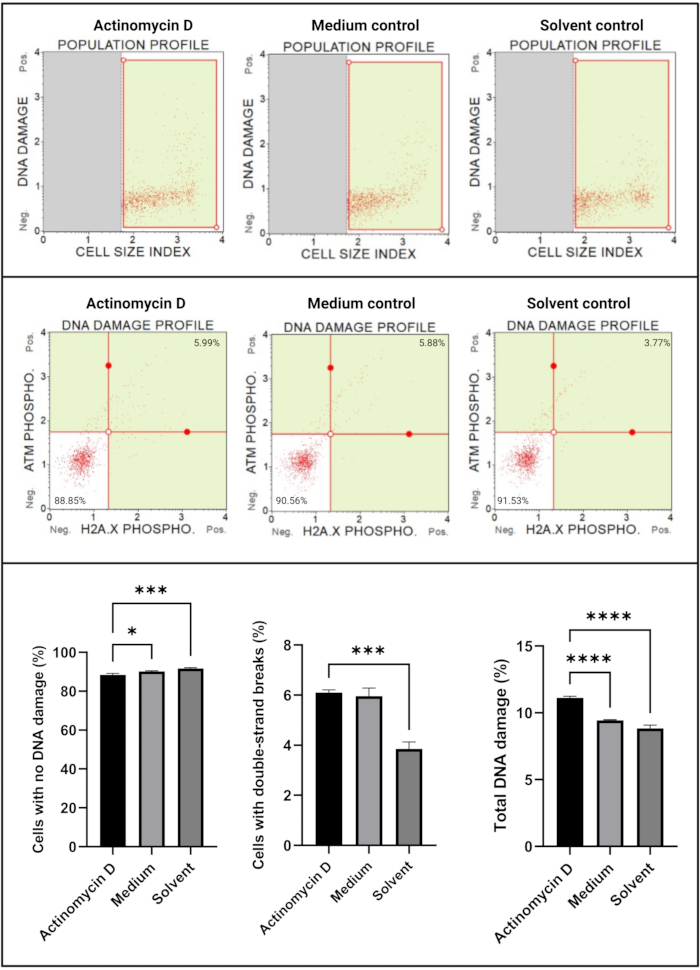
Figura 7: Ensaio de danos ao DNA. Todas as amostras apresentam parâmetros de gating idênticos, e a análise estatística de cada subpopulação revela um aumento significativo nos danos ao DNA de fita dupla e danos totais ao DNA em células tratadas com actinomicina D. Todos os ensaios foram realizados em três experimentos independentes, e cada experimento foi ensaiado em triplicata. Os dados são apresentados como média ± DP, sendo considerado estatisticamente significante p < 0,05. * p < 0,05; p < 0,001; p < 0,0001. Clique aqui para ver uma versão maior desta figura.
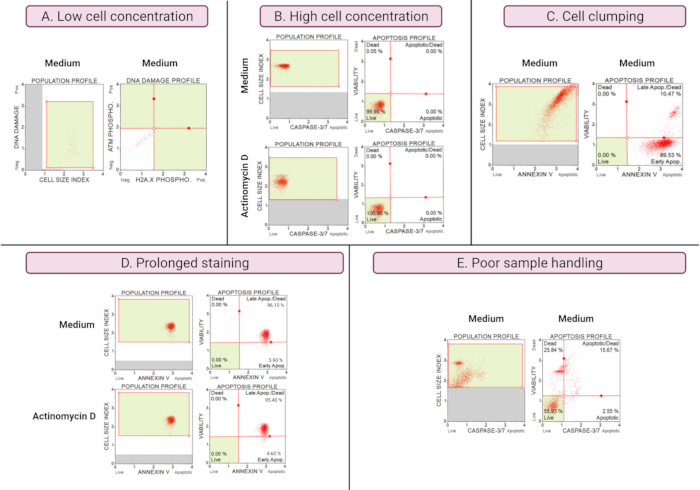
Figura 8: Condições experimentais subótimas produzem resultados ruins . (A) Baixa concentração de células, (B) alta concentração de células, (C) aglomeração e agregação celular evidente pelo alto índice de tamanho celular, (D) coloração prolongada de amostras celulares evidente pelo aumento da coloração positiva em ambas as amostras e (E) má manipulação das amostras evidente pelo aumento de detritos celulares (índice de tamanho celular < 2.2). Clique aqui para ver uma versão maior desta figura.
Discussão
Neste estudo, células SiHa tratadas com actinomicina D analisadas por FC revelaram biomarcadores precoces e tardios significativos para apoptose. Condições subótimas para preparo, enumeração e coloração celular identificaram resultados imprecisos, enfatizando a necessidade de estreita aderência às instruções do fabricante ao realizar a CF.
Este estudo da apoptose por meio da identificação precoce e tardia de biomarcadores está de acordo com as diretrizes da DCNT1 para investigação de apoptose. Culturas de SiHa tratadas com actinomicina D demonstraram biomarcadores positivos para estágios apoptóticos precoce e tardio. O ensaio de Anexina V/PI e o ensaio de permeabilidade mitocondrial mostraram que a actinomicina D induziu um padrão PS-flip e dissipação da transição da membrana mitocondrial, respectivamente. Uma vez que as células apoptóticas atingem o ponto de não retorno induzido pela perturbação mitocondrial, as caspases terminais são ativadas 3,7. A ativação das caspases terminais 3 e 7 observada neste estudo indica apoptose tardia. Além disso, a ativação da caspase terminal causa clivagem internucleossômica do DNA e extensa fragmentação do DNA, o que classicamente tem sido relatado como um padrão de escada observado por eletroforese em gel28,38.
Os danos nucleares com o ATM e H2A. O ensaio de danos ao DNA do X FC mostrou quebras de fita dupla no DNA e danos totais ao DNA. Estes resultados confirmaram o dano nuclear apoptótico clássico induzido pela caspase a jusante (cariorrexe e cariorrlise) em culturas experimentais. O uso de múltiplos biomarcadores de citometria de fluxo detectou, assim, os eventos sequenciais em múltiplos estágios na apoptose e identificou de forma precisa e reprodutível populações celulares nos estágios apoptóticos iniciais e tardios. Esses achados são consistentes com as conhecidas características pró-apoptóticas da actinomicina D no tratamento do câncer em humanos 37,39,40,41 e apoiam ainda mais o uso da actinomicina D como controle positivo em experimentos de cultura de células FC que investigam apoptose.
O confinamento das populações celulares neste estudo foi informado por meio negativo e controles solventes, que separaram células apoptóticas de células saudáveis. Alternativamente, uma mistura de populações de controles positivos e negativos também pode ser usada para definir populações de células vivas e apoptóticas para estabelecer portões populacionais celulares 7,9. Uma vez que os estados celulares doentes e saudáveis são definidos e controlados, as configurações do modelo podem ser aplicadas a todas as culturas experimentais e de controle subsequentes.
A adesão rigorosa ao protocolo de CF é essencial para evitar falsos resultados. Durante a otimização do protocolo, os seguintes problemas foram observados: (1) baixa concentração celular, (2) alta concentração celular, (3) aglomeração celular, (4) coloração prolongada e (5) mau manuseio da amostra. Esses problemas podem ser evitados pela estrita adesão aos requisitos otimizados do protocolo. Isso enfatiza a natureza crucial das etapas pré-analíticas e analíticas para que a CF obtenha dados precisos. Durante a preparação celular, tripsinização, pipetagem, centrifugação e diluições devem ser conduzidas com cuidado. A tripsinização excessiva e a pipetagem vigorosa podem resultar em cisalhamento químico e mecânico das células, respectivamente. A centrifugação prolongada e de alta velocidade pode resultar em degradação celular e altas contagens de detritos celulares. A concentração celular ideal é necessária para minimizar a aquisição incorreta de eventos celulares. Portanto, as suspensões celulares primárias devem ser diluídas para obter a concentração celular ótima.
Além disso, ao manusear amostras, deve-se tomar cuidado para evitar aglomeração e fragmentação celular e garantir que as células permaneçam em suspensão durante a análise. O manuseio da amostra para evitar a aglomeração de células permite o fluxo de células laminares únicas, evita o bloqueio mecânico da tubulação capilar do instrumento e reduz os índices espúrios de tamanho de células grandes. Outra ressalva é proteger as culturas contra a luz para evitar foto-oxidação e extinção dos fluoróforos nos ensaios para evitar resultados falso-negativos. Deve-se tomar cuidado para garantir uma exposição mínima à luz na etapa de coloração das células e etapas subsequentes de processamento. Além disso, tempos prolongados de imunomarcação podem resultar em resultados falso-positivos, uma vez que as proteínas são coradas não especificamente. Portanto, a adesão aos períodos de incubação prescritos pelo fabricante é importante.
Em resumo, a CF pode detectar com precisão a apoptose e discriminar entre biomarcadores de apoptose precoce e tardia em cultura celular. Além disso, os avanços na tecnologia levaram à fabricação de citômetros de fluxo de bancada para cientistas não especialistas estudarem a saúde celular e vias complexas de sinalização intracelular.
Divulgações
A Luminex® Corporation gentilmente forneceu taxas de processamento de artigos.
Agradecimentos
O estudo foi financiado pela National Research Foundation (NRF) e pelo South African Medical Research Council (SAMRC). Gostaríamos de agradecer ao Serviço Nacional de Laboratório de Saúde (NHLS) pela compra do Analisador de Células de Goiaba. Todas as figuras desta publicação foram criadas com Biorender.com.
Materiais
| Name | Company | Catalog Number | Comments |
| 6-well plates | Lasec | P1PLA044C-000006 | |
| Dimethyl Sulfoxide | Sigma-Aldrich | D8418 | |
| DMEM | ThermoFisher | 41966052 | |
| Glutamine | Sigma-Aldrich | P10-040500 | |
| Guava Muse Cell Analyzer | Luminex | 0500-3115 | |
| Microcentrifuge tubes/Eppendorf | Merck | EP0030122208-200EA | |
| Muse Annexin V kit | Merck | MCH100105 | |
| Muse Caspase-3/7 kit | Merck | MCH100108 | |
| Muse Count and Viability kit | Merck | MCH600103 | |
| Muse DNA Damage kit | Merck | MCH200107 | |
| Muse MitoPotential kit | Merck | MCH100110 | |
| PBS Buffer | ThermoFisher | 70013065 | |
| Pen-strep | Sigma-Aldrich | P4333 | |
| SiHa cells | ATCC | CRL-1550 | |
| T25 culture flasks | Sigma-Aldrich | C6231 | |
| Trypsin | Pan Biotech | P10-040500 |
Referências
- Galluzzi, L., et al. Molecular mechanisms of cell death: Recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death and Differentiation. 25 (3), 486-541 (2018).
- Kerr, J. F., Wyllie, A. H., Currie, A. R. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. British journal of cancer. 26 (4), 239-257 (1972).
- Riccardi, C., Nicoletti, I. Analysis of apoptosis by propidium iodide staining and flow cytometry. Nature Protocols. 1 (3), 1458-1461 (2006).
- Edinger, A. L., Thompson, C. B. Death by design: apoptosis, necrosis and autophagy. Current Opinion in Cell Biology. 16 (6), 663-669 (2004).
- Arends, M. J., Morris, R. G., Wyllie, A. H. Apoptosis. The role of the endonuclease. The American journal of pathology. 136 (3), 593-608 (1990).
- Majno, G., Joris, I. Apoptosis, oncosis, and necrosis. An overview of cell death. Am J Pathol. 146 (1), 3-15 (1995).
- Darzynkiewicz, Z., Traganos, F., Al-Rubeai, M. . Apoptosis. , 33-73 (1998).
- Wlodkowic, D., Skommer, J., Darzynkiewicz, Z. Flow cytometry-based apoptosis detection. Methods in molecular biology. 559, 19-32 (2009).
- . Introduction to Flow Cytometry Basics Available from: https://www.bio-rad-antibodies.com/introduction-to-flow-cytometry.html (2021)
- Telford, W. G., Komoriya, A., Packard, B. Z. Detection of localized caspase activity in early apoptotic cells by laser scanning cytometry. Cytometry. 47 (2), 81-88 (2002).
- Castedo, M., et al. Quantitation of mitochondrial alterations associated with apoptosis. J Immunol Methods. 265 (1-2), 39-47 (2002).
- McKinnon, K. M. Flow Cytometry: An Overview. Current protocols in immunology. 120, 1-11 (2018).
- Macey, M. G. Flow cytometry: principles and clinical applications. Med Lab Sci. 45 (2), 165-173 (1988).
- Darzynkiewicz, Z., et al. Features of apoptotic cells measured by flow cytometry. Cytometry. 13 (8), 795-808 (1992).
- Darzynkiewicz, Z., et al. Cytometry in cell necrobiology: Analysis of apoptosis and accidental cell death (necrosis). Cytometry. 27 (1), 1-20 (1997).
- Ormerod, M. G. The study of apoptotic cells by flow cytometry. Leukemia. 12 (7), 1013-1025 (1998).
- van Engeland, M., Nieland, L. J., Ramaekers, F. C., Schutte, B., Reutelingsperger, C. P. Annexin V-affinity assay: a review on an apoptosis detection system based on phosphatidylserine exposure. Cytometry. 31 (1), 1-9 (1998).
- Vermes, I., Haanen, C., Reutelingsperger, C. Flow cytometry of apoptotic cell death. Journal of Immunological Methods. 243 (1), 167-190 (2000).
- Jahan-Tigh, R. R., Ryan, C., Obermoser, G., Schwarzenberger, K. Flow cytometry. J Invest Dermatol. 132 (10), 1-6 (2012).
- Lövborg, H., Gullbo, J., Larsson, R. Screening for apoptosis-classical and emerging techniques. Anti-cancer drugs. 16 (6), 593-599 (2005).
- Vorobjev, I. A., Barteneva, N. S. Multi-parametric imaging of cell heterogeneity in apoptosis analysis. Methods. 112, 105-123 (2017).
- Telford, W. G., Komoriya, A., Packard, B. Z. Multiparametric analysis of apoptosis by flow and image cytometry. Methods in molecular biology. 263, 141-160 (2004).
- Kagami, S., Rizzo, H. L., Lee, J. J., Koguchi, Y., Blauvelt, A. Circulating Th17, Th22, and Th1 cells are increased in psoriasis. J Invest Dermatol. 130 (5), 1373-1383 (2010).
- . Muse® Annexin V & Dead Cell Kit Available from: https://www.luminexcorp.com/muse-annexin-v-dead-cell-kit/ (2019)
- Roederer, M. Spectral compensation for flow cytometry: visualization artifacts, limitations, and caveats. Cytometry. 45 (3), 194-205 (2001).
- Kroemer, G., et al. Classification of cell death: recommendations of the Nomenclature Committee on Cell Death. Cell Death and Differentiation. 12 (2), 1463-1467 (2005).
- Apoptosis assays and markers guide. Abcam Available from: https://www.abcam.com/kits/apoptosis-assays (2021)
- Vermes, I., Haanen, C., Steffens-Nakken, H., Reutelingsperger, C. A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V. Journal of Immunological Methods. 184 (1), 39-51 (1995).
- Elmore, S. Apoptosis: A Review of Programmed Cell Death. Toxicologic Pathology. 35 (4), 495-516 (2007).
- Saelens, X., et al. Toxic proteins released from mitochondria in cell death. Oncogene. 23 (16), 2861-2874 (2004).
- Muse™ MitoPotential Kit User's Guide. Luminex Corporation Available from: https://www.luminexcorp.com/muse-mitopotential-kit (2013)
- McIlwain, D. R., Berger, T., Mak, T. W. Caspase functions in cell death and disease. Cold Spring Harbor Perspectives in Biology. 5 (4), 008656 (2013).
- Wigdal, S. S., Kirkland, R. A., Franklin, J. L., Haak-Frendscho, M. Cytochrome c release precedes mitochondrial membrane potential loss in cerebellar granule neuron apoptosis: lack of mitochondrial swelling. Journal of Neurochemistry. 82 (5), 1029-1038 (2002).
- Muse® Caspase-3/7 Kit. Luminex Corporation Available from: https://www.luminexcorp.com/muse-caspase-3-7-kit/#overview (2019)
- Häcker, G. The morphology of apoptosis. Cell and Tissue Research. 301 (1), 5-17 (2000).
- Muse® Multi-Color DNA Damage Kit User's Guide. Luminex Corporation Available from: https://www.luminexcorp.com/muse-multi-color-dna-damage-kit/#overview (2020)
- Kleeff, J., Kornmann, M., Sawhney, H., Korc, M. Actinomycin D induces apoptosis and inhibits growth of pancreatic cancer cells. International journal of cancer. 86 (3), 399-407 (2000).
- Wlodkowic, D., Skommer, J., Darzynkiewicz, Z. Cytometry of apoptosis. Historical perspective and new advances. Experimental oncology. 34 (3), 255-262 (2012).
- Szeberenyi, J. The effect of actinomycin D on RNA metabolism in human cells. Biochem Mol Biol Educ. 34 (1), 50-51 (2006).
- Ginell, S., Lessinger, L., Berman, H. M. The crystal and molecular structure of the anticancer drug actinomycin D--some explanations for its unusual properties. Biopolymers. 27 (5), 843-864 (1988).
- Hou, M. H., Robinson, H., Gao, Y. G., Wang, A. H. Crystal structure of actinomycin D bound to the CTG triplet repeat sequences linked to neurological diseases. Nucleic Acids Res. 30 (22), 4910-4917 (2002).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados