Method Article
ניתוח ציטומטרי זרימה של סמנים ביולוגיים אפופטוטיים בתאי סרטן צוואר הרחם SiHa שטופלו ב- Actinomycin D
Summary
אפופטוזיס יכול להיות מאופיין על ידי ניתוח ציטומטרי זרימה של סמנים ביולוגיים אפופטוטיים מוקדמים ומאוחרים. קו תאי סרטן צוואר הרחם, SiHa, נותח עבור סמנים ביולוגיים אפופטוזיס לאחר טיפול עם Actinomycin D באמצעות ציטומטר זרימה benchtop.
Abstract
סמנים ביולוגיים של אפופטוזיס נחקרו בתאי סרטן צוואר הרחם SiHa שטופלו באקטינומיצין D באמצעות ציטומטר זרימה benchtop. סמנים ביולוגיים מוקדמים (Annexin V ופוטנציאל הממברנה המיטוכונדריאלית) וסמנים ביולוגיים מאוחרים (קספזות 3 ו-7, ונזק לדנ"א) של אפופטוזיס נמדדו בתרביות ניסוי וביקורת. תרביות הודגרו במשך 24 שעות באינקובטור לח ב 37 מעלות צלזיוס עם 5% CO2. לאחר מכן נותקו התאים באמצעות טריפסין ונמנו באמצעות בדיקת ספירת תאים ציטומטרית של זרימה. תאים נותחו עוד יותר עבור אפופטוזיס באמצעות בדיקת Annexin V, בדיקת פוטנציאל טרנסממברנה אלקטרוכימית מיטוכונדריאלית, בדיקת קספז 3/7 ובדיקת נזק ל- DNA. מאמר זה מספק סקירה כללית של אפופטוזיס וציטומטריית זרימה מסורתית, ומפרט פרוטוקולים ציטומטריים של זרימה לעיבוד וניתוח תאי SiHa. התוצאות מתארות נתוני ניסוי חיוביים, שליליים ותת-אופטימליים. כמו כן נדונו פרשנות וסייגים בביצוע אנליזה ציטומטרית של אפופטוזיס באמצעות פלטפורמה אנליטית זו. ניתוח ציטומטרי זרימה מספק מדידה מדויקת של סמנים ביולוגיים מוקדמים ומאוחרים לאפופטוזיס.
Introduction
אפופטוזיס, המסווג כמוות תאי מתוכנתמסוג 1 1, מבטיח שיווי משקל בין התפשטות תאים למוות תאי2. אפופטוזיס חיוני במהלך התפתחות האדם, לאחר פציעה, ולמניעת מחלות כגון סרטן3. מסלולי איתות אפופטוטיים פנימיים וחיצוניים למוות תאי4 גורמים לשינויים תוך-תאיים ביוכימיים ומורפולוגיים רציפים 2,5,6. ניתן לזהות תכונות אפופטוטיות מורפולוגיות באמצעות מיקרוסקופיה, ואת ההפרעה הביוכימית ניתן לנתח על ידי בדיקות ביוכימיות, כולל ציטומטריית זרימה (FC)7.
ניתוח ציטומטרי של זרימה לזיהוי אפופטוזיס והבנת המנגנונים התוך-תאיים הקשורים התפתח בשני העשורים האחרונים8. FC היא מתודולוגיה מדעית שמנתחת תאים בנוזל שעובר דרך לייזרים חד-ערוציים או רב-ערוציים (איור 1)9,10,11. התאים בנוזל ממוקדים לקובץ יחיד על ידי מערכת הפלואידיקה של ציטומטר הזרימה באמצעות מיקוד הידרודינמי. כאשר תאים עוברים דרך הלייזר, האור מתפזר או נפלט מהתאים. האור המפוזר יכול להיות בכיוון קדימה (פיזור קדימה) או לכיוון הצד (פיזור צד) ומספק מידע על גודל התא, גרעיניות התא או מבנים פנימיים, בהתאמה.
בנוסף, ריאגנטים פלואורסצנטיים, כגון צבעים פלואורסצנטיים או נוגדנים המסומנים בפלואורופורים, מזהים מבנים או מולקולות ספציפיים על פני השטח או תוך תאיים. כאשר הלייזר מעורר את הפלואורופורים, האור נפלט באורך גל מסוים. גלאים – בדרך כלל צינורות מכפיל אור – מכמתים את האור המפוזר והנפלט מדגימות תאים. הגלאים מייצרים זרם הניתן לכימות הפרופורציונלי לפיזור האור ולפליטת הפלואורסצנטיות. הפלט האלקטרוני מומר לאותות דיגיטליים על ידי תוכנת מחשוב לזיהוי אוכלוסיות תאים בהתבסס על גודל התא, גרעיניות התא והפלואורסצנטיות התאית היחסית של מולקולות המסומנות בפלואורופור 9,12,13.
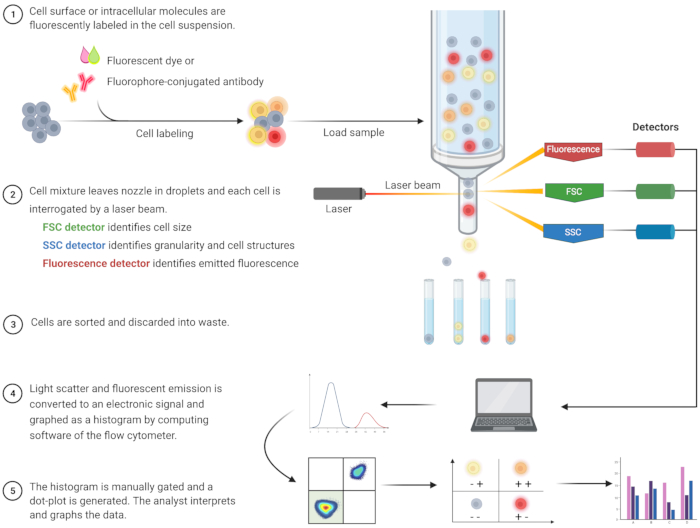
איור 1: סכמטי המתאר את הפעולה הטכנית ואת זרימת העבודה של ציטומטריית זרימה מסורתית. תאים מוכתמים בריאגנטים פלואורסצנטיים ונבדקים על ידי לייזר. אותות הפלואורסצנטיות הנוצרים מזוהים ומומרים לפלט אלקטרוני, אשר עובר דיגיטציה נוספת ומנותח על ידי תוכנות מחשב ותוכנות סטטיסטיות. קיצורים: FSC = פיזור קדימה; SSC = פיזור צד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
FC משמש הן במחקר והן באבחון בריאות. שתי המטרות של FC בנקרוביולוגיה הן הבהרת התכונות המולקולריות והתפקודיות של מוות תאי וההבחנה בין מצבים שונים של מוות תאי 14,15,16,17,18. יישומי FC כוללים ספירת תאים, מיון אוכלוסיות תאים, אימונופנוטיפ, זיהוי סמנים ביולוגיים (למשל, סמנים ביולוגיים של אפופטוזיס), מחקרי רעילות והנדסת חלבונים12. בנוסף, FC מיושם בדרך כלל לאבחון רפואי כדי לסייע באבחון וניטור של חולים עם ממאירויות המטולוגיות. ההתקדמות במכשור, זיהוי פלואורופור ומערכות גלאים מרחיבה את יישומי FC וכוללים ציטומטריית הדמיה, ציטומטריית מסה וציטומטריה ספקטרלית עם יישומי מחקר רחבים יותר12.
הניתוח הציטומטרי של אפופטוזיס מספק יתרונות על פני טכניקות מסורתיות המשמשות להערכת בריאות התא. FC יכול לנתח תאים בודדים רבים במדגם הטרוגני במהירות ובשחזור כדי להעריך אפופטוזיס 3,5. היכולת של FC לספק מידע כמותי על פנוטיפים של תאים על בסיס תא בודד, ולהימנע מאנליזה בתפזורת, מציעה רגישות גבוהה יותר לבדיקות אימונוסורבנטיות מערביות, בדיקות אימונוסורבנטיות מקושרות אנזימים (ELISAs), פלואורומטריה וספקטרופוטומטריה המשמשות בניתוח אפופטוזיס 8,19. יתר על כן, הקלות היחסית של ניתוח FC בניגוד לצעדים הידניים המסורבלים והגרועים הניתנים לשחזור של כתמים מערביים ו- ELISAs היא יתרון. ניתוח השחזור, המדויק ובתפוקה הגבוהה של FC מועיל אפוא בחקר הסרטן20.
FC מתיר גם ניתוח סימולטני של פרמטרים של מחזור התא עבור אוכלוסיות תאים אפופטוטיים בריאות ולא תקינות21. מכיוון שאפופטוזיס הוא תהליך דינמי, שיטות שונות יכולות לייצר תוצאות משתנות ותלויות בנקודת הזמן שבה קוצרים את התאים22 . הערכה כמותית סימולטנית של פרמטרים מרובים של פנוטיפ התא מאפשרת זיהוי של תת-אוכלוסיות קטנות בדיוק גבוה, למשל, תת-קבוצות תאים נדירות בתדירות נמוכה של 0.01% ניתנות לזיהוי23. ניתוח FC רב-פרמטרי שימושי במיוחד מכיוון שמוות אפופטוטי מתרחש לאורך ספקטרום של שינויים ביוכימיים מוקדמים ומאוחרים עם תאים בנקודות שונות לאורך הרצף האפופטוטי. לדוגמה, השימוש בצביעה כפולה באמצעות Annexin V ו-propidium iodide באנליזה FC של תאים אפופטוטיים מאפשר סיווג של תאים אפופטוטיים מוקדמים, תאים אפופטוטיים מאוחרים ותאים מתים24. זיהוי מדויק של אפופטוזיס בשלבים מרובים מונע סיווג שגוי ותוצאות שליליות שגויות. לפיכך, ניתוח מולטי-פרמטרי על ידי FC משפר את הספציפיות הכוללת של זיהוי פנוטיפים של תאים ומונע סיווג שגוי של אוכלוסיות קטנות. יתר על כן, מיון תאים על ידי FC מאפשר בידוד של אוכלוסיות תאים עם טוהר גבוה לניתוח הבא7.
החיסרון של FC כולל את השימוש בתאים בתרחיף, דבר שיכול להיות מאתגר בניתוח רקמות, שכן פירוק של רקמה לתאים עלול לשנות את תפקוד התא19. יתר על כן, היעדר סטנדרטיזציה של הגדרת מכשירי FC, ניתוח נתונים ודוחות בדיקה עלול לגרום לשונות בתוצאות19, תוך הדגשת הצורך בהכשרה אופטימלית של מפעילי FC לביצוע, ניתוח ודיווח נתונים. לדוגמה, היכולת של FC להבחין בין פסולת אפופטוטית אמיתית לבין גרעינים אפופטוטיים דורשת א) הגדרות רכישה נאותות, ב) שימוש בחרוזי כיול לזיהוי שיא DNA דיפלואידי, ו-3) בקרות תאים שליליות וחיוביות שהן ספציפיות לתא3. יתר על כן, ניתוח מולטי-פרמטרי מוגבל על ידי מספר הגלאים, ויש לבצע פיצוי אופטימלי כדי למנוע תוצאות לא ספציפיות וזליגה של פליטה פלואורסצנטית בעת שימוש בריאגנטים פלואורסצנטיים מרובים25. ההתקדמות בטכנולוגיית המכשור והפלואורופור שיפרה את זיהוי הפרמטרים ל-30 פרמטרים12.
זיהוי מוות תאי אפופטוטי אינו תמיד פשוט7, ויש לקחת בחשבון סמנים ביולוגיים רגישים וספציפיים. ועדת המינוח למוות תאי (NCCD) ממליצה להשתמש ביותר מבדיקה אחת כדי לחקור ולכמת את תהליך אפופטוזיס26. ניתוח מיקרוסקופיה עבור תכונות אפופטוטיות קלאסיות26 מומלץ גם לאשר אפופטוזיס ולמנוע תוצאות חיוביות כוזבות7. ארבע תכונות ביוכימיות קרדינליות המשתרעות על פני אירועים אפופטוטיים מוקדמים ומאוחרים הן: (1) אובדן אסימטריה של קרום התא; (2) פוטנציאל פיזור הממברנה המיטוכונדריאלית (ΔΨm); (3) הפעלת קספז; (4) נזק לדנ"א26.
במהלך אפופטוזיס מוקדם, פוספטידיל-סרין מוחצן לקרום התא החיצוני 27 וניתן לזהותו על ידי Annexin V המסומן באופן פלואורסצנטי עם פיקואריתרין27,28,29. יתר על כן, צביעה כפולה עם צבע קושר DNA פלואורסצנטי, 7-aminoactinomycin D (7-AAD), מבדילה בין תאים חיים, אפופטוטיים מאוחרים ומתים. לכן, תאים אפופטוטיים מוקדמים כתם חיובי עבור Annexin V ושלילי עבור 7-AAD, בניגוד לתאים אפופטוטיים מאוחרים, כי כתם חיובי עבור שני הצבעים24.
אותות אפופטוטיים פנימיים גורמים לפיזור פוטנציאל הממברנה המיטוכונדריאלית (ΔΨm). ΔΨm המשובש גורם לשחרור חלבונים פרו-אפופטוטיים מוקדמים מחלל הקרום הבין-מיטוכונדריאלי אל הציטוזול27,29,30. ניתן להעריך את השינוי ב-ΔΨm על ידי צביעה כפולה עם הצבע הליפופילי הטעון חיובית, טטרמתילרודאמין אתיל אסטר, TMRE ו-7-AAD. צבע TMRE מצטבר בתוך הממברנה הפנימית של מיטוכונדריה שלמים כאשר פוטנציאל הממברנה גבוה. במיטוכונדריה שעברו דה-פולריזציה מדגימים ירידה בפלואורסצנטיות. תאים חיים עם מיטוכונדריה מקוטבת (קרום מיטוכונדריאלי שלם) כתם חיובי עבור TMRE ושלילי עבור 7-AAD. תאים מתים עם כתם מיטוכונדריה מקוטב שלילי עבור TMRE וחיובי עבור 7-AAD31.
הקספזות הן משפחה של פרוטאזות תוך-תאיות שכאשר הן מופעלות, מאותתות ומבצעות אפופטוזיס26,27. קספזות התליין הסופי (3,6,7) משפיעות על אפופטוזיס מאוחר 29,32,33. פעילויות קספאז-3 ו-7- ניתנות למדידה על ידי מצע מסומן פלואורסצנטית, אשר, כאשר הוא נבקע, נקשר לדנ"א ופולט אות פלואורסצנטי. יתר על כן, כל פגיעה בשלמות קרום התא ניתנת להערכה על ידי צביעה עם 7-AAD. תאים אפופטוטיים מוכתמים חיוביים עבור הצבע קושר ה- DNA אך שליליים עבור 7-AAD. תאים אפופטוטיים מאוחרים ותאים מתים כתם חיובי לשני הצבעים34.
אפופטוזיס מאוחר מאופיין על ידי נזק DNA27,29,35, אשר ניתן להעריך על ידי phosphorylated ataxiatelangiectasia מוטציה קינאז (ATM) ו היסטון H2A.X. שברי DNA דו גדילי (DSBs) לגרום phosphorylation של H2A.X. מסומן פלואורסצנטית נוגדנים נגד ATM ו- H2A. X יכול לקבוע נזק לדנ"א. זיהוי שלילי של כספומט ו- H2A. X מציין שאין נזק לדנ"א, בעוד שזיהוי שני הצבעים מצביע על נוכחות של שברים דו-גדיליים בדנ"א36.
Actinomycin D הוא גורם רב עוצמה של אפופטוזיס ופועל על ידי קשירה ל- DNA כדי לחסום אירועי שעתוק ותרגום37. מחקר זה נועד להעריך אפופטוזיס ביוכימי המושרה על ידי אקטינומיצין D בקו תאי SiHa על ידי ניתוח סמנים ביולוגיים בשלב מוקדם ומאוחר של אפופטוזיס. ארבעה סמנים ביולוגיים ביוכימיים של אפופטוזיס העריכו את השלבים העוקבים במפל אפופטוטי שכללו אובדן אסימטריה של קרום התא, שינוי בפוטנציאל הממברנה המיטוכונדריאלית, הפעלת קספזות סופניות ונזק לדנ"א.
Disclosures
Luminex® Corporation סיפקה באדיבות דמי עיבוד מאמרים.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
Copyright © 2025 MyJoVE Corporation. All rights reserved