Method Article
Aktinomisin D ile Tedavi Edilen SiHa Serviks Kanseri Hücrelerinde Apoptotik Biyobelirteçlerin Akış Sitometrik Analizi
Bu Makalede
Özet
Apoptoz, erken ve geç apoptotik biyobelirteçlerin akış sitometrik analizi ile karakterize edilebilir. Serviks kanseri hücre hattı SiHa, bir tezgah üstü akış sitometresi kullanılarak Actinomycin D ile tedaviden sonra apoptoz biyobelirteçleri için analiz edildi.
Özet
Apoptoz biyobelirteçleri, aktinomisin D ile tedavi edilen SiHa serviks kanseri hücrelerinde bir tezgah üstü akış sitometresi kullanılarak araştırıldı. Deney ve kontrol kültürlerinde apoptozun erken biyobelirteçleri (Ek V ve mitokondriyal membran potansiyeli) ve geç biyobelirteçleri (kaspaz 3 ve 7 ve DNA hasarı) ölçüldü. Kültürler, %5 CO2 ile 37 °C'de nemlendirilmiş bir inkübatörde 24 saat boyunca inkübe edildi. Hücreler daha sonra tripsin kullanılarak ayrıldı ve bir akış sitometrik hücre sayımı testi kullanılarak numaralandırıldı. Hücreler ayrıca bir Ek V testi, bir mitokondriyal elektrokimyasal transmembran potansiyel testi, bir kaspaz 3/7 testi ve bir DNA hasar testi kullanılarak apoptoz açısından analiz edildi. Bu makale, apoptoz ve geleneksel akış sitometrisine genel bir bakış sunmakta ve SiHa hücrelerinin işlenmesi ve analizi için akış sitometrik protokollerini detaylandırmaktadır. Sonuçlar pozitif, negatif ve sub-optimal deneysel verileri tanımlamaktadır. Ayrıca, bu analitik platformu kullanarak apoptozun akış sitometrik analizinin yapılmasında yorumlama ve uyarılar da tartışılmıştır. Akış sitometrik analizi, apoptoz için erken ve geç biyobelirteçlerin doğru bir şekilde ölçülmesini sağlar.
Giriş
Tip 1 programlanmış hücre ölümü1 olarak sınıflandırılan apoptoz, hücre proliferasyonu ile hücre ölümü2 arasında bir denge sağlar. Apoptoz, insan gelişimi sırasında, yaralanma sonrası ve kanser gibi hastalıkların önlenmesi için gereklidir3. İntrinsik ve ekstrinsik apoptotik hücre ölümü sinyal yolakları4 ardışık biyokimyasal ve morfolojik hücre içi değişikliklere neden olur 2,5,6. Morfolojik apoptotik özellikler mikroskopi ile tanımlanabilir ve biyokimyasal pertürbasyon, akış sitometrisi (FC) 7 dahil olmak üzere biyokimyasal testlerle analiz edilebilir.
Apoptozu tanımlamak ve ilişkili hücre içi mekanizmaları anlamak için akış sitometrik analizi son yirmi yılda filizlenmiştir8. FC, tek veya çok kanallı lazerlerden geçen bir sıvıdaki hücreleri analiz eden bilimsel bir metodolojidir (Şekil 1)9,10,11. Akışkandaki hücreler, hidrodinamik odaklama kullanılarak akış sitometresinin akışkan sistemi tarafından tek bir dosyaya odaklanır. Hücreler lazerden geçerken, ışık hücrelerden dağılır veya yayılır. Saçılan ışık ileri yönde (ileri saçılma) veya yana doğru (yan saçılma) olabilir ve sırasıyla hücre boyutu ve hücre granülerliği veya iç yapıları hakkında bilgi sağlar.
Ek olarak, floresan boyalar veya floroforlarla etiketlenmiş antikorlar gibi floresan reaktifler, belirli yüzey veya hücre içi yapıları veya molekülleri tespit eder. Lazer floroforları uyardığında, ışık belirli bir dalga boyunda yayılır. Dedektörler - genellikle fotoçarpan tüpleri - hücre örneklerinden saçılan ve yayılan ışığı ölçer. Dedektörler, ışık saçılması ve floresan emisyonu ile orantılı olarak ölçülebilir bir akım üretir. Elektronik çıktı, hücre büyüklüğüne, hücre granülerliğine ve florofor etiketlimoleküllerin 9,12,13 nispi hücre floresansına göre hücre popülasyonlarını tanımlamak için bilgisayar yazılımı tarafından dijital sinyallere dönüştürülür.
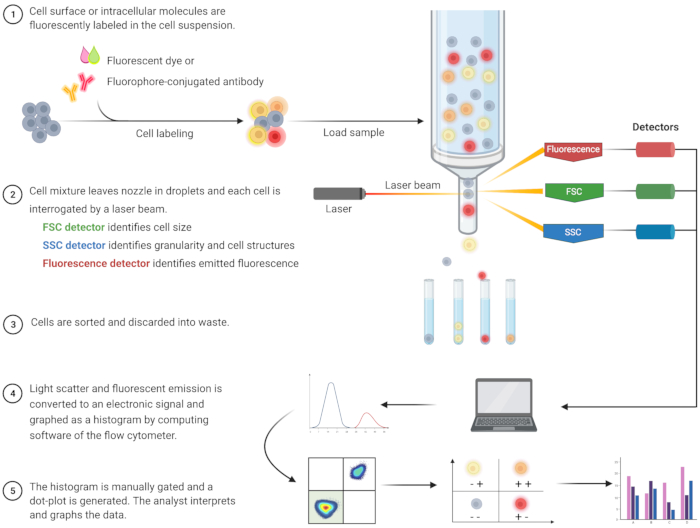
Şekil 1: Geleneksel akış sitometrisinin teknik çalışmasını ve iş akışını açıklayan şematik. Hücreler floresan reaktiflerle boyanır ve bir lazer ile incelenir. Üretilen floresan sinyalleri algılanır ve bilgisayar yazılımı ve istatistiksel programlar tarafından daha da sayısallaştırılan ve analiz edilen elektronik bir çıkışa dönüştürülür. Kısaltmalar: FSC = ileri saçılma; SSC = yan saçılma. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
FC hem araştırma hem de sağlık teşhisinde kullanılır. FC'nin nekrobiyolojideki iki amacı, hücre ölümünün moleküler ve fonksiyonel özelliklerinin aydınlatılması ve hücre ölümünün çeşitli modlarının ayırt edilmesidir 14,15,16,17,18. FC uygulamaları arasında hücre sayımı, hücre popülasyonlarının sıralanması, immünofenotipleme, biyobelirteç tespiti (örneğin, apoptoz biyobelirteçleri), toksisite çalışmaları ve protein mühendisliği12 bulunmaktadır. Ek olarak, FC, hematolojik maligniteleri olan hastaların tanı ve izlenmesine yardımcı olmak için sağlık teşhisine yaygın olarak uygulanır. Enstrümantasyon, florofor tespiti ve dedektör sistemlerindeki ilerlemeler, FC uygulamalarını görüntüleme sitometrisi, kütle sitometrisi ve spektral sitometriyi daha geniş araştırma uygulamaları ile içerecek şekilde genişletmektedir12.
Apoptozun akış sitometrik analizi, hücre sağlığının değerlendirilmesinde kullanılan geleneksel tekniklere göre avantajlar sağlar. FC, apoptozu tahmin etmek için heterojen bir numunedeki birçok tek hücreyi hızlı ve tekrarlanabilir bir şekilde analiz edebilir 3,5. FC'nin bireysel hücre bazında hücre fenotipleri hakkında nicel bilgi sağlama ve toplu analizden kaçınma yeteneği, apoptoz 8,19 analizinde kullanılan Western lekeleme, enzime bağlı immünosorbent tahlilleri (ELISA'lar), florometri ve spektrofotometri tekniklerine üstün duyarlılık sunar. Ayrıca, Batı lekelerinin ve ELISA'ların hantal ve zayıf tekrarlanabilir manuel adımlarının aksine, FC analizinin göreceli kolaylığı avantajlıdır. Bu nedenle FC'nin tekrarlanabilir, doğru ve yüksek verimli analizi, kanser araştırmalarında faydalıdır20.
FC ayrıca sağlıklı ve anormal apoptotik hücre popülasyonları için hücre döngüsü parametrelerinin eşzamanlı analizine izin verir21. Apoptoz dinamik bir süreç olduğundan, farklı yöntemler değişken sonuçlar üretebilir ve hücrelerin toplandığı zaman noktasına bağlıdır22. Hücre fenotipinin çoklu parametrelerinin eşzamanlı kantitatif değerlendirmesi, küçük alt popülasyonların yüksek doğrulukla tespit edilmesine izin verir, örneğin,% 0.01'lik düşük bir frekansa sahip nadir hücre alt kümeleri tespit edilebilir23. Multi-parametrik FC analizi, apoptotik ölüm, apoptotik süreklilik boyunca çeşitli noktalardaki hücrelerle erken ve geç biyokimyasal değişikliklerin bir spektrumu boyunca meydana geldiği için özellikle yararlıdır. Örneğin, apoptotik hücrelerin FC analizinde Ek V ve propidyum iyodür kullanılarak çift boyamanın kullanılması, erken apoptotik hücrelerin, geç apoptotik hücrelerin ve ölü hücrelerin kategorize edilmesini sağlar24. Apoptozun birçok aşamada doğru tespiti, yanlış sınıflandırmayı ve yanlış negatif sonuçları önler. Bu nedenle, FC tarafından yapılan multiparametrik analiz, hücre fenotiplerini tespit etmenin genel özgüllüğünü geliştirir ve küçük popülasyonların yanlış sınıflandırılmasını önler. Ayrıca, FC tarafından hücre sıralama, sonraki analizler için yüksek saflıkta hücre popülasyonlarının izole edilmesine izin verir7.
FC'nin dezavantajı, doku analizinde zor olabilen süspansiyonda hücrelerin kullanılmasını içerir, çünkü dokunun hücrelere ayrılması hücresel fonksiyonu değiştirebilir19. Ayrıca, FC enstrüman kurulumunun, veri analizinin ve tahlil raporlarının standardizasyonunun olmaması, FC operatörlerinin performans göstermesi, verileri analiz etmesi ve raporlaması için en uygun şekilde eğitilmesi ihtiyacını vurgulayarak, sonuç19'da değişikliklere neden olabilir. Örneğin, FC'nin gerçek apoptotik kalıntıları apoptotik çekirdeklerden ayırt etme yeteneği, i) uygun edinim ayarlarını, ii) bir diploid DNA zirvesini tanımlamak için kalibrasyon boncuklarının kullanılmasını ve iii) hücreye özgü negatif ve pozitif hücre kontrollerini gerektirir3. Ayrıca, multiparametrik analiz, dedektör sayısı ile sınırlıdır ve birden fazla floresan reaktifi kullanıldığında spesifik olmayan sonuçları ve floresan emisyonunun yayılmasını önlemek için optimum kompanzasyonun yapılması gerekir25. Cihaz ve florofor teknolojisindeki ilerlemeler, parametre algılamayı 30 parametreye yükseltmiştir12.
Apoptotik hücre ölümünün tanımlanması her zaman basit değildir7 ve hassas ve spesifik biyobelirteçler dikkate alınmalıdır. Hücre Ölümü İsimlendirme Komitesi (NCCD), apoptoz26 sürecini incelemek ve ölçmek için birden fazla tahlilin kullanılmasını önermektedir. Klasik apoptotik özellikler için mikroskopi analizi26 da apoptozu doğrulamak ve yanlış pozitif sonuçlardan kaçınmak için önerilir7. Erken ve geç apoptotik olayları kapsayan dört kardinal biyokimyasal özellik şunlardır: (1) hücre zarı asimetrisinin kaybı; (2) dağılım mitokondriyal membran potansiyeli (ΔΨm); (3) kaspaz aktivasyonu; ve (4) DNA hasarı26.
Erken apoptoz sırasında, fosfatidilserin dış hücre zarı 27'ye eksternalize edilir ve fikoeritrin27,28,29 ile floresan olarak etiketlenmiş Ek V ile tespit edilebilir. Ayrıca, floresan DNA bağlayıcı boya, 7-aminoaktinomisin D (7-AAD) ile çift boyama, canlı, geç apoptotik ve ölü hücreleri ayırt eder. Bu nedenle, erken apoptotik hücreler, her iki boya için de pozitif olan geç apoptotik hücrelerin aksine, Ek V için pozitif ve 7-AAD için negatif boyanır24.
İçsel apoptotik sinyaller mitokondriyal membran potansiyelinin (ΔΨm) dağılmasını indükler. Bozulmuş ΔΨm, erken pro-apoptotik proteinlerin mitokondriyal membranlar arası boşluktan sitosol 27,29,30'a salınmasına neden olur. ΔΨm'deki değişim, pozitif yüklü, lipofilik boya, tetrametilrhodamin etil ester, TMRE ve 7-AAD ile çift boyama ile değerlendirilebilir. TMRE boyası, membran potansiyeli yüksek olduğunda bozulmamış mitokondrinin iç zarında birikir. Depolarize mitokondri, floresansın azaldığını gösterir. Polarize mitokondrili (sağlam mitokondriyal membran) canlı hücreler TMRE için pozitif ve 7-AAD için negatif boyanır. Depolarize mitokondrili ölü hücreler TMRE için negatif, 7-AAD31 için pozitiftir.
Kaspazlar, aktive edildiğinde apoptozu26,27 işaret eden ve yürüten bir hücre içi proteaz ailesidir. Terminal cellat kaspazları (3,6,7) geç apoptozuetkiler 29,32,33. Kaspaz-3 ve -7 aktiviteleri, bölündüğünde DNA'ya bağlanan ve floresan bir sinyal yayan floresan olarak etiketlenmiş bir substrat ile ölçülebilir. Ayrıca, hücre zarı bütünlüğünden herhangi bir ödün verilmesi, 7-AAD ile boyanarak değerlendirilebilir. Apoptotik hücreler DNA bağlayıcı boya için pozitif, ancak 7-AAD için negatiftir. Geç apoptotik ve ölü hücreler her iki boya için de pozitif lekelenir34.
Geç apoptoz, fosforile ataksi telanjiektazi mutasyona uğramış kinaz (ATM) ve histon H2A.X. Çift sarmallı DNA kırılmaları (DSB'ler) H2A.X'in fosforilasyonuna neden olan DNA hasarı 27,29,35 ile karakterizedir. X, DNA hasarını belirleyebilir. Hem ATM hem de H2A'nın negatif tespiti. X, DNA hasarı olmadığını gösterirken, her iki boyanın tespiti DNA36'da çift iplikçik kırılmalarının varlığını gösterir.
Aktinomisin D, apoptozun güçlü bir indükleyicisidir ve transkripsiyon ve translasyon olaylarını bloke etmek için DNA'ya bağlanarak hareket eder37. Bu çalışmada, SiHa hücre hattında aktinomisin D'nin indüklediği biyokimyasal apoptozun, apoptozun erken ve geç evre biyobelirteçlerini analiz ederek değerlendirilmesi amaçlanmıştır. Apoptozun dört biyokimyasal biyobelirteci, hücre zarı asimetrisinin kaybı, mitokondriyal membran potansiyelindeki değişim, terminal kaspazların aktivasyonu ve DNA hasarını içeren apoptotik kaskaddaki sıralı adımları değerlendirdi.
Protokol
NOT: Bu protokol, bir tezgah üstü akış sitometresinde ölçülen ve analiz edilen akış sitometrik ticari tahlilleri kullanarak aktinomisin D ile muamele edilen SiHa hücrelerinin hücre hazırlığı, hücre sayımı, hücre boyama ve analizindeki adımları açıklamaktadır (Şekil 2).
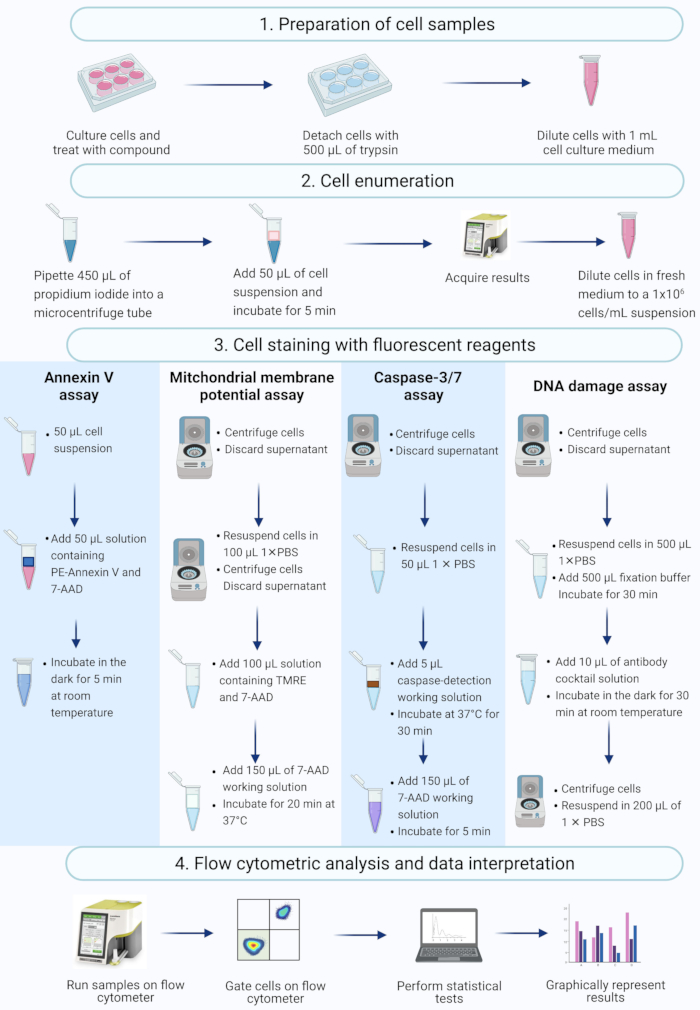
Şekil 2: Biyokimyasal apoptotik biyobelirteçlerin akış sitometrisi ile tespiti için iş akışı. Hücreler kültürlenir ve protokol adım 1.1'de açıklandığı gibi tedavi edilir. (1) Hücreler kültürlenir, (2) numaralandırılır ve (3) floresan reaktiflerle boyanır ve (4) bir tezgah üstü akış sitometresi ile analiz edilir. Veriler daha da ileri götürülür ve istatistiksel olarak analiz edilir. Kısaltmalar: 7-AAD = 7-aminoaktinomisin D; PBS = fosfat tamponlu salin; PE = Fikoeritrin; TMRE = tetrametilrhodamine etil ester. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
1. Hücre kültürünün hazırlanması ve akım sitometrisi için tedaviler
NOT: Hücre kültürlerini işlerken aseptik tekniğin izlendiğinden emin olun.
- Hücre kültürlerini 37 °C'de nemlendirilmiş bir CO 2 ortamında %5 CO2 ile büyütün. Deneyler için hücreleri geçmeden önce hücre kültürünün ana şişede yaklaşık% 70 oranında birleştiğinden emin olun.
- Ortamı şişeden çıkarın, hücreleri 1x fosfat tamponlu salin (PBS) ile yıkayın ve hücreleri ayırmak için 500 μL tripsin ekleyin. Hücreler yuvarlanmaya ve şişeden ayrılmaya başladıktan sonra, hücreleri ayırmak için şişenin tabanını tezgahta keskin bir şekilde vurun. Daha sonra, hücreleri saymadan önce% 10 fetal buzağı serumu ile desteklenmiş yaklaşık 5 mL taze kültür ortamı ekleyerek tripsini nötralize edin.
- 6 kuyucuklu bir hücre kültürü plakasında 3 mL hücre kültürü ortamında 15.000 hücre / mL'de tohum hücreleri. Hücrelerin kuyunun dibine yapışmasını sağlamak için kültür plakalarını gece boyunca 37 ° C'de% 5 CO2 ile inkübe edin.
- Deney kültürlerini 100 ng/mL aktinomisin D ve ortam ve solvent kontrollerini sırasıyla taze kültür ortamı ve dimetil sülfoksit (DMSO) ile 24 saat boyunca tedavi edin. Harcanan ortamı 15 mL'lik bir tüpte toplayın ve hücreleri 1x PBS ile yıkayın. Bundan sonra, 1x PBS yıkamasını tüpe ekleyin ve ardından kuyuya 500 μL tripsin ekleyin. Daha sonra, 5 mL taze kültür ortamı ekleyerek tripsini nötralize edin.
NOT: (1) Uzun süreli tripsin inkübasyonu veya eksik nötralizasyon, hücreleri sindirebilir ve hücre zarını tehlikeye atabilir, bu da sonuçları çarpıtabilir. Ek olarak, hücre zarı asimetrisini ve dolayısıyla fosfatidilserine erişilebilirliği de değiştirebilir. (2) Ayrılan ve yüzeye yüzen hücreler, çıkarılan ortamı 5 dakika boyunca 300 × g'da santrifüj ederek ve hücreleri taze kültür ortamında yeniden askıya alarak sonraki analize dahil edilebilir.
2. Canlılık testini kullanarak hücrelerin numaralandırılması
- Bir mikrosantrifüj tüpünde pipet 450 μL propidyum iyodür. Mikrosantrifüj tüpüne 50 μL hücre süspansiyonu ekleyin. Tüpü oda sıcaklığında 5 dakika boyunca inkübe edin. Hücreleri akış sitometrisine göre numaralandırın (bölüm 4'e bakınız).
- Apoptoz tahlillerine geçmeden önce tüm numuneleri hücre kültürü ortamı ile 1 × 106 hücre / mL konsantrasyonuna seyreltin.
3. Akış sitometrisi için boyama hücreleri
NOT: Protokolün bu bölümü için steril koşullar gerekli değildir.
- Ek V kullanılarak fosfatidilserin dışsallaştırmasının tespiti
- Bir mikrosantrifüj tüpüne 100 μL hücre süspansiyonu ekleyin. 1:1 floresan konjuge Ek V ve 7-AAD reaktif karışımından 100 μL ekleyin. Oda sıcaklığında 20 dakika boyunca inkübe edin, ışıktan korunun.
- Mitokondriyal membran depolarizasyonunun analizi
- Hücre süspansiyonunun 100 μL'sini 300 × g'da 5 dakika boyunca santrifüj edin ve süpernatanı atın.
- Hücreleri 1 mL 1x PBS içinde yeniden askıya alın, her numuneye 100 μL TMRE boyama çözeltisi ekleyin ve süspansiyonu nazik geri pipetleme ile karıştırın.
- Hücreleri 37 ° C'de nemlendirilmiş bir CO2 ortamında 20 dakika boyunca inkübe edin. Işıktan korumak için numuneleri temiz alüminyum folyoya sarın.
NOT: Mitokondriyal membran potansiyeli, hücre ortamındaki küçük değişikliklere duyarlı fonksiyonel bir belirteçtir. Bu nedenle, tekrarlanabilirliği korumak için numuneler aynı koşullar altında (sıcaklık, pH ve inkübasyonun başlangıcı ile floresan ölçümü arasında geçen süre) inkübe edilmeli ve ölçülmelidir. Ayrıca, numunelerin ışıktan yetersiz korunmasının, floroforların fotoağartılmasına neden olduğunu ve bunun sonucunda yanlış bir şekilde düşük yayılan floresansı sağladığını unutmayın. - İnkübasyondan sonra, her numuneye 5 μL 7-AAD boyama çözeltisi ekleyin ve karıştırın. Işıktan korunan oda sıcaklığında 5 dakika inkübe edin.
- Kaspaz substratı DEVD kullanılarak aktif terminal kaspaz-3 ve -7'nin tespiti
NOT: Bu tahlil yapılmadan önce aşağıdaki çözeltiler hazırlanmıştır.- Kaspaz algılama çalışma çözeltisini oluşturmak için DMSO'daki DEVD'ye bağlı DNA bağlayıcı peptidi steril 1x PBS ile 1:8 oranında seyreltin. Çözeltiyi buz üzerinde veya ışıktan korunan 2-8 ° C'de saklayın.
NOT: Her numune bu çözeltiden 5 μL gerektirecektir. - 7-AAD çalışma çözümünü oluşturmak için 148 μL 1x PBS'ye 2 μL 7-AAD stok çözeltisi ekleyin. Çözeltiyi buz üzerinde veya ışıktan korunan 2-8 ° C'de saklayın.
NOT: Her numune bu çözeltiden 150 μL gerektirecektir. - Hücre süspansiyonunun 50 μL'sini 300 × g'da 5 dakika boyunca santrifüjleyin. Supernatan'ı atın. Hücreleri 50 μL 1x PBS'de, ardından 5 μL kaspaz algılama çalışma çözeltisinde yeniden askıya alın. İyice karıştırın.
- Tüplerin kapağını gevşetin ve ışıktan korunmuş, 37 ° C'de nemlendirilmiş bir CO2 ortamında 30 dakika inkübe edin. Her numuneye 150 μL 7-AAD çalışma çözeltisi ekleyin ve karıştırın. Işıktan korunan oda sıcaklığında 5 dakika inkübe edin.
- Kaspaz algılama çalışma çözeltisini oluşturmak için DMSO'daki DEVD'ye bağlı DNA bağlayıcı peptidi steril 1x PBS ile 1:8 oranında seyreltin. Çözeltiyi buz üzerinde veya ışıktan korunan 2-8 ° C'de saklayın.
- Çift sarmallı DNA kırılmalarının ve toplam DNA hasarının tespiti
- Hücre süspansiyonunun 50 μL'sini 300 × g'da 5 dakika boyunca santrifüj edin. Supernatan'ı atın.
- Hücreleri 500 μL 1x PBS'de yeniden askıya alın. 500 μL formaldehit bazlı fiksasyon tamponu ekleyin ve karıştırın. Numuneleri buz üzerinde 10 dakika boyunca inkübe edin.
- 300 × g'da 5 dakika boyunca santrifüj yapın ve süpernatanı atın. Hücreleri bir mikrosantrifüj tüpünde 90 μL 1x PBS'de yeniden askıya alın. Mikrosantrifüj tüpüne 10 μL antikor çözeltisi ekleyin. Karanlıkta 30 dakika oda sıcaklığında inkübe edin.
- 100 μL 1x PBS ekleyin ve 300 × g'da 5 dakika boyunca santrifüj yapın. Supernatan'ı atın. Hücreleri 200 μL 1x PBS'de yeniden askıya alın.
4. Akış sitometresinde örnekleri çalıştırın.
- Cihazın sistem kontrol kitini çalıştırarak akış sitometresinin analitik performansını doğrulayın. Tüm denetimler tamamlanıp geçilene kadar örnekleri çalıştırmaya devam etmeyin.
- Cihazdaki önceden programlanmış tahlillerin kataloğuna göz atarak istediğiniz tahlili bulun ve Testi Çalıştır'ı seçin.
- Numuneyi akış sitometresine yüklemeden önce numuneyi nazikçe geri pipetleyerek karıştırın.
NOT: Yeterli karıştırma, hücrelerin süspansiyonda kalmasını sağlar ve düşük hücre sayısını önler. - İlk olarak, akış sitometresine negatif bir kontrol örneği yükleyin ve cihazın numuneyi aspire etmeye başlaması ve algılanan olayların gerçek zamanlı bir önizlemesini sağlaması için Çalıştır'ı (Ayarları Ayarla) seçin. Cihaz adı ve ayrıntıları için Malzeme Tablosuna bakın.
- Canlı önizlemeyi kullanarak, floresan ve hücre boyutu için eşikleri ayarlayın ve hücre popülasyonunun etrafına dikdörtgen bir kapı çizin. Hücresel kalıntıları dışlamak için eşik işaretçisini sürükleyin. Devam etmek için İleri'yi (Sistem Durumunu Ayarla) seçin.
NOT: Hücrelerin boyutunu bilmek önemlidir. Kaydırıcıları sürükleyin ve algılanan olayların gerçek zamanlı önizlemede nasıl çizildiği konusundaki değişiklikleri gözlemleyin, çünkü bu, eşiklerin doğru bir şekilde seçilmesini sağlayacaktır. Hücresel enkaz bu aşamada dışlanmazsa, edinim sonrası analizlerde çıkarılamaz. - Hücre popülasyonlarını ayırmak ve cihaz grafiklerinin olayları gerçek zamanlı olarak algılaması için kadran işaretçilerine dokunup sürükleyin. Son kullanıcıyı kadran işaretleyicilerinin uygun şekilde yerleştirilmesi konusunda yönlendirmek için bu grafikleri kullanın. Enstrümanın ayarların bir özetini görüntülemesine devam etmek için İleri'yi (Örnekleri Doğrula) seçin. Ayarları inceledikten sonra, bu ayarları denemedeki tüm örneklere uygulamak için İleri'yi (Ayarları Doğrula) seçin.
NOT: Cihaz, cihazın ayarlarını yapmak için kullanılan hücrelerin 2 dakikalık canlı önizlemesini sağlar. Bu süre sınırı sona ererse, cihaz numuneyi serbest bırakır ve 4.2.2-4.2.4 adımlarının tekrarlanması gerekir. Numuneyi çıkarın ve yeniden yüklemeden ve devam etmeden önce iyice karıştırın. - Hücre popülasyonunun etrafına bir bölge çizerek bir hücre popülasyonunu geçitleyin. Canlı önizlemenin x ve y ekseninde bulunan kaydırıcıları kullanarak floresan ve hücre boyutu için eşikleri ayarlayın. Bu ayarları denemedeki tüm örnekler için uygulayın.
- İlk numuneyi yavaşça geri pipetleyerek karıştırın ve ilk numuneyi akış sitometresine yükleyin ve İleri'yi seçin. Örneği adlandırın ve sistemin örneği çalıştırmaya başlaması için Çalıştır'ı seçin.
NOT: Cihaz aynı anda yalnızca bir örnek çalıştırabilir. - Tüm örnekler çalıştırıldıktan sonra, denemeye uygun bir başlık vererek denemeyi kaydedin. Geçerli denemenin ayarlarını gelecekteki çalıştırmalarda almak üzere kaydedin (isteğe bağlı).
- Numuneyi akış sitometresine yüklemeden önce numuneyi nazikçe geri pipetleyerek karıştırın.
5. Satın alma sonrası analiz
- Gerekirse, satın alma sonrası kapıların veya kadran işaretleyicilerinin ince ayarını yapın.
- Sistemin dosya tarayıcısında gezinerek ayarlanması gereken denemeyi bulun ve denemeyi açın.
- Büyütmek için grafiğin küçük resim önizlemesine dokunun. Kapının boyutlarını ayarlamak için hücre kapısının sol üst veya sağ alt köşelerine dokunun. Kadran işaretçilerini ayarlamak için, dikey ve yatay çizgilerin kesişimine dokunarak işaretçileri oldukları gibi hareket ettirin. Her iki çizginin açısını ayarlamak için çizgiye dokunun ve tutamacı sürükleyin.
- İşaretçileri (daha önce 4.1.3-4.1.4 adımlarında açıklandığı gibi) istediğiniz gibi ayarlayın ve onay işareti simgesini seçip, tüm örnekleri işaretleyerek ve Kabul Et'i seçerek bu ayarları denemedeki tüm örneklere uygulayın.
6. İstatistiksel analiz
- Testleri üçlü olarak çalıştırın ve tedavi edilen numuneler ve kontroller arasındaki önemli farklılıkları değerlendirmek için post-hoc Bonferroni testi ile bir varyans analizi (ANOVA) çalıştırın.
NOT: Tercih edilen istatistiksel test, araştırmacıya ve analiz edilen değişkenlere bağlıdır.
Sonuçlar
Hücre sayısı ve canlılığı (Şekil 3) sonuçları, örneklemdeki hücrelerin% 95.2'sinin canlı ve% 4.8'inin ölü olduğunu göstermiştir. Orijinal örneklemdeki toplam hücre konsantrasyonu 6.20 x 106 hücre/mL idi.
Ek V ve hücre ölümü testi (Şekil 4), kontrollere kıyasla 100 ng / mL aktinomisin D ile tedavi edilen SiHa hücrelerinde apoptotik hücrelerde anlamlı bir artış (p < 0.0001) göstermiştir. Erken evre apoptoz sırasında hücrelerde Ek V boyama arttığından, bu bulgu SiHa hücrelerinde 100 ng / mL aktinomisin D'nin apoptozu indüklediğini düşündürmektedir.
Mitokondriyal elektrokimyasal transmembran potansiyel testi (Şekil 5), aktinomisin D, orta kontrol ve çözücü kontrolü arasında hücre sağlığı profillerinde (canlı, depolarize ve canlı, depolarize ve ölü, ölü) anlamlı bir azalma (p < 0.0001) göstermiştir. Bu veriler, 100 ng / mL aktinomisin D'nin SiHa hücrelerinde mitokondriyal depolarizasyonu indüklediğini göstermektedir.
Kaspaz 3/7 testi (Şekil 6), kontrollere kıyasla 100 ng / mL aktinomisin D ile tedavi edilen SiHa hücrelerinde kaspaz 3 ve 7'nin anlamlı (p < 0.0001) aktivasyonunu göstermiştir. Bu bulgular, SiHa hücrelerinde 100 ng/mL aktinomisin D'nin apoptozu indüklediğini göstermektedir.
DNA hasar testi (Şekil 7), 100 ng/mL aktinomisin D'nin anlamlı olarak (p < 0.0001) DNA hasar belirteçleri, ATM ve H2A'yı indüklediğini göstermiştir. X, SiHa hücrelerinde. Bu bulgu, aktinomisin D ile tedavi edilen SiHa hücrelerinde DNA hasarında önemli bir artış olduğunu göstermektedir.
Optimal olmayan deneylerin sonuçları (Şekil 8), tüm tahlillerde analitik hususları göstermektedir. Hücre konsantrasyonu verilerin doğruluğunu etkiler. Şekil 8A'da, hücre sayısı kabul edilemez derecede düşüktür. Nokta grafiğinin 4 kadranının tümündeki kapılı hücre popülasyonları düşük sinyal yoğunluğuna sahiptir. Üretici, son numune hacminde 300-700 hücre/μL için tahlili optimize eder. Bu örnek, üretici tarafından öngörülen doğru numune konsantrasyonunun kullanılmasının önemini göstermektedir.
Ek olarak, yüksek hücre konsantrasyonları da hatalı sonuçlara neden olmuştur (Şekil 8B). Orta ve deneysel kültürler sırasıyla% 99.95 ve% 100 canlı hücre gösterdi. Her iki tahlil için de akış hızı, üreticinin optimize ettiği 100-500 hücre/μL konsantrasyonunu aştı ve yanlış analizleri önlemek için 1x Tahlil Tamponu ile seyreltme gerektirdi.
Deneysel kültürlerin hazırlanması sırasında hücre kümelenmesinden kaçınılmalıdır, çünkü Ek V testinde gösterildiği gibi, artan hücre boyutu indeksleri nedeniyle yanlış sonuçlar verir. Şekil 8C , SiHa ortam kontrolünde 4'ü aşan hücre boyutu indeksleri ile kanıtlandığı gibi, üreticinin talimatını ve hücre kümelenmesini aşan ikili bir yüksek hücre konsantrasyonu problemini göstermektedir. Yüksek hücre konsantrasyonu, orta kültürlerde parlak kırmızı bir hücre düzlemi oluşturan hücrelerin tabakalanması ile gösterilir ve uyumsuz derecede yüksek apoptotik hücre popülasyonları gösterir.
Kültürlerin uzun süre boyanması, proteinlerin spesifik olmayan bir şekilde bağlanmasına neden olabilir ve Ek V testinde gösterildiği gibi yanlış sonuçlara neden olabilir. Şekil 8D , uzun süreli boyama nedeniyle orta ve deneysel kültürler için benzer sonuçlar göstermektedir.
Kötü numune işleme, yapışkan hücrelerin uzun süre denenmesi, yıkama adımları sırasında kuvvetli pipetleme ve yüksek hızlı ve uzun süreli santrifüjleme adımları hücre lizisine ve yüksek miktarda hücre döküntüsüne neden olur. Şekil 8E'de, kaspaz 3/7 testi ile analiz edilen kültürler, küçük bir hücre boyutu indeksi (<2.2 hücre boyutu indeksi) ile kanıtlanan artmış hücre enkazını göstermektedir. Bu nedenle, veri toplama için numuneler hazırlanırken dikkatli olunmalıdır.
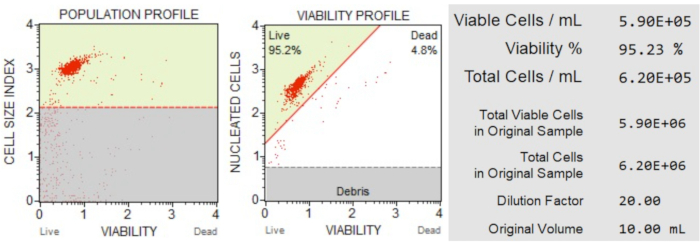
Şekil 3: Hücre Sayımı ve canlılık testi. Popülasyon profili, kalıntıları canlı ve ölü hücrelerden ayırır. İki boyutlu nokta grafiği kapılıdır ve canlı ve ölü hücre popülasyonlarını böler. Bilgi paneli, hücre sayısı, toplam canlı hücrelerin yüzdesi ve örneklemdeki toplam canlı hücre sayısı hakkında nicel veriler sağlar. Bu veriler, sonraki apoptoz analizleri için tüm örneklerdeki hücre sayısını standartlaştırmak için kullanılabilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
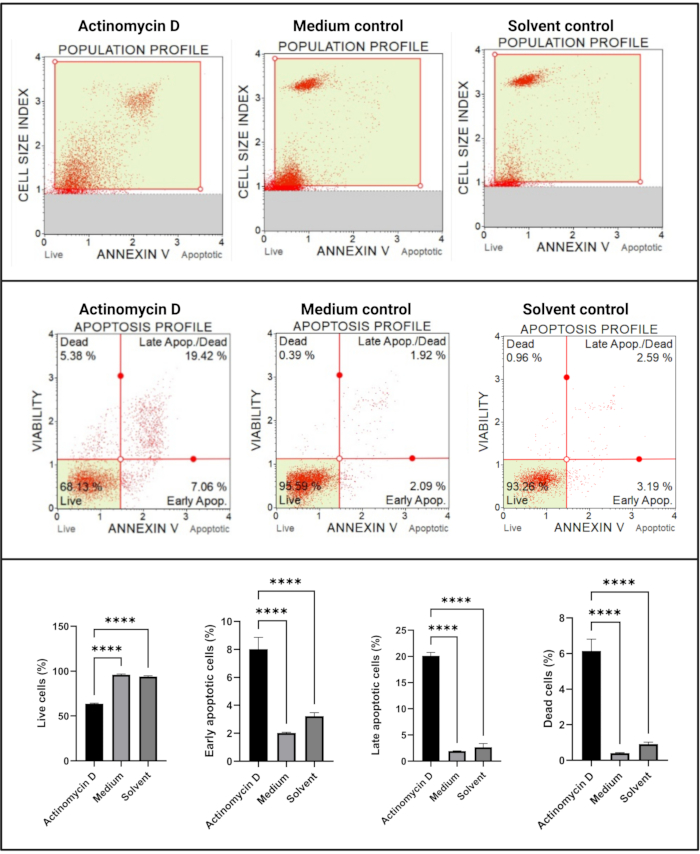
Şekil 4: Ek V testi. Tüm örnekler aynı geçit parametrelerini gösterir ve her bir alt popülasyonun istatistiksel analizi, aktinomisin D ile tedavi edilen hücrelerde apoptozda önemli bir artış olduğunu ortaya koymaktadır. Tüm testler üç bağımsız deney olarak gerçekleştirildi ve her deney üçlü olarak test edildi. Veriler SD± ortalama olarak sunulmuş ve p < 0.05 istatistiksel olarak anlamlı bulunmuştur. p < 0.0001. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
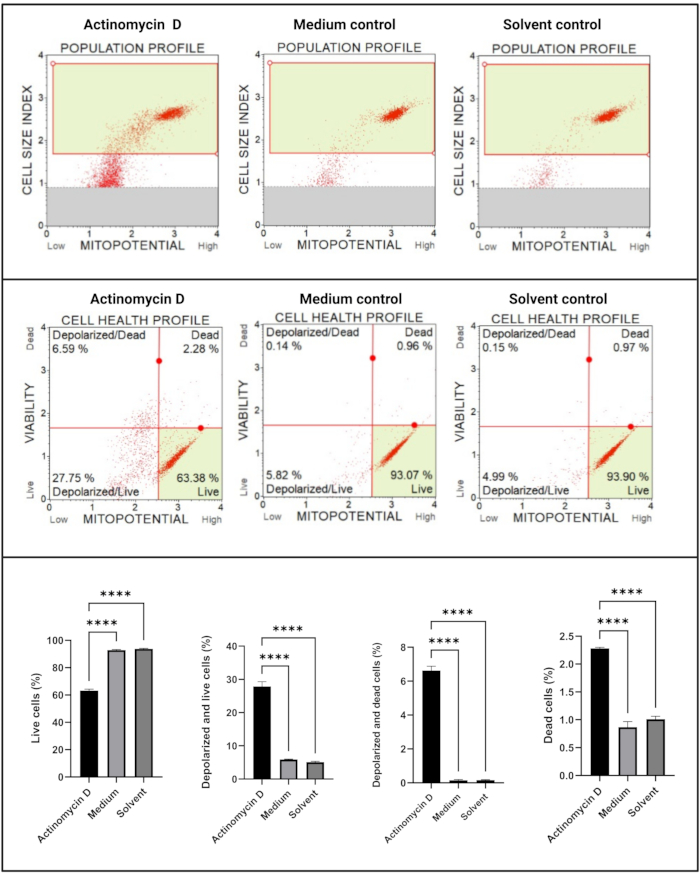
Şekil 5: Mitokondriyal elektrokimyasal transmembran potansiyel testi. Tüm örnekler aynı geçit parametrelerini gösterir ve her bir alt popülasyonun istatistiksel analizi, aktinomisin D ile tedavi edilen hücrelerde mitokondriyal membran potansiyelinde önemli bir bozulma olduğunu ortaya koymaktadır. Tüm testler üç bağımsız deney olarak gerçekleştirildi ve her deney üçlü olarak test edildi. Veriler SD± ortalama olarak sunulmuş ve p < 0.05 istatistiksel olarak anlamlı bulunmuştur. p < 0.0001. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
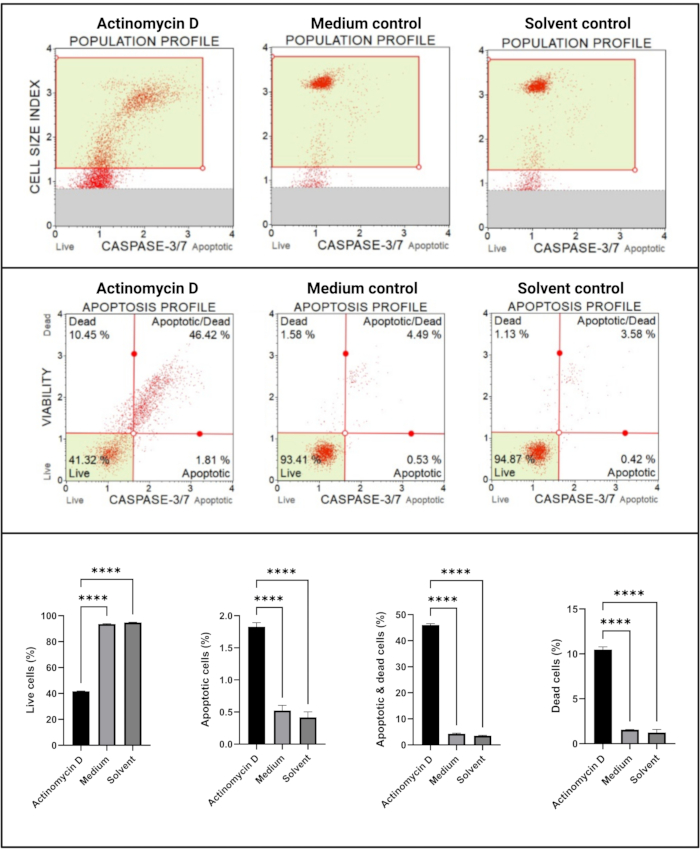
Şekil 6: Kaspaz 3/7 tespit testi. Tüm örnekler aynı geçit parametrelerini gösterir ve her bir alt popülasyonun istatistiksel analizi, aktinomisin D ile tedavi edilen hücrelerde kaspaz 3/7 aktivitesinde önemli bir artış olduğunu ortaya koymaktadır. Tüm testler üç bağımsız deney olarak gerçekleştirildi ve her deney üçlü olarak test edildi. Veriler SD± ortalama olarak sunulmuş ve p < 0.05 istatistiksel olarak anlamlı bulunmuştur. p < 0.0001. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
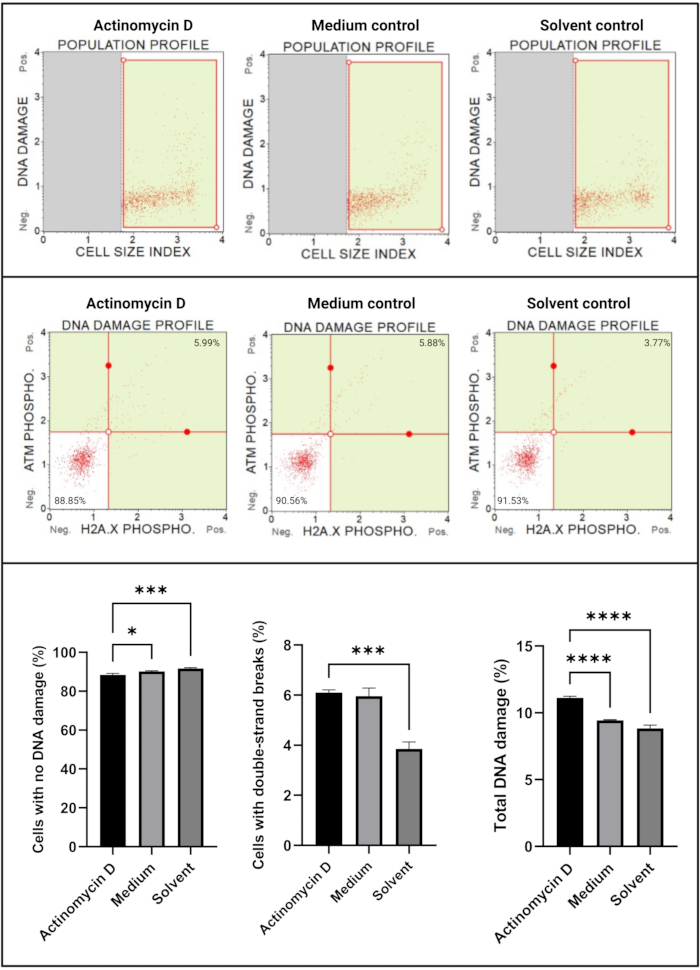
Şekil 7: DNA hasar testi. Tüm örnekler aynı geçit parametrelerini gösterir ve her bir alt popülasyonun istatistiksel analizi, aktinomisin D ile tedavi edilen hücrelerde çift sarmallı DNA hasarında ve toplam DNA hasarında önemli bir artış olduğunu ortaya koymaktadır. Tüm testler üç bağımsız deney üzerinde gerçekleştirildi ve her deney üçlü olarak test edildi. Veriler SD± ortalama olarak sunulmuş ve p < 0.05 istatistiksel olarak anlamlı bulunmuştur. * p < 0.05; p < 0,001; p < 0.0001. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
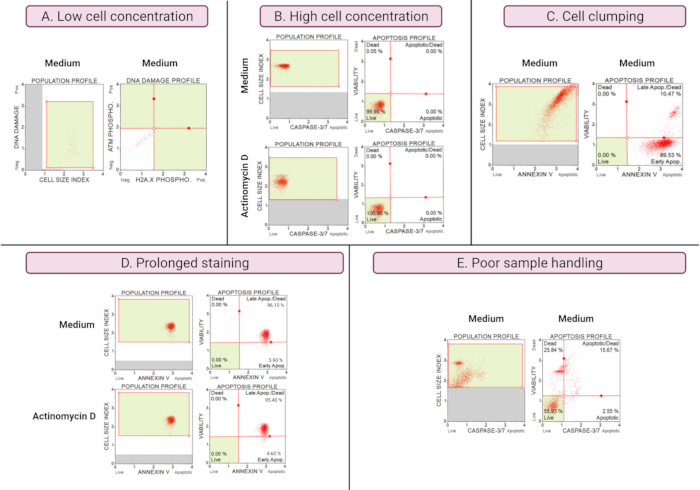
Şekil 8: Optimal olmayan deneysel koşullar kötü sonuçlar vermektedir . (A) Düşük hücre konsantrasyonu, (B) yüksek hücre konsantrasyonu, (C) yüksek hücre boyutu indeksi ile belirgin hücre kümelenmesi ve toplanması, (D) her iki numunede de artan pozitif boyama ile belirgin olan hücre örneklerinin uzun süreli boyanması ve (E) artan hücresel enkaz ile belirgin olan zayıf numune kullanımı (hücre boyutu indeksi < 2.2). Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Tartışmalar
Bu çalışmada, FC tarafından analiz edilen aktinomisin D ile tedavi edilen SiHa hücreleri, apoptoz için önemli erken ve geç biyobelirteçler ortaya koymuştur. Hücre hazırlama, numaralandırma ve boyama için alt optimal koşullar, FC'yi gerçekleştirirken üreticinin talimatlarına sıkı sıkıya bağlı kalma ihtiyacını vurgulayarak yanlış sonuçlar tespit etti.
Erken ve geç biyobelirteç tanımlaması ile yapılan bu apoptoz çalışması, apoptozun araştırılması için NCCD kılavuz1'e uygundur. Aktinomisin D ile tedavi edilen SiHa kültürleri, erken ve geç apoptotik aşamalar için pozitif biyobelirteçler göstermiştir. Ek V / PI testi ve mitokondriyal geçirgenlik testi, aktinomisin D'nin sırasıyla bir PS-çevirme paterni ve mitokondriyal membran geçişinin dağılmasını indüklediğini göstermiştir. Apoptotik hücreler mitokondriyal pertürbasyonun neden olduğu geri dönüşü olmayan noktaya ulaştığında, terminal kaspazlaraktive edilir 3,7. Bu çalışmada gözlenen terminal kaspazlar 3 ve 7'nin aktivasyonu geç evre apoptozu göstermektedir. Ayrıca, terminal kaspaz aktivasyonu, internükleozomal DNA bölünmesine ve yaygın DNA fragmantasyonuna neden olur, bu da klasik olarak jel elektroforezi28,38 tarafından gözlenen bir basamak merdiven paterni olarak bildirilmiştir.
ATM ve H2A ile nükleer hasar. X FC DNA hasar testi, DNA'da çift iplikçik kırılmaları ve toplam DNA hasarı gösterdi. Bu sonuçlar, deneysel kültürlerde klasik aşağı akış kaspazına bağlı apoptotik nükleer hasarı (karyorrhexis ve karyorrlysis) doğruladı. Çoklu akım sitometrik biyobelirteçlerin kullanılması, apoptozda sıralı çok aşamalı olayları tespit etti ve erken ve geç apoptotik aşamalarda hücre popülasyonlarını doğru ve tekrarlanabilir bir şekilde tanımladı. Bu bulgular, insanlarda kanser tedavisinde aktinomisin D'nin bilinen pro-apoptotik özellikleri ile tutarlıdır 37,39,40,41 ve apoptozu araştıran FC hücre kültürü deneylerinde pozitif bir kontrol olarak aktinomisin D'nin kullanımını desteklemektedir.
Bu çalışmada hücre popülasyonlarının geçidi, apoptotikleri sağlıklı hücrelerden ayıran negatif ortam ve çözücü kontrolleri ile bilgilendirilmiştir. Alternatif olarak, pozitif ve negatif kontrol popülasyonlarının bir karışımı, hücre popülasyonu kapılarını 7,9'u ayarlamak için canlı ve apoptotik hücre popülasyonlarını tanımlamak için de kullanılabilir. Hastalıklı ve sağlıklı hücresel durumlar tanımlandıktan ve geçitlendikten sonra, şablon ayarları sonraki tüm deney ve kontrol kültürlerine uygulanabilir.
Yanlış sonuçlardan kaçınmak için FC protokolüne sıkı sıkıya bağlı kalmak esastır. Protokolün optimizasyonu sırasında, aşağıdaki problemler gözlendi: (1) düşük hücre konsantrasyonu, (2) yüksek hücre konsantrasyonu, (3) hücre kümelenmesi, (4) uzun süreli boyama ve (5) zayıf numune kullanımı. Bu sorunlar, optimize edilmiş protokol gereksinimlerine sıkı sıkıya bağlı kalınarak önlenebilir. Bu, FC'nin doğru verileri elde etmesi için analitik öncesi ve analitik adımların çok önemli doğasını vurgulamaktadır. Hücre hazırlığı sırasında, tripsinizasyon, pipetleme, santrifüjleme ve seyreltmeler dikkatle yapılmalıdır. Aşırı tripsinizasyon ve kuvvetli pipetleme, sırasıyla hücrelerin kimyasal ve mekanik olarak kesilmesine neden olabilir. Uzun süreli ve yüksek hızlı santrifüjleme, hücre parçalanmasına ve yüksek hücresel enkaz sayımlarına neden olabilir. Hücre olaylarının yanlış edinilmesini en aza indirmek için optimal hücre konsantrasyonu gereklidir. Bu nedenle, optimal hücre konsantrasyonu elde etmek için birincil hücre süspansiyonları seyreltilmelidir.
Ayrıca, numuneleri işlerken, hücre kümelenmesini ve hücre parçalanmasını önlemek ve analiz sırasında hücrelerin süspansiyonda kalmasını sağlamak için özen gösterilmelidir. Hücre kümelenmesini önlemek için numune işleme, tek laminer hücre akışına izin verir, cihazın kılcal borusunun mekanik tıkanmasını önler ve sahte büyük hücre boyutu indekslerini engeller. Diğer bir uyarı, foto-oksidasyonu önlemek için kültürleri ışığa karşı korumak ve yanlış negatif sonuçları önlemek için tahlillerde floroforların söndürülmesidir. Hücrelerin boyama adımında ve sonraki işlem adımlarında minimum ışığa maruz kalmayı sağlamak için özen gösterilmelidir. Ayrıca, uzun süreli immün boyama süreleri, proteinler spesifik olarak boyanmadığı için yanlış pozitif sonuçlara neden olabilir. Bu nedenle, üretici tarafından reçete edilen inkübasyon boyama sürelerine bağlılık önemlidir.
Özetle, FC apoptozu doğru bir şekilde tespit edebilir ve hücre kültüründe erken ve geç apoptoz biyobelirteçleri arasında ayrım yapabilir. Ek olarak, teknolojideki ilerlemeler, uzman olmayan bilim adamlarının hücre sağlığını ve karmaşık hücre içi sinyal yollarını incelemeleri için tezgah üstü akış sitometrelerinin üretilmesine yol açmıştır.
Açıklamalar
Luminex® Corporation nazikçe makale işleme ücretleri sağladı.
Teşekkürler
Çalışma, Ulusal Araştırma Vakfı (NRF) ve Güney Afrika Tıbbi Araştırma Konseyi (SAMRC) tarafından finansal olarak desteklendi. Guava Muse Hücre Analizörü'nü satın aldığı için Ulusal Sağlık Laboratuvarı Servisi'ne (NHLS) teşekkür ederiz. Bu yayındaki tüm rakamlar Biorender.com ile oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 6-well plates | Lasec | P1PLA044C-000006 | |
| Dimethyl Sulfoxide | Sigma-Aldrich | D8418 | |
| DMEM | ThermoFisher | 41966052 | |
| Glutamine | Sigma-Aldrich | P10-040500 | |
| Guava Muse Cell Analyzer | Luminex | 0500-3115 | |
| Microcentrifuge tubes/Eppendorf | Merck | EP0030122208-200EA | |
| Muse Annexin V kit | Merck | MCH100105 | |
| Muse Caspase-3/7 kit | Merck | MCH100108 | |
| Muse Count and Viability kit | Merck | MCH600103 | |
| Muse DNA Damage kit | Merck | MCH200107 | |
| Muse MitoPotential kit | Merck | MCH100110 | |
| PBS Buffer | ThermoFisher | 70013065 | |
| Pen-strep | Sigma-Aldrich | P4333 | |
| SiHa cells | ATCC | CRL-1550 | |
| T25 culture flasks | Sigma-Aldrich | C6231 | |
| Trypsin | Pan Biotech | P10-040500 |
Referanslar
- Galluzzi, L., et al. Molecular mechanisms of cell death: Recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death and Differentiation. 25 (3), 486-541 (2018).
- Kerr, J. F., Wyllie, A. H., Currie, A. R. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. British journal of cancer. 26 (4), 239-257 (1972).
- Riccardi, C., Nicoletti, I. Analysis of apoptosis by propidium iodide staining and flow cytometry. Nature Protocols. 1 (3), 1458-1461 (2006).
- Edinger, A. L., Thompson, C. B. Death by design: apoptosis, necrosis and autophagy. Current Opinion in Cell Biology. 16 (6), 663-669 (2004).
- Arends, M. J., Morris, R. G., Wyllie, A. H. Apoptosis. The role of the endonuclease. The American journal of pathology. 136 (3), 593-608 (1990).
- Majno, G., Joris, I. Apoptosis, oncosis, and necrosis. An overview of cell death. Am J Pathol. 146 (1), 3-15 (1995).
- Darzynkiewicz, Z., Traganos, F., Al-Rubeai, M. . Apoptosis. , 33-73 (1998).
- Wlodkowic, D., Skommer, J., Darzynkiewicz, Z. Flow cytometry-based apoptosis detection. Methods in molecular biology. 559, 19-32 (2009).
- . Introduction to Flow Cytometry Basics Available from: https://www.bio-rad-antibodies.com/introduction-to-flow-cytometry.html (2021)
- Telford, W. G., Komoriya, A., Packard, B. Z. Detection of localized caspase activity in early apoptotic cells by laser scanning cytometry. Cytometry. 47 (2), 81-88 (2002).
- Castedo, M., et al. Quantitation of mitochondrial alterations associated with apoptosis. J Immunol Methods. 265 (1-2), 39-47 (2002).
- McKinnon, K. M. Flow Cytometry: An Overview. Current protocols in immunology. 120, 1-11 (2018).
- Macey, M. G. Flow cytometry: principles and clinical applications. Med Lab Sci. 45 (2), 165-173 (1988).
- Darzynkiewicz, Z., et al. Features of apoptotic cells measured by flow cytometry. Cytometry. 13 (8), 795-808 (1992).
- Darzynkiewicz, Z., et al. Cytometry in cell necrobiology: Analysis of apoptosis and accidental cell death (necrosis). Cytometry. 27 (1), 1-20 (1997).
- Ormerod, M. G. The study of apoptotic cells by flow cytometry. Leukemia. 12 (7), 1013-1025 (1998).
- van Engeland, M., Nieland, L. J., Ramaekers, F. C., Schutte, B., Reutelingsperger, C. P. Annexin V-affinity assay: a review on an apoptosis detection system based on phosphatidylserine exposure. Cytometry. 31 (1), 1-9 (1998).
- Vermes, I., Haanen, C., Reutelingsperger, C. Flow cytometry of apoptotic cell death. Journal of Immunological Methods. 243 (1), 167-190 (2000).
- Jahan-Tigh, R. R., Ryan, C., Obermoser, G., Schwarzenberger, K. Flow cytometry. J Invest Dermatol. 132 (10), 1-6 (2012).
- Lövborg, H., Gullbo, J., Larsson, R. Screening for apoptosis-classical and emerging techniques. Anti-cancer drugs. 16 (6), 593-599 (2005).
- Vorobjev, I. A., Barteneva, N. S. Multi-parametric imaging of cell heterogeneity in apoptosis analysis. Methods. 112, 105-123 (2017).
- Telford, W. G., Komoriya, A., Packard, B. Z. Multiparametric analysis of apoptosis by flow and image cytometry. Methods in molecular biology. 263, 141-160 (2004).
- Kagami, S., Rizzo, H. L., Lee, J. J., Koguchi, Y., Blauvelt, A. Circulating Th17, Th22, and Th1 cells are increased in psoriasis. J Invest Dermatol. 130 (5), 1373-1383 (2010).
- . Muse® Annexin V & Dead Cell Kit Available from: https://www.luminexcorp.com/muse-annexin-v-dead-cell-kit/ (2019)
- Roederer, M. Spectral compensation for flow cytometry: visualization artifacts, limitations, and caveats. Cytometry. 45 (3), 194-205 (2001).
- Kroemer, G., et al. Classification of cell death: recommendations of the Nomenclature Committee on Cell Death. Cell Death and Differentiation. 12 (2), 1463-1467 (2005).
- Apoptosis assays and markers guide. Abcam Available from: https://www.abcam.com/kits/apoptosis-assays (2021)
- Vermes, I., Haanen, C., Steffens-Nakken, H., Reutelingsperger, C. A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V. Journal of Immunological Methods. 184 (1), 39-51 (1995).
- Elmore, S. Apoptosis: A Review of Programmed Cell Death. Toxicologic Pathology. 35 (4), 495-516 (2007).
- Saelens, X., et al. Toxic proteins released from mitochondria in cell death. Oncogene. 23 (16), 2861-2874 (2004).
- Muse™ MitoPotential Kit User's Guide. Luminex Corporation Available from: https://www.luminexcorp.com/muse-mitopotential-kit (2013)
- McIlwain, D. R., Berger, T., Mak, T. W. Caspase functions in cell death and disease. Cold Spring Harbor Perspectives in Biology. 5 (4), 008656 (2013).
- Wigdal, S. S., Kirkland, R. A., Franklin, J. L., Haak-Frendscho, M. Cytochrome c release precedes mitochondrial membrane potential loss in cerebellar granule neuron apoptosis: lack of mitochondrial swelling. Journal of Neurochemistry. 82 (5), 1029-1038 (2002).
- Muse® Caspase-3/7 Kit. Luminex Corporation Available from: https://www.luminexcorp.com/muse-caspase-3-7-kit/#overview (2019)
- Häcker, G. The morphology of apoptosis. Cell and Tissue Research. 301 (1), 5-17 (2000).
- Muse® Multi-Color DNA Damage Kit User's Guide. Luminex Corporation Available from: https://www.luminexcorp.com/muse-multi-color-dna-damage-kit/#overview (2020)
- Kleeff, J., Kornmann, M., Sawhney, H., Korc, M. Actinomycin D induces apoptosis and inhibits growth of pancreatic cancer cells. International journal of cancer. 86 (3), 399-407 (2000).
- Wlodkowic, D., Skommer, J., Darzynkiewicz, Z. Cytometry of apoptosis. Historical perspective and new advances. Experimental oncology. 34 (3), 255-262 (2012).
- Szeberenyi, J. The effect of actinomycin D on RNA metabolism in human cells. Biochem Mol Biol Educ. 34 (1), 50-51 (2006).
- Ginell, S., Lessinger, L., Berman, H. M. The crystal and molecular structure of the anticancer drug actinomycin D--some explanations for its unusual properties. Biopolymers. 27 (5), 843-864 (1988).
- Hou, M. H., Robinson, H., Gao, Y. G., Wang, A. H. Crystal structure of actinomycin D bound to the CTG triplet repeat sequences linked to neurological diseases. Nucleic Acids Res. 30 (22), 4910-4917 (2002).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır