需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
检测蛋白质低洼构象状态的高压NMR实验
摘要
我们详细描述了组装高压电池所需的步骤,建立并记录了高压NMR实验,最后分析了压力下的峰值强度和化学移位变化。这些实验可以为蛋白质的折叠途径和结构稳定性提供有价值的见解。
摘要
高压是一种众所周知的扰动方法,可用于破坏球状蛋白的稳定,并以可逆的方式分离蛋白质复合物。静水压力将热力学平衡推向摩尔体积较低的状态。因此,压力的增加提供了微调球蛋白稳定性和蛋白质复合物寡聚平衡的机会。高压NMR实验通过结合压力扰动的精细稳定性调谐能力和溶液NMR光谱提供的位点分辨率,对球蛋白稳定性、折叠机制和寡聚机制的因素进行了详细描述。在这里,我们提出了一个协议,通过一组从1巴记录到2.5千巴的2D 1H-15N实验来探索蛋白质的局部折叠稳定性。获取和分析此类实验所需的步骤用在 hnRNPA1 的 RRM2 域获得的数据来说明。
引言
人们早就认识到,高能量、稀疏的蛋白质和蛋白质复合物的构象状态在许多生物途径1、2、3中起着关键作用。由于基于卡尔-珀塞尔-梅布姆-吉尔(CPMG)4、化学交换饱和转移(CEST)5和暗态交换饱和转移(DEST)6脉冲序列(等)的实验,解决方案NMR光谱学已成为描述瞬态构象状态7的一种选择方法。除了这些实验,可以引入温度、pH值或化学变性剂等扰动,以增加高能量构象亚态的相对数量。同样,蛋白质平衡也可以通过施加高静水压力来扰乱。根据与相应的构象变化相关的体积变化的大小,压力增加几百到几千条可以显著稳定更高的能量状态或导致蛋白质完全展开8,9,10。蛋白质NMR光谱通常显示两种类型的水静压变化:(i) 化学转移变化和(ii) 峰值强度变化。化学移位变化反映了蛋白质地表水界面的变化和/或蛋白质结构的局部压缩在快速的时间尺度(相对于NMR时间尺度)11。表现出大型非线性化学转移压力依赖性的十字说可以表明存在较高的能量构象状态12,13。另一方面,峰值强度变化指向缓慢时间尺度上的主要构象过渡,例如折叠/展开状态人口的变化。折叠中间体或更高能量状态的存在可以从体积变化幅度的巨大变化中检测到,当展开测量给定蛋白质的不同残留物14,15,16,17。根据我们的经验,即使是通常被归类为两州文件夹的微小蛋白质,对压力的反应也不均匀,这为当地折叠稳定性提供了有用的信息。这里描述的是获取和分析中层峰值强度和1H化学转移压力依赖性的协议,用作模型蛋白的分离RNA识别主题2(RRM2)的异质核核核蛋白A1(hnRNPA1)。
研究方案
注:此处描述的协议要求 (i) 高压泵和电池具有 2.5 kbar 额定铝硬氧化锌管18,(ii)软件 SPARKY19 用于分析 NMR 光谱,(iii) 曲线拟合软件。
1. 样品制备、高压电池组装和设置实验。
- 缓冲器的选择:使用等离子和离子缓冲的混合物,如磷酸盐和三叶草20,21。
注:磷酸盐和 MES 等电离子缓冲器的 pKa 与大量反应体积(即酸和电电产品的部分摩尔体积的差异)相关。因此,这种缓冲器的pH值可能会受到压力变化(+0.25-0.5 pH单位/kbar)的显著影响。 - 确保所需的样品体积与标准直径为 3 mm 的 NMR 管 (+300μL) 相似。
- 将带有玻璃移液器的 15个 N 标记样品引入氧化锌管。确保样品座椅位于管子底部。配以 200 μL 矿物油,以防止样品与输送液(例如水)混合。将管子的其余部分填充透气液。
- 将一次性 O 环放在氧化锌管顶部,将管子滑入底座(图 1A,B)。然后,将管子连接到高压系绳线,然后先用手将底座拧紧到细胞上。然后,应用 14.7 Nm 的扭矩,以防止在较低压力下泄漏(图 1C,D)。
- 为了检查压力电池组件的完整性,使用电池支撑和密封容器对光谱仪外的管子加压至 300 条。等待 15 分钟,将压力重置为 1 条,并使用干净的无绒毛擦拭检查泄漏情况。
- 通过仔细引导系绳线,将未加压管插入光谱仪。在光谱仪中滑动管,直到达到样品坐姿(图1E)。
- 锁定、闪烁、匹配,并像往常一样调整 1H 和 15N 频道。
注:高压额定氧化锌管的下缝与标准 NMR 管大不相同。建议保存优化的微光以供将来使用。 - 设置1H-15N-HSQC 或 TROSY-HSQC,并在大气条件下(1bar)记录参考实验。
2. 记录高压NMR实验
- 逐渐增加压力从1巴到2.5千巴与500条增量,以测试蛋白质的整体稳定性。默认情况下,将压力泵的速度设置为 +18 bar/s。如果不知道精确的折叠/展开速率,请让样品在每个 500 条增量后均等于 15-20 分钟。以 2.5 kbar 记录频谱。
- 逐渐将压力降低到 1 条,用 500 条步数测试压力扰动的可逆性。在大气条件下记录另一个频谱,并将化学变化和峰值强度与以前在相同条件下记录的参考光谱进行比较。
注:如果在压力运行后,原生十字线更强烈,则可能表明大气压力溶液中的小聚合体可能已分离并适当重新折叠。另一方面,强度损失或重大化学变化表明,蛋白质在高压条件下可能会经历不可逆的误折叠。 - 每 500 条记录一系列 2D 实验,从 1 巴到 2.5 kbar。建议在折叠/展开过渡的拐点附近记录其他实验,以提高拟合精度。
3. 分析峰值强度变化
- 处理所有光谱,将骨干任务从 1 bar 的参考频谱传输到 500 bar 记录的光谱,然后将作业从 500 条转移到 1 kbar 等。
注:由于压力诱导 1 H 和15N 化学移位的非均匀转移,因此不要简单地将骨干作业从一个频谱复制到另一个频谱。 手动调整。 - 在火花菜单中,单击 峰值>峰列表 (lt)。在 峰值列表 窗口中,单击 选项 并选择显示 频率 (ppm) 和 数据高度的选项。保存为每个频谱获得的列表。
- 在曲线拟合软件中,复制交叉话标识和峰值强度值,将压力值(在条形中)作为 X 轴变量,将强度作为 Y 轴变量。
- 如果观察到完整或接近完整(>80%)展开,则分别使用简单的两态模型,适合各个峰值强度轮廓,以在展开时提取自由能量和体积变化:
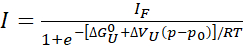 Eq. 1
Eq. 1
其中,"I"是特定压力 p 和 I F 下观测到的交叉话的强度,而 IF是完全折叠状态下同一交叉话的强度。R 是气体常数,T 是绝对温度,\G U0标准 Gibbs 自由能量差在大气压力 p0 (1 bar) 展开和折叠状态之间展开,并且 \Vu展开时体积变化。在开尔文的杆和温度 T 中,R = 1.987 卡/K,+GU0在卡尔/摩尔,+VU在卡尔/摩尔/酒吧。将从拟合物获得的+VU值乘以41.84,转换为mL/mol。 在这里,所有参数都表示关于展开的反应,但可以很容易地转换成折叠反应参数(+GU0 = -=GF0和+VU = -ÉVF)。
4. 分析化学移位变化
- 安排软件中的列,以便将压力点变为可变,从 Sparky 列表中提取的 1H 化学位移为 Y 轴。
- 将 1H 化学转移的压力依赖性适合简单的二次方程:
δ (p) = δ0(p0) = B1(p-p0) = B2 (p-p0)2 Eq. 2
其中,δ(p)是测得的1H化学移位的交叉嘴在给定压力p和δ 0(p0)在参考频谱中记录的1H化学移位在1bar。B1和 B2分别表示 ppm/bar 和 ppm/bar2中表示的第一和第二顺序参数。
结果
此处描述的协议用于调查 RRM2 的压力依赖性,RRM2 是 hnRNPA1 的第二个 RNA 识别主题(残留物 95-106),几乎完全展开于 2.5 kbar 范围内(>90%)。1H-15N光谱收集在1杆,500杆,750杆,1巴,1.5千巴,2公里,和2.5千巴(图2)。由于在2.5千巴的噪音水平以上看不到任何本地十字语,所有相应的残留物在这种压力下的强度值均为0(图3A)。根据方程 ...
讨论
这项研究详细介绍了一项旨在探测蛋白质结构和热力学对压力扰动的反应的协议。RRM2上记录的高压实验表明,在相对较小的单一领域蛋白质中,可以发现+VU值的巨大变化,表明非完全合作展开。分析压力下的1H化学移位变化时,也出现了类似的情况。应当指出,卡尔比策和同事已经证明,可以对化学移位变化进行更深入的分析,将非线性和线性系数(B2/B1)与可压...
披露声明
所有作者都阅读并批准了手稿。他们宣布没有利益冲突。
致谢
这项工作得到了罗伊·卡弗慈善信托基金和朱利安·罗氏基金的支持。我们感谢J.D.莱文古德和B.S.托尔伯特提供RRM2样本。
材料
| Name | Company | Catalog Number | Comments |
| Bruker Nmr Cell 2.5 Kbar | Daedalus Innovations LLC | NMRCELL-B | |
| Sparky3 | University of California San Francisco, CA | N/A | |
| Xtreme-60 Syringe pump | Daedalus Innovations LLC | XTREME-60 |
参考文献
- Alderson, R. T., Kay, L. E. Unveiling invisible protein states with NMR spectroscopy. Current Opinion in Structural Biology. 60, 39-49 (2020).
- Korzhnev, D. M., Kay, L. E. probing invisible, low-populated states of protein molecules by relaxation dispersion NMR spectroscopy: An application to protein folding. Accounts of Chemical Research. 41, 442-451 (2008).
- Loria, P. J., Berlow, R. B., Watt, E. D. Characterization of enzyme motions by solution NMR relaxation dispersion. Accounts of Chemical Research. 41, 214-221 (2008).
- Ishima, R. CPMG relaxation dispersion. Methods in Molecular Biology. 1084, 29-49 (2014).
- Longo, D. L., et al. Chemical exchange saturation transfer (CEST): an efficient tool for detecting molecular information on proteins' behaviour. Analyst. 39, 2687-2690 (2014).
- Fawzi, N. L., Ying, J., Torchia, D. A., Clore, M. G. Probing exchange kinetics and atomic resolution dynamics in high-molecular-weight complexes using dark-state exchange saturation transfer NMR spectroscopy. Nature Protocols. 7, 1523-1533 (2012).
- Anthis, N. J., Clore, M. G. Visualizing transient dark states by NMR spectroscopy. Quarterly Reviews of Biophysics. 48, 35-116 (2015).
- Roche, J., et al. Cavities determine the pressure unfolding of proteins. Proceedings of the National Academy of Sciences of the United States of America. 109, 6945-6950 (2012).
- Chen, C. R., Makhatadze, G. I. Molecular determinant of the effects of hydrostatic pressure on protein folding stability. Nature Communications. 8, 14561 (2017).
- Roche, J., Royer, C. A. Lessons from pressure denaturation of proteins. Journal of the Royal Society Interface. 15, 20180244 (2018).
- Xu, X., Gagné, D., Aramini, J. M., Gardner, K. H. Volume and compressibility differences between protein conformations revealed by high-pressure NMR. Biophysical Journal. 120, 924-935 (2021).
- Akasaka, K., Li, H. Low-lying excited states of proteins revealed from non-linear pressure shifts in 1H and 15N NMR. Biochemistry. 40, 8665-8671 (2001).
- Akasaka, K. Probing conformational fluctuation of proteins by pressure perturbation. Chemical Reviews. 106, 1814-1835 (2006).
- Kitahara, R., Yokoyama, S., Akasaka, K. NMR snapshots of a fluctuating protein structure: ubiquitin at 30 bar-3 kbar. Journal of Molecular Biology. 347, 277-285 (2005).
- Roche, J., et al. remodeling of the folding free energy landscape of Staphylococcal nuclease by cavity-creating mutations. Biochemistry. 51, 9535-9546 (2012).
- Nucci, N. V., Fuglestad, B., Athanasoula, E. A., Wand, J. A. Role of cavities and hydration in the pressure unfolding of T4 lysozyme. Proceedings of the National Academy of Sciences of the United States of America. 111, 13846-13851 (2014).
- Maeno, A., et al. Cavity as a source of conformational fluctuation and high-energy state: High-pressure NMR study of a cavity-enlarged mutant of T4 lysozyme. Biophysical Journal. 108, 133-145 (2015).
- Peterson, R. W., Wand, J. A. Self-contained high-pressure cell, apparatus, and procedure for the preparation of encapsulated proteins dissolved in low viscosity fluids for nuclear magnetic resonance spectroscopy. Review of Scientific Instruments. 76, 094101 (2005).
- Goddard, T. D., Kneller, D. G. . Sparky 3. , (2010).
- Caro, J. A., Wand, J. A. Practical aspects of high-pressure NMR spectroscopy and its applications in protein biophysics and structural biology. Methods. 148, 67-80 (2018).
- Kitamura, T., Itoh, J. Reaction volume of protonic ionization for buffering agents. Prediction of pressure dependence of pH and pOH. Journal of Solution Chemistry. 16, 715-725 (1987).
- Royer, C. A. Revisiting volume changes in pressure-induced protein unfolding. Biochimica et Biophysica Acta. 1595, 201-209 (2002).
- Erlach, M. B., et al. Relationship between nonliner pressure-induced chemical shift changes and thermodynamic parameters. Journal of Physical Chemistry B. 118, 5681-5690 (2014).
- de Oliveira, G. A. P., Silva, J. L. A hypothesis to reconcile the physical and chemical unfolding of proteins. Proceedings of the National Academy of Sciences of The United States of America. 112, 2775-2784 (2015).
- Nguyen, L. M., Roche, J. High-pressure NMR techniques for the study of protein dynamics, folding and aggregation. Journal of Magnetic Resonance. 277, 179-185 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。