Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Эксперименты ямР высокого давления для обнаружения белковых низколежащих конформационных состояний
В этой статье
Резюме
Мы предоставляем подробное описание этапов, необходимых для сборки ячейки высокого давления, настройки и записи экспериментов с ЯМР высокого давления и, наконец, анализа как пиковой интенсивности, так и изменений химического сдвига под давлением. Эти эксперименты могут дать ценную информацию о путях сворачивания и структурной стабильности белков.
Аннотация
Высокое давление является хорошо известным методом возмущения, который может быть использован для дестабилизации глобулярных белков и диссоциации белковых комплексов обратимым образом. Гидростатическое давление приводит термодинамическое равновесие к состоянию (состояниям) с меньшим молярным объемом. Таким образом, повышение давления дает возможность точно настроить стабильность глобулярных белков и равновесия олигомеризации белковых комплексов. Эксперименты с ЯМР высокого давления позволяют детально охарактеризовать факторы, управляющие стабильностью глобулярных белков, механизмы их сворачивания и механизмы олигомеризации, сочетая способность тонкой настройки стабильности возмущения давлением и разрешение сайта, предлагаемое растворной ЯМР-спектроскопией. Здесь мы представляем протокол для исследования локальной стабильности сворачивания белка с помощью набора экспериментов 2D 1H-15N, записанных от 1 бар до 2,5 кбар. Шаги, необходимые для получения и анализа таких экспериментов, иллюстрируются данными, полученными по домену RRM2 hnRNPA1.
Введение
Давно признано, что высокоэнергетические, малонаселенные конформационные состояния белков и белковых комплексов играют ключевую роль во многих биологических путях1,2,3. Благодаря экспериментам, основанным на последовательностях импульсов Карра-Перселла-Мейбума-Гилла (CPMG)4,переноса насыщения химического обмена (CEST)5и переносанасыщения обмена в темном состоянии (DEST) 6 (среди прочих), раствор ЯМР-спектроскопии появился в качестве метода выбора для характеристики переходных конформационных состояний7. Наряду с этими экспериментами могут быть введены возмущения, такие как температура, рН или химические денатуранты, чтобы увеличить относительную популяцию конформационных субсостояний с более высокой энергией. Аналогичным образом, белковые равновесия также могут быть возмущены применением высокого гидростатического давления. В зависимости от величины изменения объема, связанного с соответствующими конформационными изменениями, увеличение давления на несколько сотен до нескольких тысяч бар может значительно стабилизировать более высокое энергетическое состояние или привести к полному раскрытию белкана 8,9,10. Спектры ЯМР белка обычно отображают два типа изменений с гидростатическим давлением: (i) изменения химического сдвига и (ii) изменения пиковой интенсивности. Изменения химического сдвига отражают изменения на границе раздела белка с поверхностью воды и/или локальное сжатие структуры белка в быстрой шкале времени (относительно шкалы времени ЯМР)11. Поперечные спицы, демонстрирующие большие нелинейные химические сдвиги зависимости давления, могут указывать на наличие более высоких энергетических конформационных состояний12,13. С другой стороны, изменения пиковой интенсивности указывают на крупные конформационные переходы в медленной шкале времени, такие как изменения в сложенных / развернутых популяциях состояний. Наличие складчатых промежуточных продуктов или более высоких энергетических состояний может быть обнаружено по большим вариациям величины изменения объема при развертывании, измеренному для различных остатков данного белка14,15,16,17. Основываясь на нашем опыте, даже небольшие белки, которые обычно классифицируются как папки с двумя состояниями, демонстрируют неоднородные реакции на давление, что дает полезную информацию об их локальной стабильности сворачивания. Здесь описан протокол получения и анализа зависимости от амидных пиковых и химических сдвигов 1H, использующих в качестве модели белка изолированный мотив распознавания РНК 2 (RRM2) гетерогенного ядерного рибонуклеопротеина A1 (hnRNPA1).
протокол
ПРИМЕЧАНИЕ: Протокол, описанный здесь, требует (i) насоса высокого давления и ячейки с алюминиевой закаленной циркониевой трубкой 2,5 кбар18,(ii) программного обеспечения SPARKY19 для анализа спектров ЯМР и (iii) программного обеспечения для установки кривых.
1. Пробоподготовка, сборка ячейки высокого давления и постановка экспериментов.
- Выбор буфера: Используйте равную смесь анионных и катионных буферов, таких как фосфат и Tris20,21.
ПРИМЕЧАНИЕ: pKa арионных буферов, таких как фосфат и MES, связан со значительным реакционным объемом (т.е. разницей в частичных моляных объемах кислоты и ионизированных продуктов). Таким образом, на рН таких буферов может существенно повлиять изменение давления (~0,25-0,5 рН единицы/кбар). - Убедитесь, что требуемый объем образца аналогичен объему стандартной ЯМР-трубки диаметром 3 мм (~300 мкл).
- Введите образец с маркировкой 15N со стеклянной пипеткой в циркониевые трубки. Убедитесь, что образец сидит в нижней части трубки. В комплекте с 200 мкл минерального масла для предотвращения смешивания образца с трансмиссионной жидкостью (например, водой). Заполните остальную часть трубки трансмиссионной жидкостью.
- Поместите одноразовое уплотнительное кольцо поверх циркониевой трубки и вставьте трубку в основание(рисунок 1A,B). Затем подключите трубку к линии троса высокого давления и затяните основание к ячейке сначала вручную. Затем примените 14,7 Нм крутящего момента для предотвращения утечек при более низком давлении(рисунок 1C,D).
- Чтобы проверить целостность ячейки давления в сборе, нажмите трубку до 300 бар вне спектрометра с помощью поддержки ячейки и защитного сосуда. Подождите 15 минут, сбросьте давление до 1 бар и проверьте наличие утечек чистой безворсовой салфеткой.
- Вставьте трубку без давления в спектрометр, осторожно направляя линию троса. Сдвиньте трубку в спектрометр до тех пор, пока не достигнете сидячего положенияобразца (рисунок 1Е).
- Как обычно, блокируйте, сжимайте, сопоставляйте и настраивайте каналы 1H и 15N.
ПРИМЕЧАНИЕ: Прокладки для циркониевых трубок высокого давления сильно отличаются от стандартных ЯМР-трубок. Рекомендуется сохранить оптимизированные прокладки для дальнейшего использования. - Установите 1H-15N-HSQC или TROSY-HSQC и запишите эталонный эксперимент в атмосферных условиях (1 бар).
2. Запись экспериментов с ЯМР высокого давления
- Постепенно увеличивайте давление с 1 бар до 2,5 кбар с шагом 500 бар, чтобы проверить общую стабильность белка. Установите скорость напорного насоса по умолчанию на ~18 бар/с. Если точные скорости складывания/разворачивания неизвестны, пусть образец уравновешивается через 15-20 минут после каждого 500-барного приращения. Запись спектра при 2,5 кбар.
- Постепенно снижайте давление обратно до 1 бар с шагом 500 бар, чтобы проверить обратимость возмущения давления. Запишите другой спектр в атмосферных условиях и сравните химические сдвиги и пиковые интенсивности с этим спектром, ранее зарегистрированным в тех же условиях.
ПРИМЕЧАНИЕ: Если нативные поперечные поперечные трубы более интенсивны после пробега давления, это может указывать на то, что мелкие агрегаты, присутствующие в растворе при атмосферном давлении, могут диссоциировать и правильно сворачиваться. С другой стороны, потеря интенсивности или значительные изменения химического сдвига предполагают, что белок может испытывать необратимое неправильное сворачивание в условиях высокого давления. - Запишите серию 2D-экспериментов от 1 бар до 2,5 кбар каждые 500 бар. Рекомендуется записывать дополнительные эксперименты вблизи точки перегиба перехода складывания/разворачивания для повышения точности подгонки.
3. Анализ изменений пиковой интенсивности
- Обработайте все спектры и перенесите основное назначение из опорного спектра при 1 бар в спектр, записанный при 500 бар, а затем перенесите назначение с 500 бар на 1 кбар и так далее.
ПРИМЕЧАНИЕ: Поскольку давление вызывает неравномерный сдвиг химических сдвигов на 1Н и 15Н, не следует просто копировать распределение магистрали из одного спектра в другой. Отрегулируйте его вручную. - В меню Sparky выберите Пик > ПикОвый список (lt). В окне «Список пиков» нажмите «Параметры» и выберите параметр для отображения частот (ppm) и высоты данных. Сохраните список, полученный для каждого спектра.
- В программном обеспечении для подгонки кривых скопируйте идентификатор крестообразного и пикового значения интенсивности, чтобы значения давления (в барах) были переменной оси X, а интенсивность — переменной оси Y.
- Если наблюдается полное или почти полное (>80%) развертывание, подготовьте отдельные профили пиковой интенсивности для извлечения свободной энергии и изменения объема при развертывании, соответственно, используя простую модель двух состояний:
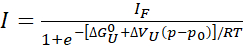 Экв. 1
Экв. 1
Где «I» — наблюдаемая интенсивность поперечного скрипа при заданном давлении p, а IF — интенсивность одного и того же кросспика в полностью сложенном состоянии. R — газовая постоянная, T — абсолютная температура, ΔGU0 — стандартная разность свободной энергии Гиббса между развернутым и сложенным состояниями при атмосферном давлении p0 (1 бар) и ΔVu изменение объема при разворачивании. При давлении p в баре и температуре T в кельвинах R = 1,987 кал/К, ΔGU0 в кал/моль, а ΔVU в кал/моль/бар. Умножьте значения ΔVU, полученные из прилега, на 41,84 для преобразования в мл/моль. Значения ΔVU обычно находятся в диапазоне от -50 до -150 мл/моль для глобулярных белков22. Здесь все параметры выражены относительно разворачивающейся реакции, но могут быть легко преобразованы в параметры реакции складывания (ΔGU0 = -ΔGF0 и ΔVU = -ΔVF).
4. Анализ изменений химического сдвига
- Расположите столбцы в программном обеспечении таким образом, чтобы точки давления были переменными, а химические сдвиги 1H, извлеченные из списков Sparky, были осью Y.
- Уложить зависимость давления химических сдвигов 1H к простому квадратичному уравнению:
δ(p) = δ0(p0) + B1(p-p0) + B2 (p-p0)2 экв. 2
Где,δ(p)- измеренный химическийсдвиг поперечного поперечного δ0(p0) 1H химических сдвигов того же поперечного спектра в опорном спектре, зарегистрированных при 1 баре. B1 и B2 представляют параметры первого и второго порядка, выраженные в ppm/bar и ppm/bar2соответственно.
Результаты
Описанный здесь протокол был использован для исследования зависимости давления RRM2, второго мотива распознавания РНК hnRNPA1 (остатки 95-106), который почти полностью развернут в диапазоне 2,5 кбар (>90%). 1 1 СпектрыH-15N были собраны при 1 бар, 500 бар, 750 бар, 1 кбар, 1,5 кбар, 2 кбар и 2,5 кбар
Обсуждение
В этом исследовании подробно описывается протокол, реализованный для исследования структурных и термодинамических реакций белка на возмущение давления. Эксперименты с высоким давлением, записанные здесь на RRM2, демонстрируют, что большие вариации значений ΔVU, свидетельствующие...
Раскрытие информации
Все авторы прочитали и одобрили рукопись. Они не заявляют о конфликте интересов.
Благодарности
Эта работа была поддержана средствами благотворительного фонда Роя Карвера Жюльена Роша. Мы благодарим J. D. Levengood и B. S. Tolbert за любезное предоставление образца RRM2.
Материалы
| Name | Company | Catalog Number | Comments |
| Bruker Nmr Cell 2.5 Kbar | Daedalus Innovations LLC | NMRCELL-B | |
| Sparky3 | University of California San Francisco, CA | N/A | |
| Xtreme-60 Syringe pump | Daedalus Innovations LLC | XTREME-60 |
Ссылки
- Alderson, R. T., Kay, L. E. Unveiling invisible protein states with NMR spectroscopy. Current Opinion in Structural Biology. 60, 39-49 (2020).
- Korzhnev, D. M., Kay, L. E. probing invisible, low-populated states of protein molecules by relaxation dispersion NMR spectroscopy: An application to protein folding. Accounts of Chemical Research. 41, 442-451 (2008).
- Loria, P. J., Berlow, R. B., Watt, E. D. Characterization of enzyme motions by solution NMR relaxation dispersion. Accounts of Chemical Research. 41, 214-221 (2008).
- Ishima, R. CPMG relaxation dispersion. Methods in Molecular Biology. 1084, 29-49 (2014).
- Longo, D. L., et al. Chemical exchange saturation transfer (CEST): an efficient tool for detecting molecular information on proteins' behaviour. Analyst. 39, 2687-2690 (2014).
- Fawzi, N. L., Ying, J., Torchia, D. A., Clore, M. G. Probing exchange kinetics and atomic resolution dynamics in high-molecular-weight complexes using dark-state exchange saturation transfer NMR spectroscopy. Nature Protocols. 7, 1523-1533 (2012).
- Anthis, N. J., Clore, M. G. Visualizing transient dark states by NMR spectroscopy. Quarterly Reviews of Biophysics. 48, 35-116 (2015).
- Roche, J., et al. Cavities determine the pressure unfolding of proteins. Proceedings of the National Academy of Sciences of the United States of America. 109, 6945-6950 (2012).
- Chen, C. R., Makhatadze, G. I. Molecular determinant of the effects of hydrostatic pressure on protein folding stability. Nature Communications. 8, 14561 (2017).
- Roche, J., Royer, C. A. Lessons from pressure denaturation of proteins. Journal of the Royal Society Interface. 15, 20180244 (2018).
- Xu, X., Gagné, D., Aramini, J. M., Gardner, K. H. Volume and compressibility differences between protein conformations revealed by high-pressure NMR. Biophysical Journal. 120, 924-935 (2021).
- Akasaka, K., Li, H. Low-lying excited states of proteins revealed from non-linear pressure shifts in 1H and 15N NMR. Biochemistry. 40, 8665-8671 (2001).
- Akasaka, K. Probing conformational fluctuation of proteins by pressure perturbation. Chemical Reviews. 106, 1814-1835 (2006).
- Kitahara, R., Yokoyama, S., Akasaka, K. NMR snapshots of a fluctuating protein structure: ubiquitin at 30 bar-3 kbar. Journal of Molecular Biology. 347, 277-285 (2005).
- Roche, J., et al. remodeling of the folding free energy landscape of Staphylococcal nuclease by cavity-creating mutations. Biochemistry. 51, 9535-9546 (2012).
- Nucci, N. V., Fuglestad, B., Athanasoula, E. A., Wand, J. A. Role of cavities and hydration in the pressure unfolding of T4 lysozyme. Proceedings of the National Academy of Sciences of the United States of America. 111, 13846-13851 (2014).
- Maeno, A., et al. Cavity as a source of conformational fluctuation and high-energy state: High-pressure NMR study of a cavity-enlarged mutant of T4 lysozyme. Biophysical Journal. 108, 133-145 (2015).
- Peterson, R. W., Wand, J. A. Self-contained high-pressure cell, apparatus, and procedure for the preparation of encapsulated proteins dissolved in low viscosity fluids for nuclear magnetic resonance spectroscopy. Review of Scientific Instruments. 76, 094101 (2005).
- Goddard, T. D., Kneller, D. G. . Sparky 3. , (2010).
- Caro, J. A., Wand, J. A. Practical aspects of high-pressure NMR spectroscopy and its applications in protein biophysics and structural biology. Methods. 148, 67-80 (2018).
- Kitamura, T., Itoh, J. Reaction volume of protonic ionization for buffering agents. Prediction of pressure dependence of pH and pOH. Journal of Solution Chemistry. 16, 715-725 (1987).
- Royer, C. A. Revisiting volume changes in pressure-induced protein unfolding. Biochimica et Biophysica Acta. 1595, 201-209 (2002).
- Erlach, M. B., et al. Relationship between nonliner pressure-induced chemical shift changes and thermodynamic parameters. Journal of Physical Chemistry B. 118, 5681-5690 (2014).
- de Oliveira, G. A. P., Silva, J. L. A hypothesis to reconcile the physical and chemical unfolding of proteins. Proceedings of the National Academy of Sciences of The United States of America. 112, 2775-2784 (2015).
- Nguyen, L. M., Roche, J. High-pressure NMR techniques for the study of protein dynamics, folding and aggregation. Journal of Magnetic Resonance. 277, 179-185 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены