Method Article
移动式单分子FRET探头的自动化二维时空分析
摘要
本文介绍了一种使用宽视场荧光显微镜对基于移动单分子Förster共振能量转移(smFRET)的探针进行时空分析的方法。新开发的软件工具包允许确定移动探针的smFRET时间迹线,包括正确的FRET效率和分子位置,作为时间的函数。
摘要
单分子Förster共振能量转移(smFRET)是一种多功能技术,可报告亚纳米到纳米范围内的距离。它已被广泛用于生物物理和分子生物学实验,包括分子力的测量,生物分子构象动力学的表征,蛋白质细胞内共定位的观察以及受体 - 配体相互作用时间的测定。在宽视场显微镜配置中,实验通常使用表面固定探针进行。在这里,提出了一种将单分子跟踪与交替激发(ALEX)smFRET实验相结合的方法,允许在质膜或玻璃支持的脂质双层中获取表面结合但移动探针的smFRET时间痕迹。为了分析记录的数据,开发了一个自动化的开源软件集合,支持(i)荧光信号的定位,(ii)单颗粒跟踪,(iii)确定与FRET相关的量,包括校正因子,(iv)严格验证smFRET痕量,以及(v)直观地呈现结果。生成的数据可以方便地用作通过专用软件进一步探索的输入,例如,用于评估探针的扩散行为或研究FRET跃迁。
引言
Förster共振能量转移(FRET)一直是分子生物学和生物物理研究的主要驱动力,因为它允许以亚纳米分辨率研究过程。由于供体和受体荧光团之间的能量转移效率很大程度上取决于亚纳米至纳米范围内的染料间距离,因此已有效地将其用作光谱标尺来探索生物分子的静态和动态构象1,2,3,4。此外,FRET现象已被广泛用于膜相关和细胞内蛋白质的体积水平的共定位研究5,6。在过去的二十年中,该方法被应用于监测smFRET事件7,这有助于显着提高时间和空间分辨率,甚至解决了异质样品中罕见的亚群。利用这些技术,对RNA聚合酶II8的转录本处理速率、DNA聚合酶的复制速度9、10、核小体易位率11、组装剪接体的转录本剪接和停滞率12、核糖体亚群的活性13、驱动蛋白马达的行走速度等分子机制的动力学有了独特的见解。,仅举几例。受体-配体相互作用持续时间15 和分子力16 已被量化。
基于强度的smFRET研究通常依靠敏化发射来测量FRET效率:发射路径中的分束器在空间上将来自供体和受体荧光团的光分离,在供体激发时,允许量化单个荧光强度。随后,效率可以计算为受体发射的光子相对于总光子计数的分数17。此外,供体激发(ALEX)后的受体激发允许测量FRET事件的化学计量,有助于区分来自信号的真正低FRET信号,例如,来自具有光漂白受体荧光团的探针18。
单分子FRET实验通常以两种方式之一进行。首先,使用共聚焦显微镜照亮样品体积中的一个小区域。溶液中的单个探针分子碰巧在焦点体积内扩散时会被激发。通过这种技术,可以使用快速光子计数探测器,从而实现亚微秒级的时间分辨率。其次,探针专门固定在表面上,并通过宽视场显微镜进行监测,通常使用全内反射(TIR)配置来最大限度地减少背景荧光。探头固定允许比使用第一种方法更长的记录时间。此外,更大的视野允许并行监控多个探头。与上述方法相比,对相机的需求使得此方法速度较慢。时间分辨率限制为毫秒到秒的范围。
如果需要较长的时间迹线,例如,用于在毫秒到第二时间尺度上研究动态过程,则第一种方法不适用,因为荧光爆发通常太短。当固定不可行时,第二种方法就会失败,例如,在具有探针在细胞膜内扩散的活细胞实验中。此外,已经观察到生物模型系统可以根据接触表面的迁移率而显着改变其响应16。
虽然过去已经进行了记录移动FRET探针的smFRET和单粒子跟踪实验组合19,但没有公开可用的软件来评估数据。这促使了一种新的分析平台的开发,该平台允许确定移动荧光探针的多种特性,包括smFRET效率和化学计量,具有亚像素精度的位置以及作为时间函数的荧光强度。建立了通过检查逐步漂白行为,最近邻距离,发射强度和其他性状来过滤所得痕迹的方法,以专门选择正确合成和功能性的单探针分子。该软件还支持最近在多实验室研究中商定的实验和分析技术,以产生可靠,定量的smFRET数据17。特别是,该实现遵循了计算FRET效率和化学计量的经过验证的程序。供体发射通道IDD和受体发射通道IDA中供体激发时的荧光强度用于使用方程(1)计算视在FRET效率Eapp。
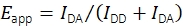 (1)
(1)
在受体激发IAA时受体发射通道中的荧光强度的帮助下,使用Eq(2)计算表观化学计量。
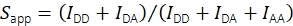 (二)
(二)
FRET效率E和化学计量学S可以通过考虑四个校正因子从Eapp和Sapp推导出来。
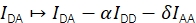
α描述了供体荧光泄漏到受体发射通道中,并且可以使用仅包含供体荧光团的样品或通过分析受体已被漂白的部分轨迹来确定。δ校正供体激发光源对受体的直接激发,并且可以使用仅具有受体荧光团的样品或通过分析供体已被漂白的部分轨迹来测量。
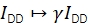 .
.
γ对IDD进行分级,以纠正供体和受体发射通道中的不同检测效率以及荧光团的不同量子效率。该因子可以通过分析受体漂白时在具有高FRET效率的轨迹中白化时供体强度的增加来计算20,或者通过研究具有多个离散FRET状态的样品。
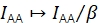
β对IAA进行缩放,以校正供体和受体激发的不同效率。如果通过受体漂白分析确定γ,则可以从已知供体与受体比率的样本中计算出β 21。否则,多态FRET样品也会产生β。
总之,校正允许使用等式(3)计算校正后的FRET效率。
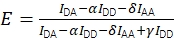 (3)
(3)
以及使用Eq(4)校正的化学计量。
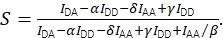 (4)
(4)
理想情况下,供体与受体比为1:1的校正化学计量学给出 S = 0.5。在实践中,降低的信噪比会产生 S测量值的扩散,从而阻碍了仅供体信号(S = 1)和仅受体信号(S = 0)的区分。由此产生的时间轨迹可用作对单分子轨迹进行更详细分析的输入,以获得诸如时空力分布16、单分子事件的迁移率22或不同状态之间的过渡动力学等信息1。
以下协议描述了smFRET跟踪实验的实验参数和程序,以及使用新开发的软件套件进行数据分析的工作原理。对于实验数据的获取,建议使用符合以下要求的显微镜设置:i)检测单染料分子发射的能力;ii)宽视场照明:特别是对于活细胞实验,建议使用全内反射(TIR23,24,25)配置;iii)根据波长对发射光进行空间分离,以便供体和受体荧光投射到同一相机芯片25 或不同相机的不同区域;iv)以毫秒级精度调制供体和受体激发的光源,例如,使用可直接调制的激光器或通过声光调制器进行调制。这允许频闪照明,以最大限度地减少荧光团的光漂白以及交替激发以确定化学计量;v) 每个记录的图像序列输出一个文件,格式可由 PIMS Python 包读取26。特别是,支持多页 TIFF 文件。
研究方案
1. 软件先决条件
- 安装 miniconda Python 发行版27 (最低要求 Python 版本:3.7)。
- 在 Windows"开始"菜单中打开 Anaconda 提示符,或者打开终端并执行 conda 激活 (如果使用 Linux 或 macOS)。
- 通过执行以下命令,启用社区维护的 conda-forge 软件包存储库28 :
conda config --add Channels conda-forge
conda config --set channel_priority strict
康达更新 --所有 - 通过执行以下命令安装所需的 Python 包:
conda install opencv trackpy lmfit ipympl scikit-learn pyqt sdt-python jupyterlab - 熟悉 JupyterLab,分析软件的用户界面(请参阅软件文档29)。
- 安装 git 版本控制系统,稍后将用于下载和更新分析软件。如果使用 Linux,请使用发行版的包管理软件进行下载和更新。否则,请执行:
conda install git - (可选)安装 sidecar Python 包,以便在分析过程中执行过滤步骤后显示数据集:
康达安装边车
2. 样品测量
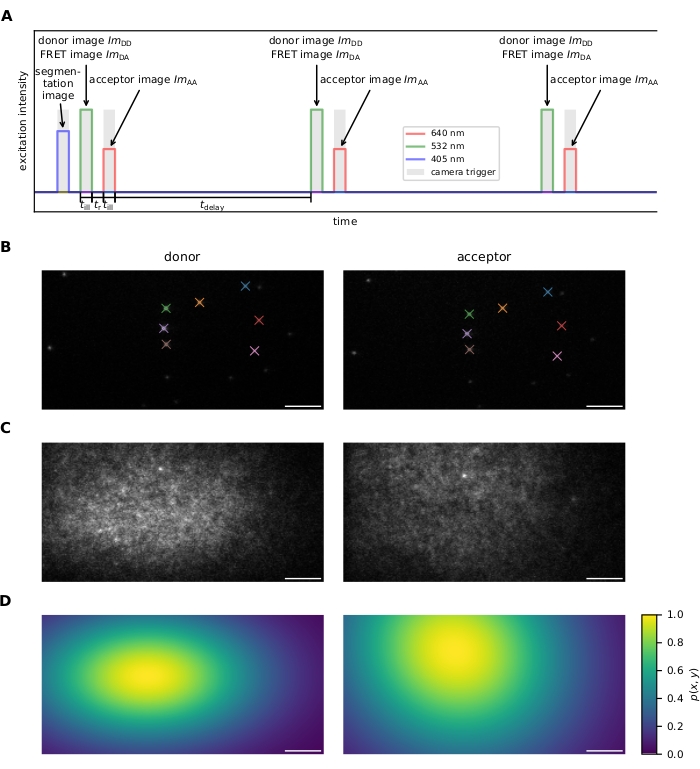
图 1:图像采集。 (A) 激励顺序。在使用405 nm激光器记录染料加载电池的可选图像后,供体和受体分别使用532 nm和640 nm激光器交替和重复激发照度时间。供体和受体激发之间的时间TR必须足够长,以便相机读取图像。延迟时间 tdelay 可用于调整采集帧速率,从而调整光漂白前的观察时间跨度。此面板从 16 修改而来。(B)基准标记用于计算两个发射通道之间的坐标变换。匹配的基准点由颜色表示。应记录几个偏移的图像,以确保覆盖整个视野。(C)使用密集标记的样品记录用于平场校正的激光轮廓。记录和光漂白受体配置文件,然后获取供体配置文件。应在不同的样品区域拍摄多张图像,进行平均和平滑处理,以减轻样品缺陷(例如,图像中顶部的亮点)的影响。(D)平场校正图p(x,y)根据C中描述的记录的20个激光轮廓计算得出。缩写:FRET = Förster 共振能量转移;ImDD = 供体激发时的供体发射图像;ImDA = 供体激发时的受体发射图像;ImAA = 供体激发时的受体发射图像。比例尺 = 5 μm。请单击此处查看此图的放大版本。
- 使用电子倍增电荷耦合器件(EMCCD)相机时,使EM增益能够以高信噪比观察单分子信号(请参阅制造商的说明)。
- 激励序列(有关更多详细信息,请参见 图1A )。
- (可选)记录图像以进行分割,以将数据分析限制在视野中的某些区域。例如,使用405 nm激光激发Fura-2负载的电池,并在510 nm附近捕获其发射,以仅评估位于细胞和支持的脂质双分子层(SLB)之间界面的探针。因此,请等待时间 tr 以允许相机读出。
注:在 EMCCD 相机上,TR 取决于所选感兴趣区域 (ROI) 中的线数。因此,选择较小的ROI可能是有利的,因为它减少了帧之间的延迟和记录数据的大小。此外,启用帧传输模式可以进一步降低 tr。 - 交替地反复激发供体和受体荧光团。
- 激发供体的 照明时间( 5-10 ms通常足够短以避免运动模糊),同时触发相机。
- 等待时间 tr 以允许相机读出。
- 在触发相机时激发受体。
- 等待一段时间。
注:此值必须比 tr 长,才能使相机读出,但可以任意选择。它应平衡时间分辨率和跟踪长度的要求。 - 重复步骤 2.2.2.1-2.2.2.4。选择足够大的重复次数,以确保每个探针在视场内至少一个荧光团的光漂白,从而允许逐步光漂白分析,以区分来自聚集体的单分子信号。
注意:选择适当的光栅和激发激光强度通常需要一些实验:照明时间越长,激光强度越高,所得图像中的信噪比越好,但产生的时间迹线越短。
- (可选)记录图像以进行分割,以将数据分析限制在视野中的某些区域。例如,使用405 nm激光激发Fura-2负载的电池,并在510 nm附近捕获其发射,以仅评估位于细胞和支持的脂质双分子层(SLB)之间界面的探针。因此,请等待时间 tr 以允许相机读出。
- 为每个样本录制足够数量的短片。
3. 用于确定校正因子的附加测量
- 记录在两个发射通道中可见的一系列随机放置的基准标记,以进行图像配准(即,找到将供体发射通道的坐标映射到受体发射通道上的变换,反之亦然)。参见 图1B。
注:图像配准由软件执行;请参阅步骤 6.1.4。 - 测量供体和受体激发光源的强度曲线,以进行平场校正(即,校正整个视场中的非均匀激发)。为此,制备具有高密度FRET探针的样品,并首先在受体激发时获取图像,然后对受体进行光漂白,随后在供体激发时记录图像。为了提高稳定性,请在不同的样品区域重复几次。参见 图1C,D。或者,记录仅用供体分子装饰的样品和仅用受体荧光团装饰的第二个样品。
注:平场校正由分析软件执行;请参阅步骤 8.1.2。 - 记录没有受体荧光团的探针的单分子样品(如第2节),以确定进入受体通道的供体发射泄漏。
注意:供体泄漏也可以根据受体漂白后实际探针的时间迹线计算出来。如果记录了足够数量的此类事件,则无需进行额外的测量。分析软件支持这两个选项;请参阅 补充信息,第 3.15 节。 - 获取没有供体荧光团的探针的记录,以量化供体激发光源的直接受体激发。
注意:直接受体激发也可以从供体漂白后实际探针的时间轨迹中得出。如果记录了足够数量的此类事件,则无需进行额外的测量。分析软件支持这两个选项;请参阅 补充信息,第 3.15 节。 - 记录具有两种不同FRET效率的单分子样品,以校正供体和受体发射通道的不同检测效率以及染料的不同量子产率。
注意:例如,此类样本可能是Holliday连接1,它在两个构象之间波动,或者DNA棒具有FRET对,以不同的,明确定义的距离连接。如果探针具有高且足够恒定的FRET效率,则还可以根据探针时间迹线的受体漂白事件来计算校正,在这种情况下,不需要额外的测量。分析软件支持这两个选项;请参阅 补充信息,第 3.15 节。
4. 单分子定位算法
注意:几个分析步骤需要单分子定位。在高斯拟合算法30 和质心计算31之间进行选择,具体取决于信号密度、背景和信噪比。
- 要执行高斯拟合,请通过相应的用户界面选择 3D-DAOSTORM30 算法。
注: 3D-DAOSTORM 设计用于区分具有重叠点扩散函数的偶数信号。虽然这通常是一个优势,但它需要注意:单个明亮的信号偶尔会被识别为两个相邻的信号,这可能会混淆跟踪算法,并导致检测两个短轨迹而不是单个长轨迹。
设置以下参数(有关详细信息,请参阅 sdt-python 库32 的文档,该库提供了算法的实现)。- radius:根据有效像素大小设置高斯拟合函数的初始σ值(以像素为单位)。
-
阈值:设置最小振幅(即,最亮的像素值,根据估计的本地背景进行校正),以拟合局部强度最大值。
注意:阈值可以说是最重要的参数。如果设置得太低,噪声可能被视为荧光信号,并且明亮的信号可能具有两个高斯。如果设置得太高,则表示信号不合时宜。 -
模型:设置为 2d 以拟合圆形高斯。
注:其他型号不适用于 smFRET 数据。 -
查找滤波器:在找到局部最大值之前应用滤波器以降低噪声,这在信噪比较低的情况下很有帮助。这可以是i) 身份:没有过滤器;ii) 克罗克-格里尔:克罗克-格里尔算法的带通滤波器31,33;或 iii) 高斯:具有由 sigma 参数设置σ的高斯模糊。
注意:对于 Crocker-Grier, feat. size 参数应大致是点展开函数的半径(以像素为单位)。
注: 拟合是使用未过滤的原始数据执行的。 -
最小距离:拟合两个远景信号,间隔小于最小距离像素,由单个高斯值分隔。
注意:在上述将亮信号错误地检测为两个相邻信号的情况下,这会有所帮助。 - 尺寸范围:选择拟合的最小和最大σ,以消除由于噪声引起的杂散信号的检测。
- 通过相应的用户界面选择克罗克-格里尔算法来执行质心计算(基于克罗克和格里尔想法的改进算法313)。
注意:即使在低信噪比场景中,以及在处理具有一定强度范围但无法精确拟合具有重叠点扩散函数的分子时,该算法也非常可靠。- 半径:将磁盘的半径(以像素为单位)设置为足以包含整个点展开函数。
-
信号脱粒:为要分析的局部强度最大值设置最小振幅(估计背景上方最亮的像素)。
注:如果设置得太低,噪声可能被视为荧光信号。如果设置得太高,则表示信号不合时宜。 -
质量脱粒:设置要分析的信号的最小总强度(背景校正像素值的总和)。
注意:上述相同的注意事项适用。
5. 软件初始化
- 下载分析脚本。在 Anaconda 提示符下,导航到文件夹以保存分析(使用 cd 命令)并执行
git 克隆 https://github.com/schuetzgroup/fret-analysis.git 目标文件夹- 将 目标文件夹 替换为描述性名称,例如 2021-06-14_Force-FRET-experiment。
注意:分析软件将最终位于此文件夹中;事先确保此文件夹不存在。建议为每个实验下载分析脚本的副本。这样,可以在以后重新访问分析,调用使用的参数并进行更改。
- 将 目标文件夹 替换为描述性名称,例如 2021-06-14_Force-FRET-experiment。
- 复制 Jupyter 笔记本 (01.Tracking.ipynb, 02.Analysis.ipynb, 03.Plots.ipynb)放入新创建的文件夹(以下简称根文件夹)。如果这是第一次使用该软件,请从根文件夹的笔记本子文件夹中获取它们。
注意:如果已经分析了类似的数据集,则从以前的实验中复制笔记本可能是一个方便的选择,因为参数可能只是略有变化。 - 通过在 Anaconda 提示符下执行以下命令来启动 JupyterLab 服务器,以打开显示 JupyterLab 的 Web 浏览器窗口。
朱皮特实验室
注意:浏览器只是界面,而在 Anaconda 提示符下运行的进程正在执行实际工作。因此,关闭浏览器窗口的效果微乎其微。可以通过访问 http://localhost:8888 来恢复会话 。 但是,在提示符下中断 JupyterLab 进程或关闭提示符将终止分析,从而导致丢失未保存的工作。 - 在 JupyterLab 浏览器窗口中,使用左窗格导航到 根文件夹。双击 01. Tracking.ipynb 以启动第一个笔记本。启动后,查找要出现的新选项卡,该选项卡显示Python代码的框,即所谓的单元格。
注意:所有 Jupyter 笔记本都带有描述每个代码单元功能的注释。此外,通过将文本光标放在紧挨着打开 位置( 然后按 Shift+Tab)来显示每个方法调用的文档。 - 有关数据分析过程的概述,请参见 图 2 。
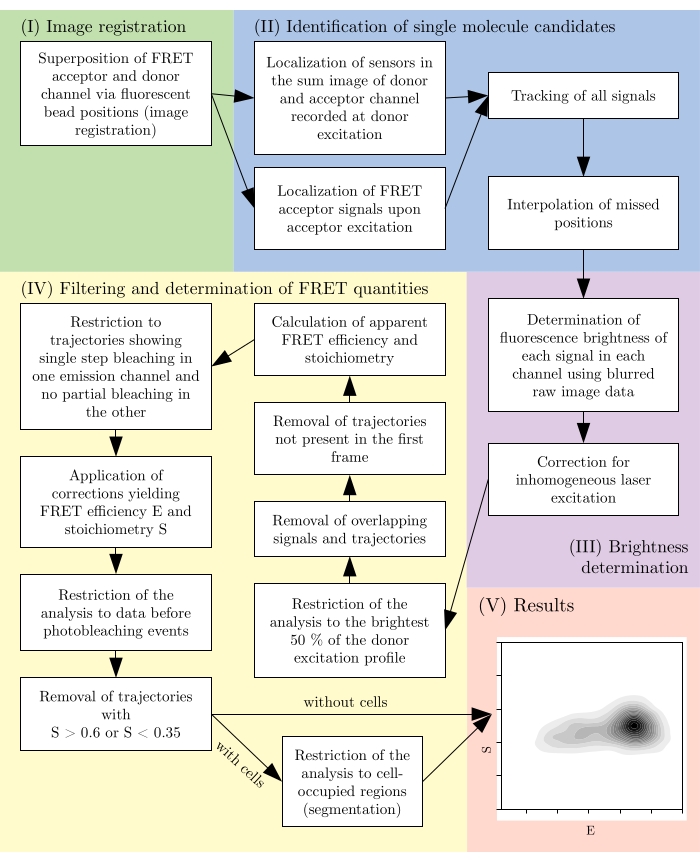
图 2:典型分析管道概述。 请注意,滤波步骤会根据实验设计进行调整。此数字是从 16修改而来的。缩写:FRET = Förster 共振能量转移。 请点击此处查看此图的放大版本。
注:试用该软件的示例数据可从 https://github.com/schuetzgroup/fret-analysis/releases/tag/example_files
6. 单分子的定位、跟踪和荧光强度分析(01.Tracking.ipynb)。
- 使用 01. 跟踪.ipynb Jupyter笔记本用于可靠分析单分子信号的荧光强度值,这是为精确定量量身定制的,特别是FRET测量中经常发生的微弱信号(例如,由于高FRET事件中的低供体信号,反之亦然)。
注:为此,实现了原始数据中像素强度的直接集成,并对局部背景进行了校正。有关每个分析步骤的屏幕截图和函数调用参数的说明,请参阅 补充信息.- 指定照明序列以允许选择供体和受体激发帧,以及用于从记录的图像序列中进行图像分割的帧。
注意:由于该软件允许处理使用任意照明协议记录的数据,因此有必要指示在激发哪种类型的荧光团的同时获取了图像序列中的哪个帧;请参阅 补充信息,第 1.2 节,步骤 3。将保留原始图像序列的帧号。 - 描述和加载数据集。一次分析多个数据集,前提是使用相同的照明设置记录这些数据集。为每个数据集分配与相应图像序列文件名匹配的标识符和模式。此外,为特殊目的定义特定数据集,例如记录用于图像配准的基准标记,用于平场校正的激发光曲线,以及可选的仅供体和仅受体样本以确定校正因子。
- 如果两个通道都是使用单个相机录制的,请选择原始图像中的发射通道。为此,请使用适当的图形小部件为供体和受体发射选择适当的区域。
- 在两个发射通道中定位基准标记并执行图像配准。使用提供的用户界面查找供体和受体发射通道的定位算法的适当参数。有关支持的本地化算法的信息,请参阅第 4 节。
注意:随机分布的基准标记可以通过其最近邻居的空间分布在发射通道之间识别(图1B)。在sdt-python库中提出的选择性平面照明显微镜34算法的自定义实现自动匹配供体发射通道中每个标记的位置与受体发射通道中的位置。通过将仿射变换到标记位置的线性最小二乘拟合,可以找到将供体发射通道的坐标映射到受体发射通道坐标的变换 T35。RANSAC 用于考虑异常值,例如上一步中错误匹配的位置。 - 在所有帧中,供体和受体激发独立定位FRET探针,并将结果合并到一个表中,其中包含原始帧编号,二维坐标和引用源图像文件的标识符。
注:为此,软件提供了用户界面,以便为本地化算法找到适当的选项。- 根据供体激发在供体激发时将FRET探针定位为从供体发射ImDD和受体发射ImDA获得的图像的总和,这几乎不依赖于FRET效率。有关本地化算法选项的信息,请参见第 4 节。
注意:每个和图像都是通过使用先前从图像配准获得的转换T转换ImDD并逐像素添加到ImDA来计算的。 - 在受体发射通道 IMAA 中的受体激发时定位探针(有关定位算法的详细信息,请参见第 4 节)。
- 根据供体激发在供体激发时将FRET探针定位为从供体发射ImDD和受体发射ImDA获得的图像的总和,这几乎不依赖于FRET效率。有关本地化算法选项的信息,请参见第 4 节。
- 执行跟踪和荧光强度测量。
- 指定照明序列以允许选择供体和受体激发帧,以及用于从记录的图像序列中进行图像分割的帧。
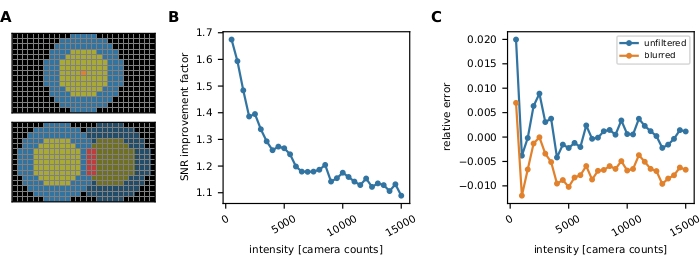
图3:单分子强度测量。 (A)对于位于橙色像素处的荧光团,其未校正的强度Iuncorr是通过对圆盘内所有像素的强度(黄色和橙色像素)进行求和来确定的,该圆盘(黄色和橙色像素)大到足以覆盖受信号影响的所有像素: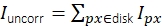 。本地背景计算为磁盘周围环形(蓝色像素)中像素的平均值:
。本地背景计算为磁盘周围环形(蓝色像素)中像素的平均值: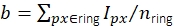 ,其中 nring 是环中的像素数。荧光强度I是从未校正的强度中减去背景的结果,I = Iuncorr - b × ndisk,其中ndisk是磁盘中的像素数。圆半径通过追踪方法的feat_radius参数指定。环的宽度由bg_frame参数给出。如果一个信号的点扩散函数与另一个信号的背景环(底部面板)重叠,则受影响的像素(红色)将从本地背景分析中排除。如果两个点扩散函数重叠,则无法可靠地计算荧光强度,因此将被丢弃。(二、三)仿真表明,应用标准差为1像素的高斯模糊可将低荧光强度(B)下的信噪比提高到接近2的系数,并且几乎不会产生任何误差(略微低估小于1%,(C))16。此外,相对误差(即(Imeas - Itruth)/Itruth,其中Itruth是基本真理,Imeas是分析的结果)在整个强度范围内是恒定的,因此对于FRET效率和化学计量等比率量,可以抵消。所有地块均基于先前发表的作品16。缩写:SNR = 信噪比;FRET = Förster 共振能量转移。请点击此处查看此图的放大版本。
,其中 nring 是环中的像素数。荧光强度I是从未校正的强度中减去背景的结果,I = Iuncorr - b × ndisk,其中ndisk是磁盘中的像素数。圆半径通过追踪方法的feat_radius参数指定。环的宽度由bg_frame参数给出。如果一个信号的点扩散函数与另一个信号的背景环(底部面板)重叠,则受影响的像素(红色)将从本地背景分析中排除。如果两个点扩散函数重叠,则无法可靠地计算荧光强度,因此将被丢弃。(二、三)仿真表明,应用标准差为1像素的高斯模糊可将低荧光强度(B)下的信噪比提高到接近2的系数,并且几乎不会产生任何误差(略微低估小于1%,(C))16。此外,相对误差(即(Imeas - Itruth)/Itruth,其中Itruth是基本真理,Imeas是分析的结果)在整个强度范围内是恒定的,因此对于FRET效率和化学计量等比率量,可以抵消。所有地块均基于先前发表的作品16。缩写:SNR = 信噪比;FRET = Förster 共振能量转移。请点击此处查看此图的放大版本。
- 为用于将FRET探针定位链接到轨迹的trackpy36algorithm选择适当的选项。特别是,设置从一帧到下一帧的最大搜索距离,以及信号可能未被检测到的连续帧数,这可能是由于漂白或错过定位而发生的。
注意:这些间隙通过前一个和随后位置之间的插值来填充。这些插值位置被标记,稍后仅用于读出强度值,但不用于扩散分析。在受体发射通道的坐标系中分析轨迹。对于荧光强度分析(步骤6.1.6.2),使用通过图像配准获得的逆变换T-1将轨迹另外转换为供体发射通道的坐标系(参见步骤6.1.4)。 - 选择荧光强度计算算法的选项(有关详细信息,请参见 图3A )。指定 i) 磁盘的半径,当以信号位置为中心时,该半径包含受该信号影响的所有像素,以及 ii) 用于确定本地背景的每个磁盘周围环的宽度。
注:为了减少所获得的强度测量值中的噪声,对图像施加标准偏差为1像素的高斯模糊(图3B,C)。
- 使用分析软件功能处理来自图像序列的辅助图像数据。
- 提取记录的其他图像以方便分割(参见步骤2.2.1,在激励序列中用 s 标记(参见 补充信息,第1.2节,步骤3)。
- 从密集标记的样品上记录的图像中确定整个视野中的供体和受体激发光曲线(参见步骤3.2)。
注:逐像素平均值是根据图像计算的,用于计算光分布。相机基线被减去。使用高斯滤光片对图像进行模糊处理,以减少样品杂质引起的影响。最后,将生成的图像按像素除以最大值,以获得将轮廓 p(x,y)映射坐标到区间[0,1]上。
7. FRET轨迹的可视化(可选)
- 使用 检测器 应用程序在原始图像数据中显示单分子轨迹,以及相应的荧光强度以及明显的 FRET 效率和化学计量。
注意:这是评估所选参数的有效性并手动接受或拒绝单个时间跟踪的宝贵工具。有关屏幕截图和详细的用法信息,请参阅 补充 信息。
8. 单分子数据分析与过滤(02.Analysis.ipynb)
- 使用 02. 分析.ipynb Jupyter 用于分析和过滤通过 01. 跟踪.ipynb 笔记本。有关典型分析管道,请参阅以下步骤。
注意:不同的科学问题和实验设计可能需要调整设置。使用Jupyter笔记本可以通过省略,重新排列和修改分析步骤来轻松适应。有关每个分析步骤的屏幕截图和函数调用参数的说明,请参阅 补充信息.- 执行初始筛选步骤。
- 丢弃具有重叠点扩散功能的信号,因为很难可靠地确定其荧光强度。
- 在不均匀照明的情况下,仅接受位于视野内照明良好的区域的信号,以确保良好的信噪比。
- 如果研究分子内FRET,请将分析限制在从图像序列开始存在的那些轨迹上,以确保记录所有漂白步骤,并且可以在稍后逐步光漂白分析期间进行正确评估。
注意:当使用分子间FRET探针进行实验时,其中供体和受体荧光团不是预制复合物的一部分,因此将分析限制在最初存在的轨迹上是不可行的。
- 执行平场校正,它使用在步骤6.1.7.2中获得的激发光源曲线来逆转由不均匀照明引起的位置相关荧光强度变化。
注:探头在位置(x,y)处的荧光强度I(x,y)通过以下方式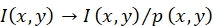 校正;参见图1C,D。
校正;参见图1C,D。 - 计算视谱FRET效率Eapp(即,从供体荧光团传递到受体荧光团的能量分数)和表观化学计量学Sapp(即供体荧光团的数量除以衍射受限点内的荧光团总数)。
注意:通过绘制每个数据点的 E 与 S ,可以区分由于供体 - 受体距离的变化而导致的FRET效率的变化与由于化学计量学变化引起的变化18。这允许由于染料分离而区分 E = 0,由于没有活性受体而使 E = 0。 E-S 图在整个分析过程中用作质量评估的工具;参见 图 4 作为示例。 - 执行光漂白的逐步分析,以区分单分子探针和聚集体。选择接受以下选项之一。
注意:为此,分析软件将变化点检测算法 PELT37 的自定义实现 32 分别应用于供体激发 (IDD + IDA) 和受体激发 (IAA) 时的荧光强度。- 选择选项1,其中受体荧光团在单个步骤中漂白,而供体没有显示部分漂白(即,没有漂白步骤到非零强度)。
注意:此选项进一步拒绝供体在单个步骤中在受体之前漂白的轨迹。选项1是接受者光漂白率高的情况下的首选。 - 选择选项2,其中供体在单个步骤中漂白,而没有部分受体漂白。
注意:此选项进一步拒绝供体在单个步骤中在受体之后漂白的轨迹。选项2是供体光漂白率高的情况下的首选。 - 选择选项3,其中任一荧光团漂白在一个步骤中,而另一个不部分漂白。
注:备选方案3比备选方案1和2具有更高的灵活性,是建议的数据分析优先选择。 - 选择选项4,其中供体和受体荧光团显示单步光漂白或根本没有光漂白。
注:在光漂白率低的情况下,首选选项4。
- 选择选项1,其中受体荧光团在单个步骤中漂白,而供体没有显示部分漂白(即,没有漂白步骤到非零强度)。
- 计算供体排放泄漏到受体通道α校正因子、直接受体激励δ、检测效率γ和激励效率β 17。
- 使用校正因子从表观效率 Eapp 计算 FRET 效率 E,从表观化学计量 Sapp 计算化学计量 S。
- 执行进一步的筛选步骤。仅选择每个轨迹中第一次漂白事件之前的数据点。此外,仅接受至少 75% 的数据点满足 0.35 < S < 0.6 的轨迹,以将分析限制为单分子探针(数字可调)。
注:应根据感兴趣的人群与要排除在分析中的人群(例如,仅供体和仅接受者人群)的分布来选择上限和下限。根据经验,0.35 < S < 0.6 对于许多实验情况来说是一个不错的选择。 - 通过全局或自适应阈值方法35 对相应的辅助图像执行图像分割(请参阅步骤 2.2.1 和 6.1.7),以将分析限制在视野内的不同区域。
注意:例如,这允许对位于单元-SLB接口或图案化结构上的探针进行独家评估。
- 执行初始筛选步骤。
9. 绘制结果并进一步分析(03.Plot.ipynb)
注意:有关 Jupyter 笔记本的屏幕截图和函数调用参数的说明,请参阅 补充信息 。
- 创建 E-S 图以验证是否已正确识别和删除不正确的化学计量信号。
- 绘制 FRET 效率的直方图,以提供 FRET 效率分布的完善概述。对直方图进行分组,以便于比较不同实验的结果。
- 利用科学的Python库,在笔记本中进一步评估数据(例如,扩散分析,使用分子力传感器或过渡分析将FRET效率转换为实验中的力)。
注:数据也可以以多种文件格式导出,作为其他分析软件的输入。
结果
根据实验的科学问题,可以从smFRET轨道中提取各种低级和高级信息。这里,介绍了具有模拟和数字探针的分析管道示例:基于肽的分子力传感器16 和具有随机开关其构象的DNA探针38。有关这些探头的设计和工作原理,请参见 图5 。
在按照协议中所述执行定位和跟踪算法后,该软件包提供了多个数据可视化工具来优化初始参数和后续的过滤步骤:(i)单个smFRET事件的可视化,(ii)可选的图像分割以分析某些感兴趣区域的数据,(iii)通过FRET效率与化学计量(E-S)图监测过滤器步骤。单分子数据的可视化如图 6所示。
最后,滤波后的 FRET 事件由 E-S 图和 FRET 效率直方图表示(图 4)。E-S 图是优化上述滤波步骤和调查最终结果的有用工具。部分漂白或不完全标记的FRET传感器可以通过其化学计量值来排除。迁移率参数可以通过在 x-y 图(图 6)或均方位移 (MSD) 图(图 4)中绘制单个轨迹路径来研究。第一种方法对于区分移动和固定事件特别有用,而后者用于计算扩散系数。
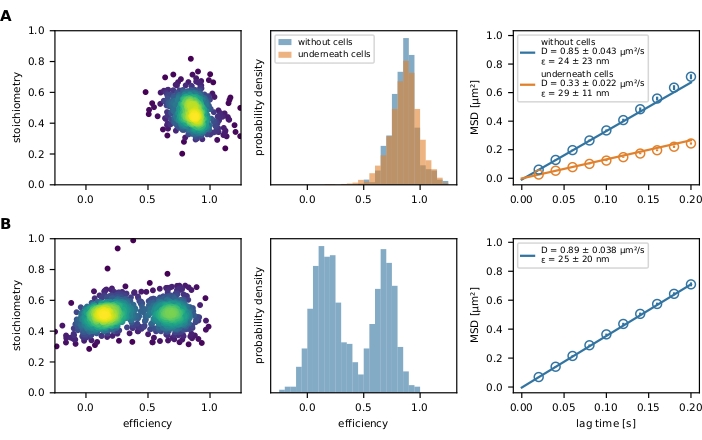
图 4:示例性输出。 (A)对于装饰玻璃支撑的脂质双层并由T细胞应变的分子力传感器(左图)的群体绘制了FRET效率与化学计量学(E-S图)。只有一个人口云可见。FRET效率的相应直方图说明了存在和不存在单元的力传感器群之间的差异(中间图)。在存在T细胞的情况下,可以观察到传感器群体的FRET效率降低的变化,这表明传感器模块几乎没有力依赖性拉伸。这些实验条件的MSD图证实,T细胞下方的力传感器群体比未结合的对应物移动得慢得多(右图)。(B)使用相同的分析是用Holliday连接DNA传感器装饰玻璃支撑的流体脂质双层进行的。E-S图清楚地显示了两个群体,这在FRET效率直方图中也很明显。MSD 图指示存在一个快速移动的传感器群体。缩写:FRET = Förster 共振能量转移;MSD = 均方位移。请点击此处查看此图的放大版本。
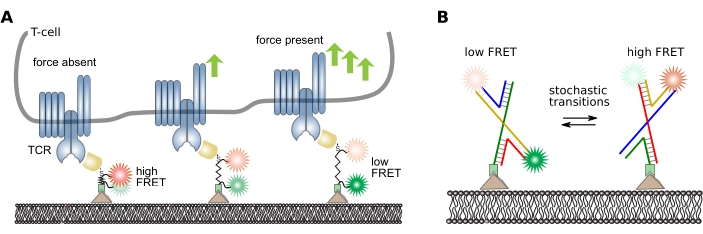
图5:分子内FRET探针的设计和工作原理 (A)用于定量机械分子力的模拟肽传感器。供体和受体荧光团共价附着在肽主链的任一端。传感器模块特异性地附着在特定配体上,而配体又结合感兴趣的细胞驻留表面受体(此处为特异性识别T细胞受体β链的抗体片段)。在受体 - 配体结合时,施加力,传感器模块延伸并最终在键断裂后反冲。此面板从 16 修改而来。(B) 用于定量 FRET 跃迁的数字 DNA 传感器。FRET传感器由形成Holliday连接的四条DNA链组成。供体和受体荧光团共价附着在两条链上。霍利迪结经常根据周围的缓冲条件切换其构象。这些构象的随机开关可以通过量化单个探头的FRET效率来监测。缩写: TCR = T细胞受体;FRET = Förster 共振能量转移。 请点击此处查看此图的放大版本。
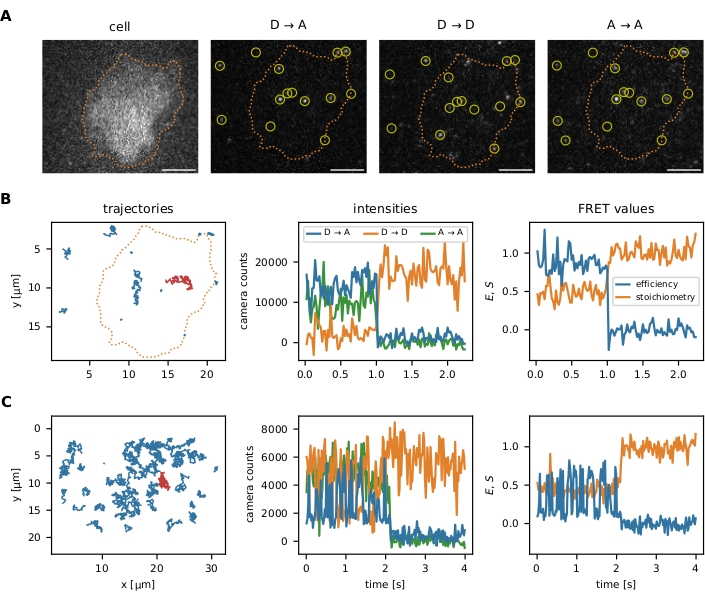
图 6:FRET 探头的定位和跟踪示例。 (A)通过量化供体激发时供体荧光团的强度(D→D),供体激发时受体荧光团的强度(D→A)和受体激发时受体荧光团的强度(A→A)来计算单个事件的FRET效率和化学计量。最近邻滤波通过闭合发射器的重叠点扩散函数防止偏差。图像分割允许用户选择定位在感兴趣区域(例如,细胞或微模式)内的某些smFRET事件。作为图像分割的一个例子,用Fura-2染色T细胞(显示在左侧)并进行自适应阈值以识别细胞边缘(橙色虚线)。比例尺 = 5 μm. (B) 使用分子力传感器的 smFRET 轨迹。可以在 x-y 平面中绘制单个轨迹,可视化其扩散行为和定位(左图)。此外,每个轨迹的强度可以随时间绘制,以识别FRET过渡或漂白步骤(中间面板从左侧面板显示红色轨迹)。由此产生的FRET效率和化学计量学可以类似地可视化(右图)。(C)使用Holliday连接DNA传感器的smFRET轨迹。在测量过程中使用HBSS + 12 mM MgCl2作为缓冲液。除了这些示例的序列末端附近的明显受体漂白步骤外,还可以确定每个传感器的FRET跃迁频率。Holliday结以高频率切换其构象,而分子力传感器不表现出FRET跃迁。这些信息使得调整实验条件(例如帧之间的延迟)以增加或减少观察到的转变次数成为可能。缩写:FRET = Förster 共振能量转移;smFRET = 单分子 FRET;HBSS = 汉克平衡盐溶液。 请点击此处查看此图的放大版本。
补充信息:单分子的定位和跟踪(01.Tracking.ipynb)。 请单击此处下载此文件。
讨论
本文详细介绍了对来自移动但表面系留探针分子的smFRET数据的自动记录和定量分析的管道。它补充了 smFRET 实验的两种主要方法,涉及表面固定探针或探针在溶液中扩散到共聚焦激发体积和从共聚焦激发体积中扩散17。它提供了正确的FRET效率和分子位置作为时间的函数。因此,它可以用作专用分析程序的输入,例如,量化过渡动力学1,FRET直方图39或二维扩散22。
该软件根据开源促进会批准的免费开源许可证发布,该许可证授予用户免费使用,修改和再分发的永久权利。Github被选为开发和分发平台,以便通过报告错误或贡献代码40,尽可能轻松地获取软件并参与开发过程。该软件是用Python编写的,不依赖于专有组件。选择Jupyter笔记本作为用户界面,便于在每个分析步骤中检查数据,并允许专门为手头的实验系统定制和扩展管道。 sdt-python 库32 作为基础并实现了评估荧光显微镜数据的功能,例如单分子定位、扩散分析、荧光强度分析、色通道配准、共定位分析和 ROI 处理。
原则上,单粒子跟踪可以在一维、二维或三维系统中进行。在这里,单分子分析管道是为2D移动系统的研究量身定制的。这一选择反映了简单系统的可用性,例如平面支持的脂质双层(SLB),以呈现移动荧光探针。这种脂质双层体系通常由两个或多个磷脂部分组成,其中本体部分决定了SLB的关键物理化学参数(例如相和粘度),并且次要部分为生物分子提供了附着位点。这些附着位点可以是生物素化的磷脂,用于亲和素或链霉亲和素基蛋白质平台,或镍NTA偶联磷脂,用于具有组氨酸标签的蛋白质平台41。选择将蛋白质连接到SLB的适当平台取决于科学问题。读者可以参考文献16,38,42 ,了解成功采用策略的示例。样品中探针的密度应足够低,以避免重叠点扩散函数;通常,建议每μm2 少于0.1个分子。请参阅代表性结果部分(特别是 图6),了解显示合适探头密度的示例。该分析方法也适用于在活细胞质膜中扩散的单个荧光标记的蛋白质分子。
smFRET实验的一个关键方面是FRET探针本身的生产和表征。为FRET对选择荧光团时,其Förster半径应与预期的染间距离相匹配43。首选耐光漂白的染料,因为它们会产生长时间的痕迹。然而,对于升高的漂白率,可以使用一种荧光团物种通过逐步光漂白分析来识别来自共定位分子的多发射器事件;请参阅协议部分中的步骤 8.1.4。荧光团对应具有位点特异性并共价附着在感兴趣的分子上,形成分子内或分子间的FRET对。
将smFRET与其他现成的技术相结合可以将其空间分辨率提高到衍射极限之外(通过STED44)。这里介绍的smFRET跟踪算法拓宽了该方法对新实验设置和模型系统的适用性。这包括研究(i)移动生物分子化学计量的动力学变化,(ii)移动生物分子的动态关联,(iii)自由扩散反应物的酶促反应速率,以及(iv)移动生物分子构象变化的动力学。前两个示例需要显示分子间FRET的模型系统,即供体和受体与感兴趣的生物分子实体偶联。后一种例子可以利用在同一分子实体(分子内FRET)内携带供体和受体的生物传感器。
基于分子内FRET的传感器可以深入了解生物分子的内在构象变化1,2,3,4,由内源性或外力负荷引起的构象变化(分子力传感器16),或纳米环境中的离子浓度,如钙45和pH46.根据模型系统和首选的锚定平台,可以在2D或3D中跟踪此类smFRET事件:(i)smFRET事件的平面跟踪可用于量化质膜内受体 - 配体相互作用时间,膜锚定信号放大级联的关联以及表面受体的化学计量变化;(ii)smFRET事件的体积跟踪可用于活细胞或体外重组系统中的任何分子内或分子间FRET探针。
smFRET跟踪方法的开发主要考虑了分子内FRET探针。这些探针具有固定且众所周知数量的荧光标记,这一事实被用来拒绝来自团聚和错误合成(例如,不完全标记)分子的数据,以及来自其中一个荧光团已被光漂白的探针的数据。然而,通过调整滤波步骤,该方法也可以应用于分子间FRET探针。例如,与其只接受具有单个供体和单个受体荧光团的分子,不如检查供体和受体染料的空间轨迹,并选择例如共扩散供体 - 受体轨迹。
由于3D-DAOSTORM算法支持通过散光确定信号沿光轴的位置,这是由于发射光束路径中的圆柱透镜,因此3D实验可以轻松集成到分析管道中。在这种情况下,受体激发时的受体信号将用于确定化学计量和轴向位置。该分析软件还可用于利用其高度自动化和过滤方案来评估具有固定探头的实验数据。事实上,使用该软件的早期版本分析了固定在凝胶相双分子层38 上的Holliday结的smFRET效率数据集。
披露声明
作者声明没有利益冲突。
致谢
这项工作得到了奥地利科学基金(FWF)项目P30214-N36,P32307-B和维也纳科学技术基金(WWTF)LS13-030的支持。
材料
| Name | Company | Catalog Number | Comments |
| 1,2-dioleoyl-sn-glycero-3-[(N-(5-amino-1-carboxypentyl)iminodiacetic acid)succinyl] (nickel salt) (Ni-NTA-DOGS) | Avanti Polar Lipids | 790404P | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Avanti Polar Lipids | 850375P | |
| 1-palmitoyl-2-oleoyl-glycero-3-phosphocholine (POPC) | Avanti Polar Lipids | 850457P | |
| α Plan-FLUAR 100x/1.45 oil objective | Zeiss | 000000-1084-514 | |
| Axio Observer microscope body | Zeiss | ||
| Bandpass filter | Chroma Technology Corp | ET570/60m | donor emission filter |
| Bandpass filter | Chroma Technology Corp | ET675/50m | acceptor emission filter |
| conda-forge | conda-forge community | community-maintaned Python package repository for Anaconda/miniconda | |
| Coverslips 60 mm x 24 mm #1.5 | MENZEL | ||
| Dichroic mirror | Semrock Inc | FF640-FDi01-25×36 | separation of donor and acceptor emission |
| Dichroic mirror (quad band) | Semrock Inc | Di01-R405/488/532/635-25×36 | separation of excitation and emission light |
| DPBS | Sigma-Aldrich | D8537 | |
| FCS | Sigma-Aldrich | F7524 | for imaging buffer |
| fret-analysis | Schütz group at TU Wien | Python package for smFRET data analysis; version 3 | |
| Fura-2 AM | Thermo Fisher Scientific | 11524766 | |
| HBSS | Sigma-Aldrich | H8264 | for imaging buffer |
| iBeam Smart 405-S 405 nm laser | Toptica Photonics AG | ||
| iXon Ultra 897 EMCCD camera | Andor Technology Ltd | ||
| Lab-Tek chambers (8 wells) | Thermo Fisher Scientific | 177402PK | for sample preparation and imaging |
| Millenia Prime 532 nm laser | Spectra Physics | ||
| miniconda | Anaconda Inc. | Python 3 distribution. Min. version: 3.7 | |
| Monovalent streptavidin (plasmids for bacterial expression) | Addgene | 20860 & 20859 | |
| OBIS 640 nm laser | Coherent Inc | 1185055 | |
| Optosplit II | Cairn Research | ||
| Ovalbumin | Sigma-Aldrich | A5253 | for imaging buffer |
| Plasma cleaner | Harrick Plasma | PDC-002 | |
| sdt-python | Schütz group at TU Wien | Python library for data analysis; version 17 | |
| TetraSpek bead size kit | Thermo Fisher Scientific | T14792 | Randomly distributed, immobilized fiducial markers for image registration |
| USC500TH Ultrasound bath | VWR | for SUV formation |
参考文献
- McKinney, S. A., Déclais, A. -. C., Lilley, D. M. J., Ha, T. Structural dynamics of individual holliday junctions. Nature Structural Biology. 10 (2), 93-97 (2002).
- Wang, S., Vafabakhsh, R., Borschel, W. F., Ha, T., Nichols, C. G. Structural dynamics of potassium-channel gating revealed by single-molecule FRET. Nature Structural & Molecular Biology. 23 (1), 31-36 (2015).
- Hellenkamp, B., Wortmann, P., Kandzia, F., Zacharias, M., Hugel, T. Multidomain structure and correlated dynamics determined by self-consistent FRET networks. Nature Methods. 14 (2), 174-180 (2016).
- Kilic, S., et al. Single-molecule FRET reveals multiscale chromatin dynamics modulated by HP1α. Nature Communications. 9 (1), 235 (2018).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47 (1), 819-846 (1978).
- Wu, P. G., Brand, L. Resonance energy transfer: Methods and applications. Analytical Biochemistry. 218 (1), 1-13 (1994).
- Qiao, Y., Luo, Y., Long, N., Xing, Y., Tu, J. Single-molecular förster resonance energy transfer measurement on structures and interactions of biomolecules. Micromachines. 12 (5), 492 (2021).
- Malkusch, N., Dörfler, T., Nagy, J., Eilert, T., Michaelis, J. smFRET experiments of the RNA polymerase II transcription initiation complex. Methods. 120, 115-124 (2017).
- Lee, J. -. B., et al. Single-molecule views of MutS on mismatched DNA. DNA repair. 20, 82-93 (2014).
- Phelps, C., Israels, B., Jose, D., Marsh, M. C., von Hippel, P. H., Marcus, A. H. Using microsecond single-molecule FRET to determine the assembly pathways of T4 ssDNA binding protein onto model DNA replication forks. Proceedings of the National Academy of Sciences of the United States of America. 114 (18), E3612-E3621 (2017).
- Deindl, S., Zhuang, X. Monitoring conformational dynamics with single-molecule fluorescence energy transfer: Applications in nucleosome remodeling. Methods in Enzymology. 513, 59-86 (2012).
- Crawford, D. J., Hoskins, A. A., Friedman, L. J., Gelles, J., Moore, M. J. Single-molecule colocalization FRET evidence that spliceosome activation precedes stable approach of 5' splice site and branch site. Proceedings of the National Academy of Sciences of the United States of America. 110 (17), 6783-6788 (2013).
- Wang, Y., Xiao, M., Li, Y. Heterogeneity of single molecule FRET signals reveals multiple active ribosome subpopulations. Proteins. 82 (1), 1-9 (2014).
- Mori, T., Vale, R. D., Tomishige, M. How kinesin waits between steps. Nature. 450 (7170), 750-754 (2007).
- Huppa, J. B., et al. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature. 463 (7283), 963-967 (2010).
- Göhring, J., et al. Temporal analysis of T-cell receptor-imposed forces via quantitative single molecule FRET measurements. Nature Communications. 12 (1), 2502 (2021).
- Hellenkamp, B., et al. Precision and accuracy of single-molecule FRET measurements-a multi-laboratory benchmark study. Nature Methods. 15 (9), 669 (2018).
- Kapanidis, A. N., et al. Fluorescence-aided molecule sorting: Analysis of structure and interactions by alternating-laser excitation of single molecules. Proceedings of the National Academy of Sciences of the United States of America. 101 (24), 8936-8941 (2004).
- Sakon, J. J., Weninger, K. R. Detecting the conformation of individual proteins in live cells. Nature Methods. 7 (3), 203-205 (2010).
- McCann, J. J., Choi, U. B., Zheng, L., Weninger, K., Bowen, M. E. Optimizing methods to recover absolute FRET efficiency from immobilized single molecules. Biophysical Journal. 99 (3), 961-970 (2010).
- Lee, N. K., et al. Accurate FRET measurements within single diffusing biomolecules using alternating-laser excitation. Biophysical Journal. 88 (4), 2939-2953 (2005).
- Asher, W. B., et al. Single-molecule FRET imaging of GPCR dimers in living cells. Nature Methods. 18 (4), 397-405 (2021).
- Joo, C., Ha, T. . Single-molecule FRET with total internal reflection microscopy. (12), 1223-1237 (2012).
- Joo, C., Ha, T. Objective-type total internal reflection microscopy (excitation) for single-molecule FRET. Cold Spring Harbor Protocols. 11, 1189-1191 (2012).
- Joo, C., Ha, T. Objective-type total internal reflection microscopy (emission) for single-molecule FRET. Cold Spring Harbor Protocols. 11, 1192-1194 (2012).
- Allan, D. B., Caswell, T., van der Wel, C. M., Dimiduk, T. . Soft-matter/pims: PIMS v0.5. , (2020).
- Anaconda Inc. . Miniconda. , (2021).
- conda-forge community. . The conda-forge project: community-based software distribution built on the conda package format and ecosystem. , (2015).
- . . JupyterLab Contributors Notebooks - JupyterLab documentation. , (2021).
- Babcock, H., Sigal, Y. M., Zhuang, X. A high-density 3D localization algorithm for stochastic optical reconstruction microscopy. Optical Nanoscopy. 1 (6), (2012).
- Gao, Y., Kilfoil, M. L. Accurate detection and complete tracking of large populations of features in three dimensions. Optics Express. 17 (6), 4685 (2009).
- Schrangl, L. . sdt-python: Python library for fluorescence microscopy data analysis (v17.1). , (2021).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. Journal of Colloid and Interface Science. 179 (1), 298-310 (1996).
- Preibisch, S., Saalfeld, S., Schindelin, J., Tomancak, P. Software for bead-based registration of selective plane illumination microscopy data. Nature Methods. 7 (6), 418-419 (2010).
- Bradski, G. The OpenCV library. Dr. Dobb's Journal: Software Tools for the Professional Programmer. 25 (11), 120-123 (2000).
- Allan, D. B., Caswell, T., Keim, N. C., van der Wel, C. M., Verweij, R. W. Soft-matter/trackpy: Trackpy v0.5.0. Zenodo. , 4682814 (2021).
- Killick, R., Fearnhead, P., Eckley, I. A. Optimal detection of changepoints with a linear computational cost. Journal of the American Statistical Association. 107 (500), 1590-1598 (2012).
- Schrangl, L., Göhring, J., Schütz, G. J. Kinetic analysis of single molecule FRET transitions without trajectories. The Journal of Chemical Physics. 148 (12), 123328 (2018).
- Santoso, Y., Torella, J. P., Kapanidis, A. N. Characterizing single-molecule FRET dynamics with probability distribution analysis. ChemPhysChem. 11 (10), 2209-2219 (2010).
- Schrangl, L. Single-molecule FRET analysis software (3.0). Zenodo. , (2021).
- Nye, J. A., Groves, J. T. Kinetic control of histidine-tagged protein surface density on supported lipid bilayers. Langmuir. 24 (8), 4145-4149 (2008).
- Platzer, R., et al. Unscrambling fluorophore blinking for comprehensive cluster detection via photoactivated localization microscopy. Nature Communications. 11 (1), 4993 (2020).
- Johnson, I., Spence, M. . The molecular probes handbook: A guide to fluorescent probes and labeling technologies. , (2010).
- Szalai, A. M., et al. Super-resolution imaging of energy transfer by intensity-based STED-FRET. Nano Letters. 21 (5), 2296-2303 (2021).
- Miyawaki, A., et al. Fluorescent indicators for Ca2+ based on green fluorescent proteins and calmodulin. Nature. 388 (6645), 882-887 (1997).
- Zhai, B., Zhai, S., Hao, R., Xu, J., Liu, Z. A FRET-based two-photon probe for in vivo tracking of pH during a traumatic brain injury process. New Journal of Chemistry. 43 (43), 17018-17022 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。