Method Article
Автоматизированный двумерный пространственно-временный анализ мобильных одномолекулярных зондов FRET
В этой статье
Резюме
В данной статье представлен метод пространственно-временного анализа подвижных одномолекулярных зондов на основе резонансного переноса энергии Фёрстера (smFRET) с использованием широкоугольной флуоресцентной микроскопии. Недавно разработанный программный инструментарий позволяет определять следы времени smFRET движущихся зондов, включая правильную эффективность FRET и молекулярные положения, как функции времени.
Аннотация
Одномолекулярный резонансный перенос энергии Фёрстера (smFRET) является универсальным методом, сообщающим о расстояниях в диапазоне от субнанометра до нанометра. Он был использован в широком спектре биофизических и молекулярно-биологических экспериментов, включая измерение молекулярных сил, характеристику конформационной динамики биомолекул, наблюдение внутриклеточной колокализации белков и определение времени взаимодействия рецептор-лиганд. В конфигурации широкоугольной микроскопии эксперименты обычно проводятся с использованием поверхностных иммобилизованных зондов. Здесь представлен метод, сочетающий отслеживание одной молекулы с экспериментами с переменным возбуждением (ALEX) smFRET, позволяющий получать следы времени smFRET поверхностных, но мобильных зондов в плазматических мембранах или липидных бислоях со стеклянной поддержкой. Для анализа записанных данных был разработан автоматизированный сбор программного обеспечения с открытым исходным кодом, поддерживающий (i) локализацию флуоресцентных сигналов, (ii) отслеживание одиночных частиц, (iii) определение величин, связанных с FRET, включая поправочные коэффициенты, (iv) строгую проверку следов smFRET и (v) интуитивное представление результатов. Сгенерированные данные могут быть удобно использованы в качестве входных данных для дальнейшего исследования с помощью специализированного программного обеспечения, например, для оценки диффузионного поведения зондов или исследования переходов FRET.
Введение
Резонансный перенос энергии Фёрстера (FRET) был основным драйвером в молекулярно-биологических и биофизических исследованиях, поскольку он позволяет исследовать процессы с субнанометровым разрешением. Поскольку эффективность передачи энергии между донорскими и акцепторными флуорофорами сильно зависит от межкрасильного расстояния в субнанометровом и нанометровом диапазоне, он был эффективно использован в качестве спектроскопической линейки для исследования статической и динамической конформации биомолекул1,2,3,4. Кроме того, феномен FRET широко используется для исследований колокализации мембраноассоциированных и внутриклеточных белков на объемном уровне5,6. В последние два десятилетия метод был адаптирован для мониторинга событий smFRET7, что помогло существенно увеличить временное и пространственное разрешение и разрешить даже редкие субпопуляции в гетерогенных образцах. Благодаря этим методам были получены уникальные сведения о динамике молекулярных механизмов, таких как скорость обработки транскриптов РНК-полимеразы II8, скорость репликации ДНК-полимераз9,10, скорость транслокации нуклеосом11, скорость сплайсинга и сваливания транскриптов собранных сплайсеосом12, активность рибосомных субпопуляций13 и скорость ходьбы кинезиновых двигателей14 , и это лишь некоторые из них. Определены длительности взаимодействия рецептор-лиганд15 и молекулярные силы16.
Исследования smFRET на основе интенсивности обычно полагаются на сенсибилизированное излучение для измерения эффективности FRET: делитель пучка в пути излучения пространственно разделяет свет, исходящий от донорских и акцепторных флуорофоров при возбуждении донора, что позволяет количественно оценить индивидуальные интенсивности флуоресценции. Эффективность впоследствии может быть рассчитана как доля фотонов, испускаемых акцептором, по отношению к общему количеству фотонов17. Кроме того, акцепторное возбуждение после донорского возбуждения (ALEX) позволяет измерять стехиометрию событий FRET, помогая в различении истинных сигналов низкого FRET от сигналов, возникающих, например, от зондов с фотоотбеленным акцепторным флуорофором18.
Одномолекулярные эксперименты с FRET обычно проводятся одним из двух способов. Во-первых, небольшая область в объеме образца освещается с помощью конфокального микроскопа. Одиночные молекулы зонда в растворе возбуждаются, когда они диффундируют в фокальном объеме. С помощью этого метода можно использовать детекторы быстрого подсчета фотонов, что обеспечивает разрешение времени менее микросекунды. Во-вторых, зонды специально иммобилизуются на поверхностях и контролируются с помощью широкоугольной микроскопии, часто с использованием конфигурации полного внутреннего отражения (TIR) для минимизации фоновой флуоресценции. Иммобилизация зонда позволяет гораздо дольше регистрировать время, чем при первом подходе. Кроме того, большее поле зрения позволяет параллельно контролировать несколько зондов. Необходимость в камере делает этот метод медленным по сравнению с описанным выше. Временное разрешение ограничено миллисекундой до второго диапазона.
Если требуются длинные временные следы, например, для изучения динамических процессов в масштабе от миллисекунды до второй времени, первый метод неприменим, так как флуоресцентные всплески обычно слишком короткие. Второй подход терпит неудачу всякий раз, когда иммобилизация невозможна, например, в экспериментах с живыми клетками с зондами, диффундирующими внутри клеточной мембраны. Кроме того, было замечено, что биологические модельные системы могут резко варьировать свою реакцию в зависимости от подвижности контактируемой поверхности16.
Хотя в прошлом19 года проводились комбинированные эксперименты по отслеживанию smFRET и одиночных частиц, записывающие мобильные зонды FRET, общедоступного программного обеспечения для оценки данных не существует. Это побудило к разработке новой аналитической платформы, которая позволяет определять множественные свойства мобильных флуоресцентных зондов, включая эффективность smFRET и стехиометрию, положения с субпиксельной точностью и интенсивность флуоресценции как функции времени. Были установлены методы фильтрации полученных следов путем изучения поведения ступенчатого обесцвечивания, расстояний ближайших соседей, интенсивности излучения и других признаков исключительно для выбора правильно синтезированных и функциональных однозондовых молекул. Программное обеспечение также поддерживает экспериментальные и аналитические методы, недавно согласованные в многолабораторном исследовании для получения надежных количественных данных smFRET17. В частности, реализация придерживается валидированных процедур расчета эффективности FRET и стехиометрии. Интенсивности флуоресценции при возбуждении донора в донорском эмиссионном канале IDD и акцепторном эмиссионном канале IDA используются для расчета кажущейся эффективности FRET Eapp с использованием Eq (1).
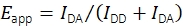 (1)
(1)
С помощью интенсивности флуоресценции в канале излучения акцептора при акцепторном возбуждении IAA кажущаяся стехиометрия рассчитывается с использованием Eq (2).
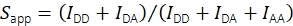 (2)
(2)
Эффективность FRET E и стехиометрия S могут быть получены из Eapp и Sapp путем рассмотрения четырех поправочных коэффициентов.
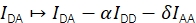
α описывает утечку донорской флуоресценции в акцепторный эмиссионный канал и может быть определен с использованием образца, содержащего только донорские флуорофоры, или путем анализа участков траекторий, где акцептор был обесцвечен. δ корректирует прямое возбуждение акцептора источником света возбуждения донора и может быть измерено с использованием образца только с акцепторными флуорофорами или путем анализа участков траекторий, где донор был отбелен.
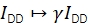 .
.
γ масштабирует IDD для устранения различий в эффективности обнаружения доноров и акцепторных эмиссионных каналов и различной квантовой эффективности флуорофоров. Коэффициент может быть рассчитан путем анализа увеличения интенсивности донорства при акцепторном отбеливании по траекториям с высокой эффективностью FRET20 или путем изучения образца с несколькими дискретными состояниями FRET.
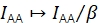
β шкалирует IAA для коррекции разрозненной эффективности возбуждения донора и акцептора. Если γ определяли с помощью акцепторного отбеливания, β можно было бы рассчитать по выборке известного соотношения донора к акцептору21. В противном случае многоштатный образец FRET также дает β.
Вместе эти поправки позволяют рассчитать скорректированную эффективность FRET с использованием Eq (3).
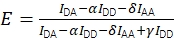 (3)
(3)
и скорректированная стехиометрия с использованием Eq (4).
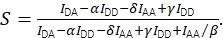 (4)
(4)
В идеале скорректированная стехиометрия для соотношения донор/акцептор 1:1 дает S = 0,5. На практике пониженное отношение сигнал/шум приводит к распространению измеренных значений S, препятствуя дискриминации по сигналам только донора (S = 1) и сигналам только акцептора (S = 0). Полученные временные следы могут быть использованы в качестве входных данных для более детального анализа траекторий одной молекулы для получения такой информации, как профили пространственно-временных сил16, подвижность одномолекулярных событий22 или кинетика перехода между различными состояниями1.
Следующий протокол описывает экспериментальные параметры и процедуры для экспериментов по отслеживанию smFRET, а также принцип работы анализа данных с использованием недавно разработанного пакета программного обеспечения. Для получения экспериментальных данных рекомендуется использовать микроскопическую установку, отвечающую следующим требованиям: i) способность обнаруживать эмиссию одиночных молекул красителя; ii) широкоугольное освещение: в частности, для экспериментов с живыми клетками рекомендуется конфигурация полного внутреннего отражения (TIR23,24,25); iii) пространственное разделение излучения света по длине волны таким образом, что донорная и акцепторная флуоресценция проецируется на разные области одного и того же чипа камеры25 или разных камер; iv) модуляция источников света для донорского и акцепторного возбуждения с миллисекундной точностью, например, с использованием непосредственно модулируемых лазеров или модуляция с помощью акустооптических модуляторов. Это позволяет стробоскопическому освещению свести к минимуму фотоотбеливание флуорофоров, а также попеременное возбуждение для определения стехиометрий; v) вывод одного файла на записанную последовательность изображений в формате, который может быть прочитан пакетом PIMS Python26. В частности, поддерживаются многостраничные TIFF-файлы.
протокол
1. Требования к программному обеспечению
- Установите дистрибутив miniconda Python27 (минимальная требуемая версия Python: 3.7).
- Откройте приглашение Anaconda в меню «Пуск» Windows или откройте терминал и выполните активацию conda при использовании Linux или macOS.
- Включите поддерживаемый сообществом репозиторий пакетов conda-forge28, выполнив следующие команды:
conda config --add channels conda-forge
conda config --set channel_priority strict
Обновление conda --all - Установите необходимые пакеты Python, выполнив:
conda install opencv trackpy lmfit ipympl scikit-learn pyqt sdt-python jupyterlab - Ознакомьтесь с JupyterLab, пользовательским интерфейсом аналитического программного обеспечения (см. документацию по программному обеспечению29).
- Установите систему контроля версий git , которая будет использоваться позже для загрузки и обновления программного обеспечения для анализа. Если вы используете Linux, используйте программное обеспечение для управления пакетами дистрибутива для загрузки и обновления. В противном случае выполните:
conda установить git - При необходимости установите пакет Python с коляской для отображения наборов данных после этапов фильтрации во время анализа:
conda установить коляску
2. Измерение образцов
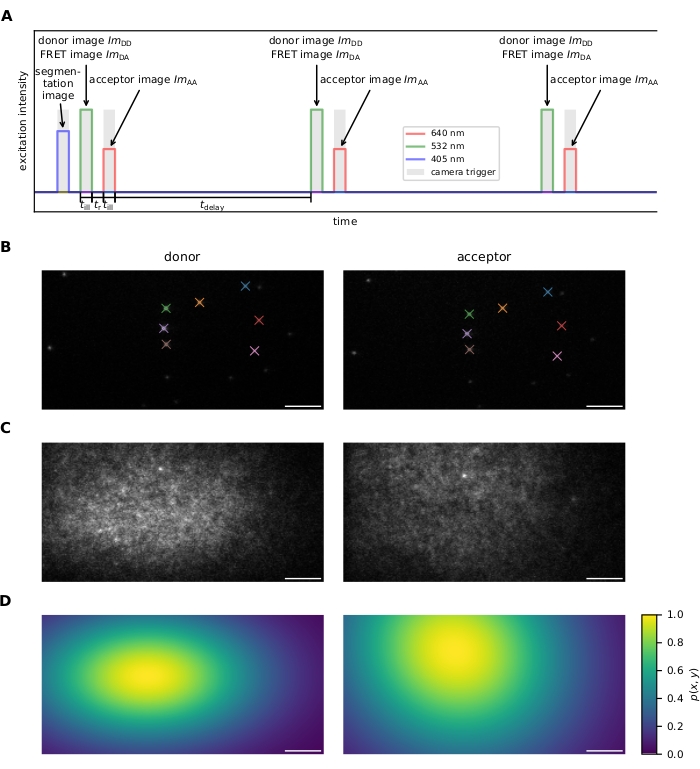
Рисунок 1: Получение изображения. (A) Последовательность возбуждения. После записи дополнительного изображения нагруженной красителем ячейки с помощью лазера 405 нм, донор и акцептор возбуждаются поочередно и многократно для времени освещения с использованием лазеров 532 нм и 640 нм соответственно. Время tr между возбуждением донора и акцептора должно быть достаточно длительным, чтобы камера могла считывать изображение. Время задержки tdelay может быть использовано для настройки частоты кадров сбора и, следовательно, интервала наблюдения перед фотоотбеливанием. Эта панель изменена с 16. (B) Фидуциальные маркеры используются для расчета координатных преобразований между двумя каналами излучения. Совпадающие фидуциалы обозначаются цветом. Несколько сдвинутых изображений должны быть записаны, чтобы гарантировать, что все поле зрения покрыто. (C) Лазерные профили для коррекции плоского поля регистрируются с использованием плотно маркированного образца. Профиль акцептора записывается и фотоотбеливается с последующим получением профиля донора. Несколько изображений должны быть сделаны в разных областях выборки, усреднены и сглажены, чтобы смягчить влияние несовершенств образца (например, яркое пятно в центре верхней части изображения). (D) Карта коррекции плоского поля p(x,y), рассчитанная на основе 20 лазерных профилей, записанных в соответствии с описанием в C. Сокращения: FRET = резонансный перенос энергии Фёрстера; ImDD = изображение излучения донора при возбуждении донора; ImDA = акцепторное эмиссионное изображение при возбуждении донора; ImAA = акцепторное эмиссионное изображение при возбуждении донора. Шкала = 5 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- При использовании камеры устройства с электронно-умножительной зарядовой связью (EMCCD) включите коэффициент усиления ЭМ для наблюдения за одномолекулярными сигналами при высоком соотношении сигнал/шум (см. инструкции производителя).
- Последовательность возбуждения (см. Рисунок 1А для получения дополнительной информации).
- При необходимости запишите изображение для сегментации, чтобы ограничить анализ данных определенными областями в поле зрения. Например, возбуждают фуражированные ячейки Fura-2 с помощью лазера 405 нм и захватывают их излучение около 510 нм для оценки только зондов, расположенных в интерфейсах между ячейками и поддерживаемыми липидными бислоями (SLB). Следовательно, подождите время tr, чтобы разрешить считывание камеры.
ПРИМЕЧАНИЕ: На камерах EMCCD tr зависит от количества линий в выбранной интересующей области (ROI). Поэтому выбор небольшой окупаемости инвестиций может быть выгодным, поскольку он уменьшает задержку между кадрами и размер записываемых данных. Кроме того, включение режима передачи кадров позволяет еще больше снизить tr. - Поочередно возбуждают донорские и акцепторные флуорофоры неоднократно.
- Возбуждайте донора в течение времени освещения (5-10 мс обычно достаточно коротко, чтобы избежать размытия движения), а также запуская камеру.
- Подождите время tr, чтобы разрешить считывание показаний камеры.
- Возбуждайте акцептор при срабатывании камеры.
- Подождите некоторое время tdelay.
ПРИМЕЧАНИЕ: Он должен быть длиннее tr, чтобы включить считывание камерой, но в противном случае может быть выбран произвольно. Он должен уравновешивать требования к разрешению времени и длине трассировки. - Повторите шаги 2.2.2.1-2.2.2.4. Выберите количество повторов, которое должно быть достаточно большим, чтобы обеспечить фотоотбеливание по крайней мере одного флуорофора на зонд в поле зрения, что позволяет проводить ступенчатый анализ фотоотбеливания для распознавания одномолекулярных сигналов от агрегатов.
ПРИМЕЧАНИЕ: Выбор подходящей интенсивности лазера на тилле и возбуждении обычно требует некоторых экспериментов: чем дольше время освещения и чем выше интенсивность лазера, тем лучше отношение сигнал/шум в результирующих изображениях, но тем короче результирующие временные следы.
- При необходимости запишите изображение для сегментации, чтобы ограничить анализ данных определенными областями в поле зрения. Например, возбуждают фуражированные ячейки Fura-2 с помощью лазера 405 нм и захватывают их излучение около 510 нм для оценки только зондов, расположенных в интерфейсах между ячейками и поддерживаемыми липидными бислоями (SLB). Следовательно, подождите время tr, чтобы разрешить считывание камеры.
- Запишите достаточное количество фильмов для каждого образца.
3. Дополнительные измерения для определения поправочных коэффициентов
- Запишите серию случайно расположенных фидуциальных маркеров, видимых в обоих эмиссионных каналах для регистрации изображения (т.е. нахождения преобразования, которое отображает координаты канала излучения донора на канал излучения акцептора и наоборот). См. рисунок 1B.
ПРИМЕЧАНИЕ: Регистрация изображений осуществляется программным обеспечением; см. шаг 6.1.4. - Измерьте профиль интенсивности как для донорских, так и для акцепторных источников возбуждения для коррекции плоского поля (т.е. с поправкой на неоднородное возбуждение в поле зрения). С этой целью готовят образец с высокой плотностью зондов FRET и сначала получают изображение при акцепторном возбуждении, затем фотоотбеливание акцептора и последующую запись изображения при возбуждении донора. Для повышения стабильности повторите несколько раз в разных областях выборки. См. рисунок 1C,D. В качестве альтернативы, запишите образец, украшенный только донорской молекулой, и второй образец, украшенный только акцепторными флуорофорами.
ПРИМЕЧАНИЕ: Коррекция плоского поля выполняется аналитическим программным обеспечением; см. шаг 8.1.2. - Запишите одномолекулярный образец (как в разделе 2) зонда без акцепторного флуорофора, чтобы определить утечку донорского излучения в акцепторный канал.
ПРИМЕЧАНИЕ: Утечка донора также может быть рассчитана по фактическим временным следам зондов после отбеливания акцептора. Если регистрируется достаточное количество таких событий, то никаких дополнительных измерений не требуется. Оба варианта поддерживаются программным обеспечением для анализа; см. Дополнительную информацию, раздел 3.15. - Получить записи зонда без донорского флуорофора для количественной оценки прямого акцепторного возбуждения источником света донорского возбуждения.
ПРИМЕЧАНИЕ: Прямое акцепторное возбуждение также может быть получено из фактических временных следов зондов после донорского отбеливания. Если регистрируется достаточное количество таких событий, то никаких дополнительных измерений не требуется. Оба варианта поддерживаются программным обеспечением для анализа; см. Дополнительную информацию, раздел 3.15. - Запишите одномолекулярный образец с двумя различными характеристиками эффективности FRET для корректировки различной эффективности обнаружения донорских и акцепторных эмиссионных каналов и различных квантовых выходов красителей.
ПРИМЕЧАНИЕ: Такими образцами могут быть, например, соединения Холлидей1, которые колеблются между двумя конформациями, или стержни ДНК, которые имеют пары FRET, прикрепленные на разных, четко определенных расстояниях. Если зонды обладают высокой и достаточно постоянной эффективностью FRET, коррекция также может быть рассчитана на основе событий отбеливания акцептора следов времени зондов, и в этом случае никаких дополнительных измерений не требуется. Оба варианта поддерживаются программным обеспечением для анализа; см. Дополнительную информацию, раздел 3.15.
4. Алгоритмы одномолекулярной локализации
ПРИМЕЧАНИЕ: Несколько этапов анализа требуют локализации одной молекулы. Выбирайте между алгоритмом гауссовской подгонки30 и вычислением центра масс31 в зависимости от плотности сигнала, фона и отношения сигнал/шум.
- Для выполнения гауссовской примерки выберите алгоритм 3D-DAOSTORM30 через соответствующие пользовательские интерфейсы.
ПРИМЕЧАНИЕ: 3D-DAOSTORM предназначен для различения четных сигналов с перекрывающимися функциями точечного спреда. Хотя это, как правило, преимущество, оно сопровождается предостережением: одиночные, яркие сигналы иногда идентифицируются как два смежных, что может запутать алгоритм отслеживания и привести к обнаружению двух коротких траекторий вместо одной длинной.
Задайте следующие параметры (подробности см. в документации библиотеки sdt-python32, которая обеспечивает реализацию алгоритма).- radius: задайте начальное значение σ функции гаусса fit в пикселях в зависимости от эффективного размера пикселя.
-
пороговое значение: установите минимальную амплитуду (т.е. самое яркое значение пикселя, скорректированное для предполагаемого локального фона) для максимального значения локальной интенсивности.
ПРИМЕЧАНИЕ: Порог, возможно, является наиболее важным параметром. Если уровень шума установлен слишком низко, он может считаться флуоресцентным сигналом, а яркие сигналы могут быть оснащены двумя гауссианами. Если установлено слишком высоко, тусклые сигналы не подходят. -
модель: Установите значение 2d , чтобы соответствовать круглым гауссианам.
ПРИМЕЧАНИЕ: Другие модели неприменимы к данным smFRET. -
Найти фильтр: примените фильтр перед поиском локальных максимумов для снижения шума, что полезно в ситуациях с низким соотношением сигнал/шум. Это может быть i) идентичность: без фильтра; ii) Крокер-Гриер: полосовой фильтр из алгоритма Крокера-Гриера31,33; или iii) Гауссово: гауссово размытие с σ задано параметром sigma.
ПРИМЕЧАНИЕ: Для Крокера-Гриера параметр feat. size должен быть примерно равен радиусу функции разброса точек в пикселях.
ПРИМЕЧАНИЕ: Подгонка выполняется с использованием нефильтрованных необработанных данных. -
минимальное расстояние: поместите два перспективных сигнала, разделенных менее чем минимальными пикселями расстояния одним гауссовым.
ПРИМЕЧАНИЕ: Это может помочь в вышеупомянутом сценарии, когда яркий сигнал ошибочно определяется как два смежных сигнала. - Диапазон размеров: Выберите минимальное и максимальное σ из подгонков для удаления обнаружений из ложных сигналов из-за шума.
- Выберите алгоритм Крокера-Гриера через соответствующие пользовательские интерфейсы для выполнения вычислений центра масс (усовершенствованный алгоритм31 , основанный на идее Крокера и Гриера33).
ПРИМЕЧАНИЕ: Этот алгоритм очень надежен даже в сценариях с низким уровнем шума и при работе с сигналами с диапазоном интенсивностей, но не может точно соответствовать молекулам с перекрывающимися функциями распространения точек.- radius: задайте радиус (в пикселях) диска, достаточно большой, чтобы вместить всю функцию точечного разброса.
-
молотилка сигнала: Установите минимальную амплитуду (самый яркий пиксель выше расчетного фона) для анализа максимума локальной интенсивности.
ПРИМЕЧАНИЕ: Если установлено слишком низкое значение, шум может рассматриваться как флуоресцентный сигнал. Если установлено слишком высоко, тусклые сигналы не подходят. -
mass thresh.: Установите минимальную общую интенсивность (сумму значений пикселей с поправкой на фон) анализируемого сигнала.
ПРИМЕЧАНИЕ: Применяются те же соображения, что и выше.
5. Инициализация программного обеспечения
- Загрузка скриптов анализа. В командной строке Anaconda перейдите в папку, чтобы сохранить анализ (с помощью команды cd ) и выполнить
GIT клонировать https://github.com/schuetzgroup/fret-analysis.git целевую папку- Замените целевую папку описательным именем, например 2021-06-14_Force-FRET-experiment.
ПРИМЕЧАНИЕ: Программное обеспечение для анализа окажется в этой папке; Убедитесь, что эта папка не существует заранее. Рекомендуется скачивать копии скриптов анализа для каждого эксперимента. Таким образом, можно вернуться к анализу позже, вспомнить используемые параметры и внести изменения.
- Замените целевую папку описательным именем, например 2021-06-14_Force-FRET-experiment.
- Копирование записных книжек Jupyter (01. Трекинг.ипинб, 02. Анализ.ипинб, 03. Plots.ipynb) во вновь созданную папку (далее именуемую корневой папкой). Если это первое использование программного обеспечения, получите их из подпапки записных книжек корневой папки.
ПРИМЕЧАНИЕ: Если подобные наборы данных уже были проанализированы, копирование записных книжек из предыдущего эксперимента может быть удобным вариантом, так как параметры могли измениться лишь незначительно. - Запустите сервер JupyterLab, выполнив следующую команду в командной строке Anaconda , чтобы открыть окно веб-браузера с JupyterLab.
Лаборатория юпитера
ПРИМЕЧАНИЕ: Браузер является только интерфейсом, в то время как процесс, выполняющийся в приглашении Anaconda , выполняет фактическую работу. Как следствие, закрытие окна браузера имеет лишь минимальный эффект; сеанс можно восстановить, обратившись к http://localhost:8888. Однако прерывание процесса JupyterLab в приглашении или закрытие приглашения завершит анализ, что приведет к потере несохраненной работы. - В окне браузера JupyterLab используйте левую панель для перехода к корневой папке. Дважды щелкните 01. Tracking.ipynb , чтобы запустить первую записную книжку. После запуска найдите новую вкладку, в которой отображаются поля, так называемые ячейки, кода Python.
ПРИМЕЧАНИЕ: Все записные книжки Jupyter содержат комментарии, описывающие функциональность каждой ячейки кода. Кроме того, документацию по каждому вызову метода можно отобразить, поместив текстовый курсор непосредственно перед открытием ( и нажав Клавиши SHIFT+TAB. - Обзор процесса анализа данных см. на рисунке 2 .
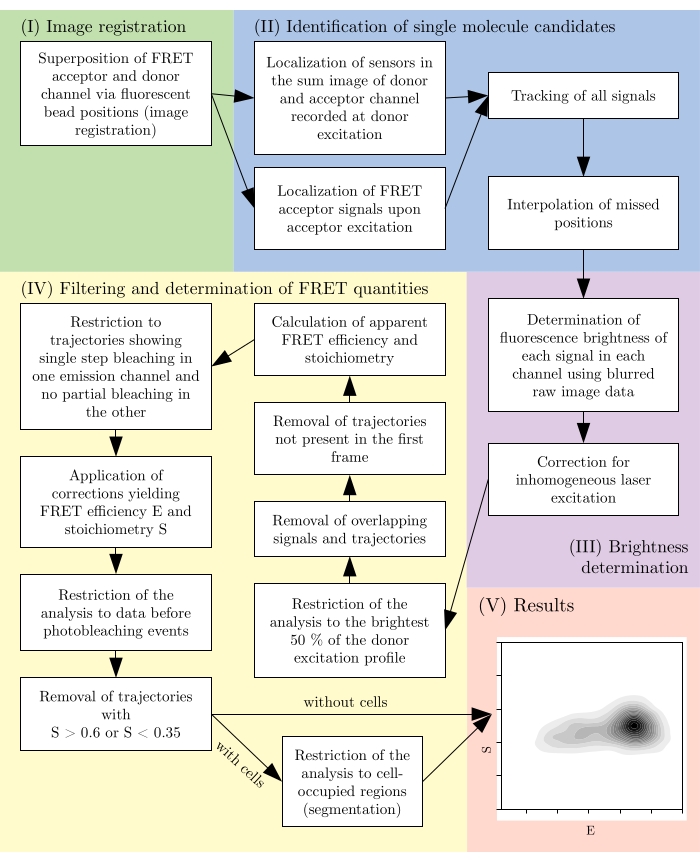
Рисунок 2: Обзор типичного конвейера анализа. Отметим, что этапы фильтрации подлежат адаптации в соответствии с экспериментальной конструкцией. Эта цифра изменена с 16. Аббревиатура: FRET = резонансный перенос энергии Фёрстера. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
ПРИМЕЧАНИЕ: Образцы данных для опробования программного обеспечения можно загрузить с https://github.com/schuetzgroup/fret-analysis/releases/tag/example_files
6. Локализация, отслеживание и анализ интенсивности флуоресценции отдельных молекул (01. Tracking.ipynb).
- Используйте 01. Tracking.ipynb Блокнот Jupyter для надежного анализа значений интенсивности флуоресценции одномолекулярных сигналов, который предназначен для точной количественной оценки, особенно слабых сигналов, часто возникающих при измерениях FRET (например, из-за низких донорских сигналов при событиях с высоким FRET и наоборот).
ПРИМЕЧАНИЕ: С этой целью реализована прямая интеграция интенсивности пикселей в необработанные данные с поправкой на локальный фон. Скриншоты каждого шага анализа и описание параметров вызова функции см. в разделе Дополнительная информация.- Укажите последовательность освещения, чтобы можно было выбрать кадры возбуждения донора и акцептора, а также кадры для сегментации изображения из записанных последовательностей изображений.
ПРИМЕЧАНИЕ: Поскольку программное обеспечение позволяет обрабатывать данные, записанные с помощью произвольных протоколов освещения, необходимо указать, какой кадр в последовательности изображения был получен, в то время как какой тип флуорофора; см. Дополнительную информацию, раздел 1.2, шаг 3. Номера кадров исходной последовательности изображений сохраняются. - Описание и загрузка наборов данных. Анализируйте несколько наборов данных одновременно, при условии, что они были записаны с использованием одних и тех же настроек освещения. Назначьте идентификатор и шаблон, соответствующие именам файлов последовательности изображений, каждому набору данных. Кроме того, определите конкретные наборы данных для специальных целей, такие как записи фидуциальных маркеров для регистрации изображений, световые профили возбуждения для коррекции плоского поля и, при необходимости, образцы только донора и акцептора для определения поправочных коэффициентов.
- Выберите каналы излучения в необработанных изображениях, если оба канала были записаны с помощью одной камеры. Для этого используйте соответствующий графический виджет, чтобы выбрать соответствующие регионы для донорской и акцепторной эмиссии.
- Локализуйте фидуциальные маркеры в обоих эмиссионных каналах и выполняйте регистрацию изображений. Используйте предоставленный пользовательский интерфейс для поиска подходящих параметров для алгоритма локализации как для донорского, так и для акцепторного эмиссионных каналов. Сведения о поддерживаемых алгоритмах локализации см. в разделе 4.
ПРИМЕЧАНИЕ: Случайно распределенные фидуциальные маркеры могут быть идентифицированы по каналам излучения по пространственному распределению их ближайших соседей (рисунок 1B). Пользовательская реализация алгоритма, предложенного для селективной плоскостной микроскопии освещения34 в библиотеке sdt-python , автоматически сопоставляет положение каждого маркера в канале излучения донора с положением в акцепторном эмиссионном канале. Преобразование T, отображающее координаты канала излучения донора с координатами акцепторного эмиссионного канала, найдено с помощью линейного наименьшего квадрата соответствия аффинного преобразования позициям маркеров35. RANSAC используется для учета выбросов, таких как неправильно подобранные позиции из предыдущего шага. - Локализуйте зонды FRET независимо от возбуждения донора и акцептора во всех кадрах и объединяйте результаты в одну таблицу, содержащую исходный номер кадра, 2-мерные координаты и идентификатор, относящийся к файлу исходного изображения.
ПРИМЕЧАНИЕ: С этой целью программное обеспечение предоставляет пользовательские интерфейсы для поиска соответствующих опций для алгоритма локализации.- Локализовать зонды FRET при возбуждении донора в сумме изображений, полученных от донорского излучения ImDD и акцепторного излучения ImDA, которые вряд ли зависят от эффективности FRET. Информацию о параметрах алгоритма локализации см. в разделе 4.
ПРИМЕЧАНИЕ: Каждая сумма изображения вычисляется путем преобразования ImDD с использованием преобразования T, ранее полученного при регистрации изображения и добавленного попикселям в ImDA. - Локализация зондов при возбуждении акцептора в канале излучения акцептора ImAA (подробнее об алгоритмах локализации см. в разделе 4).
- Локализовать зонды FRET при возбуждении донора в сумме изображений, полученных от донорского излучения ImDD и акцепторного излучения ImDA, которые вряд ли зависят от эффективности FRET. Информацию о параметрах алгоритма локализации см. в разделе 4.
- Выполните отслеживание и измерение интенсивности флуоресценции.
- Укажите последовательность освещения, чтобы можно было выбрать кадры возбуждения донора и акцептора, а также кадры для сегментации изображения из записанных последовательностей изображений.
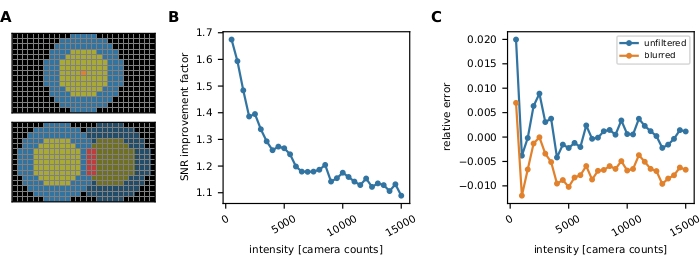
Рисунок 3: Измерение интенсивности одной молекулы. (A) Для флуорофора, расположенного в оранжевом пикселе, его неисправленная интенсивность Iuncorr определяется путем суммирования интенсивности всех пикселей в диске (желтый и оранжевый пиксели), достаточно большого, чтобы охватить все пиксели, затронутые сигналом: 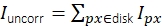 . Локальный фон вычисляется как среднее значение пикселей в кольце (синие пиксели) вокруг диска:
. Локальный фон вычисляется как среднее значение пикселей в кольце (синие пиксели) вокруг диска: 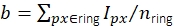 , где nring — количество пикселей в кольце. Интенсивность флуоресценции I является результатом вычитания фона из неисправленной интенсивности, I = Iuncorr - b × ndisk, где ndisk - количество пикселей в диске. Радиус окружности задается с помощью параметра feat_radius метода слежения. Ширина кольца задается параметром bg_frame. Если функция точечного спреда одного сигнала перекрывается с фоновым кольцом другого (нижняя панель), затронутые пиксели (красный) исключаются из локального фонового анализа. Если функции двухточечного распространения перекрываются, интенсивность флуоресценции не может быть надежно рассчитана и, следовательно, отбрасывается. (В, С) Моделирование показывает, что применение гауссовского размытия со стандартным отклонением 1 пиксель улучшает отношение сигнал/шум до коэффициента, близкого к 2 при низких интенсивностях флуоресценции (B) и практически не приводит к какой-либо погрешности (небольшая недооценка менее 1%, (C)))16. Более того, относительная погрешность (т.е. (Imeas - Itruth)/Itruth, где Itruth является основной истиной, а Imeas - результатом анализа) постоянна во всем диапазоне интенсивности и, следовательно, нивелирует для ратиометрических величин, таких как эффективность FRET и стехиометрии. Все сюжеты основаны на ранее опубликованной работе16. Сокращения: SNR = отношение сигнал/шум; FRET = резонансный перенос энергии Фёрстера. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
, где nring — количество пикселей в кольце. Интенсивность флуоресценции I является результатом вычитания фона из неисправленной интенсивности, I = Iuncorr - b × ndisk, где ndisk - количество пикселей в диске. Радиус окружности задается с помощью параметра feat_radius метода слежения. Ширина кольца задается параметром bg_frame. Если функция точечного спреда одного сигнала перекрывается с фоновым кольцом другого (нижняя панель), затронутые пиксели (красный) исключаются из локального фонового анализа. Если функции двухточечного распространения перекрываются, интенсивность флуоресценции не может быть надежно рассчитана и, следовательно, отбрасывается. (В, С) Моделирование показывает, что применение гауссовского размытия со стандартным отклонением 1 пиксель улучшает отношение сигнал/шум до коэффициента, близкого к 2 при низких интенсивностях флуоресценции (B) и практически не приводит к какой-либо погрешности (небольшая недооценка менее 1%, (C)))16. Более того, относительная погрешность (т.е. (Imeas - Itruth)/Itruth, где Itruth является основной истиной, а Imeas - результатом анализа) постоянна во всем диапазоне интенсивности и, следовательно, нивелирует для ратиометрических величин, таких как эффективность FRET и стехиометрии. Все сюжеты основаны на ранее опубликованной работе16. Сокращения: SNR = отношение сигнал/шум; FRET = резонансный перенос энергии Фёрстера. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Выберите подходящие параметры для trackpy36algorithm, используемого для связывания локализаций зонда FRET с траекториями. В частности, задайте максимальное расстояние поиска от одного кадра до другого и количество последовательных кадров, для которых сигнал может остаться незамеченным, что может произойти из-за обесцвечивания или пропущенных локализаций.
ПРИМЕЧАНИЕ: Эти пробелы заполняются путем интерполяции между предыдущими и последующими позициями. Эти интерполированные позиции помечаются и используются только позже для считывания значений интенсивности, но не для диффузионного анализа. Треки анализируются в системе координат акцепторного эмиссионного канала. Для анализа интенсивности флуоресценции (этап 6.1.6.2) треки дополнительно преобразуются в систему координат донорского эмиссионного канала с использованием обратного преобразования Т-1, полученного путем регистрации изображений (см. этап 6.1.4). - Выберите параметры для алгоритма расчета интенсивности флуоресценции (см. Рисунок 3A для деталей). Укажите i) радиус диска, который при центрировании на позиции сигнала, содержит все пиксели, затронутые этим сигналом, и ii) ширину кольца вокруг каждого диска, используемого для определения локального фона.
ПРИМЕЧАНИЕ: Для уменьшения шума в полученных измерениях интенсивности к изображениям применяется гауссовское размытие со стандартным отклонением 1 пиксель (рисунок 3B,C).
- Используйте функциональность программного обеспечения для анализа для обработки вспомогательных данных изображений из последовательностей изображений.
- Извлечение дополнительных изображений, записанных для облегчения сегментации (см. этап 2.2.1, помеченный s в последовательности возбуждения (см. Дополнительную информацию, раздел 1.2, шаг 3).
- Определите световые профили донора и акцептора возбуждения по всему полю зрения по изображениям, записанным на плотно маркированном образце (см. шаг 3.2).
ПРИМЕЧАНИЕ: Среднее значение попикселям вычисляется на основе изображений для вычисления профилей освещения. Базовая линия камеры вычитается. Изображения размываются с помощью гауссовского фильтра для уменьшения эффектов из-за примесей образца. Наконец, результирующие изображения делятся попикселям на их максимальное значение, чтобы получить профиль p(x,y), отображающий координаты на интервал [0,1].
7. Визуализация траекторий FRET (опционально)
- Используйте приложение инспектора для отображения одномолекулярных треков в необработанных данных изображения и соответствующих интенсивностей флуоресценции и видимой эффективности FRET и стехиометрии.
ПРИМЕЧАНИЕ: Это ценный инструмент для оценки достоверности выбранных параметров и ручного приема или отклонения отдельных временных трассировок. Дополнительные сведения см. в разделе Снимки экрана и подробные сведения об использовании.
8. Анализ и фильтрация одномолекулярных данных (02. Analysis.ipynb)
- Используйте 02. Analysis.ipynb Jupyter блокнот для анализа и фильтрации одномолекулярных данных, полученных с помощью 01. Tracking.ipynb записная книжка. Ниже приведены инструкции по типичному конвейеру анализа.
ПРИМЕЧАНИЕ: Различные научные вопросы и экспериментальные проекты могут потребовать корректировки настроек. Использование ноутбуков Jupyter позволяет легко адаптироваться, пропуская, переставляя и изменяя этапы анализа. Скриншоты каждого шага анализа и описание параметров вызова функции см. в разделе Дополнительная информация.- Выполните начальные шаги фильтрации.
- Отбрасывайте сигналы с перекрывающимися функциями точечного распространения, так как трудно надежно определить их интенсивность флуоресценции.
- В случае неоднородного освещения принимайте только сигналы, расположенные в хорошо освещенных областях в поле зрения, чтобы обеспечить хорошее соотношение сигнал/шум.
- При изучении внутримолекулярного FRET ограничьте анализ теми траекториями, которые присутствуют с начала последовательности изображений, чтобы гарантировать, что все этапы отбеливания записаны и могут быть должным образом оценены позже во время ступенчатого анализа фотоотбеливания.
ПРИМЕЧАНИЕ: При проведении экспериментов с межмолекулярными зондами FRET, в которых донорские и акцепторные флуорофоры не являются частью предварительно сформированного комплекса, может оказаться невозможным ограничить анализ первоначально представленными траекториями.
- Выполнение коррекции плоского поля, при которой используются профили источников света возбуждения, полученные на этапе 6.1.7.2, для обращения вспять зависящих от положения изменений интенсивности флуоресценции, вызванных неоднородным освещением.
ПРИМЕЧАНИЕ: Интенсивность флуоресценции I(x,y) зонда в положении (x,y) корректируется с помощью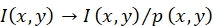 ; см. Рисунок 1C,D.
; см. Рисунок 1C,D. - Вычислите кажущуюся эффективность FRET Eapp (т.е. долю энергии, передаваемой от донорского флуорофора к акцепторному флуорофору) и кажущуюся стехиометрию Саппа (т.е. количество донорских флуорофоров, деленное на общее количество флуорофоров в дифракционно-ограниченном месте).
ПРИМЕЧАНИЕ: Путем построения графика E против S для каждой точки данных можно различить изменения в измеренной эффективности FRET из-за изменения расстояния донор-акцептор от изменений из-за изменений в стехиометрии18. Это позволяет дифференцировать E = 0 из-за отделения красителя от E = 0 из-за отсутствия активного акцептора. Участки E-S используются на протяжении всего анализа в качестве инструмента оценки качества; См. рисунок 4 в качестве примера. - Выполняйте поэтапный анализ фотоотбеливания для различения между одномолекулярными зондами и агрегатами. Выберите один из следующих вариантов.
ПРИМЕЧАНИЕ: С этой целью аналитическое программное обеспечение применяет пользовательскую реализацию32 алгоритма обнаружения точек изменения PELT37 отдельно к интенсивности флуоресценции при возбуждении донора (IDD + IDA) и акцепторном возбуждении (IAA).- Выберите вариант 1, в котором акцептор флуорофор отбеливает за один шаг, в то время как донор не показывает частичного отбеливания (т. Е. Нет шага отбеливания до ненулевой интенсивности).
ПРИМЕЧАНИЕ: Этот вариант дополнительно отклоняет траектории, где донор отбеливает перед акцептором за один шаг. Вариант 1 является предпочтительным выбором в случае высокой скорости фотоотбеливания акцептора. - Выберите вариант 2, в котором донор отбеливает в один этап, пока нет частичного акцепторного отбеливания.
ПРИМЕЧАНИЕ: Этот вариант дополнительно отклоняет траектории, где донор отбеливает после акцептора за один шаг. Вариант 2 является предпочтительным выбором в случае высокой скорости фотоотбеливания доноров. - Выберите вариант 3, в котором один флуорофор отбеливает за один шаг, в то время как другой не отбеливает частично.
ПРИМЕЧАНИЕ: Вариант 3 обеспечивает большую гибкость, чем варианты 1 и 2, и в качестве предпочтительного варианта будет отдаваться анализу данных. - Выберите вариант 4, в котором донорские и акцепторные флуорофоры показывают одноступенчатое фотоотбеливание или отсутствие фотоотбеливания вообще.
ПРИМЕЧАНИЕ: Вариант 4 является предпочтительным в случае низкой скорости фотоотбеливания.
- Выберите вариант 1, в котором акцептор флуорофор отбеливает за один шаг, в то время как донор не показывает частичного отбеливания (т. Е. Нет шага отбеливания до ненулевой интенсивности).
- Рассчитайте поправочные коэффициенты утечки выбросов доноров в α акцепторного канала, δ возбуждения прямого акцептора, эффективности обнаружения γ и эффективности возбуждения β 17.
- Используйте поправочные коэффициенты для расчета эффективности FRET E из кажущейся эффективности Eapp и стехиометрии S из кажущейся стехиометрии Sapp.
- Выполните дальнейшие шаги фильтрации. Выберите только точки данных до первого события обесцвечивания на каждой траектории. Кроме того, принимайте только траектории, по крайней мере, с 75% точек данных, удовлетворяющих 0,35 < S < 0,6, чтобы ограничить анализ одномолекулярными зондами (числа регулируются).
ПРИМЕЧАНИЕ: Верхняя и нижняя границы для должны быть выбраны в соответствии с распределением интересующей популяции по сравнению с популяциями, которые должны быть исключены из анализа (например, популяции только доноров и только акцепторы). Исходя из опыта, 0,35 < S < 0,6 оказались хорошим выбором для многих экспериментальных ситуаций. - Выполните сегментацию изображений с помощью глобальных или адаптивных методов пороговых значений35 на соответствующих вспомогательных изображениях (см. шаги 2.2.1 и 6.1.7), чтобы ограничить анализ отдельными областями в поле зрения.
ПРИМЕЧАНИЕ: Это позволяет, например, эксклюзивно оценивать зонды, расположенные в интерфейсе cell-SLB или на узорчатой структуре.
- Выполните начальные шаги фильтрации.
9. Построение результатов и дальнейший анализ (03. Plot.ipynb)
ПРИМЕЧАНИЕ: См. Дополнительную информацию для скриншотов записной книжки Jupyter и описания параметров вызова функции.
- Создайте графики E-S , чтобы убедиться, что сигналы неправильной стехиометрии были правильно идентифицированы и удалены.
- Построение гистограмм эффективности FRET для обеспечения хорошо зарекомендовавшего себя обзора распределений эффективности FRET. Группируйте гистограммы для удобного сравнения результатов различных экспериментов.
- Оцените данные дальше (например, диффузионный анализ, преобразование эффективности FRET в силы в экспериментах с использованием датчиков молекулярной силы или анализ перехода) в блокноте, используя преимущества научных библиотек Python.
ПРИМЕЧАНИЕ: Данные также могут быть экспортированы во многих форматах файлов в качестве входных данных для другого аналитического программного обеспечения.
Результаты
Из треков smFRET можно извлечь различную низко- и высокоуровневую информацию в зависимости от научного вопроса эксперимента. Здесь представлены примеры конвейеров анализа с аналоговыми и цифровыми зондами: пептидный датчик молекулярной силы16 и ДНК-зонд со стохастическим переключением его конформации38 соответственно. Обратитесь к рисунку 5 для определения конструкции и принципа работы этих датчиков.
После того, как алгоритмы локализации и отслеживания были выполнены, как описано в протоколе, пакет предлагает несколько инструментов визуализации данных для оптимизации начальных параметров и последующих этапов фильтрации: (i) визуализация отдельных событий smFRET, (ii) дополнительная сегментация изображений для анализа данных в определенных областях интересов, (iii) мониторинг шагов фильтра с помощью графиков эффективности FRET и стехиометрии (E-S). Визуализация одномолекулярных данных представлена на рисунке 6.
Наконец, отфильтрованные события FRET представлены графиком E-S и гистограммой эффективности FRET (рисунок 4). График E-S является полезным инструментом для оптимизации вышеупомянутых шагов фильтрации и исследования конечного результата. Частично отбеленные или неполностью маркированные датчики FRET могут быть исключены по их стехиометрическому значению. Параметры подвижности могут быть исследованы путем построения индивидуального траекторионного пути на графике x-y (рисунок 6) или графике среднего квадратного смещения (MSD) (рисунок 4). Первый метод особенно полезен для различения мобильных и иммобилизованных событий, в то время как последний используется для расчета коэффициента диффузии.
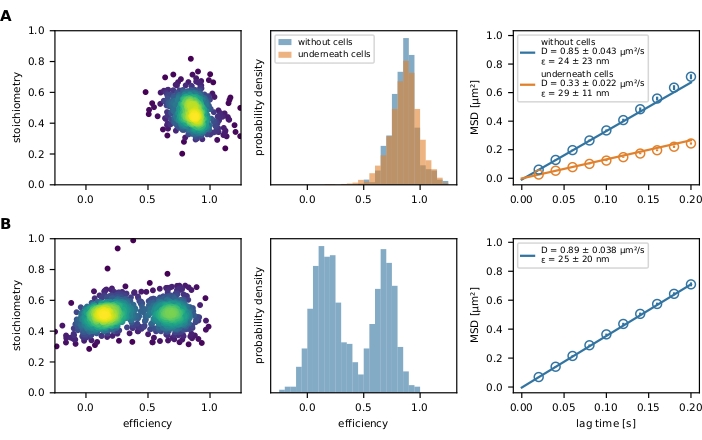
Рисунок 4: Примерный результат. (A) Эффективность FRET строится по сравнению со стехиометрией (график E-S) для популяции датчика молекулярной силы (левая панель), украшающего липидный бислой со стеклянной поддержкой и напряженного Т-клеткой. Видно только одно облако населения. Соответствующая гистограмма эффективности FRET иллюстрирует разницу между популяцией датчика силы при наличии и отсутствием клеток (средняя панель). Не наблюдается сдвига в сторону снижения эффективности FRET популяции датчиков в присутствии Т-клеток, что указывает на незначительное или полное отсутствие силозависимого растяжения сенсорного модуля. График MSD этих экспериментальных условий подтверждает, что популяция датчиков силы под Т-клеткой движется значительно медленнее, чем их несвязанные аналоги (правая панель). (B) Тот же анализ проводился с помощью датчика ДНК соединения Холлидей, украшающего поддерживаемый стеклом жидкий липидный бислой. График E-S четко показывает две популяции, которые также очевидны в гистограмме эффективности FRET. График MSD указывает на наличие одной быстро движущейся популяции датчиков. Сокращения: FRET = резонансный перенос энергии Фёрстера; MSD = среднее квадратное смещение. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
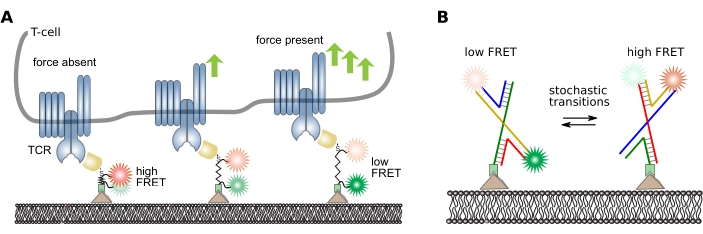
Рисунок 5: Конструкция и принцип работы внутримолекулярных датчиков FRET. (A) Аналоговый пептидный датчик для количественной оценки механических молекулярных сил. Донорский и акцепторный флуорофоры ковалентно прикреплены к обоим концам пептидной основы. Сенсорный модуль является сайт-специфически прикрепленным к определенному лиганду, который, в свою очередь, связывает интересующий рецептор клеточной резидентной поверхности (здесь фрагмент антитела, специфически распознающий бета-цепь рецептора Т-клеток). При связывании рецептор-лиганд оказывается сила, и сенсорный модуль расширяется и в конечном итоге откатывается после расщепления связи. Эта панель изменена с 16. (B) Цифровой датчик ДНК для количественной оценки переходов FRET. Датчик FRET состоит из четырех нитей ДНК, образующих соединение Холлидей. Донор и акцепторный флуорофор ковалентно прикреплены к двум нитям. Соединения Холлидей часто меняют свою конформацию в зависимости от окружающих буферных условий. Стохастическое переключение этих конформаций можно контролировать путем количественной оценки эффективности FRET отдельных зондов. Сокращения: TCR = Т-клеточный рецептор; FRET = резонансный перенос энергии Фёрстера. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
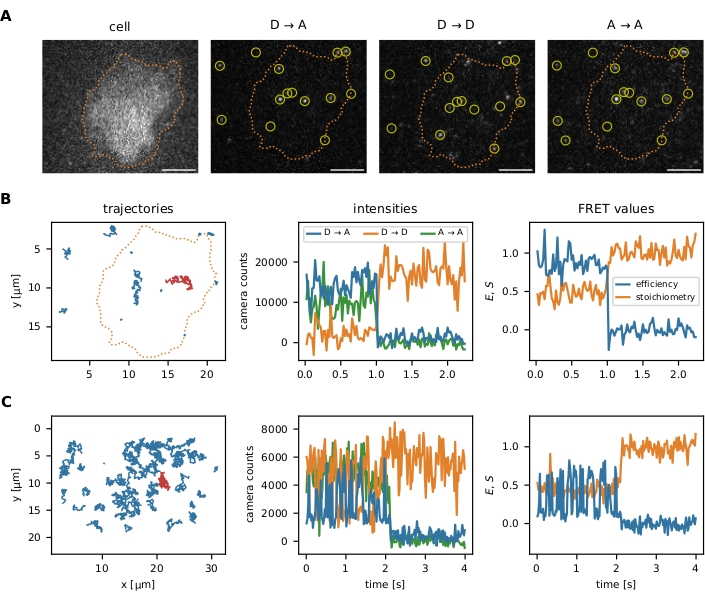
Рисунок 6: Примеры локализации и отслеживания зондов FRET. (A) Эффективность FRET и стехиометрия отдельных событий рассчитываются путем количественной оценки интенсивности донорского флуорофора при возбуждении донора (D → D), акцепторного флуорофора при возбуждении донора (D → A) и акцепторного флуорофора при акцепторном возбуждении (A → A). Фильтрация ближайших соседей предотвращает смещение за счет перекрытия функций точечного распространения близких излучателей. Сегментация изображений позволяет пользователю выбирать определенные события smFRET, локализованные в интересующей области (например, ячейка или микрошаблон). В качестве примера сегментации изображения Т-клетки окрашивали Fura-2 (отображается слева) и подвергали адаптивному пороговому значению для идентификации краев клеток (оранжевая пунктирная линия). Шкала баров = 5 мкм. (B) траекторий smFRET с использованием датчика молекулярной силы. Отдельные траектории могут быть построены в плоскости x-y , визуализируя их диффузионное поведение и локализацию (левая панель). Кроме того, интенсивность каждой траектории может быть построена с течением времени для идентификации переходов FRET или этапов отбеливания (средняя панель показывает красную траекторию с левой панели). Результирующая эффективность FRET и стехиометрия могут быть визуализированы аналогично (правая панель). (C) траектории smFRET с использованием датчика ДНК соединения Холлидей. HBSS + 12 мМ MgCl2 использовался в качестве буфера во время измерений. Помимо очевидной стадии отбеливания акцептора в конце последовательности этих примеров, может быть определена частота переходов FRET для каждого датчика. Переходы Холлидей переключают свою конформацию с высокой частотой, тогда как датчик молекулярной силы не демонстрирует переходов FRET. Эта информация позволяет корректировать экспериментальные условия, такие как задержка между кадрами, увеличивать или уменьшать количество наблюдаемых переходов. Сокращения: FRET = резонансный перенос энергии Фёрстера; smFRET = одномолекулярный ЛАД; HBSS = сбалансированный солевой раствор Хэнка. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительная информация: Локализация и отслеживание отдельных молекул (01. Tracking.ipynb). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
В этой статье подробно описывается конвейер для автоматизированных записей и количественного анализа данных smFRET, поступающих из мобильных, но поверхностно привязанных молекул зонда. Он дополняет два преобладающих подхода к экспериментам smFRET, включающие либо поверхностные иммобилизованные зонды, либо зонды, диффундирующие в растворе в конфокальный объем возбуждения и из него17. Он обеспечивает правильную эффективность FRET и молекулярные позиции в зависимости от времени. Поэтому он может быть использован в качестве входных данных для специализированных программ анализа, например, для количественной оценки кинетики перехода1, гистограмм FRET39 или двумерной диффузии22.
Программное обеспечение выпускается под свободной лицензией с открытым исходным кодом, одобренной Open Source Initiative, которая предоставляет пользователю бессрочное право на свободное использование, модификацию и распространение. Github был выбран в качестве платформы для разработки и распространения, чтобы максимально упростить получение программного обеспечения и участие в процессе разработки, сообщая об ошибках или внося код40. Написанное на Python, программное обеспечение не зависит от проприетарных компонентов. Выбор ноутбуков Jupyter в качестве пользовательских интерфейсов облегчает проверку данных на каждом этапе анализа и позволяет адаптировать и расширять конвейер специально для экспериментальной системы. Библиотека sdt-python32 служит основой и реализует функциональные возможности для оценки данных флуоресцентной микроскопии, таких как локализация одной молекулы, диффузионный анализ, анализ интенсивности флуоресценции, регистрация цветовых каналов, анализ колокализации и обработка ROI.
В принципе, отслеживание одиночных частиц может быть выполнено в одно-, двух- или трехмерных системах. Здесь конвейер одномолекулярного анализа был адаптирован для изучения 2D-мобильных систем. Этот выбор отражает доступность простых систем, таких как планарные липидные бислои (SLB), для представления мобильных флуоресцентных зондов. Такие липидные двухслойные системы обычно состоят из двух или более фрагментов фосфолипидов, где объемная фракция определяет ключевые физико-химические параметры SLB (такие как фаза и вязкость), а незначительная фракция обеспечивает места присоединения для биомолекул. Эти сайты прикрепления могут быть биотинилированными фосфолипидами для белковых платформ на основе авидина или стрептавидина или конъюгированными фосфолипидами никеля-NTA для белковых платформ с гистидиновыми метками41. Выбор подходящей платформы для связывания белков с SLB зависит от научного вопроса. Читатели могут обратиться к литературе16,38,42 для примеров успешно используемых стратегий. Плотность зондов в образце должна быть достаточно низкой, чтобы избежать перекрытия функций точечного распространения; как правило, рекомендуется менее 0,1 молекулы на мкм2. См. раздел репрезентативных результатов (в частности, рисунок 6) для примера, показывающего подходящую плотность зонда. Метод анализа также применим к одиночным флуоресцентно меченым белковым молекулам, диффундирующим в плазматической мембране живых клеток.
Одним из важнейших аспектов экспериментов smFRET является производство и характеристика самих зондов FRET. При выборе флуорофоров для пары FRET их радиус Förster должен соответствовать ожидаемым расстояниям между красителями43. Красители, устойчивые к фотоотбеливанию, являются предпочтительными, поскольку они дают длинные временные следы. Однако для повышенных скоростей обесцвечивания один вид флуорофоров может быть использован для распознавания мультиэмиттерных событий, происходящих из колокализованных молекул, с помощью ступенчатого анализа фотоотбеливания; см. шаг 8.1.4 в разделе протокола. Пары флуорофоров должны быть специфичными и ковалентно прикрепленными к интересующим молекулам, образуя внутри- или межмолекулярные пары FRET.
Сочетание smFRET с другими легкодоступными методами может увеличить его пространственное разрешение за пределы дифракции (через STED44). Представленный здесь алгоритм отслеживания smFRET расширяет применимость подхода к новым экспериментальным настройкам и модельным системам. Это включает в себя исследования (i) кинетических изменений в стехиометрии подвижных биомолекул, (ii) динамической ассоциации подвижных биомолекул, (iii) скорости ферментативных реакций свободно диффузных реагентов и (iv) кинетики конформационных изменений подвижных биомолекул. Первые два примера требуют модельных систем, которые показывают межмолекулярный FRET, т.е. донор и акцептор сопряжены с отдельными биомолекулярными объектами, представляющими интерес. В последних примерах могут использоваться биосенсоры, несущие донора и акцептора в пределах одного молекулярного объекта (внутримолекулярного ФРЕТа).
Внутримолекулярные датчики на основе ФРЕТа могут обеспечить понимание внутренних конформационных изменений биомолекул1,2,3,4, конформационных изменений, вызванных эндогенной или внешней силовой нагрузкой (датчики молекулярной силы16), или концентраций ионов в наносреде, таких как кальций45 и рН46 . В зависимости от модельной системы и предпочтительной анкерной платформы такие события smFRET могут быть отслежены в 2D или 3D: (i) планарное отслеживание событий smFRET может быть использовано для количественной оценки времени взаимодействия рецептор-лиганд в плазматической мембране, ассоциации каскадов усиления сигнала с мембранным креплением и стехиометрических изменений поверхностных рецепторов; (ii) объемное отслеживание событий smFRET может быть использовано для любых внутри- или межмолекулярных зондов FRET в живых клетках или в восстановленных системах in vitro.
Метод отслеживания smFRET был разработан в основном с учетом внутримолекулярных зондов FRET. Эти зонды имеют фиксированное и хорошо известное количество флуоресцентных меток, факт, который был использован для отклонения данных от агломерированных и неправильно синтезированных (например, неполностью меченых) молекул, а также от зондов, где один из флуорофоров был фотоотбелен. Однако, регулируя этапы фильтрации, метод также может быть применен к межмолекулярным датчикам FRET. Например, вместо того, чтобы принимать только молекулы с одним донором и одним акцепторным флуорофором, можно было бы изучить пространственные траектории донорских и акцепторных красителей и выбрать, например, для кодиффузных донор-акцепторных траекторий.
Поскольку алгоритм 3D-DAOSTORM поддерживает определение положения сигнала вдоль оптической оси с помощью астигматизма из-за цилиндрической линзы на пути излучения, 3D-эксперименты могут быть легко интегрированы в конвейер анализа. В этом случае акцепторный сигнал при возбуждении акцептора будет служить для определения стехиометрии и осевого положения. Аналитическое программное обеспечение также может быть использовано для оценки данных экспериментов с иммобилизованными зондами, используя его большую степень автоматизации и схем фильтрации. Фактически, наборы данных эффективности smFRET из переходов Холлидей, иммобилизованных на гелефазных бислоях38 , были проанализированы с использованием ранней версии программного обеспечения.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Эта работа была поддержана проектами Австрийского научного фонда (FWF) P30214-N36, P32307-B и Венским научно-техническим фондом (WWTF) LS13-030.
Материалы
| Name | Company | Catalog Number | Comments |
| 1,2-dioleoyl-sn-glycero-3-[(N-(5-amino-1-carboxypentyl)iminodiacetic acid)succinyl] (nickel salt) (Ni-NTA-DOGS) | Avanti Polar Lipids | 790404P | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Avanti Polar Lipids | 850375P | |
| 1-palmitoyl-2-oleoyl-glycero-3-phosphocholine (POPC) | Avanti Polar Lipids | 850457P | |
| α Plan-FLUAR 100x/1.45 oil objective | Zeiss | 000000-1084-514 | |
| Axio Observer microscope body | Zeiss | ||
| Bandpass filter | Chroma Technology Corp | ET570/60m | donor emission filter |
| Bandpass filter | Chroma Technology Corp | ET675/50m | acceptor emission filter |
| conda-forge | conda-forge community | community-maintaned Python package repository for Anaconda/miniconda | |
| Coverslips 60 mm x 24 mm #1.5 | MENZEL | ||
| Dichroic mirror | Semrock Inc | FF640-FDi01-25×36 | separation of donor and acceptor emission |
| Dichroic mirror (quad band) | Semrock Inc | Di01-R405/488/532/635-25×36 | separation of excitation and emission light |
| DPBS | Sigma-Aldrich | D8537 | |
| FCS | Sigma-Aldrich | F7524 | for imaging buffer |
| fret-analysis | Schütz group at TU Wien | Python package for smFRET data analysis; version 3 | |
| Fura-2 AM | Thermo Fisher Scientific | 11524766 | |
| HBSS | Sigma-Aldrich | H8264 | for imaging buffer |
| iBeam Smart 405-S 405 nm laser | Toptica Photonics AG | ||
| iXon Ultra 897 EMCCD camera | Andor Technology Ltd | ||
| Lab-Tek chambers (8 wells) | Thermo Fisher Scientific | 177402PK | for sample preparation and imaging |
| Millenia Prime 532 nm laser | Spectra Physics | ||
| miniconda | Anaconda Inc. | Python 3 distribution. Min. version: 3.7 | |
| Monovalent streptavidin (plasmids for bacterial expression) | Addgene | 20860 & 20859 | |
| OBIS 640 nm laser | Coherent Inc | 1185055 | |
| Optosplit II | Cairn Research | ||
| Ovalbumin | Sigma-Aldrich | A5253 | for imaging buffer |
| Plasma cleaner | Harrick Plasma | PDC-002 | |
| sdt-python | Schütz group at TU Wien | Python library for data analysis; version 17 | |
| TetraSpek bead size kit | Thermo Fisher Scientific | T14792 | Randomly distributed, immobilized fiducial markers for image registration |
| USC500TH Ultrasound bath | VWR | for SUV formation |
Ссылки
- McKinney, S. A., Déclais, A. -. C., Lilley, D. M. J., Ha, T. Structural dynamics of individual holliday junctions. Nature Structural Biology. 10 (2), 93-97 (2002).
- Wang, S., Vafabakhsh, R., Borschel, W. F., Ha, T., Nichols, C. G. Structural dynamics of potassium-channel gating revealed by single-molecule FRET. Nature Structural & Molecular Biology. 23 (1), 31-36 (2015).
- Hellenkamp, B., Wortmann, P., Kandzia, F., Zacharias, M., Hugel, T. Multidomain structure and correlated dynamics determined by self-consistent FRET networks. Nature Methods. 14 (2), 174-180 (2016).
- Kilic, S., et al. Single-molecule FRET reveals multiscale chromatin dynamics modulated by HP1α. Nature Communications. 9 (1), 235 (2018).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47 (1), 819-846 (1978).
- Wu, P. G., Brand, L. Resonance energy transfer: Methods and applications. Analytical Biochemistry. 218 (1), 1-13 (1994).
- Qiao, Y., Luo, Y., Long, N., Xing, Y., Tu, J. Single-molecular förster resonance energy transfer measurement on structures and interactions of biomolecules. Micromachines. 12 (5), 492 (2021).
- Malkusch, N., Dörfler, T., Nagy, J., Eilert, T., Michaelis, J. smFRET experiments of the RNA polymerase II transcription initiation complex. Methods. 120, 115-124 (2017).
- Lee, J. -. B., et al. Single-molecule views of MutS on mismatched DNA. DNA repair. 20, 82-93 (2014).
- Phelps, C., Israels, B., Jose, D., Marsh, M. C., von Hippel, P. H., Marcus, A. H. Using microsecond single-molecule FRET to determine the assembly pathways of T4 ssDNA binding protein onto model DNA replication forks. Proceedings of the National Academy of Sciences of the United States of America. 114 (18), E3612-E3621 (2017).
- Deindl, S., Zhuang, X. Monitoring conformational dynamics with single-molecule fluorescence energy transfer: Applications in nucleosome remodeling. Methods in Enzymology. 513, 59-86 (2012).
- Crawford, D. J., Hoskins, A. A., Friedman, L. J., Gelles, J., Moore, M. J. Single-molecule colocalization FRET evidence that spliceosome activation precedes stable approach of 5' splice site and branch site. Proceedings of the National Academy of Sciences of the United States of America. 110 (17), 6783-6788 (2013).
- Wang, Y., Xiao, M., Li, Y. Heterogeneity of single molecule FRET signals reveals multiple active ribosome subpopulations. Proteins. 82 (1), 1-9 (2014).
- Mori, T., Vale, R. D., Tomishige, M. How kinesin waits between steps. Nature. 450 (7170), 750-754 (2007).
- Huppa, J. B., et al. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature. 463 (7283), 963-967 (2010).
- Göhring, J., et al. Temporal analysis of T-cell receptor-imposed forces via quantitative single molecule FRET measurements. Nature Communications. 12 (1), 2502 (2021).
- Hellenkamp, B., et al. Precision and accuracy of single-molecule FRET measurements-a multi-laboratory benchmark study. Nature Methods. 15 (9), 669 (2018).
- Kapanidis, A. N., et al. Fluorescence-aided molecule sorting: Analysis of structure and interactions by alternating-laser excitation of single molecules. Proceedings of the National Academy of Sciences of the United States of America. 101 (24), 8936-8941 (2004).
- Sakon, J. J., Weninger, K. R. Detecting the conformation of individual proteins in live cells. Nature Methods. 7 (3), 203-205 (2010).
- McCann, J. J., Choi, U. B., Zheng, L., Weninger, K., Bowen, M. E. Optimizing methods to recover absolute FRET efficiency from immobilized single molecules. Biophysical Journal. 99 (3), 961-970 (2010).
- Lee, N. K., et al. Accurate FRET measurements within single diffusing biomolecules using alternating-laser excitation. Biophysical Journal. 88 (4), 2939-2953 (2005).
- Asher, W. B., et al. Single-molecule FRET imaging of GPCR dimers in living cells. Nature Methods. 18 (4), 397-405 (2021).
- Joo, C., Ha, T. . Single-molecule FRET with total internal reflection microscopy. (12), 1223-1237 (2012).
- Joo, C., Ha, T. Objective-type total internal reflection microscopy (excitation) for single-molecule FRET. Cold Spring Harbor Protocols. 11, 1189-1191 (2012).
- Joo, C., Ha, T. Objective-type total internal reflection microscopy (emission) for single-molecule FRET. Cold Spring Harbor Protocols. 11, 1192-1194 (2012).
- Allan, D. B., Caswell, T., van der Wel, C. M., Dimiduk, T. . Soft-matter/pims: PIMS v0.5. , (2020).
- Anaconda Inc. . Miniconda. , (2021).
- conda-forge community. . The conda-forge project: community-based software distribution built on the conda package format and ecosystem. , (2015).
- . . JupyterLab Contributors Notebooks - JupyterLab documentation. , (2021).
- Babcock, H., Sigal, Y. M., Zhuang, X. A high-density 3D localization algorithm for stochastic optical reconstruction microscopy. Optical Nanoscopy. 1 (6), (2012).
- Gao, Y., Kilfoil, M. L. Accurate detection and complete tracking of large populations of features in three dimensions. Optics Express. 17 (6), 4685 (2009).
- Schrangl, L. . sdt-python: Python library for fluorescence microscopy data analysis (v17.1). , (2021).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. Journal of Colloid and Interface Science. 179 (1), 298-310 (1996).
- Preibisch, S., Saalfeld, S., Schindelin, J., Tomancak, P. Software for bead-based registration of selective plane illumination microscopy data. Nature Methods. 7 (6), 418-419 (2010).
- Bradski, G. The OpenCV library. Dr. Dobb's Journal: Software Tools for the Professional Programmer. 25 (11), 120-123 (2000).
- Allan, D. B., Caswell, T., Keim, N. C., van der Wel, C. M., Verweij, R. W. Soft-matter/trackpy: Trackpy v0.5.0. Zenodo. , 4682814 (2021).
- Killick, R., Fearnhead, P., Eckley, I. A. Optimal detection of changepoints with a linear computational cost. Journal of the American Statistical Association. 107 (500), 1590-1598 (2012).
- Schrangl, L., Göhring, J., Schütz, G. J. Kinetic analysis of single molecule FRET transitions without trajectories. The Journal of Chemical Physics. 148 (12), 123328 (2018).
- Santoso, Y., Torella, J. P., Kapanidis, A. N. Characterizing single-molecule FRET dynamics with probability distribution analysis. ChemPhysChem. 11 (10), 2209-2219 (2010).
- Schrangl, L. Single-molecule FRET analysis software (3.0). Zenodo. , (2021).
- Nye, J. A., Groves, J. T. Kinetic control of histidine-tagged protein surface density on supported lipid bilayers. Langmuir. 24 (8), 4145-4149 (2008).
- Platzer, R., et al. Unscrambling fluorophore blinking for comprehensive cluster detection via photoactivated localization microscopy. Nature Communications. 11 (1), 4993 (2020).
- Johnson, I., Spence, M. . The molecular probes handbook: A guide to fluorescent probes and labeling technologies. , (2010).
- Szalai, A. M., et al. Super-resolution imaging of energy transfer by intensity-based STED-FRET. Nano Letters. 21 (5), 2296-2303 (2021).
- Miyawaki, A., et al. Fluorescent indicators for Ca2+ based on green fluorescent proteins and calmodulin. Nature. 388 (6645), 882-887 (1997).
- Zhai, B., Zhai, S., Hao, R., Xu, J., Liu, Z. A FRET-based two-photon probe for in vivo tracking of pH during a traumatic brain injury process. New Journal of Chemistry. 43 (43), 17018-17022 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены