Method Article
모바일 단일 분자 FRET 프로브의 자동화된 2차원 스파티오 측량 분석
요약
이 문서는 와이드필드 형광 현미경 검사를 사용하여 모바일, 단일 분자 Förster 공명 에너지 전송 (smFRET) 기반 프로브의 현면 분석을위한 방법을 제시한다. 새로 개발된 소프트웨어 툴킷을 사용하면 정확한 FRET 효율과 분자 위치를 포함한 움직이는 프로브의 smFRET 시간 추적을 시간의 함수로 판단할 수 있습니다.
초록
단일 분자 Förster 공명 에너지 전송 (smFRET)은 나노 미터 범위에서 나노 미터 범위까지의 거리에 보고되는 다목적 기술입니다. 그것은 분자 력의 측정, 생체 분자의 형성 역학의 특성화, 단백질의 세포 내 지역화의 관찰 및 수용체 리간드 상호 작용 시간의 측정을 포함하여 광범위한 생물 물리학 및 분자 생물학적 실험에 사용되었습니다. 와이드필드 현미경 검사법 구성에서는 일반적으로 표면 고정 프로브를 사용하여 실험이 수행됩니다. 여기서, 단일 분자 추적과 교대 로 의외(ALEX) smFRET 실험을 결합하여 표면 바운드의 smFRET 시간 추적의 획득을 허용하면서도 플라즈마 멤브레인 또는 유리지원 지질 이중층의 이동 프로브가 제시된다. 기록된 데이터의 분석을 위해, 자동화된 오픈 소스 소프트웨어 수집은 (i) 형광 신호의 국소화, (ii) 단일 입자 추적, (iii) 교정 인자를 포함한 FRET 관련 수량의 결정, (iv) smFRET 추적의 엄격한 검증 및 (v) 결과의 직관적인 프리젠테이션을 지원하여 개발되었다. 생성된 데이터는 프로브의 확산 거동 평가 또는 FRET 전환의 조사를 위해 특수 소프트웨어를 통한 추가 탐색을 위한 입력으로 편리하게 사용할 수 있습니다.
서문
Förster 공명 에너지 전송 (FRET)은 나노미터 이하 해상도에서 프로세스의 조사를 허용하기 때문에 분자 생물학 및 생물 물리학 연구의 주요 원동력이었습니다. 기증자와 수용자 형광사이의 에너지 전달효율이 나노미터 범위이하나노미터의 염료 간 거리에 크게 의존하기 때문에 생체분자의 정적 및 동적 형태형성을 탐구하는 분광도피로서 효과적으로 사용되고 있다1,2,3,4. 추가적으로, FRET 현상은 대량 수준에 막 관련및 세포내 단백질의 colocalization 연구 결과에 널리 이용되었습니다5,6. 지난 2년 동안 이 방법은 smFRET 이벤트를 모니터링하기 위해 조정되었으며, 이는 시간적 및 공간 적 해상도를 실질적으로 증가시키고 이질적인 샘플에서 드문 하위 집단도 해결하는 데 도움이 되었습니다. 이러한 기술을 탑재한 독특한 통찰력은 RNA 폴리머라제 II8의 전사체 처리 속도, DNA 폴리머라제9,10의 복제 속도, 뉴클레오성 전좌 속도111, 조립된 스플리케솜12의 전사체 접합 및 실속속도, 리보소말 하수집단13의 활성, 리보소말 하수집단의 활동 13, 걷기 속도 등 분자 기계의 역학에 대한 독특한 통찰력을 얻었다. , 몇 가지 이름을 지정합니다. 수용체-리간드 상호작용 지속시간15 및 분자력16이 정량화되었다.
강도 기반 smFRET 연구는 일반적으로 FRET 효율을 측정하기 위해 감격 방출에 의존합니다: 방출 경로의 빔 스플리터는 기증자 의 발동시 및 수용자 형광에서 유래한 빛을 공간적으로 분리하여 개별 형광 강도의 정량화를 허용합니다. 효율성은 이어서 총 광자 count17에 대하여 수용자가 방출하는 광자의 분수로 계산될 수 있다. 또한, 기증자 여기(ALEX)에 따른 수락자는 FRET 이벤트의 스토이치오메트리측정을 허용하여, 사진 표백된 수용자 형광호re18을 특징으로 하는 프로브로부터 발생하는 신호로부터의 실제 낮은 FRET 신호 사이의 차별을 돕는다.
단일 분자 FRET 실험은 일반적으로 두 가지 방법 중 하나에서 수행됩니다. 첫째, 시료 부피의 작은 영역은 공초점 현미경을 사용하여 조명된다. 용액의 단일 프로브 분자는 초점 부피 내에서 확산될 때 흥분됩니다. 이 기술을 사용하면 빠른 광자 계수 검출기를 사용하여 초초 시간 해상도를 구현할 수 있습니다. 둘째, 프로브는 특히 표면에 고정되어 와이드필드 현미경 검사를 통해 모니터링되며, 종종 전체 내부 반사(TIR) 구성을 사용하여 배경 형광을 최소화합니다. 프로브 고정을 사용하면 첫 번째 접근 방식을 사용하는 것보다 훨씬 긴 기록 시간을 허용합니다. 또한 시야가 클수록 여러 프로브를 병렬로 모니터링할 수 있습니다. 카메라의 필요성으로 인해 이 방법은 위에서 설명한 방법에 비해 느리게 만듭니다. 시간 해결은 밀리초에서 두 번째 범위로 제한됩니다.
장시간 추적이 필요한 경우, 예를 들어, 밀리초에서 두 번째 시간 척도로 동적 프로세스를 연구하기 위해 형광 버스트가 일반적으로 너무 짧기 때문에 첫 번째 방법은 적용되지 않습니다. 두 번째 접근법은 침전이 실현 가능하지 않을 때마다 실패합니다(예: 세포막 내의 확산 프로브를 특징으로 하는 살아있는 세포 실험). 더욱이, 생물학적 모델 시스템은 접촉된 surface16의 이동성에 따라 그들의 반응을 극적으로 변화시킬 수 있다는 것을 관찰되었다.
모바일 FRET 프로브를 기록하는 결합 된 smFRET 및 단일 입자 추적 실험은 지난 19에서 수행되었지만 데이터 평가를 위한 공개적으로 사용할 수있는 소프트웨어는 없습니다. 이로 인해 smFRET 효율 및 스토이치오메트리, 서브 픽셀 정확도를 가진 위치 및 시간 함수로서의 형광 강도를 포함하여 모바일 형광 프로브의 여러 특성을 판단할 수 있는 새로운 분석 플랫폼이 개발되었습니다. 단계별 표백 거동, 가장 가까운 이웃 거리, 방출 강도 및 기타 특성을 검사하여 결과 추적을 필터링하는 방법은 올바르게 합성되고 기능적인 단일 프로브 분자를 독점적으로 선택하도록 설립되었습니다. 이 소프트웨어는 또한 신뢰할 수있는 정량적 smFRET 데이터를 생산하기 위해 다연구소 연구에서 최근에 합의 된 실험 및 분석 기술을 지원합니다17. 특히 구현은 FRET 효율 및 스토이치오메트리 계산을 위한 검증된 절차를 준수합니다. 기증자 배출 채널 IDD 및 수용자 방출 채널 IDA에서 기증자 의 발 아 시 형광 강도는 Eq (1)를 사용하여 명백한 FRET 효율 Eapp의 계산에 사용됩니다.
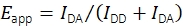 (1)
(1)
수용자 내영 IAA시 수용체 방출 채널에서 형광 강도의 도움으로, 명백한 스토이치 오메트리는 Eq(2)를 사용하여 계산된다.
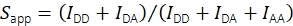 (2)
(2)
FRET 효율 E와 스토이치오메트리 S는 4가지 보정 요소를 고려하여 Eapp 및 Sapp에서 파생될 수 있습니다.
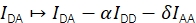
α 기증자 형광이 수용체 방출 채널로 유출되는 것을 설명하고 기증자 형광만 을 포함하는 샘플을 사용하거나 수용자가 표백된 궤적의 일부를 분석하여 결정할 수 있습니다. δ 기증자 흥분 광원에 의해 수용자의 직접 흥분을 보정하고 단지 수용자 형광이있는 샘플을 사용하여 또는 기증자가 표백 된 궤적의 일부를 분석하여 측정 할 수 있습니다.
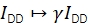 .
.
γ 기증자 및 수용자 방출 채널및 형광의 다른 양자 효율성에서 발산 검출 효율성을 바로잡기 위해 IDD를 확장합니다. 이 요인은 높은 FRET 효율20을 가진 궤적에서 수용자 표백 시 기증자 강도의 증가를 분석하거나 다중 이산 FRET 상태를 특징으로 하는 샘플을 연구함으로써 계산될 수 있다.
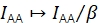
β IAA를 조정하여 기증자와 수락자 엑소터의 이질적인 효율성을 수정합니다. γ 수용자 표백 분석을 통해 결정된 경우, 알려진 기증자 대 수용자 비율21의 샘플에서 β 계산될 수 있었다. 그렇지 않으면 다중 상태 FRET 샘플도 β 산출합니다.
함께 수정하면 Eq(3)를 사용하여 수정된 FRET 효율을 계산할 수 있습니다.
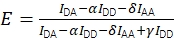 (3)
(3)
및 Eq (4)를 사용하여 교정 된 금전 측정.
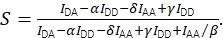 (4)
(4)
이상적으로, 1:1 기증자-수용자 비율에 대한 교정된 스토이치오메트리는 S = 0.5를 준다. 실제로 신호 대 잡음 비율이 감소하면 S의 측정값이 확산되어 기증자 전용 신호(S =1) 및 수용자 전용 신호(S = 0)의 차별을 방해합니다. 결과 시간 추적은 단일 분자 궤적 프로파일16, 단일 분자 events22의 이동성 또는 상이한 상태 간의 전이 운동과 같은 정보를 얻기 위해 단일 분자 궤적의 보다 상세한 분석을 위한 입력으로 사용될 수 있다1.
다음 프로토콜은 smFRET 추적 실험에 대한 실험 매개 변수 및 절차뿐만 아니라 새로 개발 된 소프트웨어 제품군을 사용하여 데이터 분석 뒤에 작동하는 원리를 설명합니다. 실험 데이터의 수집을 위해, 다음 요구 사항을 충족하는 현미경 설정을 사용하는 것이 좋습니다: i) 단일 염료 분자의 방출을 검출하는 기능; ii) 와이드 필드 조명 : 특히 라이브 셀 실험에 대한, 총 내부 반사 (TIR23,24,25) 구성이 권장됩니다; iii) 동일한 카메라 chip25 또는 상이한 카메라의 상이한 영역에 공여자 및 수용체 형광이 투사되는 파장에 따른 방출광의 공간 분리; iv) 공여자 및 수용자 여기를 밀리초 정밀도로 광원의 변조, 예를 들어, 직접 변조 레이저 또는 아쿠스토 광학 변조기를 통해 변조를 사용한다. 이것은 형광의 광표백을 최소화하고 궤양궤수를 결정하기 위해 회신을 번갈아 가며 스트로보스코픽 조명을 허용합니다. v) PIMS Python package26에서 읽을 수 있는 형식으로 기록된 이미지 시퀀스당 하나의 파일의 출력. 특히 다중 페이지 TIFF 파일이 지원됩니다.
프로토콜
1. 소프트웨어 전제 조건
- 미니콘다 파이썬 배포27 (최소 필수 파이썬 버전 : 3.7)를 설치합니다.
- Windows 시작 메뉴에서 Anaconda 프롬프트를 열거나 터미널을 열고 Linux 또는 macOS를 사용하는 경우 conda 활성화 를 실행합니다.
- 다음 명령을 실행하여 커뮤니티에서 유지 관리하는 콘다 포지 패키지 리포지토리28 을 활성화합니다.
콘다 구성 --채널 콘다 위조 추가
콘다 구성 --channel_priority 엄격한 설정
콘다 업데이트 --모든 - 다음을 실행하여 필요한 파이썬 패키지를 설치합니다.
콘다 설치 opencv 트랙피 lmfit ipympl scikit-learn pyqt sdt-python jupyterlab - 분석 소프트웨어의 사용자 인터페이스인 JupyterLab에 익숙해지십시오(소프트웨어 설명서29 참조).
- git 버전 제어 시스템을 설치하여 나중에 분석 소프트웨어를 다운로드하고 업데이트하는 데 사용할 것입니다. Linux를 사용하는 경우 배포판의 패키지 관리 소프트웨어를 사용하여 다운로드하고 업데이트합니다. 그렇지 않으면 다음을 실행합니다.
콘다 설치 git - 선택적으로 사이드카 파이썬 패키지를 설치하여 분석 중에 단계를 필터링한 후 데이터 집합을 표시합니다.
콘다 설치 사이드카
2. 샘플 측정
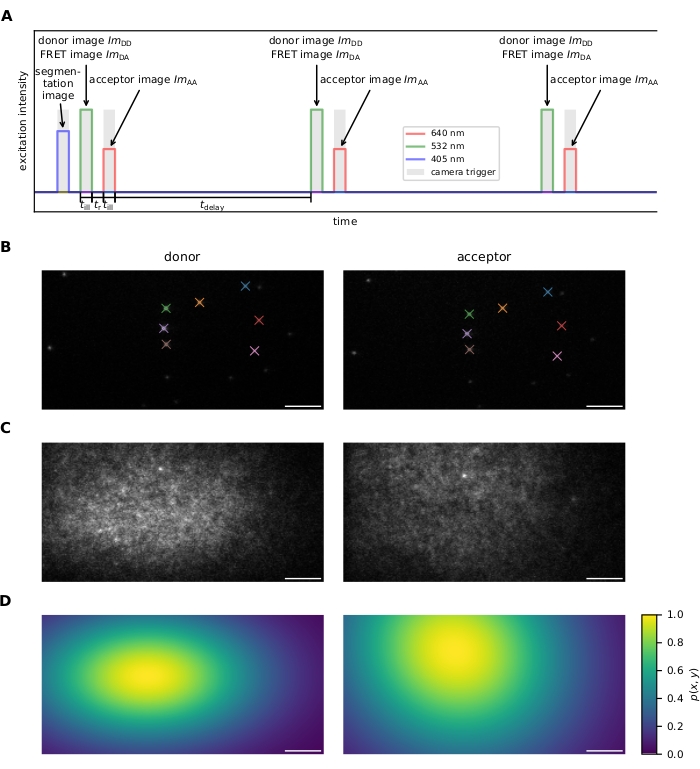
그림 1: 이미지 수집. (A) 흥분 시퀀스. 405 nm 레이저를 사용하여 염료로드 셀의 선택적 이미지를 기록한 후, 기증자와 수용자는 각각 532 nm 및 640 nm 레이저를 사용하여 조명 시간 틸에 대해 번갈아 흥분하고 반복적으로 흥분된다. 기증자와 수락자 여기 사이의 시간 tr는 카메라로 이미지 판독을 허용하기에 충분히 길어야합니다. 지연 시간 지연을 사용하여 획득 프레임 속도를 조정할 수 있으므로 광표백 전에 관측 시간 범위입니다. 이 패널은 16에서 수정됩니다. (b) 신탁 마커는 두 배출 채널 간의 좌표 변환의 계산에 사용된다. 일치하는 수탁자는 색상으로 표시됩니다. 전체 시야가 덮여 있는지 확인하기 위해 여러 개의 이동된 이미지를 기록해야 합니다. (C) 플랫필드 보정을 위한 레이저 프로파일은 조밀하게 표지된 샘플을 사용하여 기록됩니다. 수락자 프로필이 기록되고 포토표백되고 기증자 프로필이 획득됩니다. 여러 이미지는 샘플 결함의 영향을 완화하기 위해 평균화되고 매끄럽게 다양한 샘플 영역에서 가져와야 합니다(예: 이미지의 중앙 상단에 있는 밝은 점). (D) 플랫필드 보정 맵 p(x,y)에서 C에 설명된 바와 같이 20개의 레이저 프로파일에서 계산하였다. 약어: FRET = Förster 공명 에너지 전송; ImDD = 기증자 여기시공 방출 이미지; ImDA = 기부자 여기시 기임자 방출 이미지; ImAA = 기부자 여기시 기임자 방출 이미지. 스케일 바 = 5 μm. 여기를 클릭하여 이 그림의 더 큰 버전을 확인하십시오.
- 전자곱합전전결합장치(EMCCD) 카메라를 사용하는 경우 EM 게인이 높은 신호 대 잡음 비에서 단일 분자 신호를 관찰할 수 있게 한다(제조업체의 지침을 참조).
- 여기 시퀀스( 자세한 내용은 그림 1A 참조).
- 선택적으로 분할에 대한 이미지를 기록하여 뷰 필드의 특정 영역으로 데이터 분석을 제한합니다. 예를 들어, 405 nm 레이저를 사용하여 Fura-2로드 된 세포를 흥분시키고 약 510 nm의 방출을 캡처하여 세포와 지원 되는 지질 이중층 (SLBs) 사이의 인터페이스에 있는 프로브만 평가합니다. 따라서 시간 tr이 카메라 판독을 허용할 때까지 기다립니다.
참고: EMCCD 카메라의 경우 Tr은 선택한 관심 지역(ROI)의 줄 수에 따라 달라집니다. 따라서 작은 ROI를 선택하면 프레임과 기록된 데이터의 크기 사이의 지연이 감소하기 때문에 유리할 수 있습니다. 또한 프레임 전송 모드를 사용하면 Tr을 추가로 줄일 수 있습니다. - 반복적으로 기증자와 수용자 형광을 흥분.
- 조명 시간 ill에 대 한 기증자 흥분 (5-10 ms는 일반적으로 모션 흐림을 피하기 위해 충분히 짧은) 또한 카메라를 트리거 하는 동안.
- 시간 타이머를 기다려 카메라 판독을 허용합니다.
- 카메라를 트리거하는 동안 수락기에 흥분.
- 시간 지연을 기다립니다.
참고: 카메라의 판독을 활성화하려면 tr보다 길어야 하지만 임의로 선택할 수 있습니다. 시간 해결 및 추적 길이에 대한 요구 사항의 균형을 조정해야 합니다. - 2.2.2.1-2.2.2.4 단계를 반복합니다. 응집체로부터 단일 분자 신호의 차별에 대한 단계별 광표백 분석을 허용하는 시야 내에서 프로브 당 적어도 하나의 플루오로포어의 표백을 보장하기에 충분한 크기의 반복 횟수를 선택합니다.
참고: 적절한 틸 및 흥분 레이저 강도를 선택하면 일반적으로 약간의 실험이 필요합니다: 조명 시간이 길어지고 레이저 강도가 높을수록 결과 이미지의 신호 대 잡음 비율이 더 높지만, 더 짧을수록 결과 시간 추적이 됩니다.
- 선택적으로 분할에 대한 이미지를 기록하여 뷰 필드의 특정 영역으로 데이터 분석을 제한합니다. 예를 들어, 405 nm 레이저를 사용하여 Fura-2로드 된 세포를 흥분시키고 약 510 nm의 방출을 캡처하여 세포와 지원 되는 지질 이중층 (SLBs) 사이의 인터페이스에 있는 프로브만 평가합니다. 따라서 시간 tr이 카메라 판독을 허용할 때까지 기다립니다.
- 각 샘플에 대해 충분한 수의 영화를 기록합니다.
3. 보정 요인의 측정을위한 추가 측정
- 이미지 등록을 위해 두 배출 채널모두에서 무작위로 배치된 일련의 수탁 마커를 기록합니다(즉, 기증자 방출 채널의 좌표를 수락기 방출 채널에 매핑하는 변환을 찾고 그 반대의 경우도 마찬가지입니다). 그림 1B를 참조하십시오.
참고: 이미지 등록은 소프트웨어에 의해 수행됩니다. 6.1.4 단계를 참조하십시오. - 플랫필드 보정을 위한 기증자 및 수용자 여기 광원에 대한 강도 프로파일을 측정합니다(예: 시야 전반에 걸쳐 불동성 외신에 대한 수정). 이를 위해, FRET 프로브의 고밀도를 특징으로 샘플을 준비하고 먼저 수락자 여기시 이미지를 획득하고, 기증자 의 초대시 이미지의 수용자의 표백 및 후속 기록. 안정성이 향상되면 다른 샘플 영역에서 여러 번 반복하십시오. 그림 1C,D를 참조하십시오. 또는 기증자 분자만으로 장식된 샘플과 수용자 형광만으로 장식된 두 번째 샘플을 기록합니다.
참고: 플랫필드 보정은 분석 소프트웨어에 의해 수행됩니다. 8.1.2 단계를 참조하십시오. - 수용자 불소호레없이 프로브의 단일 분자 샘플 (섹션 2에서와 같이)을 기록하여 수용자 채널로 누출되는 기증자 방출을 결정합니다.
참고: 기증자 누출은 수락기 표백 후 실제 프로브의 시간 추적에서 계산할 수도 있습니다. 이러한 이벤트의 수가 충분히 기록되면 추가 측정이 필요하지 않습니다. 두 옵션 모두 분석 소프트웨어에서 지원됩니다. 추가 정보, 섹션 3.15를 참조하십시오. - 기증자 의 흥분 광원에 의한 직접 수용자 엑소터의 정량화를 위해 기증자 불소 호레없이 프로브의 기록을 획득한다.
참고: 직접 수락자 여기는 기증자 표백 후 실제 프로브의 시간 흔적에서 파생 될 수 있습니다. 이러한 이벤트의 수가 충분히 기록되면 추가 측정이 필요하지 않습니다. 두 옵션 모두 분석 소프트웨어에서 지원됩니다. 추가 정보, 섹션 3.15를 참조하십시오. - 기증자 및 수용자 방출 채널의 다른 검출 효율성과 염료의 다른 양자 수율을 보정하기 위해 두 개의 서로 다른 FRET 효율성을 특징으로 하는 단일 분자 샘플을 기록합니다.
참고: 이러한 샘플은 예를 들어, 두 개의 적합성 사이에 변동하는 홀리데이 접합부1 또는 FRET 쌍이 서로 다른 잘 정의된 거리에 부착된 DNA 막대일 수 있습니다. 프로브가 높고 충분히 일정한 FRET 효율성을 특징으로 하는 경우, 보정은 프로브의 시간 추적의 허용기 표백 이벤트에서 계산될 수 있으며, 이 경우 추가 측정이 필요하지 않습니다. 두 옵션 모두 분석 소프트웨어에서 지원됩니다. 추가 정보, 섹션 3.15를 참조하십시오.
4. 단일 분자 지역화 알고리즘
참고: 여러 분석 단계에는 단일 분자 국소화가 필요합니다. 신호 밀도, 배경 및 신호 대 잡음 비율에 따라 Gaussian 피팅 알고리즘30 및 질량 중심 계산31 중에서 선택합니다.
- 가우시안 피팅을 수행하려면 각 사용자 인터페이스를 통해 3D-DAOSTORM30 알고리즘을 선택합니다.
참고: 3D-DAOSTORM 은 겹치는 점 스프레드 기능으로 도저히 신호를 구별하도록 설계되었습니다. 이것은 일반적으로 장점이지만, 그것은 주의와 함께 제공: 단일, 밝은 신호는 때때로 두 개의 인접 한 것으로 식별 됩니다., 추적 알고리즘을 혼동 하 고 대신 하나의 긴 궤적의 두 개의 짧은 궤적의 감지 결과.
다음 매개 변수를 설정합니다(자세한 내용은 알고리즘의 구현을 제공하는 sdt-python library32의 설명서를 참조하십시오).- 반지름: 유효 픽셀 크기에 따라 가우시안 맞춤 함수의 초기 σ 값을 픽셀 단위로 설정합니다.
-
임계값: 로컬 강도 최대값에 맞게 최소 진폭(예: 예상 로컬 배경에 대해 수정됨)을 설정합니다.
참고: 임계값은 틀림없이 가장 중요한 매개 변수입니다. 너무 낮게 설정하면 노이즈가 형광 신호로 간주될 수 있으며 밝은 신호에는 두 개의 가우시안이 장착될 수 있습니다. 너무 높게 설정하면 희미한 신호가 맞지 않습니다. -
모델: 원형 가우시안에 맞게 2D 로 설정합니다.
참고: 다른 모델은 smFRET 데이터에 적용할 수 없습니다. -
필터 찾기: 로컬 최대아를 찾기 전에 필터를 적용하여 노이즈를 줄이면 낮은 신호 대 잡음 비율 상황에 도움이 됩니다. 이것은 i) ID일 수 있습니다: 필터 없음; ii) 크로커 그리어: 크로커-그리어 알고리즘31,33에서 밴드패스 필터; 또는 iii) 가우시안: 시그마 매개 변수에 의해 설정된 σ 가우시안 블러.
참고: 크로커-그리어의 경우 위업. 크기 매개 변수는 대략 픽셀의 점 확산 함수의 반지름이어야 합니다.
참고: 필터링되지 않은 원시 데이터를 사용하여 피팅이 수행됩니다. -
분 거리: 1개 이상의 가우시안으로 비거리 픽셀로 분리된 두 개의 잠재 신호를 맞춥시다.
참고: 이것은 밝은 신호가 두 개의 인접 신호로 잘못 감지되는 전술한 시나리오에서 도움이 될 수 있습니다. - 크기 범위: 최소 및 최대 σ 선택하여 노이즈로 인한 스퓨리어스 신호에서 감지를 제거합니다.
- 각 사용자 인터페이스를 통해 Crocker-Grier 알고리즘을 선택하여 질량 중심 계산(크로커와 그리어의 idea33을 기반으로 한 정제된 알고리즘31)을 수행합니다.
참고: 이 알고리즘은 낮은 신호 대 잡음 시나리오에서도 매우 견고하며 다양한 강도를 특징으로 하는 신호를 처리하지만 겹치는 점 확산 기능을 정확하게 분자에 맞출 수는 없습니다.- 반지름: 디스크의 반지름(픽셀)을 전체 점 확산 함수를 포함할 만큼 충분히 크게 설정합니다.
-
신호 thresh.: 분석할 로컬 강도 최대값에 대해 최소 진폭(예상 배경보다 가장 밝은 픽셀)을 설정합니다.
참고: 너무 낮게 설정하면 소음이 형광 신호로 간주될 수 있습니다. 너무 높게 설정하면 희미한 신호가 맞지 않습니다. -
질량 thresh.: 분석할 신호의 최소 총 강도(백그라운드 보정 픽셀 값의 합)를 설정합니다.
참고: 위와 동일한 고려 사항입니다.
5. 소프트웨어 초기화
- 분석 스크립트를 다운로드합니다. Anaconda 프롬프트에서 폴더로 이동하여 해석을 저장하고( CD 명령을 사용하여) 실행합니다.
git 클론 https://github.com/schuetzgroup/fret-analysis.git 대상 폴더- 대상 폴더를 2021-06-14_Force-FRET 실험과 같은 설명 이름으로 대체합니다.
참고: 분석 소프트웨어가 이 폴더에 표시됩니다. 이 폴더가 사전에 존재하지 않는지 확인합니다. 각 실험에 대한 분석 스크립트의 복사본을 다운로드하는 것이 좋습니다. 이렇게 하면 나중에 분석을 다시 방문하고, 사용된 매개 변수를 회수하고, 변경할 수 있습니다.
- 대상 폴더를 2021-06-14_Force-FRET 실험과 같은 설명 이름으로 대체합니다.
- 주피터 노트북 복사(01. Tracking.ipynb, 02. Analysis.ipynb, 03. 플롯.ipynb)를 새로 만든 폴더(이후부터 루트 폴더라고 함)에 넣습니다. 이 소프트웨어를 사용하는 처음인 경우 루트 폴더의 전자 필기부 하위 폴더에서 가져옵니다.
참고: 유사한 데이터 집합을 이미 분석한 경우 매개 변수가 약간만 변경될 수 있기 때문에 이전 실험에서 전자 필기장을 복사하는 것이 편리한 옵션이 될 수 있습니다. - 주피터랩이 표시되는 웹 브라우저 창을 열기 위해 아나콘다 프롬프트에서 다음 명령을 실행하여 JupyterLab 서버를 시작합니다.
주피터 실험실
참고: 브라우저는 인터페이스일 뿐이며 , 아나콘다 프롬프트에서 실행되는 프로세스가 실제 작업을 수행하는 동안입니다. 결과적으로 브라우저 창을 닫는 것은 최소한의 효과만 있습니다. 세션은 http://localhost:8888 액세스하여 복원할 수 있습니다 . 그러나 프롬프트에서 JupyterLab 프로세스를 중단하거나 프롬프트를 닫으면 분석이 종료되어 저장되지 않은 작업이 손실됩니다. - JupyterLab 브라우저 창에서 왼쪽 창을 사용하여 루트 폴더로 이동합니다. 01. Tracking.ipynb 을 두 번 클릭하여 첫 번째 노트북을 출시합니다. 시작 후 파이썬 코드의 상자, 소위 셀을 표시하는 새 탭이 나타납니다.
참고: 모든 Jupyter 노트북에는 각 코드 셀의 기능을 설명하는 주석이 있습니다. 또한 모든 메서드 호출에 대한 설명서는 개구부 바로 앞에 텍스트 커서를 배치하고 Shift+Tab를 눌러 표시할 수 있습니다. - 데이터 분석 프로세스에 대한 개요는 그림 2 를 참조하십시오.
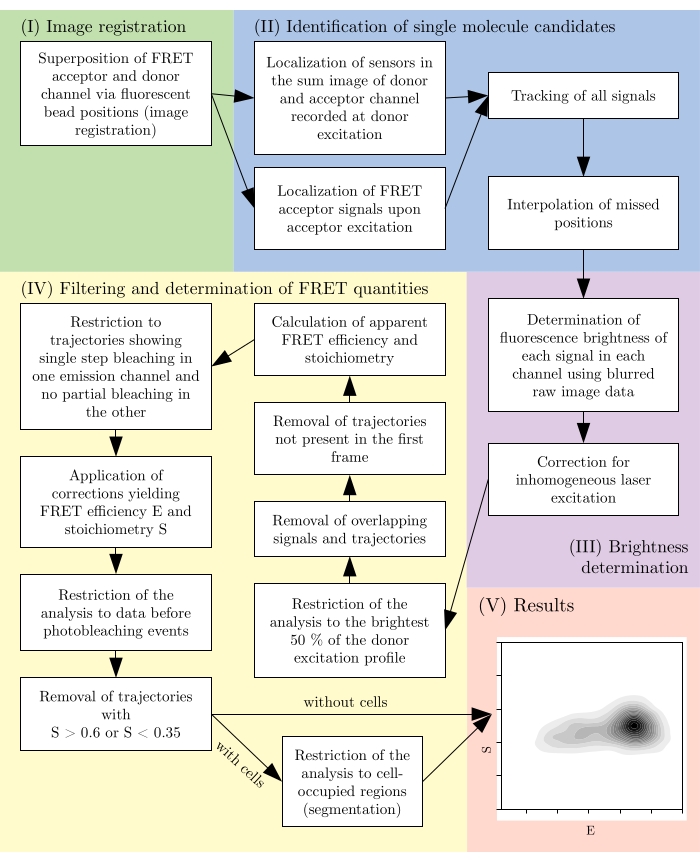
그림 2: 일반적인 분석 파이프라인 개요입니다. 필터링 단계는 실험 설계에 따라 적응될 수 있습니다. 이 그림은 16에서 수정됩니다. 약어: FRET = Förster 공명 에너지 전송. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
참고: 소프트웨어를 시험해 볼 수 있는 샘플 데이터는 https://github.com/schuetzgroup/fret-analysis/releases/tag/example_files
6. 단일 분자의 국소화, 추적 및 형광 강도 분석 (01. Tracking.ipynb).
- 사용 01. Tracking.ipynb 정밀한 정량화, 특히 FRET 측정에서 자주 발생하는 희미한 신호(예: 높은 FRET 이벤트에서 낮은 기증자 신호로 인해 그 반대의 경우도 마찬가지)에 맞게 조정된 단일 분자 신호의 형광 강도 값의 신뢰할 수 있는 분석을 위한 Jupyter 노트북.
참고: 이를 위해 원시 데이터의 픽셀 강도와 로컬 배경에 대한 보정을 직접 통합하는 것이 구현됩니다. 각 분석 단계의 스크린 샷및 함수 호출 매개 변수에 대한 설명은 추가 정보.- 조명 시퀀스를 지정하여 기록된 이미지 시퀀스에서 이미지 세분화를 위한 프레임뿐만 아니라 기증자 및 수락자 여기 프레임을 선택할 수 있도록 합니다.
참고: 소프트웨어가 임의 조명 프로토콜로 기록된 데이터의 처리를 허용하므로 이미지 시퀀스에서 어떤 유형의 플루오로포어를 흥미롭게 사용할 지 나타낼 필요가 있습니다. 보충 정보, 섹션 1.2, 3단계를 참조하십시오. 원본 이미지 시퀀스의 프레임 번호가 유지됩니다. - 데이터 집합을 설명하고 로드합니다. 동일한 조명 설정을 사용하여 기록된 경우 여러 데이터 집합을 한 번에 분석합니다. 각 데이터 집합에 각각의 이미지 시퀀스 파일 이름과 일치하는 식별자 및 패턴을 할당합니다. 또한 이미지 등록을 위한 신탁 마커 녹음, 플랫필드 보정을 위한 등신광 프로파일, 선택적으로 기증자 전용 및 수락자 전용 샘플 과 같은 특수 한 목적을 위해 특정 데이터 집합을 정의하여 보정 요소를 결정합니다.
- 두 채널이 단일 카메라를 사용하여 녹화된 경우 원시 이미지에서 배출 채널을 선택합니다. 이를 위해 적절한 그래픽 위젯을 사용하여 기증자 및 수용자 방출에 적합한 영역을 선택합니다.
- 배출 채널 모두에서 수탁 마커를 현지화하고 이미지 등록을 수행합니다. 제공된 사용자 인터페이스를 사용하여 기증자 및 수용자 방출 채널 모두에 대한 지역화 알고리즘에 적합한 매개 변수를 찾습니다. 지원되는 지역화 알고리즘에 대한 정보는 섹션 4를 참조하십시오.
참고: 가장 가까운 이웃의 공간 분포에 의해 배출 채널에서 무작위로 분포된 신탁 마커를 식별할 수 있습니다(그림 1B). sdt-python 라이브러리에서 선택적 평면 조명 현미경34에 대해 제안된 알고리즘의 사용자 지정 구현은 기증자 방출 채널의 각 마커의 위치와 수용체 방출 채널의 위치와 자동으로 일치한다. 기증자 방출 채널의 좌표를 수락기 방출 채널좌에 매핑하는 변환 T는 마커의 위치에 대한 affine 변환의 선형 최소 사각형 을 통해 발견된다35. RANSAC는 이전 단계의 잘못 일치하는 위치와 같은 이상값을 고려하는 데 사용됩니다. - 모든 프레임에서 기부자 및 수락자 여기에 독립적으로 FRET 프로브를 현지화하고 원본 프레임 번호, 2차원 좌표 및 원본 이미지 파일을 참조하는 식별자가 포함된 하나의 테이블로 결과를 병합합니다.
참고: 이를 위해 소프트웨어는 지역화 알고리즘에 적합한 옵션을 찾기 위해 사용자 인터페이스를 제공합니다.- FRET 효율에 거의 의존하지 않는 기증자 방출 ImDD 및 수용자 방출 ImDA에서 얻은 이미지의 합계에 기증자 여기에 FRET 프로브를 국소화. 지역화 알고리즘에 대한 옵션에 대한 자세한 내용은 섹션 4를 참조하십시오.
참고: 각 합계 이미지는 이미지 등록에서 이전에 얻은 변환 T를 사용하여 ImDD를 변환하고 ImDA에 픽셀 방향으로 추가하여 계산됩니다. - 수락자 방출 채널 ImAA에서 수락자 여기시 프로브를 현지화 합니다(지역화 알고리즘에 대한 자세한 내용은 섹션 4 참조).
- FRET 효율에 거의 의존하지 않는 기증자 방출 ImDD 및 수용자 방출 ImDA에서 얻은 이미지의 합계에 기증자 여기에 FRET 프로브를 국소화. 지역화 알고리즘에 대한 옵션에 대한 자세한 내용은 섹션 4를 참조하십시오.
- 추적 및 형광 강도 측정을 수행합니다.
- 조명 시퀀스를 지정하여 기록된 이미지 시퀀스에서 이미지 세분화를 위한 프레임뿐만 아니라 기증자 및 수락자 여기 프레임을 선택할 수 있도록 합니다.
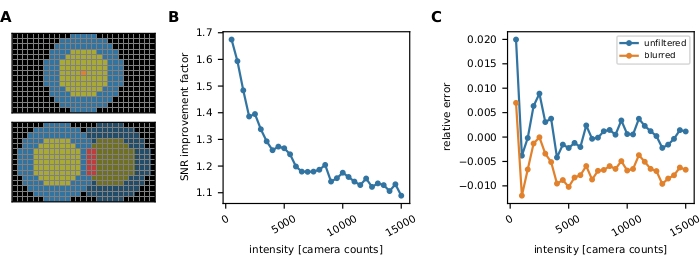
그림 3: 단일 분자 강도 측정. (A) 주황색 픽셀에 위치한 불소의 경우 수정되지 않은 강도 Iuncorr는 신호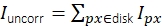 의 영향을 받는 모든 픽셀을 덮을 수 있을 만큼 큰 디스크(노란색 및 주황색 픽셀) 내의 모든 픽셀 강도를 합산하여 결정됩니다. 로컬 배경은 디스크
의 영향을 받는 모든 픽셀을 덮을 수 있을 만큼 큰 디스크(노란색 및 주황색 픽셀) 내의 모든 픽셀 강도를 합산하여 결정됩니다. 로컬 배경은 디스크 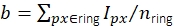 주위의 링(파란색 픽셀)의 픽셀의 평균으로 계산됩니다. 형광 강도 나는 수정되지 않은 강도, I = Iuncorr - b × ndisk, 여기서 ndisk는 디스크의 픽셀 수에서 배경을 빼는 결과입니다. 원 반지름은 추적 방법의 feat_radius 매개 변수를 통해 지정됩니다. 링의 너비는 bg_frame 매개 변수에 의해 제공됩니다. 한 신호의 점 확산 함수가 다른(아래쪽 패널)의 배경 링과 겹치는 경우 영향을 받는 픽셀(빨간색)은 로컬 배경 분석에서 제외됩니다. 두 점 스프레드 함수가 겹치는 경우 형광 강도를 안정적으로 계산할 수 없으므로 폐기됩니다. (B, C) 시뮬레이션에 따르면 1픽셀의 표준 편차가 있는 가우시안 블러를 적용하면 낮은 형광 강도(B)에서 2에 가까운 신호 대 잡음 비율을 개선하고 거의 오류(1% 미만의 약간 과소 평가)를 도입하지 않습니다( 1% 이하(C))). 또한, 상대적 오류(즉, (Imeas - Itruth)/Itruth, Itruth가 지상 진실이고 이메아스가 분석의 결과인 경우 전체 강도 범위에 걸쳐 일정하므로 FRET 효율성 및 stoichiometries와 같은 비율 측정 수량에 대해 취소합니다. 모든 플롯은 이전에 게시된 work16을 기반으로 합니다. 약어: SNR = 신호 대 잡음 비율; FRET = Förster 공명 에너지 전송. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
주위의 링(파란색 픽셀)의 픽셀의 평균으로 계산됩니다. 형광 강도 나는 수정되지 않은 강도, I = Iuncorr - b × ndisk, 여기서 ndisk는 디스크의 픽셀 수에서 배경을 빼는 결과입니다. 원 반지름은 추적 방법의 feat_radius 매개 변수를 통해 지정됩니다. 링의 너비는 bg_frame 매개 변수에 의해 제공됩니다. 한 신호의 점 확산 함수가 다른(아래쪽 패널)의 배경 링과 겹치는 경우 영향을 받는 픽셀(빨간색)은 로컬 배경 분석에서 제외됩니다. 두 점 스프레드 함수가 겹치는 경우 형광 강도를 안정적으로 계산할 수 없으므로 폐기됩니다. (B, C) 시뮬레이션에 따르면 1픽셀의 표준 편차가 있는 가우시안 블러를 적용하면 낮은 형광 강도(B)에서 2에 가까운 신호 대 잡음 비율을 개선하고 거의 오류(1% 미만의 약간 과소 평가)를 도입하지 않습니다( 1% 이하(C))). 또한, 상대적 오류(즉, (Imeas - Itruth)/Itruth, Itruth가 지상 진실이고 이메아스가 분석의 결과인 경우 전체 강도 범위에 걸쳐 일정하므로 FRET 효율성 및 stoichiometries와 같은 비율 측정 수량에 대해 취소합니다. 모든 플롯은 이전에 게시된 work16을 기반으로 합니다. 약어: SNR = 신호 대 잡음 비율; FRET = Förster 공명 에너지 전송. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- FRET 프로브 지역화를 궤도에 연결하는 데 사용되는 trackpy36알고리즘에 적합한 옵션을 선택합니다. 특히, 한 프레임에서 다음 프레임까지의 최대 검색 거리를 설정하고 신호가 감지되지 않을 수 있는 연속 프레임 수를 설정하여 표백 또는 누락된 국소화로 인해 발생할 수 있습니다.
참고: 이러한 간격은 이전 위치와 연속위치 간의 보간을 통해 채워져 있습니다. 이러한 보간 된 위치는 표시되고 나중에 강도 값을 읽기 위해만 사용되지만 확산 해석에는 사용되지 않습니다. 트랙은 수용체 방출 채널의 좌표 시스템에서 분석된다. 형광 강도 분석(step 6.1.6.2)의 경우, 트랙은 이미지 등록을 통해 얻은 역 변환 T-1을 사용하여 기증자 배출 채널의 좌표 시스템으로 추가로 변형된다(6.1.4단계 참조). - 형광 강도 계산 알고리즘에 대한 옵션을 선택합니다(자세한 내용은 그림 3A 참조). i) 신호의 위치를 중심으로 하는 디스크의 반지름을 지정하여 해당 신호및 ii) 로컬 배경을 결정하는 데 사용되는 각 디스크 주위의 링 너비에 영향을 받는 모든 픽셀이 포함되어 있습니다.
참고: 획득된 강도 측정에서 노이즈를 줄이기 위해 표준 편차가 있는 가우시안 블러가 이미지에 적용됩니다(그림 3B, C).
- 분석 소프트웨어 기능을 사용하여 이미지 시퀀스에서 보조 이미지 데이터를 처리합니다.
- 세분화를 용이하게 하기 위해 기록된 추가 이미지를 추출합니다(여기 시퀀스에서 s 로 표시된 단계 2.2.1을 참조하십시오( 보충 정보, 섹션 1.2, 3단계 참조).
- 조밀하게 레이블이 붙은 샘플에 기록된 이미지에서 시야전반에 걸쳐 기증자 및 수락자 흥분 광 프로파일을 결정합니다(3.2단계 참조).
참고: 픽셀별 평균은 이미지에서 계산되어 라이트 프로파일을 계산합니다. 카메라 기준선이 뺍니다. 이미지는 가우시안 필터를 사용하여 흐리게 되어 샘플 불순물으로 인한 효과를 줄입니다. 마지막으로 결과 이미지는 최대 값으로 픽셀방향으로 분할되어 프로파일 p(x,y) 매핑 좌표를 간격 [0,1]에 가져옵니다.
7. FRET 궤적의 시각화 (선택 사항)
- 조사관 응용 프로그램을 사용하여 원시 이미지 데이터와 해당 형광 강도 및 명백한 FRET 효율성 및 stoichiometries에 단일 분자 트랙을 표시합니다.
참고: 선택한 매개 변수의 유효성을 평가하고 개별 시간 추적을 수동으로 수락하거나 거부하는 중요한 도구입니다. 스크린샷 및 자세한 사용 정보는 추가 정보를 참조하십시오.
8. 단일 분자 데이터의 분석 및 필터링 (02. Analysis.ipynb)
- 사용 02. Analysis.ipynb 주피터 단일 분자 데이터를 통해 얻은 단일 분자 데이터의 분석 및 필터링을 위한 노트북 01. Tracking.ipynb 공책. 일반적인 분석 파이프라인은 아래 단계를 참조하십시오.
참고: 다른 과학적 질문과 실험적 설계에는 설정을 조정해야 할 수 있습니다. Jupyter 노트북을 사용하면 분석 단계를 생략, 재배열 및 수정하여 쉽게 적응할 수 있습니다. 각 분석 단계의 스크린 샷과 함수 호출 매개 변수에 대한 설명은 추가 정보.- 초기 필터링 단계를 수행합니다.
- 형광 강도를 안정적으로 결정하기 어렵기 때문에 중복점 확산 기능을 사용하여 신호를 폐기하십시오.
- 불균일한 조명의 경우, 좋은 신호 대 잡음 비율을 보장하기 위해 시야 내의 조명 이면에 있는 신호만 허용한다.
- 분자 내 FRET를 연구하는 경우, 모든 표백 단계가 기록되고 단계별 광표백 분석 중에 나중에 적절하게 평가될 수 있도록 이미지 서열의 시작부분에서 존재하는 궤적으로 분석을 제한한다.
참고: 분자 간 FRET 프로브를 사용하여 실험을 수행할 때, 기증자 및 수용자 형광은 미리 형성된 복합체의 일부가 아니며, 분석을 처음에 존재하는 궤적으로 제한하는 것이 가능하지 않을 수 있다.
- 6.1.7.2 단계에서 얻은 흥분 광원 프로파일을 사용하여 불균일한 조명으로 인한 위치 의존형 형광 강도 변동을 반전시키는 플랫필드 보정을 실행합니다.
참고: 위치(x,y)의 프로브의 형광 강도 I(x,y)는 통해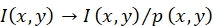 수정됩니다.
수정됩니다. - 명백한 FRET 효율 Eapp(즉, 기증자 형광로에서 수용조 형광로 로 전송되는 에너지의 분수)과 명백한 스토이치오메트리 Sapp(즉, 회절 한정 된 지점 내에서 총 형광수로 나눈 기증자 형광수)을 계산한다.
참고: 각 데이터 포인트에 대해 E 대 S를 플로팅함으로써, 스토이치오메트리18의 변화로 인한 변경으로부터 기증자 수용자 거리의 변화로 인해 측정된 FRET 효율성의 변화를 구별할 수 있다. 이를 통해 활성 수용자의 부재로 인해 E =0으로부터염 분리로 인한 E =0 사이의 분화를 가능하게 합니다. E-S 플롯은 품질 평가를 위한 도구로 분석 전반에 걸쳐 사용됩니다. 그림 4를 예로 들어 보겠습니다. - 단일 분자 프로브와 골재 간의 차별에 대한 광표백에 대한 단계별 분석을 수행합니다. 다음 옵션 중 하나를 수락하도록 선택합니다.
참고: 이를 위해 분석 소프트웨어는 변경점 검출 알고리즘 PELT37의 사용자 지정 구현32를 기증자 여기시형(IDD + IDA) 및 수락자 흥분(IAA)에 별도로 적용합니다.- 선택 옵션 1, 기증자가 부분 표백을 보여주지 않는 동안 한 단계로 수용자 형광표백제 (즉, 비 제로 강도에 표백 단계가 없습니다)를 선택합니다.
참고: 이 옵션은 기증자가 한 단계에서 수락자 앞에 표백하는 궤적을 더욱 거부합니다. 옵션 1은 높은 수용자 광표백 율의 경우 선호하는 선택입니다. - 선택 옵션 2, 기증자표백은 한 단계로 표백하는 동안 부분 수용체 표백이 없는 동안.
참고: 이 옵션은 기증자가 한 단계만에 수락자 후 표백하는 궤적을 더욱 거부합니다. 옵션 2는 높은 기증자 광표백 율의 경우 선호하는 선택입니다. - 옵션 3을 선택하면 다른 단계는 부분적으로 표백하지 않는 동안 한 단계로 형광 표백제 표백제중 하나를 선택합니다.
참고: 옵션 3은 옵션 1과 2보다 더 높은 유연성을 제공하며 데이터 분석에 권장되는 기본 설정이 됩니다. - 선택 옵션 4, 기증자와 수용자 형광은 단일 단계 광표백을 표시하거나 전혀 포토 블리칭을 표시하지 않습니다.
참고: 낮은 광표백율의 경우 옵션 4가 선호됩니다.
- 선택 옵션 1, 기증자가 부분 표백을 보여주지 않는 동안 한 단계로 수용자 형광표백제 (즉, 비 제로 강도에 표백 단계가 없습니다)를 선택합니다.
- 기증자 배출 누출에 대한 보정 요인을 α, 직접 수락자 δ, γ 검출 효율 및 흥분 효율 β 17을 계산합니다.
- 보정 요소를 사용하여 명백한 효율성 Eapp및 명백한 스토이치오메트리 Sapp의 stoichiometry S로부터 FRET 효율 E를 계산합니다.
- 추가 필터링 단계를 수행합니다. 각 궤도에서 첫 번째 표백 이벤트 이전의 데이터 점만 선택합니다. 또한 0.35 < S < 0.6을 만족시키는 데이터 포인트의 75% 이상을 가진 궤적만 허용하여 단일 분자 프로브로 분석을 제한합니다(숫자는 조정할 수 있음).
참고: 관심 있는 인구와 인구의 확산에 따라 상위 및 하한 경계를 선택해야 하며, 이는 분석에서 제외되어야 합니다(예: 기증자 전용 및 수용자 전용 인구). 경험을 바탕으로 0.35 < S < 0.6은 많은 실험 상황에서 좋은 선택으로 밝혀졌습니다. - 해당 보조 이미지(단계 2.2.1 및 6.1.7 참조)에서 전역 또는 적응형 임계값을 통해 이미지 세분화를 수행하여 분석을 시야 내의 다른 영역으로 제한합니다.
참고: 예를 들어 셀-SLB 인터페이스 또는 패턴 구조에 있는 프로브의 단독 평가를 허용합니다.
- 초기 필터링 단계를 수행합니다.
9. 결과 및 추가 분석의 플로팅 (03. 플롯.ipynb)
참고: Jupyter 노트북의 스크린샷 및 함수 호출 매개 변수에 대한 설명을 위한 보충 정보를 참조하십시오.
- 잘못된 스토이치오메트리의 신호가 올바르게 식별되고 제거되었는지 확인하기 위해 E-S 플롯을 만듭니다.
- FRET 효율성의 히스토그램을 플롯하여 FRET 효율성 분포에 대한 잘 확립된 개요를 제공합니다. 다른 실험에서 결과의 편리한 비교를 위해 히스토그램을 그룹화합니다.
- 과학적 파이썬 라이브러리를 활용하는 노트북 내에서 데이터를 추가(예: 확산 분석, FRET 효율성 변환) 분자력 센서 또는 전이 분석을 사용하여 실험에 힘을 실어주십시오.
참고: 다른 분석 소프트웨어에 대한 입력으로 데이터를 여러 파일 형식으로 내보낼 수도 있습니다.
결과
실험의 과학적 질문에 따라 smFRET 트랙에서 다양한 저급 및 높은 수준의 정보를 추출할 수 있다. 여기서, 아날로그 및 디지털 프로브를 가진 분석 파이프라인의 예가 제시됩니다: 펩티드 계 분자력 센서16 및 그 형성의 스토세스 스위칭을 가진 DNA 프로브38, 각각. 이러한 프로브의 설계 및 작동 원리에 대한 그림 5 를 참조하십시오.
프로토콜에 설명된 대로 지역화 및 추적 알고리즘이 실행된 후 패키지는 초기 매개 변수 및 후속 필터 단계를 최적화하기 위한 여러 데이터 시각화 도구를 제공합니다: (i) 개별 smFRET 이벤트의 시각화, (ii) 선택적 이미지 세분화는 관심 있는 특정 영역에서데이터를 분석하고, (iii) FRET 효율 대 스토이치오메이트리(E-S) 플롯을 통한 필터 단계 모니터링. 단일 분자 데이터의 시각화는 도 6에 제시된다.
마지막으로 필터링된 FRET 이벤트는 E-S 플롯과 FRET 효율 히스토그램(그림 4)으로 표시됩니다. E-S 플롯은 앞서 언급한 필터링 단계를 최적화하고 최종 결과를 조사하는 데 유용한 도구입니다. 부분적으로 표백되거나 불완전하게 표지된 FRET 센서는 스토이치오메트리 값으로 제외될 수 있습니다. 이동성 매개 변수는 x-y 플롯(그림 6) 또는 평균 정사각형 변위(MSD) 플롯(그림 4)에서 개별 궤적 경로를 플로팅하여 조사할 수 있습니다. 첫 번째 방법은 고정 된 이벤트에서 모바일을 차별하는 데 특히 유용하며 후자는 확산 계수를 계산하는 데 사용됩니다.
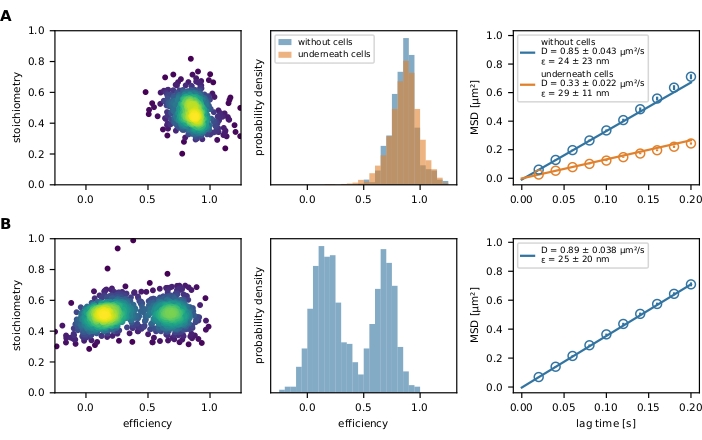
그림 4: 예시출력. (A) FRET 효율은 유리지지 지질 이중층을 장식하고 T 세포에 의해 긴장되는 분자력 센서(좌패널)의 집단을 위해 스토이치오메트리(E-S 플롯)에 비해 플롯된다. 하나의 인구 클라우드만 표시됩니다. FRET의 각각의 히스토그램은 세포(중간 패널)의 존재와 부재에서 힘 센서 집단 간의 차이를 예시한다. T 셀이 있는 센서 집단의 FRET 효율을 낮추기 위한 이동은 관찰될 수 없으며, 이는 센서 모듈의 힘 의존적 스트레칭을 거의 또는 전혀 나타내지 않는다는 것을 나타낸다. 이러한 실험 조건의 MSD 플롯은 T 셀 아래의 힘 센서 인구가 언바운드 대응(오른쪽 패널)보다 상당히 느리게 움직이는것을 확인합니다. (B) 동일한 분석은 유리 지원 유체 지질 이중층을 장식하는 홀리데이 접합 DNA 센서로 수행되었다. E-S 플롯은 FRET 효율 히스토그램에서도 명백한 두 개의 인구를 명확하게 보여줍니다. MSD 플롯은 빠르게 움직이는 하나의 센서 채우기의 존재를 나타냅니다. 약어: FRET = Förster 공명 에너지 전송; MSD = 평균 정사각형 변위. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
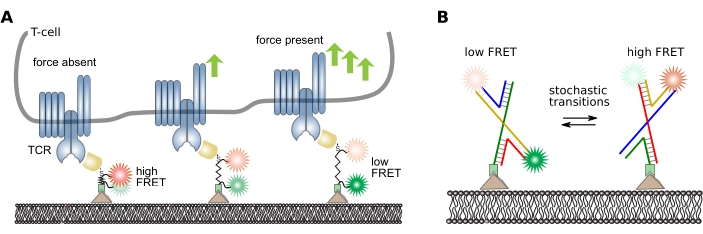
그림 5: 분자 내 FRET 프로브의 설계 및 작동 원리. (A) 기계 분자력의 정량화를 위한 아날로그 펩타이드 센서. 기증자 및 수용자 형광은 펩티드 백본의 양쪽 끝에 공동으로 부착됩니다. 센서 모듈은 특정 리간드에 부지에 특별히 부착되어 있으며, 이는 차례로 관심있는 세포 거주자 표면 수용체를 결합합니다 (여기서, T 세포 수용체의 베타 사슬을 구체적으로 인식하는 항체 단편). 수용체 리간드 결합시 힘이 가해지고 센서 모듈이 결합 분열 후 결국 반동됩니다. 이 패널은 16에서 수정됩니다. (B) FRET 전이의 정량화를 위한 디지털 DNA 센서. FRET 센서는 홀리데이 접합을 형성하는 4개의 DNA 가닥으로 구성됩니다. 기증자와 수용자 불소는 두 가닥에 공유하게 부착됩니다. 홀리데이 접합부는 주변 버퍼 조건에 따라 변형을 자주 전환합니다. 이러한 적합성의 스토세스틱 스위칭은 개별 프로브의 FRET 효율을 정량화하여 모니터링할 수 있습니다. 약어: TCR = T 세포 수용체; FRET = Förster 공명 에너지 전송. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
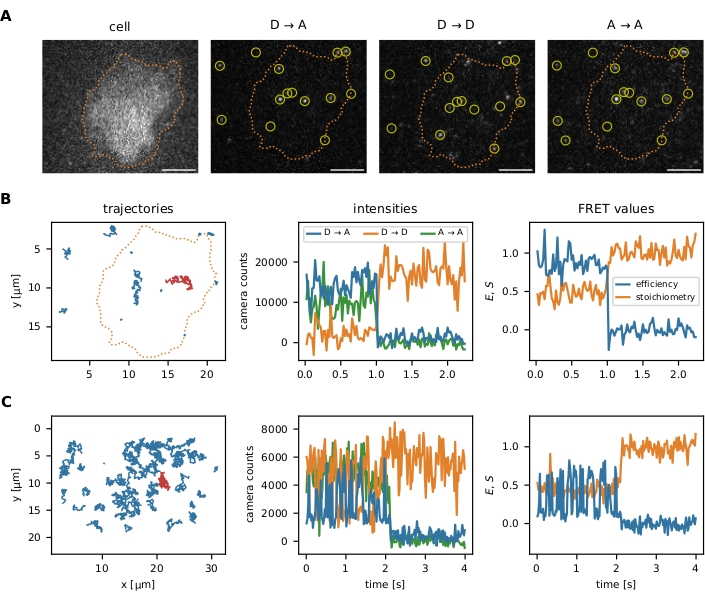
그림 6: FRET 프로브의 현지화 및 추적의 예입니다. (A) 개별 이벤트의 FRET 효율 및 stoichiometry는 기증자 여기 (D → D), 기증자 여기시 수용자 불소 (D → A), 및 수락자 훈증 (a → A)에 따라 기증자 플루오로포어의 강도를 정량화하여 계산됩니다. 가장 가까운 이웃 필터링은 가까운 이미터의 포인트 확산 함수를 겹쳐바이어스를 방지합니다. 이미지 세분화를 통해 사용자는 관심 영역(예: 셀 또는 마이크로패턴)내에서 지역화된 특정 smFRET 이벤트를 선택할 수 있습니다. 이미지 세분화의 예로, T 셀은 Fura-2(왼쪽에 표시)로 염색되었고 셀 가장자리(주황색 점선)를 식별하기 위한 적응 형 임계값을 적용하였다. 스케일 바 = 분자력 센서를 이용한 5 μm. (B) 스마프레트 궤적. 개별 궤적을 x-y 평면에 플롯하여 확산 동작 및 지역화(왼쪽 패널)를 시각화할 수 있습니다. 또한, 각 궤적의 강도는 FRET 전환 또는 표백 단계를 식별하기 위해 시간이 지남에 따라 플롯 될 수있다 (중간 패널은 왼쪽 패널에서 빨간색 궤적을 보여줍니다). 결과 FRET 효율과 스토이치오메트리는 유사하게 시각화할 수 있습니다(오른쪽 패널). (C) 홀리데이 접합 DNA 센서를 이용한 smFRET 궤적. HBSS + 12 mM MgCl2 는 측정 중에 완충제로 사용되었다. 이러한 예의 서열 끝 부근의 명백한 수용체 표백 단계 외에도 각 센서에 대한 FRET 전이 주파수를 결정할 수 있습니다. 홀리데이 접합부는 고주파로 변형을 전환하지만 분자 력 센서는 FRET 전이를 나타내지 않습니다. 이 정보를 사용하면 프레임 간의 지연과 같은 실험 조건을 조정하여 관찰된 전환 수를 늘리거나 줄일 수 있습니다. 약어: FRET = Förster 공명 에너지 전송; smFRET = 단일 분자 FRET; HBSS = 행크의 균형 잡힌 소금 솔루션. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 정보: 단일 분자의 현지화 및 추적(01. Tracking.ipynb). 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 문서에서는 모바일 아직 표면 테더링된 프로브 분자에서 비롯된 smFRET 데이터의 자동화된 기록 및 정량적 분석을 위한 파이프라인을 자세히 설명합니다. 그것은 smFRET 실험에 대한 두 가지 주요 접근 방식을 보완, 공초점 여기 볼륨17안팎에서 솔루션으로 확산 표면 고정 프로브 또는 프로브 중 하나를 포함17. 그것은 시간의 함수로서 올바른 FRET 효율과 분자 위치를 제공합니다. 따라서 전이 운동학1, FRET 히스토그램39 또는 2차원 확산22를 정량화하기 위해 특수 분석 프로그램에 대한 입력으로 사용할 수 있습니다.
이 소프트웨어는 사용자에게 무료 사용, 수정 및 재배포할 수 있는 영구적인 권리를 부여하는 오픈 소스 이니셔티브에 의해 승인된 무료 및 오픈 소스 라이선스에 따라 릴리스됩니다. Github는 버그를 보고하거나 code40을 기여하여 소프트웨어를 최대한 쉽게 확보하고 개발 프로세스에 참여할 수 있도록 개발 및 배포 플랫폼으로 선정되었습니다. 파이썬으로 작성된 이 소프트웨어는 독점 구성 요소에 의존하지 않습니다. 사용자 인터페이스로 Jupyter 노트북을 선택하면 모든 분석 단계에서 데이터 검사를 용이하게 하고 현재 실험 시스템을 위해 파이프라인을 조정하고 확장할 수 있습니다. sdt-python library32 는 단일 분자 국소화, 확산 분석, 형광 강도 분석, 컬러 채널 등록, 공동 지역화 분석 및 ROI 처리와 같은 형광 현미경 데이터를 평가하는 기능을 구현합니다.
원칙적으로 단일 입자 추적은 1차원, 2차원 또는 3차원 시스템에서 수행될 수 있습니다. 여기서, 단일 분자 분석 파이프라인은 2D 모바일 시스템의 연구에 맞추어졌습니다. 이 선택은 플랑어 지원 지질 이중층(SLB)과 같은 간단한 시스템의 가용성을 반영하여 모바일 형광 프로브를 제공합니다. 이러한 지질 이중층 시스템은 전형적으로 2개 이상의 인지질계로 구성되며, 벌크 분획은 SLB의 주요 물리화학적 파라미터(예: 위상 및 점도)를 결정하고, 사소한 분획은 생체분자에 대한 부착 부위를 제공한다. 이러한 부착 부위는 히스티딘 태그41을 가진 단백질 플랫폼을 위한 아비딘 또는 스트렙타비딘 기반 단백질 플랫폼 또는 니켈-NTA 컨쥬게이드 인지질에 대한 생체자극성 인지질일 수 있다. SLB에 단백질을 연결하기 위한 적절한 플랫폼의 선택은 과학적 질문에 달려 있습니다. 독자는 성공적으로 채택 된 전략의 예를 들어 문학16,38,42를 참조 할 수 있습니다. 샘플의 프로브 밀도는 겹치는 점 확산 함수를 피하기에 충분히 낮아야 합니다. 전형적으로, μm2당 0.1 미만의 분자가 권장됩니다. 적합한 프로브 밀도를 나타내는 예는 대표적인 결과 섹션(특히 도 6)을 참조하십시오. 분석 방법은 또한 살아있는 세포의 혈장 막에서 확산되는 단일 형광 표지 단백질 분자에 적용됩니다.
smFRET 실험의 한 가지 중요한 측면은 FRET 프로브 자체의 생산 및 특성입니다. FRET 쌍에 대한 형광을 선택할 때, 그들의 Förster 반경은 예상된 염료 간 거리43과 일치해야 합니다. 장시간 흔적을 얻을 수 있기 때문에 포토표백에 강한 염료가 선호됩니다. 그러나, 높은 표백 비율에 대 한, 1 개의 형광종 단계별 광 표백 분석을 통해 지역화 된 분자에서 유래 하는 다중 혈소판 이벤트를 인식 하기 위해 활용할 수 있습니다.; 프로토콜 섹션에서 8.1.4 단계를 참조하십시오. 불소엽소 쌍은 사이트 특이적으로 그리고 관심있는 분자에 공유하게 되어야 하며, 분자 간 FRET 쌍을 형성해야 한다.
smFRET와 쉽게 사용할 수 있는 다른 기술을 결합하면 회절 제한을 초과하여 공간 해상도를 높일 수 있습니다(STED44 를 통해). 여기에 제시된 smFRET 추적 알고리즘은 새로운 실험 설정 및 모델 시스템에 대한 접근 방식의 적용 가능성을 넓혀주입니다. 여기에는 이동식 생체 분자의 스토이치오메트리(stoichiometry) 역학 적 변화, (ii) 모바일 생체 분자의 동적 연관성, (iii) 자유롭게 확산 반응의 효소 반응 의 속도, 그리고 (iv) 모바일 생체 분자의 형성 변화의 운동의 운동학의 연구가 포함된다. 처음 두 가지 예는 분자 간 FRET, 즉 기증자 및 수용자가 관심있는 생체 분자 개체를 분리하기 위해 공주되는 것을 보여주는 모델 시스템을 요구합니다. 후자의 예는 동일한 분자 실체(분자 내 FRET) 내에서 기증자 및 수용자를 운반하는 바이오 센서를 사용할 수 있습니다.
분자 내 FRET 기반 센서는 생체 분자의 본질적인 형성 변화에 대한 통찰력을 제공할 수 있습니다1,2,3,4, 내인성 또는 외부 힘 부하로 인한 형성 변화 (분자 력 센서16), 또는 칼슘45 및 pH46와 같은 나노 환경에서 이온 농도 . 모델 시스템 및 바람직한 앵커링 플랫폼에 따라, 이러한 smFRET 이벤트는 2D 또는 3D로 추적될 수 있습니다: (i) smFRET 이벤트의 평면 추적은 플라즈마 멤브레인 내의 수용체-리간드 상호작용 시간의 정량화, 멤브레인 고정 신호 증폭 캐스케이드의 연관성 및 표면 수용체의 스토이치오메이트리 변화에 사용될 수 있다. (ii) smFRET 이벤트의 부피 추적은 살아있는 세포 또는 체외 재구성 시스템에서 임의의 분자 간 FRET 프로브에 사용될 수 있다.
smFRET 추적 방법은 주로 분자 내 FRET 프로브를 염두에 두고 개발되었다. 이 프로브는 응집되고 잘못 합성된 분자(예: 불완전하게 표지된) 분자로부터 데이터를 거부하는 데 악용된 사실뿐만 아니라 형광술 중 하나가 포토블리치된 프로브에서 수집되고 잘 알려진 형광 라벨수를 특징으로 합니다. 그러나 필터링 단계를 조정함으로써 분자 간 FRET 프로브에도 방법을 적용할 수 있습니다. 예를 들어, 단일 기증자와 단일 수용자 형광소를 특징으로 하는 분자만 받아들이는 대신, 기증자 및 수용자 염료의 공간 궤적을 검사하고 예를 들어, 공동 확산 기증자 수용자 궤적을 선택할 수 있습니다.
3D-DAOSTORM 알고리즘은 배출 빔 경로의 원통형 렌즈로 인한 난시를 통해 광학 축을 따라 신호의 위치를 결정하는 지원을 하므로 3D 실험은 분석 파이프라인에 쉽게 통합될 수 있습니다. 이 경우, 수락자 여기시 수락신호는 금식성 및 축 위치를 결정하는 역할을 한다. 또한 분석 소프트웨어는 대규모 자동화 및 필터링 체계를 활용하여 고정 프로브를 특징으로 하는 실험의 데이터를 평가하는 데도 사용할 수 있습니다. 실제로, 젤상 바이레이어38 에 고정된 홀리데이 접합부에서 smFRET 효율 데이터 세트를 초기 버전의 소프트웨어를 사용하여 분석했습니다.
공개
저자는 이해 상충을 선언하지 않습니다.
감사의 말
이 작품은 오스트리아 과학 기금 (FWF) 프로젝트 P30214-N36, P32307-B, 비엔나 과학 기술 기금 (WWTF) LS13-030에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 1,2-dioleoyl-sn-glycero-3-[(N-(5-amino-1-carboxypentyl)iminodiacetic acid)succinyl] (nickel salt) (Ni-NTA-DOGS) | Avanti Polar Lipids | 790404P | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Avanti Polar Lipids | 850375P | |
| 1-palmitoyl-2-oleoyl-glycero-3-phosphocholine (POPC) | Avanti Polar Lipids | 850457P | |
| α Plan-FLUAR 100x/1.45 oil objective | Zeiss | 000000-1084-514 | |
| Axio Observer microscope body | Zeiss | ||
| Bandpass filter | Chroma Technology Corp | ET570/60m | donor emission filter |
| Bandpass filter | Chroma Technology Corp | ET675/50m | acceptor emission filter |
| conda-forge | conda-forge community | community-maintaned Python package repository for Anaconda/miniconda | |
| Coverslips 60 mm x 24 mm #1.5 | MENZEL | ||
| Dichroic mirror | Semrock Inc | FF640-FDi01-25×36 | separation of donor and acceptor emission |
| Dichroic mirror (quad band) | Semrock Inc | Di01-R405/488/532/635-25×36 | separation of excitation and emission light |
| DPBS | Sigma-Aldrich | D8537 | |
| FCS | Sigma-Aldrich | F7524 | for imaging buffer |
| fret-analysis | Schütz group at TU Wien | Python package for smFRET data analysis; version 3 | |
| Fura-2 AM | Thermo Fisher Scientific | 11524766 | |
| HBSS | Sigma-Aldrich | H8264 | for imaging buffer |
| iBeam Smart 405-S 405 nm laser | Toptica Photonics AG | ||
| iXon Ultra 897 EMCCD camera | Andor Technology Ltd | ||
| Lab-Tek chambers (8 wells) | Thermo Fisher Scientific | 177402PK | for sample preparation and imaging |
| Millenia Prime 532 nm laser | Spectra Physics | ||
| miniconda | Anaconda Inc. | Python 3 distribution. Min. version: 3.7 | |
| Monovalent streptavidin (plasmids for bacterial expression) | Addgene | 20860 & 20859 | |
| OBIS 640 nm laser | Coherent Inc | 1185055 | |
| Optosplit II | Cairn Research | ||
| Ovalbumin | Sigma-Aldrich | A5253 | for imaging buffer |
| Plasma cleaner | Harrick Plasma | PDC-002 | |
| sdt-python | Schütz group at TU Wien | Python library for data analysis; version 17 | |
| TetraSpek bead size kit | Thermo Fisher Scientific | T14792 | Randomly distributed, immobilized fiducial markers for image registration |
| USC500TH Ultrasound bath | VWR | for SUV formation |
참고문헌
- McKinney, S. A., Déclais, A. -. C., Lilley, D. M. J., Ha, T. Structural dynamics of individual holliday junctions. Nature Structural Biology. 10 (2), 93-97 (2002).
- Wang, S., Vafabakhsh, R., Borschel, W. F., Ha, T., Nichols, C. G. Structural dynamics of potassium-channel gating revealed by single-molecule FRET. Nature Structural & Molecular Biology. 23 (1), 31-36 (2015).
- Hellenkamp, B., Wortmann, P., Kandzia, F., Zacharias, M., Hugel, T. Multidomain structure and correlated dynamics determined by self-consistent FRET networks. Nature Methods. 14 (2), 174-180 (2016).
- Kilic, S., et al. Single-molecule FRET reveals multiscale chromatin dynamics modulated by HP1α. Nature Communications. 9 (1), 235 (2018).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47 (1), 819-846 (1978).
- Wu, P. G., Brand, L. Resonance energy transfer: Methods and applications. Analytical Biochemistry. 218 (1), 1-13 (1994).
- Qiao, Y., Luo, Y., Long, N., Xing, Y., Tu, J. Single-molecular förster resonance energy transfer measurement on structures and interactions of biomolecules. Micromachines. 12 (5), 492 (2021).
- Malkusch, N., Dörfler, T., Nagy, J., Eilert, T., Michaelis, J. smFRET experiments of the RNA polymerase II transcription initiation complex. Methods. 120, 115-124 (2017).
- Lee, J. -. B., et al. Single-molecule views of MutS on mismatched DNA. DNA repair. 20, 82-93 (2014).
- Phelps, C., Israels, B., Jose, D., Marsh, M. C., von Hippel, P. H., Marcus, A. H. Using microsecond single-molecule FRET to determine the assembly pathways of T4 ssDNA binding protein onto model DNA replication forks. Proceedings of the National Academy of Sciences of the United States of America. 114 (18), E3612-E3621 (2017).
- Deindl, S., Zhuang, X. Monitoring conformational dynamics with single-molecule fluorescence energy transfer: Applications in nucleosome remodeling. Methods in Enzymology. 513, 59-86 (2012).
- Crawford, D. J., Hoskins, A. A., Friedman, L. J., Gelles, J., Moore, M. J. Single-molecule colocalization FRET evidence that spliceosome activation precedes stable approach of 5' splice site and branch site. Proceedings of the National Academy of Sciences of the United States of America. 110 (17), 6783-6788 (2013).
- Wang, Y., Xiao, M., Li, Y. Heterogeneity of single molecule FRET signals reveals multiple active ribosome subpopulations. Proteins. 82 (1), 1-9 (2014).
- Mori, T., Vale, R. D., Tomishige, M. How kinesin waits between steps. Nature. 450 (7170), 750-754 (2007).
- Huppa, J. B., et al. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature. 463 (7283), 963-967 (2010).
- Göhring, J., et al. Temporal analysis of T-cell receptor-imposed forces via quantitative single molecule FRET measurements. Nature Communications. 12 (1), 2502 (2021).
- Hellenkamp, B., et al. Precision and accuracy of single-molecule FRET measurements-a multi-laboratory benchmark study. Nature Methods. 15 (9), 669 (2018).
- Kapanidis, A. N., et al. Fluorescence-aided molecule sorting: Analysis of structure and interactions by alternating-laser excitation of single molecules. Proceedings of the National Academy of Sciences of the United States of America. 101 (24), 8936-8941 (2004).
- Sakon, J. J., Weninger, K. R. Detecting the conformation of individual proteins in live cells. Nature Methods. 7 (3), 203-205 (2010).
- McCann, J. J., Choi, U. B., Zheng, L., Weninger, K., Bowen, M. E. Optimizing methods to recover absolute FRET efficiency from immobilized single molecules. Biophysical Journal. 99 (3), 961-970 (2010).
- Lee, N. K., et al. Accurate FRET measurements within single diffusing biomolecules using alternating-laser excitation. Biophysical Journal. 88 (4), 2939-2953 (2005).
- Asher, W. B., et al. Single-molecule FRET imaging of GPCR dimers in living cells. Nature Methods. 18 (4), 397-405 (2021).
- Joo, C., Ha, T. . Single-molecule FRET with total internal reflection microscopy. (12), 1223-1237 (2012).
- Joo, C., Ha, T. Objective-type total internal reflection microscopy (excitation) for single-molecule FRET. Cold Spring Harbor Protocols. 11, 1189-1191 (2012).
- Joo, C., Ha, T. Objective-type total internal reflection microscopy (emission) for single-molecule FRET. Cold Spring Harbor Protocols. 11, 1192-1194 (2012).
- Allan, D. B., Caswell, T., van der Wel, C. M., Dimiduk, T. . Soft-matter/pims: PIMS v0.5. , (2020).
- Anaconda Inc. . Miniconda. , (2021).
- conda-forge community. . The conda-forge project: community-based software distribution built on the conda package format and ecosystem. , (2015).
- . . JupyterLab Contributors Notebooks - JupyterLab documentation. , (2021).
- Babcock, H., Sigal, Y. M., Zhuang, X. A high-density 3D localization algorithm for stochastic optical reconstruction microscopy. Optical Nanoscopy. 1 (6), (2012).
- Gao, Y., Kilfoil, M. L. Accurate detection and complete tracking of large populations of features in three dimensions. Optics Express. 17 (6), 4685 (2009).
- Schrangl, L. . sdt-python: Python library for fluorescence microscopy data analysis (v17.1). , (2021).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. Journal of Colloid and Interface Science. 179 (1), 298-310 (1996).
- Preibisch, S., Saalfeld, S., Schindelin, J., Tomancak, P. Software for bead-based registration of selective plane illumination microscopy data. Nature Methods. 7 (6), 418-419 (2010).
- Bradski, G. The OpenCV library. Dr. Dobb's Journal: Software Tools for the Professional Programmer. 25 (11), 120-123 (2000).
- Allan, D. B., Caswell, T., Keim, N. C., van der Wel, C. M., Verweij, R. W. Soft-matter/trackpy: Trackpy v0.5.0. Zenodo. , 4682814 (2021).
- Killick, R., Fearnhead, P., Eckley, I. A. Optimal detection of changepoints with a linear computational cost. Journal of the American Statistical Association. 107 (500), 1590-1598 (2012).
- Schrangl, L., Göhring, J., Schütz, G. J. Kinetic analysis of single molecule FRET transitions without trajectories. The Journal of Chemical Physics. 148 (12), 123328 (2018).
- Santoso, Y., Torella, J. P., Kapanidis, A. N. Characterizing single-molecule FRET dynamics with probability distribution analysis. ChemPhysChem. 11 (10), 2209-2219 (2010).
- Schrangl, L. Single-molecule FRET analysis software (3.0). Zenodo. , (2021).
- Nye, J. A., Groves, J. T. Kinetic control of histidine-tagged protein surface density on supported lipid bilayers. Langmuir. 24 (8), 4145-4149 (2008).
- Platzer, R., et al. Unscrambling fluorophore blinking for comprehensive cluster detection via photoactivated localization microscopy. Nature Communications. 11 (1), 4993 (2020).
- Johnson, I., Spence, M. . The molecular probes handbook: A guide to fluorescent probes and labeling technologies. , (2010).
- Szalai, A. M., et al. Super-resolution imaging of energy transfer by intensity-based STED-FRET. Nano Letters. 21 (5), 2296-2303 (2021).
- Miyawaki, A., et al. Fluorescent indicators for Ca2+ based on green fluorescent proteins and calmodulin. Nature. 388 (6645), 882-887 (1997).
- Zhai, B., Zhai, S., Hao, R., Xu, J., Liu, Z. A FRET-based two-photon probe for in vivo tracking of pH during a traumatic brain injury process. New Journal of Chemistry. 43 (43), 17018-17022 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유