需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
小鼠输卵管的显微解剖和解离:个体片段鉴定和单细胞分离
摘要
本文提出了一种小鼠输卵管显微解剖方法,该方法允许在保持RNA完整性的同时收集单个片段。此外,描述了非酶促卵管细胞解离过程。这些方法适用于功能不同的输卵管节段和解离的输卵管细胞的后续基因和蛋白质分析。
摘要
小鼠模型系统在疾病过程分析方面是无与伦比的,因为它们具有遗传可操纵性和实验性治疗的低成本。然而,由于它们的体型小,一些结构,如直径为200-400μm的输卵管,已被证明相对难以研究,除非通过免疫组织化学。最近,免疫组织化学研究揭示了输卵管段比以前认识到的更复杂的差异;因此,输卵管被分为四个功能段,具有七种不同上皮细胞类型的不同比例。上皮细胞类型的不同胚胎起源和比例可能使这四个功能区域对疾病有不同的易感性。例如,浆液性上皮内癌的前体病变来自小鼠模型中的内底和人类输卵管中的相应腓肠区域。这里描述的方案详细介绍了一种显微解剖方法,以产生下游分析所需的足够量和纯度的RNA,例如逆转录定量PCR(RT-qPCR)和RNA测序(RNAseq)。还描述了一种大部分非酶解组织解离方法,适用于流式细胞术或单细胞RNAseq分析的完全分化的输卵管细胞。所描述的方法将促进在生殖,生育,癌症和免疫学领域利用小鼠输卵管的进一步研究。
引言
小鼠输卵管在功能和形态上与人类输卵管相似1。两者都由假分层的纤毛上皮组成,由两个历史上描述的上皮常驻细胞组成:纤毛细胞和分泌细胞1,2。输卵管有三个经典公认的部分:腹腔,壶腹和峡部。在最近的一项研究中,Harwalkar等人。3 研究了输卵管形态和基因表达,导致将常驻上皮细胞的分类扩展到七个不同的群体。此外,他们建立了壶腹 - 地峡连接处作为输卵管3的独特部分。本文描述的方法侧重于腹足、壶腹和峡部,可以很容易地扩展到包括壶腹-峡部交界处2,3。腹股沟区域包含输卵管的开口,包括腓肠区域以及近端茎。向子宫移动,接下来是壶腹,然后是峡部。纤毛细胞在该区域的远端、卵巢近端或足底最为突出,而分泌细胞在近端或峡部最为突出1。与人类输卵管不同,小鼠输卵管是由腹膜宽韧带的延伸中脉支撑的盘绕结构1,4。此外,小鼠输卵管被包裹在滑囊中,这增加了卵母细胞转移到输卵管中的可能性4。壶腹被确定为受精的位置,发育中的胚胎在进入子宫之前从该位置进入地峡5。输卵管节段直径为200-400μm,较长的壶腹和峡部区域的长度约为0.5-1.0厘米4。输卵管在发情周期期间膨胀,腹扩和腹股沟比峡更易扩张1。
细胞(尤其是分泌细胞)的过度增殖是盆腔中发现的浆液性肿瘤的前体病变的特征6。这些前体浆液性上皮内病变仅在腓骨区域出现在输卵管上皮中;目前尚不清楚为什么病变形成仅限于该区域,其中通常主要细胞类型是纤毛的,而不是分泌的2,7,8。正常生理功能的区域性以及对卵巢癌输卵管起源的兴趣增加9,10,11,12,13,强调了单独评估输卵管段的重要性。
这里描述的方法详细介绍了单独输卵管片段的收集,用于随后对片段特异性基因表达和解离细胞的功能进行下游分析。传统上,许多组织按照苯酚:氯仿法或柱上完全提取法进行全RNA提取;然而,我们发现RNA质量得以维持,同时使用所述的组合方法产生了足够的产量。利用这种方法,可以处理输卵管的非常小的功能段以进行下游分析,而不是将输卵管作为一个整体进行研究,这可以掩盖代表不同段的结果14。
分离的小鼠输卵管细胞很少通过流式细胞术进行研究,很可能是由于该组织的细胞产量有限。克服这个问题的一种方法是解离细胞,在培养物中培养它们,然后在 体外 刺激再分化,以获得适当的细胞数用于下游细胞分析15,16,17,18。这种方法的局限性是培养物中 离体 时间和微环境的改变,这两者都可能改变基因表达。还有一种假设是,形态学上的再分化具有与完整动物相同的转录和蛋白质组学特征。目前的解离方法旨在实现异质性输卵细胞群中最高数量的上皮细胞,同时保持单细胞分化。此外,大多数非酶的方法可能会限制细胞表面蛋白的损失。
研究方案
所有动物处理和程序均由加州大学河滨分校机构动物护理和使用委员会批准,并符合美国实验动物护理协会,美国农业部和美国国立卫生研究院的指南。所述方法利用C57BL/6成年雌性小鼠。所有动物在组织收获前都通过斩首实施了安乐死。
注:该方案的概述,使用蓝色染料来帮助有效解剖和解开输卵管,如第一图所示(图1)。
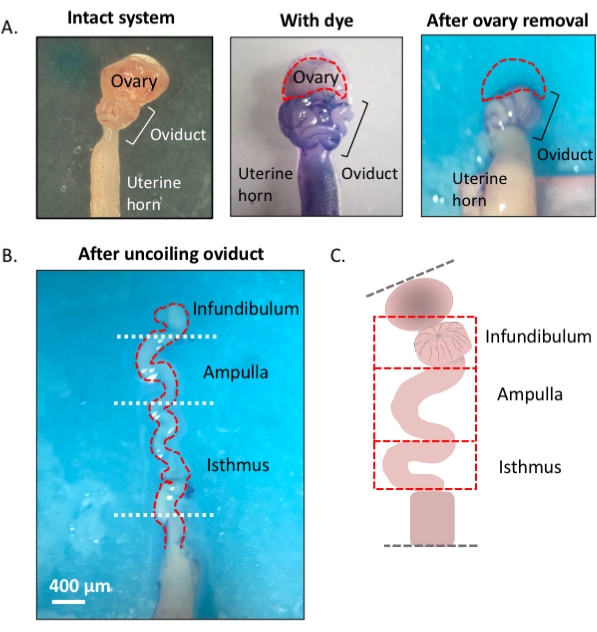
图 1:显微切割方法概述。 (A)左图显示了完整的结构,从中移除了大部分卵巢脂肪垫和输卵管周围的结缔组织残留物。在此之后,添加甲苯胺蓝有助于区分输卵管(中间面板)的线圈。右图显示了卵巢切除后的结构。(B) 具有内转弯的无螺旋输卵管,用于确定每个段的起点和终点。(三)卡通的分割所用(不按比例绘制)。 请点击此处查看此图的放大版本。
1. 解剖面的准备
- 用粘合剂将一块牙蜡贴在培养皿上,让它干燥(图2A)。用70%乙醇消毒盘子。表面已准备好进行解剖。
2. 卵巢、输卵管和子宫的大切除术
- 准备解剖时,将含有牙科蜡的培养皿固定在所选的冷平台上(例如,使用前保持在-20°C的冰袋)上,置于解剖显微镜下(图2A)。
- 用70%乙醇消毒动物的腹侧表面。用无菌解剖剪刀打开腹腔和盆腔,将胃肠道移动到一侧以定位背侧双角子宫。沿着每个子宫角向喙方向移动,找到包裹在子宫脂肪垫中的每个输卵管和卵巢,位于肾脏正下方(图2B,C)。
- 使用解剖剪刀切除卵巢和仍然附着的远端子宫角的一部分外侧输卵管。切开每个子宫外侧角,约1-2厘米的角仍然附着在盘绕的输卵管和卵巢上(图2D)。立即将组织浸没在2mL冷解剖培养基中(见 材料表)。
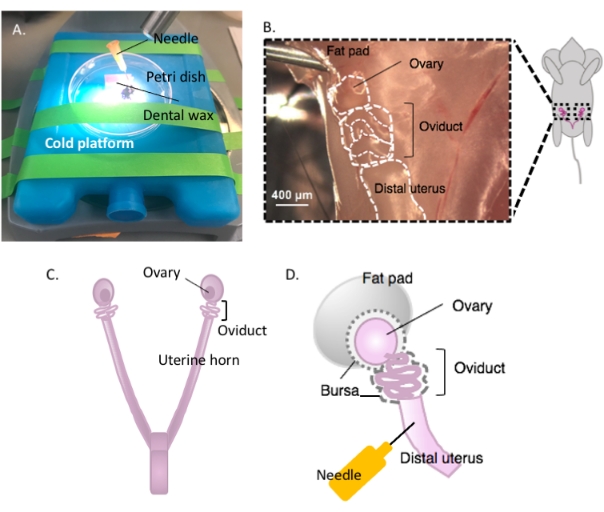
图2:卵巢的大切除术和夹层设置。 输卵管位于卵巢脂肪垫(B)内肾脏底部的盆腔背侧。定位盆腔(C)中的子宫分叉,并沿着子宫外侧角定位子宫 - 输卵管 - 卵巢连续体(B)。通过切开一个子宫角和粗解剖来去除这些结构。放在解剖平台(A)上,并用针头(A 和 D)将子宫部分贴在牙蜡上。 请点击此处查看此图的放大版本。
注意:保持足够的子宫角完好无损并连接到输卵管上,以便贴在解剖平台上(图2D)。
- 用无菌的25 G针将子宫组织贴在牙蜡上,以固定组织进行解剖(图2A,D和 图3A)。在解剖显微镜下工作,清洁并解剖卵巢脂肪垫和结缔组织,以清晰地观察输卵管(图3B)。

图3:逐步输卵管显微切割。 去除残余脂肪和结缔组织(A,B)后,向组织(C)中加入甲苯胺蓝,然后洗去,以促进卵巢的可视化和随后的切除和试管(D-H)的开卷。足底位于近端峡部和子宫-输卵管交界处 (UTJ) 旁边。在中输卵管处切开时,轻轻拉动远端,以展开并显示输卵管(H)的内源性转弯,以定向以进行适当的分割。图A-C比例尺=500μm,D-H比例尺=400μm(I)各段的卡通(未按比例绘制)。 请点击此处查看此图的放大版本。
- 使用1 mL注射器,将附着在子宫上的输卵管在1-2滴无菌1%甲苯胺蓝色染料溶液中分配并孵育30 s-1分钟。用冷杜尔贝克的磷酸盐缓冲盐水(DPBS)冲洗并除去所有液体(图3C)。
- 轻轻地将卵巢从盘绕的输卵管中拉出,并在滑囊膜和宽韧带上切开,以在不损害输卵管组织的情况下将卵巢从输卵管中取出(图3D,E)。
注意:卵巢不附着在输卵管上,而是用输卵管包裹在滑囊膜中(图2D),并通过宽韧带连接到子宫的外侧。
3. 输卵管的显微切割和分割
- 定位输卵管的远端,腓肠末端位于子宫 - 输卵管连接处(UTJ)的侧面。输卵管线圈重新盘绕在自身上;因此,纤膜末端可以位于近端的侧面,并且是定向输卵管开卷的适当起点(图3F,I)。
- 在轻轻拉动管子的同时,用弹簧形微型剪刀切开中胚层(图3I)以解开输卵管(图3G)。
- 一旦解开后,切开管以产生腹肌,壶腹和峡部区域(图3H)。
- 切除内底(腓肠末端和近端柄)后,通过在管子的第二个突出转动(在2到3圈之间切割,长约1厘米)来切除壶腹区域。最后,将剩余部分切入UTJ,即峡部区域(图3H)。
注意:输卵管不会完全展开后拉成直结构。管子将保持其转动(图3H)3。根据壶腹区域之后的后续转弯,可以进一步将剩余的管切入壶腹-峡部交界处和峡部3。在壶腹切除后,在五到六圈之间切开以获得壶腹 - 峡部连接处;剩下的管子(转六到UTJ的起点)是地峡3。
- 切除内底(腓肠末端和近端柄)后,通过在管子的第二个突出转动(在2到3圈之间切割,长约1厘米)来切除壶腹区域。最后,将剩余部分切入UTJ,即峡部区域(图3H)。
- 立即在液氮中冷冻冷冻解剖的组织片段以进行RNA分离,或固定并处理每个片段以进行定向包埋和免疫组织学分析。
- 如果进行RNA提取,则向组织中添加200μL冷RNA提取试剂和1:1均质化微球混合物(见 材料表)(见步骤5.1)。
4. 输卵管解离
- 从上面的步骤3.1.1继续)为了最佳地解离上皮,在可能的区域(即,腹腔和腹甋)切开输卵管以暴露腔内上皮(图4A)。

图4:输卵管细胞解离,第1部分。 展示如何暴露远端上皮以获得最佳细胞解离的漫画(A)和显示使用1 mm 2 网格的最简单方法的图像(B)。 请点击此处查看此图的放大版本。
- 从腓骨区域开始,使用镊子作为杠杆,用弹簧式剪刀纵向切割管子。
- 将裂开部分和剩余的输卵管切成段(〜1-2mm大小),并加入5mL温热的非酶解解缓冲液(见 材料表)并在37°C下孵育。
- 用灯泡移液器重悬组织块和解离细胞,每3分钟一次,持续9-10分钟。用冷解剖培养基以1:1稀释解离缓冲液。
- 通过离心(350× g,3分钟,4°C)收集细胞。将细胞在室温下重悬于2mL红细胞裂解缓冲液中2分钟,然后用冷解剖培养基以1:1稀释。
- 通过离心(350× g,3分钟,4°C)收集细胞并重悬于5mL冷前叉酶溶液中。
- 在pronase消化培养基中孵育,每3-5分钟用球形移液器重悬细胞团块,直到达到单个细胞悬浮液(〜25-30分钟)。
注意:此步骤最好在组织培养板或烧瓶中进行,以便持续观察,防止不必要的过度暴露于丙酶。
- 在pronase消化培养基中孵育,每3-5分钟用球形移液器重悬细胞团块,直到达到单个细胞悬浮液(〜25-30分钟)。
- 将细胞通过无菌的大网格(1 mm x 1 mm的网格,用橡皮筋固定在锥形管上(图4B))以除去任何剩余的未解离组织块。通过离心(350× g,3分钟,4°C)收集细胞,并将它们重悬于适合下游分析的冷培养基中(例如,如果继续进行流式细胞术染色,则为FACS缓冲液)。
5. 输卵管片段的RNA提取
- 使用不锈钢微珠混合物在12级的珠子弹混合器组织均质器中,在200μLRNA提取试剂中匀浆速冻样品,间隔两次(每次3分钟)。
注意:为了保持RNA的完整性,应立即将样品从快速冷冻状态移至RNA提取试剂中,并且不要称量。 - 在台式离心机中以100-200× g 在室温下短暂离心约5秒,以将液体从珠子中分离出来。将上清液转移到新鲜管中。
- 向磁珠中再加入200μLRNA提取试剂以回收更多样品,然后离心(100-200× g, 5 s,室温)。混合上清液。
注意:使用小移液器吸头(大多数p200吸头是合适的),以防止在去除上清液时残留珠子。 - 遵循制造商的指南,对 RNA 进行相分离和沉淀。将代表性样品在-20°C下用100%异丙醇(约2:1体积,异丙醇:回收水相)沉淀过夜。
- 将完整的RNA沉淀物与溶液一起转移到RNA结合离心柱中,并在9,500×g下离心30 秒。根据制造商的指南在色谱柱上纯化RNA,然后在20μL无核酸酶水中洗脱RNA。评估微量分光光度计和/或生物分析仪的质量/数量。
结果
所描述的解离方案每只小鼠产生100,000-120,000个细胞,两个输卵管池化。该方法足够温和,可以保持多纤毛细胞边界完整,从而可以区分多纤毛细胞和分泌细胞,并验证消化方法是否足够温和以防止去分化。图5中的代表性免疫荧光图像显示了步骤4.2.1之后的小细胞团块,在4%多聚甲醛(PFA)/ DPBS中固定3分钟,用1%牛血清白蛋白(BSA)/Tris缓冲盐水补间(BTBST)洗涤并在悬浮液...
讨论
输卵管的三个节段在组织学上,形态学上和功能上是不同的1,2,3。上皮从输卵管的一端到另一端变化很大。纤毛细胞在腓肠/腹肌末端占主导地位,而分泌细胞在峡部区域占主导地位1。虽然这种总体梯度已经被认识到了一段时间,但最近的工作已经发现了输卵管节段之间的更多区别。因此,虽然纤毛细胞在?...
披露声明
作者没有什么可透露的。
致谢
这项工作得到了国防部对AMW突破奖(BCRP W81XWH-14-1-0425)的部分支持。KCR部分得到了校内奖学金的支持:Pease癌症博士预科奖学金和Mary Galvin Burden生物医学科学博士前奖学金以及加州大学河滨分校,校内奖:研究生理事会奖学金委员会论文研究补助金和研究生部论文年度计划奖。作者感谢Gillian M. Wright和Alyssa M. Kumari在这种方法的早期故障排除方面的帮助。
材料
| Name | Company | Catalog Number | Comments |
| 0.5 mm Stainless steel bead mix | Next Advance | SSB05 | Mix 1:1 with 1.4 mm SSB14B, sterilized |
| 1.4 mm Stainless steel bead mix | Next Advance | SSB14B | Mix 1:1 with 0.5 mm SSB05, sterilized |
| 1X Dulbecco's Phosphate Buffered Saline A, pH 7.4 (DPBS) | Gibco | 21600-010 | Cold, sterile |
| 25G needle | BD | 305122 | |
| 60 mm sterile petri dishes | Corning | 430166 | |
| 70 μm cell meshes | Fisherbrand | 22-636-548 | |
| Agilent Eukaryote Total RNA 6000 Pico Chip kit | Agilent 2100 Bioanalyzer | 5067-1513 | |
| Bead Bullet Blender Tissue Homogenizer | Next Advance | BBY24M | |
| Bioanlyzer | Agilent 2100 Bioanalyzer | ||
| Bovine serum albumin | Sigma Aldrich | A7906 | |
| Cold plate/pack/surface of choice | N/A | N/A | Kept at -20C for dissection |
| Dental wax | Polysciences Inc. | 403 | |
| Dulbecco’s Modified Eagle’s Medium (DMEM)/ Ham’s F12 | Corning | 10-090-CV | Prepare dissection medium: DMEM/ Ham’s F12, 10% FBS, 25 mM Hepes, 1% Pen-Strep |
| Fetal Bovine Serum | Corning | 35-015CV | |
| Fine point forceps of choice | N/A | N/A | |
| Glycine | Sigma Aldrich | G712b | Immunocytochemical validation images |
| Goat anti-mouse IgG Alexa Fluor 555 | Invitrogen | A-21422 | Immunocytochemical validation images |
| Goat anti-rabbit IgG Alexa Fluor 488 | Invitrogen | A-11001 | Immunocytochemical validation images |
| Hepes | Sigma Aldrich | H-3784 | |
| Hoescht 33342 | Cell Signaling Technologies | 4082S | Immunocytochemical validation images |
| Inverted compound microscope | Keyence BZ-X700 | ||
| Mouse anti-mouse Occludin | Invitrogen | 33-1500 | Immunocytochemical validation images |
| Non-enzymatic dissociation buffer | N/A | 5 mM EDTA, 1 g/L glucose, 0.4% BSA, 1X DPBS | |
| Nylon macro-mesh 1 mm x 1 mm | Thomas Scientific | 1210U04 | |
| Paraformaldehyde | Sigma Aldrich | P-6148 | Immunocytochemical validation images |
| Pen-Strep | MP Biomedicals | 10220-718 | |
| Prolong Gold Antifade Reagent | Cell Signaling Technologies | 9071S | Immunocytochemical validation images: antifade mounting medium |
| Pronase | Sigma Aldrich | 10165921001 | Prepare pronase digestion medium: 0.15% Pronase in DMEM/Ham's F12, sterile |
| Propidium Iodide | Roche | 11 348 639 001 | Viability validation images |
| Rabbit anti-mouse Acetylated-Tubulin | Abcam | ab179484 | Immunocytochemical validation images |
| RBC lysis buffer | BD Biosciences | 555899 | |
| RNeasy Mini Kit | Qiagen | 74134 | Utilized for on-column purification in text. |
| Spring form microdissection scissors | Roboz Surgical | RS-5610 | |
| Sterile 3 mL bulb pipettors | Globe Scientific | 137135 | |
| Toluidine blue | Alfa Aesar | J66015 | Prepare toluidine blue solution: 1% in 1X DPBS, sterile |
| Tris-Buffered Saline-Tween (TBST) | N/A | N/A | Immunocytochemical validation images; 0.1 N NaCl, 10 mM Tris-Cl pH 7.5, 1% Tween 20 |
| Triton-X-100 | Mallinckrodt Inc. | 3555 | Immunocytochemical validation images |
| Trizol RNA Extraction Reagent | Invitrogen | 15596026 | Referred to as RNA extraction reagent. Nucelase-free water, chloroform and isoproponal are required in supplement of performing Trizol extraction per manufacturer's guidelines |
参考文献
- Stewart, C. A., et al., Kubiak, J. Z., et al. . Mouse oviduct developmemt in Mouse Development: From Oocyte to Stem Cells. , 247-262 (2012).
- Ford, M. J., et al. Oviduct epithelial cells constitute two developmentally distinct lineages that are spatially separated along the distal-proximal axis. Cell Reports. 36 (10), 109677 (2021).
- Harwalkar, K., et al. Anatomical and cellular heterogeneity in the mouse oviduct-its potential roles in reproduction and preimplantation development. Biology of Reproduction. 104 (6), 1249-1261 (2021).
- Agduhr, E. Studies on the structure and development of the bursa ovarica and the tuba uterina in the mouse. Acta Zoologica. 8 (1), 1 (1927).
- Pulkkinen, M. O. Oviductal function is critical for very early human life. Annals of Medicine. 27 (3), 307-310 (1995).
- Kindelberger, D. W., et al. Intraepithelial carcinoma of the fimbria and pelvic serous carcinoma: Evidence for a causal relationship. American Journal of Surgical Pathology. 31 (2), 161-169 (2007).
- Ghosh, A., Syed, S. M., Tanwar, P. S. In vivo genetic cell lineage tracing reveals that oviductal secretory cells self-renew and give rise to ciliated cells. Development. 144 (17), 3031-3041 (2017).
- Lee, Y., et al. A candidate precursor to serous carcinoma that originates in the distal fallopian tube. Journal of Pathology. 211 (1), 26-35 (2007).
- Kim, J., et al. High-grade serous ovarian cancer arises from fallopian tube in a mouse model. Proceedings of the National Academy of Sciences of the United States of America. 109 (10), 3921-3926 (2012).
- Perets, R., et al. Transformation of the fallopian tube secretory epithelium leads to high-grade serous ovarian cancer in Brca;Tp53;Pten models. Cancer Cell. 24 (6), 751-765 (2013).
- Sherman-Baust, C. A., et al. A genetically engineered ovarian cancer mouse model based on fallopian tube transformation mimics human high-grade serous carcinoma development. Journal of Pathology. 233 (3), 228-237 (2014).
- Zhai, Y. L., et al. High-grade serous carcinomas arise in the mouse oviduct via defects linked to the human disease. Journal of Pathology. 243 (1), 16-25 (2017).
- Karthikeyan, S., et al. Prolactin signaling drives tumorigenesis in human high grade serous ovarian cancer cells and in a spontaneous fallopian tube derived model. Cancer Letters. 433, 221-231 (2018).
- Shao, R., et al. Differences in prolactin receptor (PRLR) in mouse and human fallopian tubes: Evidence for multiple regulatory mechanisms controlling PRLR isoform expression in mice. Biology of Reproduction. 79 (4), 748-757 (2008).
- Alwosaibai, K., et al. PAX2 maintains the differentiation of mouse oviductal epithelium and inhibits the transition to a stem cell-like state. Oncotarget. 8 (44), 76881-76897 (2017).
- Peri, L. E., et al. A novel class of interstitial cells in the mouse and monkey female reproductive tracts. Biology of Reproduction. 92 (4), 102 (2015).
- Lõhmussaar, K., et al. Assessing the origin of high-grade serous ovarian cancer using CRISPR-modification of mouse organoids. Nature Communications. 11 (1), 2660 (2020).
- Chen, S., et al. An air-liquid interphase approach for modeling the early embryo-maternal contact zone. Scientific Reports. 7, 42298 (2017).
- Desjardins, P., Conklin, D. NanoDrop microvolume quantitation of nucleic acids. Journal of Visualized Experiments: JoVE. (45), e2565 (2010).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Molecular Biology. 7, 3 (2006).
- McGlade, E. A., et al. Cell-type specific analysis of physiological action of estrogen in mouse oviducts. The FASEB Journal. 35 (5), 21563 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。