Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Microdissection et dissociation de l’oviducte murin : identification de segment individuel et isolement unicellulaire
Dans cet article
Résumé
Une méthode de microdissection de l’oviducte de souris qui permet la collecte des segments individuels tout en maintenant l’intégrité de l’ARN est présentée. En outre, une procédure de dissociation des cellules oviductales non enzymatiques est décrite. Les méthodes sont appropriées pour l’analyse ultérieure des gènes et des protéines des segments oviductaux fonctionnellement différents et des cellules oviductales dissociées.
Résumé
Les systèmes de modèles murins sont inégalés pour l’analyse des processus pathologiques en raison de leur manipulabilité génétique et du faible coût des traitements expérimentaux. Cependant, en raison de leur petite taille corporelle, certaines structures, telles que l’oviducte d’un diamètre de 200 à 400 μm, se sont avérées relativement difficiles à étudier, sauf par immunohistochimie. Récemment, des études immunohistochimiques ont révélé des différences plus complexes dans les segments d’oviductes que ce qui était reconnu auparavant; ainsi, l’oviducte est divisé en quatre segments fonctionnels avec des rapports différents de sept types de cellules épithéliales distinctes. Les différentes origines embryologiques et les ratios des types de cellules épithéliales rendent probablement les quatre régions fonctionnelles différentiellement sensibles à la maladie. Par exemple, les lésions précurseurs des carcinomes intraépithéliaux séreux proviennent de l’infundibulum dans les modèles murins et de la région fimbriale correspondante dans la trompe de Fallope humaine. Le protocole décrit ici détaille une méthode de microdissection pour subdiviser l’oviducte de manière à produire une quantité et une pureté suffisantes d’ARN nécessaires à l’analyse en aval, telles que la TRANSCRIPTION inverse-PCR quantitative (RT-qPCR) et le séquençage de l’ARN (RNAseq). On décrit également une méthode de dissociation tissulaire principalement non enzymatique appropriée pour la cytométrie en flux ou l’analyse RNAseq unicellulaire de cellules oviductales entièrement différenciées. Les méthodes décrites faciliteront la poursuite des recherches utilisant l’oviducte murin dans le domaine de la reproduction, de la fertilité, du cancer et de l’immunologie.
Introduction
L’oviducte murin a une fonction et une morphologie similaires à celles de la trompe de Fallope humaine1. Les deux sont constitués d’un épithélium cilié pseudostratifié, composé de deux cellules résidentes épithéliales décrites historiquement: les cellules ciliées et les cellules sécrétoires1,2. L’oviducte a trois segments classiquement reconnus: l’infundibulum, l’ampoule et l’isthme. Dans une étude récente, Harwalkar et al. 3 a étudié la morphologie des oviductes et l’expression des gènes conduisant à l’expansion de la catégorisation des cellules épithéliales résidentes à sept populations distinctes. En outre, ils ont établi la jonction ampullaire-isthme comme un segment distinct de l’oviducte3. La méthode décrite ici, qui se concentre sur l’infundibulum, l’ampoule et l’isthme, pourrait facilement être étendue pour inclure également la jonction ampullaire-isthmique2,3. La région infundibulaire contient l’ostium, ou ouverture de l’oviducte, et comprend la région fimbriale ainsi que la tige proximale. En se déplaçant vers l’utérus, vient ensuite l’ampoule, puis l’isthme. Les cellules ciliées sont les plus importantes à l’extrémité distale de la région, proximales de l’ovaire ou infundibulum, tandis que les cellules sécrétoires sont plus importantes à l’extrémité proximale ou au segment de l’isthme1. Contrairement à la trompe de Fallope humaine, l’oviducte murin est une structure enroulée soutenue par le mésoalpinx, une extension du large ligament péritoine1,4. De plus, l’oviducte de souris est enfermé dans un sac de bourse qui augmente la probabilité de transfert d’ovocytes dans l’oviducte4. L’ampoule est identifiée comme le lieu de fécondation, à partir duquel les embryons en développement passent dans l’isthme avant d’entrer dans l’utérus5. Les segments tubaires ont un diamètre de 200 à 400 μm et les régions ampullaires et isthmes plus longues mesurent environ 0,5 à 1,0 cm de longueur4. Les distédes d’oviductes pendant le cycle œstral et l’ampoule et l’infundibulum sont plus dissemblables que l’isthme1.
La prolifération excessive des cellules, en particulier des cellules sécrétoires, caractérise les lésions précurseurs des tumeurs séreuses présentes dans la cavité pelvienne6. Ces lésions intraépithéliales séreuses précurseurs apparaissent dans l’épithélium de l’oviducte uniquement dans la région fimbriale; on ne sait pas pourquoi la formation de lésions est limitée à cette région où normalement le type de cellule prédominant est cilié, et non sécrétoire2,7,8. La régionalité en termes de fonction physiologique normale, ainsi que l’intérêt accru pour l’origine oviductale du cancer de l’ovaire9,10,11,12,13, soulignent l’importance d’une évaluation séparée des segments d’oviductes.
La méthode décrite ici détaille la collecte de segments oviductaux distincts pour des analyses ultérieures en aval de l’expression et de la fonction des gènes spécifiques à un segment des cellules dissociées. Traditionnellement, de nombreux tissus sont traités pour l’extraction de l’ARN entier en suivant soit la méthode du phénol: chloroforme ou une méthode d’extraction complète sur colonne; cependant, nous avons constaté que la qualité de l’ARN était maintenue tout en produisant un rendement suffisant avec la méthode de combinaison décrite. En utilisant cette méthode, de très petits segments fonctionnels de l’oviducte peuvent être traités pour des analyses en aval plutôt que d’étudier l’oviducte dans son ensemble, ce qui peut masquer des résultats représentatifs des différents segments14.
Les cellules oviductales murines dissociées ont rarement été étudiées par cytométrie en flux, probablement en raison de la limitation du rendement cellulaire de ce tissu. Une approche pour surmonter ce problème a été de dissocier les cellules, de les cultiver en culture, puis de stimuler la re-différenciation in vitro pour obtenir des nombres de cellules appropriés pour l’analyse cellulaire en aval15,16,17,18. Une limite à cette approche est le temps ex vivo et le microenvironnement altéré en culture, qui modifient probablement l’expression des gènes. On suppose également que la redifférection morphologique a la même signature transcriptionnelle et protéomique que celle présente chez l’animal intact. La méthode de dissociation actuelle a été conçue pour obtenir le plus grand nombre de cellules épithéliales dans une population de cellules oviductales hétérogènes tout en maintenant la différenciation unicellulaire. De plus, l’approche principalement non enzymatique limite probablement la perte de protéines de surface cellulaire.
Protocole
Toutes les manipulations et procédures de manipulation et d’utilisation des animaux ont été approuvées par le comité institutionnel de soins et d’utilisation des animaux de l’Université de Californie à Riverside et étaient conformes aux directives de l’American Association for Laboratory Animal Care, du département de l’Agriculture des États-Unis et des National Institutes of Health. La méthode décrite utilisait des souris femelles adultes C57BL/6. Tous les animaux ont été euthanasiés par décapitation avant la récolte des tissus.
REMARQUE: Un aperçu du protocole, qui utilise un colorant bleu pour aider à la dissection efficace et au débobinage de l’oviducte, est illustré dans la première figure (Figure 1).
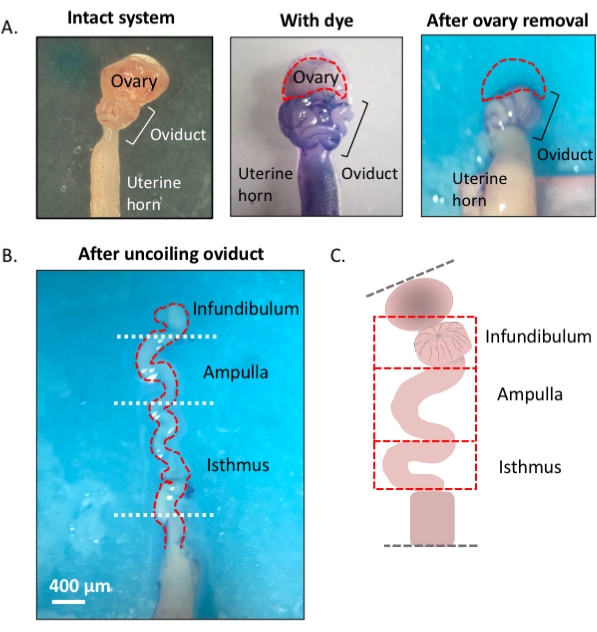
Figure 1 : Vue d’ensemble de la méthode de microdissection. (A) Le panneau de gauche montre la structure intacte d’où la plupart des coussinets adipeux ovariens et des restes de tissu conjonctif entourant l’oviducte ont été retirés. Après cela, l’ajout de bleu de toluidine aide à distinguer les bobines de l’oviducte (panneau du milieu). Le panneau de droite montre les structures après l’ablation de l’ovaire. (B) Un oviducte non enroulé avec des tours internes pour déterminer où chaque segment commence et se termine. (C) Caricature de la segmentation utilisée (non dessinée à l’échelle). Veuillez cliquer ici pour voir une version agrandie de cette figure.
1. Préparation de la surface de dissection
- Apposez un morceau de cire dentaire sur une boîte de Petri avec de l’adhésif et laissez-le sécher (Figure 2A). Désinfectez le plat avec 70% d’éthanol. La surface est prête pour la dissection.
2. Macrodissection de l’ovaire, de l’oviducte et de l’utérus
- Immobiliser la boîte de Petri contenant la cire dentaire sur une plate-forme froide de votre choix (p. ex., un sac de glace maintenu à -20 °C avant utilisation) sous un microscope à dissection lorsqu’elle est prête à être dissection (figure 2A).
- Désinfectez la surface ventrale de l’animal avec de l’éthanol à 70%. Ouvrez la cavité abdominale et pelvienne avec des ciseaux de dissection stériles et déplacez le tractus gastro-intestinal d’un côté pour localiser l’utérus bihornal dorsal. Suivez chaque corne utérine rostralement pour localiser chaque oviducte et ovaire enveloppé dans le coussinet adipeux utérin, situé juste en dessous du rein (Figure 2B, C).
- Excisez les deux oviductes latéraux avec les ovaires et une partie de la corne utérine distale encore attachée à l’aide de ciseaux à dissection. Couper chaque corne utérine latérale avec environ 1 à 2 cm de la corne encore attachée à l’oviducte enroulé et à l’ovaire (figure 2D). Immergez immédiatement le tissu dans 2 mL de milieu de dissection à froid (voir Tableau des matériaux).
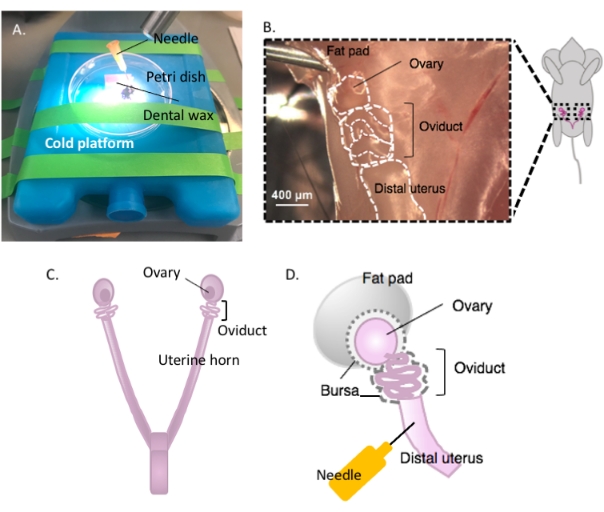
Figure 2 : Macrodissection de l’ovaire et configuration de la dissection. L’oviducte est situé dorsalement dans la cavité pelvienne à la base du rein dans le coussinet adipeux ovarien (B). Localisez la bifurcation utérine dans la cavité pelvienne (C) et suivez la corne utérine latérale pour localiser le continuum utérus-oviducte-ovaire (B). Enlevez ces structures en coupant à travers une corne utérine et une dissection grossière. Placer sur la plate-forme de dissection (A) et apposer la partie utérine sur la cire dentaire avec une aiguille (A et D). Veuillez cliquer ici pour voir une version agrandie de cette figure.
REMARQUE: Laissez suffisamment de corne utérine intacte et attachée à l’oviducte pour permettre l’apposition sur la plate-forme de dissection (Figure 2D).
- Apposez le tissu utérin à la cire dentaire à l’aide d’une aiguille stérile de 25 G pour fixer le tissu en vue de la dissection (figure 2A, D et figure 3A). En travaillant au microscope à dissection, nettoyez et disséquez le coussinet adipeux ovarien et le tissu conjonctif pour permettre une visualisation claire de l’oviducte (Figure 3B).

Figure 3 : Microdissection d’oviductes étape par étape. Après l’élimination des restes de graisse et de tissu conjonctif (A, B), ajoutez du bleu de toluidine au tissu (C), puis lavez-les pour faciliter la visualisation et le retrait ultérieur de l’ovaire et le débobinage du tube (D-H). L’infundibulum se trouve à côté de l’isthme proximal et de la jonction utérine-tubaire (UTJ). Tirez légèrement l’extrémité distale tout en coupant au mésoalpinx pour dérouler et révéler les tours endogènes de l’oviducte (H) pour s’orienter pour une segmentation appropriée. Figure Barre d’échelle A-C = 500 μm, barre d’échelle D-H = 400 μm (I) Dessin animé des différents segments (non dessiné à l’échelle). Veuillez cliquer ici pour voir une version agrandie de cette figure.
- À l’aide d’une seringue de 1 mL, distribuer et incuber l’oviducte fixé à l’utérus dans 1-2 gouttes de solution stérile de colorant bleu de toluidine à 1% pendant 30 s-1 min. Rincer à froid la solution saline tamponnée au phosphate (DPBS) de Dulbecco et retirer tout le liquide (Figure 3C).
- Tirez légèrement l’ovaire de l’oviducte enroulé et coupez la membrane de la bourse et le ligament large pour retirer l’ovaire de l’oviducte sans compromettre le tissu tubaire (Figure 3D, E).
REMARQUE: L’ovaire n’est pas attaché à l’oviducte mais enfermé dans la membrane de la bourse avec l’oviducte (Figure 2D) et relié au côté latéral de l’utérus par le ligament large.
3. Microdissection et segmentation de l’oviducte
- Localisez l’extrémité distale et fimbriale de l’oviducte située latéralement à la jonction utérine-tubaire (UTJ). L’oviducte s’enroule sur lui-même; par conséquent, l’extrémité fimbriale peut être située latéralement à l’extrémité proximale et constitue un point de départ approprié pour s’orienter pour le débobinage de l’oviducte (figure 3F,I).
- Tout en tirant doucement le tube, coupez le mésosalpinx (Figure 3I) avec des micro-ciseaux à ressort pour dérouler l’oviducte (Figure 3G).
- Une fois déroulé, coupez le tube pour produire les régions infundibulaires, ampullaires et isthmiques (Figure 3H).
- Après excision de l’infundibulum (extrémité fimbriale et tige proximale), exciser la région ampullaire en coupant après le deuxième tour proéminent du tube (coupé entre les tours deux et trois, d’environ 1 cm de longueur). Enfin, coupez la partie restante dans l’UTJ, qui est la région isthmique (Figure 3H).
REMARQUE: L’oviducte ne se déroulera pas complètement dans une structure droite. Le tube maintiendra ses virages (Figure 3H)3. Sur la base des virages suivant la région ampullaire, on peut segmenter davantage le tube restant dans la jonction ampullaire-isthmique et l’isthme3. Après l’excision de l’ampoule, couper entre les virages cinq et six pour obtenir la jonction ampullaire-isthmique; le tube restant (virage six jusqu’au début de l’UTJ) est l’isthme3.
- Après excision de l’infundibulum (extrémité fimbriale et tige proximale), exciser la région ampullaire en coupant après le deuxième tour proéminent du tube (coupé entre les tours deux et trois, d’environ 1 cm de longueur). Enfin, coupez la partie restante dans l’UTJ, qui est la région isthmique (Figure 3H).
- Enclencher immédiatement les segments de tissu disséqués par congélation dans l’azote liquide pour l’isolement de l’ARN ou fixer et traiter chaque segment pour l’intégration orientée et l’analyse immunohistologique.
- Ajouter 200 μL de réactif d’extraction d’ARN à froid et un mélange de billes d’homogénéisation 1:1 (voir tableau des matériaux) au tissu si vous procédez à l’extraction d’ARN (voir l’étape 5.1).
4. Dissociation des oviductes
- Suite de l’étape 3.1.1 ci-dessus) Pour une dissociation optimale de l’épithélium, ouvrir l’oviducte dans les zones où cela est possible (c.-à-d. infundibulum et ampoule) pour exposer l’épithélium luminal (figure 4A).

Figure 4 : Dissociation des cellules d’oviducte, partie 1. Dessin animé montrant comment exposer l’épithélium distal pour une dissociation cellulaire optimale (A) et une image montrant la façon la plus simple d’utiliser le maillage de 1 mm2 (B). Veuillez cliquer ici pour voir une version agrandie de cette figure.
- En commençant par la région fimbriale, en utilisant des pinces comme levier, fendez le tube longitudinalement avec des ciseaux en forme de ressort.
- Hacher les parties fendues et l’oviducte restant en segments (~1-2 mm) et ajouter 5 mL de tampon de dissociation chaud et non enzymatique (voir tableau des matériaux) et incuber à 37 °C.
- Ressuspendez les morceaux de tissu et les cellules dissociées avec un pipetteur à bulbe toutes les 3 minutes pendant 9 à 10 minutes. Diluer le tampon de dissociation 1:1 avec un milieu de dissection à froid.
- Prélever les cellules par centrifugation (350 x g, 3 min, 4 °C). Remettre les cellules en suspension dans 2 mL de tampon de lyse RBC pendant 2 min à température ambiante, puis diluer 1:1 avec un milieu de dissection à froid.
- Prélever les cellules par centrifugation (350 x g, 3 min, 4 °C) et remettre en suspension dans 5 mL de solution de pronase froide.
- Incuber dans un milieu de digestion de la pronase et remettre en suspension les amas cellulaires avec un pipetteur à bulbe toutes les 3-5 minutes jusqu’à ce qu’une suspension à une seule cellule soit obtenue (~ 25-30 min).
REMARQUE: Cette étape est mieux effectuée dans une plaque de culture tissulaire ou une fiole pour permettre une observation constante empêchant une surexposition inutile à la pronase.
- Incuber dans un milieu de digestion de la pronase et remettre en suspension les amas cellulaires avec un pipetteur à bulbe toutes les 3-5 minutes jusqu’à ce qu’une suspension à une seule cellule soit obtenue (~ 25-30 min).
- Passer les cellules à travers un macro-maillage stérile (maille de 1 mm x 1 mm fixée à un tube conique avec un élastique (figure 4B)) pour enlever les morceaux de tissu non dissociés restants. Prélever les cellules par centrifugation (350 x g, 3 min, 4 °C) et les remettre en suspension dans un milieu froid approprié pour l’analyse en aval (p. ex., tampon FACS si l’on procède à la coloration pour la cytométrie en flux).
5. Extraction de l’ARN des segments oviductaux
- Homogénéiser des échantillons congelés instantanément dans 200 μL de réactif d’extraction d’ARN dans un homogénéisateur de tissu mélangeur de billes au niveau 12 pendant deux intervalles (3 min chacun) à 4 °C à l’aide du mélange de billes en acier inoxydable.
REMARQUE: Pour préserver l’intégrité de l’ARN, les échantillons doivent être immédiatement déplacés de l’état surgelé dans le réactif d’extraction de l’ARN et non pesés. - Centrifuger brièvement l’homogénat à 100-200 x g dans une centrifugeuse de table pendant environ 5 s à température ambiante pour séparer le liquide des billes. Transférer le surnageant dans un tube frais.
- Ajouter 200 μL supplémentaires de réactif d’extraction d’ARN aux billes pour récupérer plus d’échantillons, suivi d’une centrifugation (100-200 x g, 5 s, température ambiante). Combinez les surnageants.
REMARQUE: Utilisez une petite pointe de pipette (la plupart des embouts p200 conviennent) pour éviter le transfert de billes lors du retrait du surnageant. - Suivez les directives du fabricant pour séparer et précipiter l’ARN. Des échantillons représentatifs ont été précipités pendant la nuit à -20 °C avec 100 % d’isopropanol (environ 2:1 volume, isopropanol : phase aqueuse récupérée).
- Transférer le précipité d’ARN complet avec la solution dans une colonne de spin de liaison à l’ARN et centrifuger pendant 30 s à 9 500 x g. Purifier l’ARN sur colonne conformément aux directives du fabricant, puis éluer l’ARN dans 20 μL d’eau sans nucléase. Évaluer la qualité/quantité sur un spectrophotomètre à microvolume et/ou un bioanalyseur.
Résultats
Le protocole de dissociation décrit donne 100 000 à 120 000 cellules par souris avec mise en commun des deux oviductes. La méthode est suffisamment douce pour laisser intactes les bordures cellulaires multi-ciliées, permettant une distinction entre les cellules multi-ciliées et les cellules sécrétoires, et vérifiant que la méthode de digestion est suffisamment douce pour empêcher la dédifférenciation. Les images représentatives de l’immunofluorescence de la figure 5 montrent d...
Discussion
Les trois segments de l’oviducte sont histologiquement, morphologiquement et fonctionnellement distincts1,2,3. L’épithélium varie considérablement d’une extrémité de l’oviducte à l’autre. Les cellules ciliées dominent à l’extrémité fimbriale/infundibulaire, tandis que les cellules sécrétoires dominent dans la région isthmique1. Bien que ce gradient global soit reconnu depuis un ce...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu en partie par un DoD Breakthrough Award à AMW (BCRP W81XWH-14-1-0425). KCR a été partiellement soutenu par des bourses intra-muros: la bourse pré-doctorale Pease Cancer et la bourse pré-doctorale Mary Galvin Burden en sciences biomédicales et à l’Université de Californie, Riverside, des prix intra-muros: la subvention de recherche de thèse du Comité des bourses du Graduate Council et le prix du programme de l’année de thèse de la division des études supérieures. Les auteurs remercient Gillian M. Wright et Alyssa M. Kumari pour leur aide dans le dépannage précoce de cette méthode.
matériels
| Name | Company | Catalog Number | Comments |
| 0.5 mm Stainless steel bead mix | Next Advance | SSB05 | Mix 1:1 with 1.4 mm SSB14B, sterilized |
| 1.4 mm Stainless steel bead mix | Next Advance | SSB14B | Mix 1:1 with 0.5 mm SSB05, sterilized |
| 1X Dulbecco's Phosphate Buffered Saline A, pH 7.4 (DPBS) | Gibco | 21600-010 | Cold, sterile |
| 25G needle | BD | 305122 | |
| 60 mm sterile petri dishes | Corning | 430166 | |
| 70 μm cell meshes | Fisherbrand | 22-636-548 | |
| Agilent Eukaryote Total RNA 6000 Pico Chip kit | Agilent 2100 Bioanalyzer | 5067-1513 | |
| Bead Bullet Blender Tissue Homogenizer | Next Advance | BBY24M | |
| Bioanlyzer | Agilent 2100 Bioanalyzer | ||
| Bovine serum albumin | Sigma Aldrich | A7906 | |
| Cold plate/pack/surface of choice | N/A | N/A | Kept at -20C for dissection |
| Dental wax | Polysciences Inc. | 403 | |
| Dulbecco’s Modified Eagle’s Medium (DMEM)/ Ham’s F12 | Corning | 10-090-CV | Prepare dissection medium: DMEM/ Ham’s F12, 10% FBS, 25 mM Hepes, 1% Pen-Strep |
| Fetal Bovine Serum | Corning | 35-015CV | |
| Fine point forceps of choice | N/A | N/A | |
| Glycine | Sigma Aldrich | G712b | Immunocytochemical validation images |
| Goat anti-mouse IgG Alexa Fluor 555 | Invitrogen | A-21422 | Immunocytochemical validation images |
| Goat anti-rabbit IgG Alexa Fluor 488 | Invitrogen | A-11001 | Immunocytochemical validation images |
| Hepes | Sigma Aldrich | H-3784 | |
| Hoescht 33342 | Cell Signaling Technologies | 4082S | Immunocytochemical validation images |
| Inverted compound microscope | Keyence BZ-X700 | ||
| Mouse anti-mouse Occludin | Invitrogen | 33-1500 | Immunocytochemical validation images |
| Non-enzymatic dissociation buffer | N/A | 5 mM EDTA, 1 g/L glucose, 0.4% BSA, 1X DPBS | |
| Nylon macro-mesh 1 mm x 1 mm | Thomas Scientific | 1210U04 | |
| Paraformaldehyde | Sigma Aldrich | P-6148 | Immunocytochemical validation images |
| Pen-Strep | MP Biomedicals | 10220-718 | |
| Prolong Gold Antifade Reagent | Cell Signaling Technologies | 9071S | Immunocytochemical validation images: antifade mounting medium |
| Pronase | Sigma Aldrich | 10165921001 | Prepare pronase digestion medium: 0.15% Pronase in DMEM/Ham's F12, sterile |
| Propidium Iodide | Roche | 11 348 639 001 | Viability validation images |
| Rabbit anti-mouse Acetylated-Tubulin | Abcam | ab179484 | Immunocytochemical validation images |
| RBC lysis buffer | BD Biosciences | 555899 | |
| RNeasy Mini Kit | Qiagen | 74134 | Utilized for on-column purification in text. |
| Spring form microdissection scissors | Roboz Surgical | RS-5610 | |
| Sterile 3 mL bulb pipettors | Globe Scientific | 137135 | |
| Toluidine blue | Alfa Aesar | J66015 | Prepare toluidine blue solution: 1% in 1X DPBS, sterile |
| Tris-Buffered Saline-Tween (TBST) | N/A | N/A | Immunocytochemical validation images; 0.1 N NaCl, 10 mM Tris-Cl pH 7.5, 1% Tween 20 |
| Triton-X-100 | Mallinckrodt Inc. | 3555 | Immunocytochemical validation images |
| Trizol RNA Extraction Reagent | Invitrogen | 15596026 | Referred to as RNA extraction reagent. Nucelase-free water, chloroform and isoproponal are required in supplement of performing Trizol extraction per manufacturer's guidelines |
Références
- Stewart, C. A., et al., Kubiak, J. Z., et al. . Mouse oviduct developmemt in Mouse Development: From Oocyte to Stem Cells. , 247-262 (2012).
- Ford, M. J., et al. Oviduct epithelial cells constitute two developmentally distinct lineages that are spatially separated along the distal-proximal axis. Cell Reports. 36 (10), 109677 (2021).
- Harwalkar, K., et al. Anatomical and cellular heterogeneity in the mouse oviduct-its potential roles in reproduction and preimplantation development. Biology of Reproduction. 104 (6), 1249-1261 (2021).
- Agduhr, E. Studies on the structure and development of the bursa ovarica and the tuba uterina in the mouse. Acta Zoologica. 8 (1), 1 (1927).
- Pulkkinen, M. O. Oviductal function is critical for very early human life. Annals of Medicine. 27 (3), 307-310 (1995).
- Kindelberger, D. W., et al. Intraepithelial carcinoma of the fimbria and pelvic serous carcinoma: Evidence for a causal relationship. American Journal of Surgical Pathology. 31 (2), 161-169 (2007).
- Ghosh, A., Syed, S. M., Tanwar, P. S. In vivo genetic cell lineage tracing reveals that oviductal secretory cells self-renew and give rise to ciliated cells. Development. 144 (17), 3031-3041 (2017).
- Lee, Y., et al. A candidate precursor to serous carcinoma that originates in the distal fallopian tube. Journal of Pathology. 211 (1), 26-35 (2007).
- Kim, J., et al. High-grade serous ovarian cancer arises from fallopian tube in a mouse model. Proceedings of the National Academy of Sciences of the United States of America. 109 (10), 3921-3926 (2012).
- Perets, R., et al. Transformation of the fallopian tube secretory epithelium leads to high-grade serous ovarian cancer in Brca;Tp53;Pten models. Cancer Cell. 24 (6), 751-765 (2013).
- Sherman-Baust, C. A., et al. A genetically engineered ovarian cancer mouse model based on fallopian tube transformation mimics human high-grade serous carcinoma development. Journal of Pathology. 233 (3), 228-237 (2014).
- Zhai, Y. L., et al. High-grade serous carcinomas arise in the mouse oviduct via defects linked to the human disease. Journal of Pathology. 243 (1), 16-25 (2017).
- Karthikeyan, S., et al. Prolactin signaling drives tumorigenesis in human high grade serous ovarian cancer cells and in a spontaneous fallopian tube derived model. Cancer Letters. 433, 221-231 (2018).
- Shao, R., et al. Differences in prolactin receptor (PRLR) in mouse and human fallopian tubes: Evidence for multiple regulatory mechanisms controlling PRLR isoform expression in mice. Biology of Reproduction. 79 (4), 748-757 (2008).
- Alwosaibai, K., et al. PAX2 maintains the differentiation of mouse oviductal epithelium and inhibits the transition to a stem cell-like state. Oncotarget. 8 (44), 76881-76897 (2017).
- Peri, L. E., et al. A novel class of interstitial cells in the mouse and monkey female reproductive tracts. Biology of Reproduction. 92 (4), 102 (2015).
- Lõhmussaar, K., et al. Assessing the origin of high-grade serous ovarian cancer using CRISPR-modification of mouse organoids. Nature Communications. 11 (1), 2660 (2020).
- Chen, S., et al. An air-liquid interphase approach for modeling the early embryo-maternal contact zone. Scientific Reports. 7, 42298 (2017).
- Desjardins, P., Conklin, D. NanoDrop microvolume quantitation of nucleic acids. Journal of Visualized Experiments: JoVE. (45), e2565 (2010).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Molecular Biology. 7, 3 (2006).
- McGlade, E. A., et al. Cell-type specific analysis of physiological action of estrogen in mouse oviducts. The FASEB Journal. 35 (5), 21563 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon