Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mikrodissektion und Dissoziation des Murinen Eileiters: Identifizierung einzelner Segmente und Einzelzellisolierung
In diesem Artikel
Zusammenfassung
Eine Methode zur Mikrodissektion des Eileiters der Maus, die die Sammlung der einzelnen Segmente unter Beibehaltung der RNA-Integrität ermöglicht, wird vorgestellt. Darüber hinaus wird ein nicht-enzymatisches oviduktales Zelldissoziationsverfahren beschrieben. Die Methoden eignen sich für die anschließende Gen- und Proteinanalyse der funktionell unterschiedlichen Eileitersegmente und dissoziierten Eileiterzellen.
Zusammenfassung
Mausmodellsysteme sind aufgrund ihrer genetischen Manipulierbarkeit und der geringen Kosten experimenteller Behandlungen unübertroffen für die Analyse von Krankheitsprozessen. Aufgrund ihrer geringen Körpergröße haben sich jedoch einige Strukturen, wie der Eileiter mit einem Durchmesser von 200-400 μm, als relativ schwierig erwiesen, außer immunhistochemisch zu untersuchen. In jüngster Zeit haben immunhistochemische Studien komplexere Unterschiede in den Eileitersegmenten aufgedeckt als bisher angenommen; So wird der Eileiter in vier funktionelle Segmente mit unterschiedlichen Verhältnissen von sieben verschiedenen Epithelzelltypen unterteilt. Die unterschiedlichen embryologischen Ursprünge und Verhältnisse der epithelialen Zelltypen machen die vier funktionellen Regionen wahrscheinlich unterschiedlich anfällig für Krankheiten. Zum Beispiel entstehen Vorläuferläsionen zu serösen intraepithelialen Karzinomen aus dem Infundibulum in Mausmodellen und aus der entsprechenden Fimbrialregion im menschlichen Eileiter. Das hier beschriebene Protokoll beschreibt eine Methode zur Mikrodissektion, um den Eileiter so zu unterteilen, dass eine ausreichende Menge und Reinheit der RNA entsteht, die für die nachgeschaltete Analyse wie die reverse transkriptionsquantitative PCR (RT-qPCR) und die RNA-Sequenzierung (RNAseq) erforderlich ist. Ebenfalls beschrieben ist eine meist nicht-enzymatische Gewebedissoziationsmethode, die für die Durchflusszytometrie oder die Einzelzell-RNAseq-Analyse von vollständig differenzierten Eileiterzellen geeignet ist. Die beschriebenen Methoden werden die weitere Forschung unter Verwendung des moinen Eileiters auf dem Gebiet der Fortpflanzung, Fruchtbarkeit, Krebs und Immunologie erleichtern.
Einleitung
Der eiförmige Eileiter ähnelt in Funktion und Morphologie dem menschlichen Eileiter1. Beide bestehen aus einem pseudostratifizierten Flimmerepithel, das aus zwei historisch beschriebenen epithelialen Residentzellen besteht: Flimmerzellen und sekretorischen Zellen1,2. Das Eileiter hat drei klassisch anerkannte Segmente: das Infundibulum, die Ampulle und den Isthmus. In einer aktuellen Studie haben Harwalkar et al. 3 untersuchte die Eileitermorphologie und Genexpression, was zur Erweiterung der Kategorisierung von residenten Epithelzellen auf sieben verschiedene Populationen führte. Darüber hinaus etablierten sie die Ampullar-Isthmus-Verbindung als eigenständiges Segment des Eileiters3. Das hierin beschriebene Verfahren, das sich auf das Infundibulum, die Ampulle und den Isthmus konzentriert, könnte leicht erweitert werden, um auch die ampullär-isthmische Verbindung einzubeziehen2,3. Die infundibuläre Region enthält das Ostium oder die Öffnung des Eileiters und umfasst die Fimbriumregion sowie den proximalen Stiel. Wenn Sie sich in Richtung Gebärmutter bewegen, ist als nächstes die Ampulle und dann der Isthmus. Bewimmerte Zellen sind am prominentesten im distalen Ende der Region, proximal zum Eierstock oder infundibulum, während sekretorische Zellen am prominentesten im proximalen Ende oder Isthmussegment sind1. Im Gegensatz zum menschlichen Eileiter ist der eiförmige Eileiter eine gewundene Struktur, die von der Mesosalpinx, einer Erweiterung des breiten Ligamentiotoneums, getragen wird1,4. Darüber hinaus ist das Eileiter der Maus in einem Bursalsack eingeschlossen, der die Wahrscheinlichkeit eines Eizelltransfers in das Eileiter4 erhöht. Die Ampulle wird als Ort der Befruchtung identifiziert, von dem aus sich entwickelnde Embryonen in den Isthmus gelangen, bevor sie in die Gebärmutter gelangen5. Tubensegmente haben einen Durchmesser von 200-400 μm und die längeren Ampull- und Isthmusregionen sind etwa 0,5-1,0 cm lang4. Die Eileiterdehnungen während des Östruszyklus und die Ampulle und das Infundibulum sind dehnungsfähiger als der Isthmus1.
Überproliferation von Zellen, insbesondere sekretorischen Zellen, charakterisieren Vorläuferläsionen zu serösen Tumoren in der Beckenhöhle6. Diese serösen intraepithelialen Läsionen entstehen im Eileiterepithel ausschließlich in der Fimbrienregion; Es ist nicht bekannt, warum die Läsionsbildung auf diese Region beschränkt ist, in der normalerweise der vorherrschende Zelltyp bewimpert und nicht sekretorisch ist2,7,8. Die Regionalität in Bezug auf die normale physiologische Funktion sowie das erhöhte Interesse am eiduktalen Ursprung von Eierstockkrebs9,10,11,12,13 unterstreichen die Bedeutung einer separaten Bewertung der Eileitersegmente.
Die hier beschriebene Methode beschreibt die Erfassung separater Eileitersegmente für nachfolgende nachgeschaltete Analysen der segmentspezifischen Genexpression und Funktion dissoziierter Zellen. Traditionell werden viele Gewebe für die Extraktion ganzer RNA entweder nach der Phenol: Chloroform-Methode oder einer vollständigen Extraktionsmethode auf der Säule verarbeitet. Wir fanden jedoch heraus, dass die RNA-Qualität erhalten blieb, während mit der beschriebenen Kombinationsmethode eine ausreichende Ausbeute erzielt wurde. Mit dieser Methode können sehr kleine funktionelle Segmente des Eileiters für nachgeschaltete Analysen verarbeitet werden, anstatt den Eileiter als Ganzes zu untersuchen, was die für die verschiedenen Segmente repräsentativen Ergebnisse maskieren kann14.
Dissoziierte murine Eileiterzellen wurden selten durch Durchflusszytometrie untersucht, höchstwahrscheinlich aufgrund der begrenzenden Zellausbeute aus diesem Gewebe. Ein Ansatz zur Überwindung dieses Problems bestand darin, Zellen zu dissoziieren, sie in Kultur zu züchten und dann die Redifferenzierung in vitro zu stimulieren, um geeignete Zellzahlen für die nachgeschaltete Zellanalyse zu erhalten15,16,17,18. Eine Einschränkung dieses Ansatzes ist die Zeit ex vivo und die veränderte Mikroumgebung in Kultur, die beide wahrscheinlich die Genexpression verändern. Es wird auch angenommen, dass die morphologische Redifferenzierung die gleiche transkriptionelle und proteomische Signatur aufweist wie das intakte Tier. Die derzeitige Dissoziationsmethode wurde entwickelt, um die höchste Anzahl von Epithelzellen in einer heterogenen eiduktalen Zellpopulation zu erreichen und gleichzeitig die Differenzierung einzelner Zellen beizubehalten. Darüber hinaus begrenzt der meist nicht-enzymatische Ansatz wahrscheinlich den Verlust von Zelloberflächenproteinen.
Protokoll
Alle Tierhandhabungen und -verfahren wurden vom institutionellen Tierpflege- und Verwendungsausschuss der University of California, Riverside, genehmigt und entsprachen den Richtlinien der American Association for Laboratory Animal Care, des Landwirtschaftsministeriums der Vereinigten Staaten und der National Institutes of Health. Die beschriebene Methode verwendete C57BL/6 erwachsene, weibliche Mäuse. Alle Tiere wurden vor der Gewebeentnahme durch Enthauptung eingeschläfert.
HINWEIS: Eine Übersicht über das Protokoll, das einen blauen Farbstoff verwendet, um das effiziente Dissezieren und Abwickeln des Eileiters zu unterstützen, ist in der ersten Abbildung dargestellt (Abbildung 1).
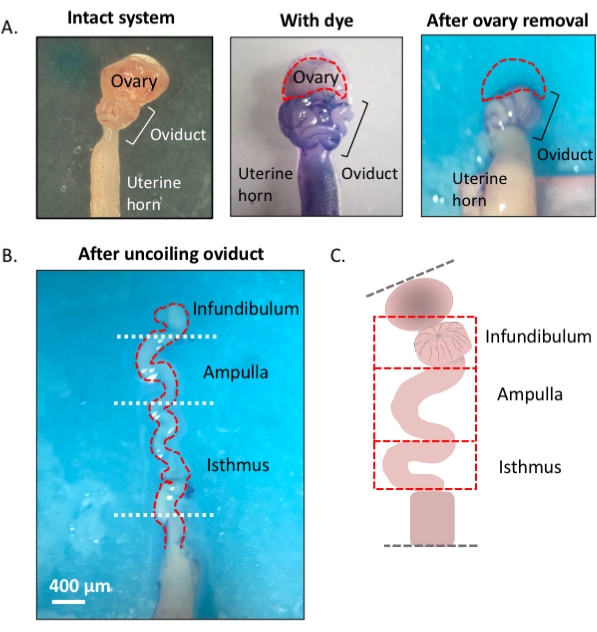
Abbildung 1: Überblick über die Mikrodissektionsmethode. (A) Das linke Feld zeigt die intakte Struktur, aus der der größte Teil des ovariellen Fettpolsters und die Reste des Bindegewebes, die den Eileiter umgeben, entfernt wurden. Danach hilft die Zugabe von Toluidinblau, die Spulen des Eileiters (mittlere Platte) zu unterscheiden. Das rechte Feld zeigt Strukturen nach der Entfernung des Eierstocks. (B) Ein abgewickelter Eileiter mit internen Drehungen zur Bestimmung, wo jedes Segment beginnt und endet. (C) Karikatur der verwendeten Segmentierung (nicht maßstabsgetreu gezeichnet). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
1. Vorbereitung der Dissektionsfläche
- Kleben Sie ein Stück Zahnwachs mit Klebstoff auf eine Petrischale und lassen Sie es trocknen (Abbildung 2A). Desinfizieren Sie das Gericht mit 70% Ethanol. Die Oberfläche ist bereit für die Dissektion.
2. Makrodissektion des Eierstocks, des Eileiters und der Gebärmutter
- Immobilisieren Sie die Petrischale mit dem Dentalwachs auf einer kalten Plattform Ihrer Wahl (z. B. einem Eisbeutel, der vor der Verwendung bei -20 °C aufbewahrt wurde) unter einem Dissektionsmikroskop, wenn Sie zur Dissektion bereit sind (Abbildung 2A).
- Desinfizieren Sie die ventrale Oberfläche des Tieres mit 70% Ethanol. Öffnen Sie die Bauch- und Beckenhöhle mit einer sterilen Dissektionsschere und bewegen Sie den Magen-Darm-Trakt zur Seite, um die dorsale bihornale Gebärmutter zu lokalisieren. Folgen Sie jedem Uterushorn rostrally, um jeden Eileiter und Eierstock zu lokalisieren, der in das Uterusfettpolster eingehüllt ist, das sich direkt unter der Niere befindet (Abbildung 2B, C).
- Schneiden Sie beide lateralen Eileiter mit den Eierstöcken und einem Teil des distalen Uterushorns aus, der noch mit einer Dissektionsschere befestigt ist. Schneiden Sie jedes laterale Uterushorn mit etwa 1-2 cm des Horns ab, das noch am gewundenen Eileiter und Eierstock befestigt ist (Abbildung 2D). Tauchen Sie das Gewebe sofort in 2 ml kaltes Dissektionsmedium (siehe Materialtabelle).
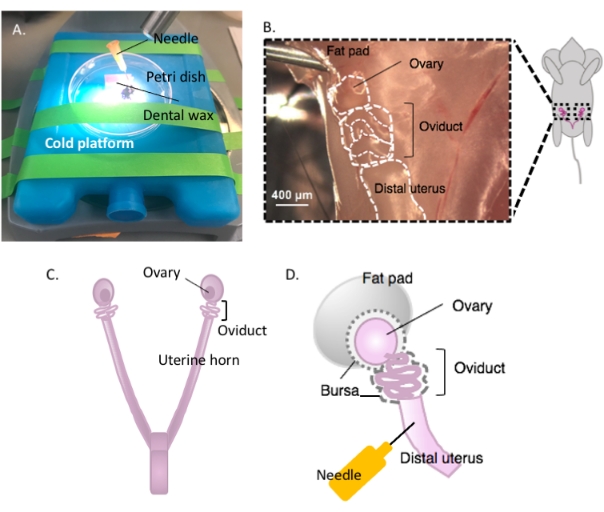
Abbildung 2: Makrodissektion des Eierstocks und der Dissektionsaufbau. Der Eileiter befindet sich dorsal in der Beckenhöhle an der Basis der Niere innerhalb des Eierstockfettpolsters (B). Lokalisieren Sie die Uterusbifurkation in der Beckenhöhle (C) und folgen Sie dem lateralen Uterushorn, um das Uterus-Eileiter-Ovarial-Kontinuum (B) zu lokalisieren. Entfernen Sie diese Strukturen, indem Sie ein Uterushorn durchschneiden und grob sezieren. Auf die Sezierplattform (A) legen und den Uterusanteil mit einer Nadel (A und D) auf Zahnwachs befestigen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
HINWEIS: Lassen Sie genügend Uterushorn intakt und am Eileiter befestigt, um eine Befestigung an der Sezierplattform zu ermöglichen (Abbildung 2D).
- Befestigen Sie das Gebärmuttergewebe mit einer sterilen 25 G Nadel auf dem Zahnwachs, um das Gewebe für die Dissektion zu sichern (Abbildung 2A, D und Abbildung 3A). Reinigen und sezieren Sie unter dem Seziermikroskop das Eierstockfettpolster und das Bindegewebe, um eine klare Visualisierung des Eileiters zu ermöglichen (Abbildung 3B).

Abbildung 3: Schritt für Schritt Eileiter-Mikrodissektion. Nach der Entfernung von Restfett und Bindegewebe (A, B) toluidinblau in das Gewebe (C) geben und dann wegwaschen, um die Visualisierung und anschließende Entfernung des Eierstocks und das Abwickeln der Röhre (D-H) zu erleichtern. Das Infundibulum befindet sich neben dem proximalen Isthmus und der Uterus-Tubal-Verbindung (UTJ). Ziehen Sie das distale Ende leicht, während Sie an der Mesosalpinx schneiden, um die endogenen Windungen des Eileiters (H) abzuwickeln und zu enthüllen, um sich für eine geeignete Segmentierung zu orientieren. Abbildung A-C Maßstabsbalken = 500 μm, D-H Maßstabsbalken = 400 μm (I) Karikatur der verschiedenen Segmente (nicht maßstabsgetreu gezeichnet). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Mit einer 1-ml-Spritze das an der Gebärmutter befestigte Eileiter in 1-2 Tropfen steriler 1% iger toluidinblauer Farbstofflösung für 30 s-1 min dosieren und inkubieren. Mit kalter phosphatgepufferter Kochsalzlösung (DPBS) von Dulbecco abspülen und die gesamte Flüssigkeit entfernen (Abbildung 3C).
- Ziehen Sie den Eierstock leicht aus dem gewundenen Eileiter und schneiden Sie ihn an der Schleimbeutelmembran und dem breiten Band ab, um den Eierstock aus dem Eileiter zu entfernen, ohne das Eileitergewebe zu beeinträchtigen (Abbildung 3D, E).
HINWEIS: Der Eierstock ist nicht am Eileiter befestigt, sondern mit dem Eileiter in der Bursalmembran eingeschlossen (Abbildung 2D) und über das breite Band mit der lateralen Seite des Uterus verbunden.
3. Mikrodissektion und Segmentierung des Eileiters
- Lokalisieren Sie das distale, fimbriale Ende des Eileiters, das lateral zum Uterus-Tubal-Übergang (UTJ) gefunden wird. Die Eileiterspulen spulen sich wieder auf sich selbst; daher kann das fimbriale Ende lateral zum proximalen Ende liegen und ist ein geeigneter Ausgangspunkt für die Orientierung beim Abwickeln des Eileiters (Abbildung 3F,I).
- Während Sie das Röhrchen vorsichtig ziehen, schneiden Sie es an der Mesosalpinx (Abbildung 3I) mit einer federförmigen Mikroschere weg, um den Eileiter abzuwickeln (Abbildung 3G).
- Nach dem Abwickeln schneiden Sie die Röhre ab, um die infundibulären, ampullären und isthmischen Regionen zu erzeugen (Abbildung 3H).
- Nach der Exzision des Infundibulums (Fimbrialende und proximaler Stiel) schneiden Sie die ampulläre Region heraus, indem Sie nach der zweiten prominenten Drehung der Röhre schneiden (schnitt zwischen den Kurven zwei und drei, ungefähr 1 cm lang). Schneiden Sie schließlich den verbleibenden Teil auf den UTJ ab, der die isthmische Region ist (Abbildung 3H).
HINWEIS: Der Eileiter wird sich nicht vollständig zu einer geraden Struktur abwickeln. Das Rohr behält seine Windungen bei (Abbildung 3H)3. Basierend auf den nachfolgenden Windungen, die der ampullären Region folgen, kann man das verbleibende Rohr weiter in die ampullär-isthmische Verbindung und den Isthmus3 segmentieren. Nach der Ampullenexzision zwischen den Kurven fünf und sechs schneiden, um die ampullär-isthmische Verbindung zu erhalten; die verbleibende Röhre (Kurve sechs zum Beginn des UTJ) ist der Isthmus3.
- Nach der Exzision des Infundibulums (Fimbrialende und proximaler Stiel) schneiden Sie die ampulläre Region heraus, indem Sie nach der zweiten prominenten Drehung der Röhre schneiden (schnitt zwischen den Kurven zwei und drei, ungefähr 1 cm lang). Schneiden Sie schließlich den verbleibenden Teil auf den UTJ ab, der die isthmische Region ist (Abbildung 3H).
- Sofortiges Einfrieren von sezierten Gewebesegmenten in flüssigem Stickstoff zur RNA-Isolierung oder Fixierung und Verarbeitung jedes Segments für eine orientierte Einbettung und immunhistologische Analyse.
- 200 μL kaltes RNA-Extraktionsreagenz und 1:1 Homogenisierungsperlenmischung (siehe Materialtabelle) in das Gewebe geben, wenn Sie mit der RNA-Extraktion fortfahren (siehe Schritt 5.1).
4. Eileiterdissoziation
- Fortsetzung von Schritt 3.1.1 oben) Für eine optimale Dissoziation des Epithels öffnen Sie den Eileiter nach Möglichkeit in den Bereichen (d. h. Infundibulum und Ampulle), um das luminale Epithel freizulegen (Abbildung 4A).

Abbildung 4: Eileiterzelldissoziation, Teil 1. Cartoon, der zeigt, wie man das distale Epithel für eine optimale Zelldissoziation freilegt (A) und ein Bild, das den einfachsten Weg zeigt, das 1 mm2-Netz (B) zu verwenden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Ausgehend von der Fimbrialregion schlitzen Sie das Rohr mit einer Pinzette als Hebel in Längsrichtung mit einer Federschere auf.
- Zerkleinern Sie die aufgeschlitzten Teile und den verbleibenden Eileiter in Segmente (~ 1-2 mm groß) und fügen Sie 5 ml warmen, nicht-enzymatischen Dissoziationspuffer hinzu (siehe Tabelle der Materialien) und inkubieren Sie bei 37 ° C.
- Resuspendieren Sie die Gewebestücke und dissoziierten Zellen mit einem Bulbpipettor alle 3 min für 9-10 min. Verdünnen Sie den Dissoziationspuffer 1:1 mit kaltem Dissektionsmedium.
- Sammeln Sie die Zellen durch Zentrifugation (350 x g, 3 min, 4 °C). Resuspendieren Sie die Zellen in 2 mL RBC-Lysepuffer für 2 min bei Raumtemperatur und verdünnen Sie sie dann 1: 1 mit kaltem Dissektionsmedium.
- Sammeln Sie die Zellen durch Zentrifugation (350 x g, 3 min, 4 °C) und resuspenieren Sie in 5 ml Kaltpronaselösung.
- Inkubieren Sie in Pronase-Verdauungsmedium und resuspen Sie die Zellklumpen mit einem BulbPipettor alle 3-5 min, bis eine einzelne Zellsuspension erreicht ist (~ 25-30 min).
HINWEIS: Dieser Schritt wird am besten in einer Gewebekulturplatte oder einem Gewebekolben durchgeführt, um eine ständige Beobachtung zu ermöglichen und eine unnötige Überbelichtung der Pronase zu vermeiden.
- Inkubieren Sie in Pronase-Verdauungsmedium und resuspen Sie die Zellklumpen mit einem BulbPipettor alle 3-5 min, bis eine einzelne Zellsuspension erreicht ist (~ 25-30 min).
- Führen Sie die Zellen durch ein steriles Makronetz (1 mm x 1 mm Netz, das mit einem Gummiband an einem konischen Röhrchen befestigt ist (Abbildung 4B)), um alle verbleibenden undissoziierten Gewebestücke zu entfernen. Sammeln Sie die Zellen durch Zentrifugation (350 x g, 3 min, 4 °C) und resuspenieren Sie sie in einem kalten Medium, das für die nachgeschaltete Analyse geeignet ist (z. B. FACS-Puffer, wenn Sie mit der Färbung für die Durchflusszytometrie fortfahren).
5. RNA-Extraktion von Eileitersegmenten
- Homogenisieren Sie snapgefrorene Proben in 200 μL RNA-Extraktionsreagenz in einem Bead Bullet Blender Gewebehomogenisator auf Stufe 12 für zwei Intervalle (je 3 min) bei 4 °C unter Verwendung der Edelstahl-Perlenmischung.
HINWEIS: Um die RNA-Integrität zu erhalten, sollten Proben sofort aus dem snapgefrorenen Zustand in das RNA-Extraktionsreagenz bewegt und nicht gewogen werden. - Kurz zentrifugieren Sie homogenat bei 100-200 x g in einer Tischzentrifuge für ca. 5 s bei Raumtemperatur, um die Flüssigkeit von den Kügelchen zu trennen. Den Überstand in ein frisches Röhrchen geben.
- Weitere 200 μL RNA-Extraktionsreagenz in die Kügelchen geben, um weitere Proben zu gewinnen, gefolgt von einer Zentrifugation (100-200 x g, 5 s, Raumtemperatur). Kombinieren Sie die Überstände.
HINWEIS: Verwenden Sie eine kleine Pipettenspitze (die meisten p200-Spitzen sind geeignet), um eine Perlenverschleppung beim Entfernen des Überstandes zu verhindern. - Befolgen Sie die Richtlinien des Herstellers, um RNA phasenweise zu trennen und auszufällen. Repräsentative Proben wurden über Nacht bei -20 °C mit 100% Isopropanol (ca. 2:1 Volumen, Isopropanol: gewonnene wässrige Phase) ausgefällt.
- Den kompletten RNA-Niederschlag zusammen mit der Lösung in eine RNA-bindende Spinsäule überführen und für 30 s bei 9.500 x g zentrifugieren. Reinigen Sie die RNA an der Säule gemäß den Richtlinien des Herstellers und eluieren Sie dann die RNA in 20 μL nukleasefreiem Wasser. Beurteilen Sie die Qualität/Quantität eines Mikrovolumen-Spektralphotometers und/oder Bioanalytikers.
Ergebnisse
Das beschriebene Dissoziationsprotokoll ergibt 100.000-120.000 Zellen pro Maus mit Pooling beider Eileiter. Die Methode ist schonend genug, um mehrgliedrige Zellränder intakt zu lassen, was eine Unterscheidung zwischen multi-ciliarierten Zellen und sekretorischen Zellen ermöglicht und überprüft, ob die Verdauungsmethode sanft genug ist, um eine Dedifferenzierung zu verhindern. Repräsentative Immunfluoreszenzbilder in Abbildung 5 zeigen kleinzellige Klumpen nach Schritt 4.2.1, fixiert f?...
Diskussion
Die drei Segmente des Eileiters sind histologisch, morphologisch und funktionell unterscheidbar1,2,3. Das Epithel variiert stark von einem Ende des Eileiters zum anderen. Bewimperte Zellen dominieren am fimbrialen/infundibulären Ende, während sekretorische Zellen in der isthmischen Region dominieren1. Während dieser Gesamtgradient seit einiger Zeit erkannt wurde, haben neuere Arbeiten mehr Unterschiede...
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Diese Arbeit wurde zum Teil durch einen DoD Breakthrough Award an AMW (BCRP W81XWH-14-1-0425) unterstützt. KCR wurde teilweise durch intramurale Stipendien unterstützt: das Pease Cancer Pre-Doctoral Fellowship und das Mary Galvin Burden Pre-Doctoral Fellowship in Biomedical Sciences und die University of California, Riverside, intramurale Auszeichnungen: den Graduate Council Fellowship Committee Dissertation Research Grant und den Graduate Division Dissertation Year Program Award. Die Autoren danken Gillian M. Wright und Alyssa M. Kumari für die Unterstützung bei der frühzeitigen Fehlerbehebung dieser Methode.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.5 mm Stainless steel bead mix | Next Advance | SSB05 | Mix 1:1 with 1.4 mm SSB14B, sterilized |
| 1.4 mm Stainless steel bead mix | Next Advance | SSB14B | Mix 1:1 with 0.5 mm SSB05, sterilized |
| 1X Dulbecco's Phosphate Buffered Saline A, pH 7.4 (DPBS) | Gibco | 21600-010 | Cold, sterile |
| 25G needle | BD | 305122 | |
| 60 mm sterile petri dishes | Corning | 430166 | |
| 70 μm cell meshes | Fisherbrand | 22-636-548 | |
| Agilent Eukaryote Total RNA 6000 Pico Chip kit | Agilent 2100 Bioanalyzer | 5067-1513 | |
| Bead Bullet Blender Tissue Homogenizer | Next Advance | BBY24M | |
| Bioanlyzer | Agilent 2100 Bioanalyzer | ||
| Bovine serum albumin | Sigma Aldrich | A7906 | |
| Cold plate/pack/surface of choice | N/A | N/A | Kept at -20C for dissection |
| Dental wax | Polysciences Inc. | 403 | |
| Dulbecco’s Modified Eagle’s Medium (DMEM)/ Ham’s F12 | Corning | 10-090-CV | Prepare dissection medium: DMEM/ Ham’s F12, 10% FBS, 25 mM Hepes, 1% Pen-Strep |
| Fetal Bovine Serum | Corning | 35-015CV | |
| Fine point forceps of choice | N/A | N/A | |
| Glycine | Sigma Aldrich | G712b | Immunocytochemical validation images |
| Goat anti-mouse IgG Alexa Fluor 555 | Invitrogen | A-21422 | Immunocytochemical validation images |
| Goat anti-rabbit IgG Alexa Fluor 488 | Invitrogen | A-11001 | Immunocytochemical validation images |
| Hepes | Sigma Aldrich | H-3784 | |
| Hoescht 33342 | Cell Signaling Technologies | 4082S | Immunocytochemical validation images |
| Inverted compound microscope | Keyence BZ-X700 | ||
| Mouse anti-mouse Occludin | Invitrogen | 33-1500 | Immunocytochemical validation images |
| Non-enzymatic dissociation buffer | N/A | 5 mM EDTA, 1 g/L glucose, 0.4% BSA, 1X DPBS | |
| Nylon macro-mesh 1 mm x 1 mm | Thomas Scientific | 1210U04 | |
| Paraformaldehyde | Sigma Aldrich | P-6148 | Immunocytochemical validation images |
| Pen-Strep | MP Biomedicals | 10220-718 | |
| Prolong Gold Antifade Reagent | Cell Signaling Technologies | 9071S | Immunocytochemical validation images: antifade mounting medium |
| Pronase | Sigma Aldrich | 10165921001 | Prepare pronase digestion medium: 0.15% Pronase in DMEM/Ham's F12, sterile |
| Propidium Iodide | Roche | 11 348 639 001 | Viability validation images |
| Rabbit anti-mouse Acetylated-Tubulin | Abcam | ab179484 | Immunocytochemical validation images |
| RBC lysis buffer | BD Biosciences | 555899 | |
| RNeasy Mini Kit | Qiagen | 74134 | Utilized for on-column purification in text. |
| Spring form microdissection scissors | Roboz Surgical | RS-5610 | |
| Sterile 3 mL bulb pipettors | Globe Scientific | 137135 | |
| Toluidine blue | Alfa Aesar | J66015 | Prepare toluidine blue solution: 1% in 1X DPBS, sterile |
| Tris-Buffered Saline-Tween (TBST) | N/A | N/A | Immunocytochemical validation images; 0.1 N NaCl, 10 mM Tris-Cl pH 7.5, 1% Tween 20 |
| Triton-X-100 | Mallinckrodt Inc. | 3555 | Immunocytochemical validation images |
| Trizol RNA Extraction Reagent | Invitrogen | 15596026 | Referred to as RNA extraction reagent. Nucelase-free water, chloroform and isoproponal are required in supplement of performing Trizol extraction per manufacturer's guidelines |
Referenzen
- Stewart, C. A., et al., Kubiak, J. Z., et al. . Mouse oviduct developmemt in Mouse Development: From Oocyte to Stem Cells. , 247-262 (2012).
- Ford, M. J., et al. Oviduct epithelial cells constitute two developmentally distinct lineages that are spatially separated along the distal-proximal axis. Cell Reports. 36 (10), 109677 (2021).
- Harwalkar, K., et al. Anatomical and cellular heterogeneity in the mouse oviduct-its potential roles in reproduction and preimplantation development. Biology of Reproduction. 104 (6), 1249-1261 (2021).
- Agduhr, E. Studies on the structure and development of the bursa ovarica and the tuba uterina in the mouse. Acta Zoologica. 8 (1), 1 (1927).
- Pulkkinen, M. O. Oviductal function is critical for very early human life. Annals of Medicine. 27 (3), 307-310 (1995).
- Kindelberger, D. W., et al. Intraepithelial carcinoma of the fimbria and pelvic serous carcinoma: Evidence for a causal relationship. American Journal of Surgical Pathology. 31 (2), 161-169 (2007).
- Ghosh, A., Syed, S. M., Tanwar, P. S. In vivo genetic cell lineage tracing reveals that oviductal secretory cells self-renew and give rise to ciliated cells. Development. 144 (17), 3031-3041 (2017).
- Lee, Y., et al. A candidate precursor to serous carcinoma that originates in the distal fallopian tube. Journal of Pathology. 211 (1), 26-35 (2007).
- Kim, J., et al. High-grade serous ovarian cancer arises from fallopian tube in a mouse model. Proceedings of the National Academy of Sciences of the United States of America. 109 (10), 3921-3926 (2012).
- Perets, R., et al. Transformation of the fallopian tube secretory epithelium leads to high-grade serous ovarian cancer in Brca;Tp53;Pten models. Cancer Cell. 24 (6), 751-765 (2013).
- Sherman-Baust, C. A., et al. A genetically engineered ovarian cancer mouse model based on fallopian tube transformation mimics human high-grade serous carcinoma development. Journal of Pathology. 233 (3), 228-237 (2014).
- Zhai, Y. L., et al. High-grade serous carcinomas arise in the mouse oviduct via defects linked to the human disease. Journal of Pathology. 243 (1), 16-25 (2017).
- Karthikeyan, S., et al. Prolactin signaling drives tumorigenesis in human high grade serous ovarian cancer cells and in a spontaneous fallopian tube derived model. Cancer Letters. 433, 221-231 (2018).
- Shao, R., et al. Differences in prolactin receptor (PRLR) in mouse and human fallopian tubes: Evidence for multiple regulatory mechanisms controlling PRLR isoform expression in mice. Biology of Reproduction. 79 (4), 748-757 (2008).
- Alwosaibai, K., et al. PAX2 maintains the differentiation of mouse oviductal epithelium and inhibits the transition to a stem cell-like state. Oncotarget. 8 (44), 76881-76897 (2017).
- Peri, L. E., et al. A novel class of interstitial cells in the mouse and monkey female reproductive tracts. Biology of Reproduction. 92 (4), 102 (2015).
- Lõhmussaar, K., et al. Assessing the origin of high-grade serous ovarian cancer using CRISPR-modification of mouse organoids. Nature Communications. 11 (1), 2660 (2020).
- Chen, S., et al. An air-liquid interphase approach for modeling the early embryo-maternal contact zone. Scientific Reports. 7, 42298 (2017).
- Desjardins, P., Conklin, D. NanoDrop microvolume quantitation of nucleic acids. Journal of Visualized Experiments: JoVE. (45), e2565 (2010).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Molecular Biology. 7, 3 (2006).
- McGlade, E. A., et al. Cell-type specific analysis of physiological action of estrogen in mouse oviducts. The FASEB Journal. 35 (5), 21563 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten