Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Murine Oviduct'un Mikroseksiyonu ve Ayrışması: Bireysel Segment Tanımlama ve Tek Hücre İzolasyonu
Bu Makalede
Özet
RNA bütünlüğünü korurken tek tek segmentlerin toplanmasına izin veren fare yumurta kanalının mikro dezenfeksiyonu için bir yöntem sunulmuştur. Ayrıca enzymatik olmayan ovidüktal hücre ayrışması prosedürü açıklanmıştır. Yöntemler fonksiyonel olarak farklı ovidüktal segmentlerin ve ayrışmış ovidüktal hücrelerin sonraki gen ve protein analizi için uygundur.
Özet
Fare modeli sistemleri, genetik manipülabillikleri ve deneysel tedavilerin maliyetinin düşük olması nedeniyle hastalık süreçlerinin analizi için eşsizdir. Bununla birlikte, küçük vücut boyutları nedeniyle, 200-400 μm çapındaki yumurta kanalı gibi bazı yapıların, immünhistokimya dışında incelenmesinin nispeten zor olduğu kanıtlanmıştır. Son zamanlarda, immünohistokimyasal çalışmalar, yumurta kanalı segmentlerinde daha önce tanınandan daha karmaşık farklılıklar ortaya çıkarmıştır; böylece, yumurta kanalı yedi farklı epitel hücre tipinin farklı oranlarına sahip dört fonksiyonel segmente ayrılır. Epitel hücre tiplerinin farklı embriyolojik kökenleri ve oranları muhtemelen dört fonksiyonel bölgeyi hastalığa farklı olarak duyarlı hale getirir. Örneğin, seröz intraepithelial karsinomların öncü lezyonları fare modellerindeki infundibulumdan ve insan fallop tüpündeki ilgili fimbrial bölgeden kaynaklanır. Burada açıklanan protokol, mikrodiseksiyonun, ters transkripsiyon-nicel PCR (RT-qPCR) ve RNA dizilimi (RNAseq) gibi aşağı akış analizi için gerekli olan yeterli miktarda ve saflıkta RNA elde etmek için yeterli miktarda ve saflıkta bir şekilde alt bölümlere ayırma yöntemini detaylandırmamaktadır. Ayrıca, akış sitometrisine veya tamamen farklılaştırılmış ovidüktal hücrelerin tek hücreli RNAseq analizine uygun çoğunlukla enzimatik olmayan bir doku ayrışma yöntemidir. Açıklanan yöntemler, üreme, doğurganlık, kanser ve immünoloji alanında murine yumurta kanalını kullanarak daha fazla araştırmayı kolaylaştıracaktır.
Giriş
Murin oviduct fonksiyon ve morfoloji olarak insan fallop tüpüne benzer1. Her ikisi de tarihsel olarak tanımlanmış iki epitel yerleşik hücreden oluşan sözde siliated epitelden oluşur: siliated hücreler ve salgı hücreleri1,2. Yumurta kanalının klasik olarak tanınan üç bölümü vardır: infundibulum, ampulla ve isthmus. Yeni bir çalışmada, Harwalkar ve ark. 3, yerleşik epitel hücrelerinin kategorizasyonunun yedi farklı popülasyona genişlemesine yol açan yumurta kanalı morfolojisi ve gen ekspresyasyonu araştırılmıştır. Buna ek olarak, ampullary-isthmus kavşağını oviduct3'ün ayrı bir segmenti olarak kurdular. Burada açıklanan ve infundibulum, ampulla ve isthmus'a odaklanan yöntem, ampullery-isthmic kavşağını da içerecek şekilde kolayca genişletilebilir2,3. İnfundibular bölge ostium veya yumurta kanalının açılmasını içerir ve fimbrial bölgenin yanı sıra proksimal sapı içerir. Rahime doğru ilerlerken, sırada ampulla ve sonra isthmus var. Siliated hücreler en çok bölgenin distal ucunda, yumurtalık proksimal veya infundibulumda öne çıkarken, salgı hücreleri en çok proksimal uçta veya isthmus segmentinde belirgindir1. İnsan fallop tüpünün aksine, murine oviduct, geniş ligament peritonunun bir uzantısı olan mezosalpinx tarafından desteklenen sarmal bir yapıdır1,4. Ek olarak, fare oviduct, oviduct4'e oosit transferi olasılığını artıran bir bursal keseye kaplanmıştır. Ampulla, gelişmekte olan embriyoların uterusa girmeden önce isthmusa geçtiği döllenme yeri olarak tanımlanır5. Tubal segmentler 200-400 μm çapında ve daha uzun ampullery ve isthmus bölgeleri yaklaşık 0.5-1.0 cm uzunluğundadır4. Östrous döngüsü sırasındaki oviduct distendleri ve ampulla ve infundibulum isthmus1'den daha dağılabilir.
Hücrelerin, özellikle de salgı hücrelerinin aşırı çoğalması, pelvik boşlukta bulunan seröz tümörlere öncü lezyonları karakterize eder6. Bu öncül seröz intraepithelial lezyonlar sadece fimbrial bölgede yumurta kanalı epitelinde ortaya çıkar; lezyon oluşumunun neden salgı 2,7,8 değil, normalde baskın hücre tipinin siliated olduğu bu bölge ile sınırlı olduğu bilinmemektedir. Normal fizyolojik fonksiyon açısından bölgesellik ve yumurtalık kanserinin ovidüktal kökenine olan ilginin artması9,10,11,12,13, yumurta kanalı segmentlerinin ayrı ayrı değerlendirilmesinin öneminin altını çizmektedir.
Burada açıklanan yöntem, segmente özgü gen ekspresyonunun ve ayrışmış hücrelerin işlevinin sonraki aşağı akış analizleri için ayrı ovidüktal segmentlerin toplanmasını detaylandırmaktadır. Geleneksel olarak, birçok doku fenolden sonra tüm RNA ekstraksiyonu için işlenir: kloroform yöntemi veya sütun üzerinde tam ekstraksiyon yöntemi; ancak açıklanan kombinasyon yöntemi ile yeterli verim üretilirken RNA kalitesinin korunduğunu tespit ettik. Bu yöntem kullanılarak, yumurta kanalının çok küçük fonksiyonel segmentleri, yumurta kanalını bir bütün olarak araştırmak yerine aşağı akış analizleri için işlenebilir ve bu da farklı segmentlerin sonuç temsilcisini maskeleyebilir14.
Dissositasyonlu murin ovidüktal hücreler, büyük olasılıkla bu dokudan hücre verimini sınırlaması nedeniyle akış sitometrisi tarafından nadiren araştırılmıştır. Bu sorunun üstesinden gelmek için bir yaklaşım, hücreleri ayrıştırmak, kültürde büyütmek ve daha sonra aşağı akış hücre analizi için uygun hücre numaralarını elde etmek için yeniden farklılaşma in vitrosunu teşvik etmek olmuştur15,16,17,18. Bu yaklaşımın bir sınırlaması, kültürde ex vivo ve değiştirilmiş mikroçevrim zamanıdır ve her ikisi de gen ekspresyonunun değişmesidir. Morfolojik yeniden farklılaşmanın, bozulmamış hayvanda mevcut olan transkripsiyon ve proteomik imzaya sahip olduğu varsayımı da vardır. Mevcut ayrışma yöntemi, tek hücre farklılaşması sürdürülürken heterojen ovidüktal hücre popülasyonunda en yüksek sayıda epitel hücre elde etmek için tasarlanmıştır. Ayrıca, çoğunlukla enzmatik olmayan yaklaşım muhtemelen hücre yüzey proteinlerinin kaybını sınırlar.
Protokol
Tüm hayvan taşıma ve prosedürleri Kaliforniya Üniversitesi, Riverside kurumsal hayvan bakım ve kullanım komitesi tarafından onaylandı ve Amerikan Laboratuvar Hayvanları Bakım Derneği, Amerika Birleşik Devletleri Tarım Bakanlığı ve Ulusal Sağlık Enstitüleri'nin yönergelerine uygundu. Açıklanan yöntem C57BL / 6 yetişkin, dişi fareler kullandı. Tüm hayvanlar doku hasadı öncesinde kafalarının kesilmesiyle ötenaziye tabi edildi.
NOT: Yumurta kanalının verimli bir şekilde sökülmesine ve geri tepmesine yardımcı olmak için mavi bir boya kullanan protokole genel bir bakış ilk şekilde gösterilmiştir (Şekil 1).
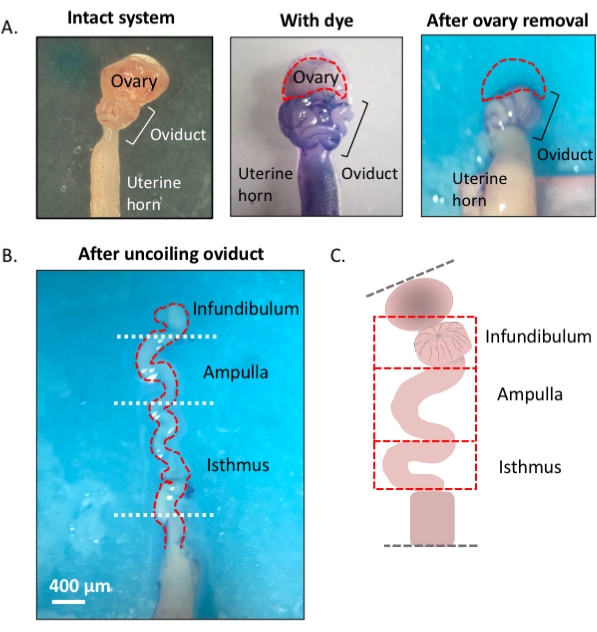
Şekil 1: Mikrodiseksiyon yöntemine genel bakış. (A) Sol panel, yumurtalık yağ yastığının çoğunun ve yumurtalığı çevreleyen bağ dokusu kalıntılarının çoğunun çıkarıldığı sağlam yapıyı gösterir. Bundan sonra, toluidin mavisinin eklenmesi, yumurta kanalının bobinlerini (orta panel) ayırt etmeye yardımcı olur. Sağ panel, yumurtalığın çıkarılmasından sonraki yapıları gösterir. (B) Her segmentin nerede başlayıp nerede bittiğini belirlemek için iç dönüşlere sahip tepmeyen bir yumurta kanalı. (C) Kullanılan segmentasyonun karikatürü (ölçeklemek için çizilmez). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
1. Diseksiyon yüzeyinin hazırlanması
- Petri kabına yapışkanlı bir diş cilası parçası yapıştırın ve kurumaya bırakın (Şekil 2A). Yemeği% 70 etanol ile sterilize edin. Yüzey diseksiyona hazır.
2. Yumurtalık, yumurtalık ve uterusun makrodiseksiyonu
- Diş mumunu içeren Petri kabını diseksiyona hazır olduğunda diseksiyon mikroskobu altında tercih edilen soğuk bir platformda (örneğin, kullanımdan önce -20 °C'de tutulan bir buz torbası) hareketsiz hale getirin (Şekil 2A).
- Hayvanın ventral yüzeyini% 70 etanol ile dezenfekte edin. Karın ve pelvik boşluğu steril diseksiyon makası ile açın ve dorsal bihornal uterusu bulmak için gastrointestinal sistemi bir tarafa taşıyın. Böbreğin hemen altında bulunan rahim yağ yastığında zarflanmış her bir yumurtalığı ve yumurtalığı bulmak için her bir uterus boynuzu rostral olarak takip edin (Şekil 2B,C).
- Hem yumurtalıklarla lateral oviducts hem de diseksiyon makası kullanılarak hala bağlı distal rahim boynuzu bir kısmını kesin. Her bir lateral rahim boynuzu, hala sarmal yumurtalığa ve yumurtalığa bağlı olan boynuzunun yaklaşık 1-2 cm'si ile kesin (Şekil 2D). Dokuyu hemen 2 mL soğuk diseksiyon ortamına batırın (bkz. Malzeme tablosu).
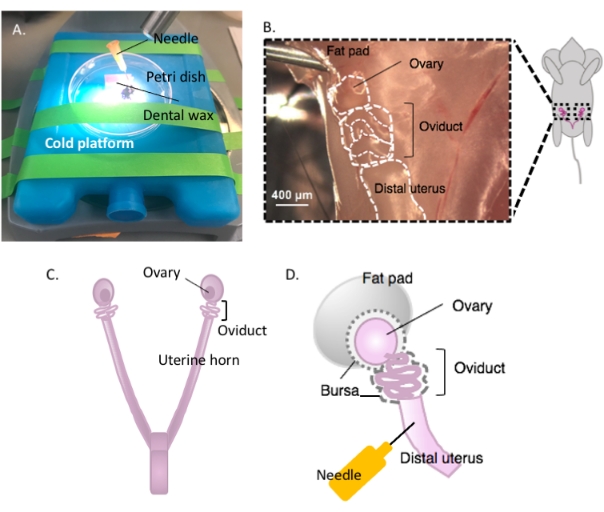
Şekil 2: Yumurtalığın makrodiseksiyonu ve diseksiyon kurulumu. Yumurta kanalı, yumurtalık yağ yastığı (B) içindeki böbreğin tabanındaki pelvik boşlukta dorsally olarak bulunur. Pelvik boşlukta (C) rahim çatallanmasını bulun ve uterus-oviduct-yumurtalık sürekliliğini (B) bulmak için lateral rahim boynuzu izleyin. Bir rahim boynuzu ve kaba diseksiyonu keserek bu yapıları çıkarın. Diseksiyon platformuna (A) yerleştirin ve rahim kısmını diş ağdasına bir iğne (A ve D) ile yapıştırın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
NOT: Diseksiyon platformuna yapışmaya izin vermek için yeterli rahim boynuzu sağlam ve yumurta kanalına tutturulmuş olarak bırakın (Şekil 2D).
- Diseksiyon için dokuyu sabitlemek için steril 25 G iğne ile rahim dokusunu diş ağdasına yapıştırın (Şekil 2A, D ve Şekil 3A). Diseksiyon mikroskobu altında çalışarak yumurtalık yağ yastığını ve bağ dokusunu temizleyip parçalara ayrıştırarak yumurta kanalının net bir şekilde görselleştirilmesini sağlar (Şekil 3B).

Şekil 3: Adım adım oviduct mikrodiseksiyon. Kalıntı yağ ve bağ dokusunun (A,B) çıkarılmasını takiben, dokuya (C) toluidin mavisi ekleyin ve ardından yumurtalığın görselleştirilmesini ve daha sonra çıkarılmasını ve tüpün (D-H) geri tepmesini kolaylaştırmak için yıkayın. Infundibulum proksimal isthmus ve uterin-tubal kavşağının (UTJ) yanında bulunabilir. Mezosalpinx'te keserken distal ucu hafifçe çekin ve uygun segmentasyona yönlendirmek için yumurta kanalının (H) endojen dönüşlerini ortaya çıkarın. Şekil A-C ölçek çubuğu = 500 μm, D-H ölçek çubuğu = 400 μm (I) Çeşitli segmentlerin karikatürü (ölçeklemek için çizilmez). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- 1 mL şırınd kullanarak, uterusa yapıştırılmış oviduct'u 30 s-1 dakika boyunca 1-2 damla steril% 1 toluidin mavi boya çözeltisi içinde dağıtın ve kuluçkaya yayalım. Soğuk Dulbecco fosfat tamponlu salin (DPBS) ile durulayın ve tüm sıvıyı çıkarın (Şekil 3C).
- Yumurtalığı bobinli yumurtalıktan hafifçe çekin ve tubal dokudan ödün vermeden yumurtalığı yumurtalıktan çıkarmak için bursal zarı ve geniş ligamenti kesin (Şekil 3D,E).
NOT: Yumurtalık yumurta kanalına bağlanmaz, ancak oviduct (Şekil 2D) ile bursal zara kaplanır ve geniş bağ yoluyla uterusun lateral tarafına bağlanır.
3. Yumurta kanalının mikrodispeksiyonu ve segmentasyonu
- Rahim-tubal kavşağına (UTJ) yanal bulunan yumurta kanalının distal, fimbrial ucunu bulun. Yumurta kanalı kendi kendine döner; bu nedenle fimbrial uç proksimal uca yanal olarak yerlenebilir ve yumurta kanalının tesirini çözmek için yönlendirmek için uygun bir başlangıç noktasıdır (Şekil 3F,I).
- Tüpü hafifçe çekerken, yumurta kanalını sönmek için yay şeklindeki mikro makasla mezosalpinkste (Şekil 3I) kesin (Şekil 3G).
- Tesbihini açtıktan sonra, infundibular, ampullary ve istemik bölgeleri üretmek için tüpü kesin (Şekil 3H).
- İnfundibulum 'un (fimbrial uç ve proksimal sap) eksizyonunun ardından, ampullery bölgesini tüpün ikinci belirgin dönüşünden sonra keserek kesin (iki ila üç dönüşler arasında yaklaşık 1 cm uzunluğunda kesin). Son olarak, kalan kısmı istikam bölgesi olan UTJ'ye kesin (Şekil 3H).
NOT: Yumurta kanalı tamamen düz bir yapıya dönüşmeyecektir. Tüp dönüşlerini koruyacaktır (Şekil 3H)3. Ampullary bölgesini takip eden sonraki dönüşlere dayanarak, kalan tüpü ampullary-isthmic kavşağına ve isthmus3'e daha fazla parçalayabilir. Ampulla eksizyonun ardından, ampullary-isthmic kavşağını elde etmek için beş ila altı dönüşleri arasında kesin; kalan tüp (UTJ'nin başlangıcına altı dönüş) isthmus3'tür.
- İnfundibulum 'un (fimbrial uç ve proksimal sap) eksizyonunun ardından, ampullery bölgesini tüpün ikinci belirgin dönüşünden sonra keserek kesin (iki ila üç dönüşler arasında yaklaşık 1 cm uzunluğunda kesin). Son olarak, kalan kısmı istikam bölgesi olan UTJ'ye kesin (Şekil 3H).
- RNA izolasyonu için sıvı nitrojende parçalanmış doku segmentlerini hemen dondurun veya her segmenti yönlendirilmiş gömme ve immünohistolojik analiz için sabitleyin ve işleyin.
- RNA ekstraksiyonu için devam ediyorsanız dokuya 200 μL soğuk RNA ekstraksiyon reaktifi ve 1:1 homojenizasyon boncuk karışımı ekleyin (bkz. malzeme tablosu).
4. Oviduct ayrışması
- Yukarıdaki adım 3.1.1'den devam eder) Epitelinin optimal ayrışması için, luminal epitelin açığa çıkması için mümkün olan alanlarda (yani infundibulum ve ampulla) yumurta kanalını kesin (Şekil 4A).

Şekil 4: Oviduct hücre ayrışması, bölüm 1. Optimal hücre ayrışması (A) için distal epitelin nasıl açığa çıkarılacağını gösteren karikatür ve 1 mm2 mesh'i (B) kullanmanın en kolay yolunu gösteren bir görüntü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Fimbrial bölgeden başlayarak, forsepsleri kaldıraç olarak kullanarak, tüpü yay şeklindeki makasla uzunlamasına kesin.
- Yarık açık kısımları ve kalan yumurta kanalını parçalara ayırın (~1-2 mm boyut) ve 5 mL sıcak, enzimatik olmayan ayrıştırma tamponu ekleyin (bkz. Malzeme Tablosu) ve 37 °C'de kuluçkaya yatırın.
- Doku parçalarını ve ayrışmış hücreleri 9-10 dakika boyunca her 3 dakikada bir ampul pipetörü ile yeniden biriktirin. Dissosiyelasyon tamponu 1:1'i soğuk diseksiyon ortamı ile seyreltin.
- Hücreleri santrifüjleme (350 x g, 3 dk, 4 °C) ile toplayın. Hücreleri oda sıcaklığında 2 dakika boyunca 2 mL RBC liziz tamponunda yeniden depolayın ve ardından soğuk diseksiyon ortamı ile 1:1 seyreltin.
- Hücreleri santrifüjleme (350 x g, 3 dk, 4 °C) ile toplayın ve 5 mL soğuk pronaz çözeltisinde yeniden depolayın.
- Pronaz sindirim ortamında kuluçkaya yaslanın ve tek bir hücre süspansiyonu elde edilene kadar (~25-30 dk) her 3-5 dakikada bir ampul pipetörü ile hücre kümelerini yeniden dürtün.
NOT: Bu adım, gereksiz aşırı pozlamanın pronase olmasını önleyen sürekli gözleme izin vermek için en iyi şekilde bir doku kültürü plakasında veya şişesinde gerçekleştirilir.
- Pronaz sindirim ortamında kuluçkaya yaslanın ve tek bir hücre süspansiyonu elde edilene kadar (~25-30 dk) her 3-5 dakikada bir ampul pipetörü ile hücre kümelerini yeniden dürtün.
- Kalan bozulmamış doku parçalarını çıkarmak için hücreleri steril bir makro ağdan (kauçuk bantlı konik bir tüpe yapıştırılmış 1 mm x 1 mm ağ) geçirin (Şekil 4B).). Hücreleri santrifüjleme (350 x g, 3 dk, 4 °C) ile toplayın ve aşağı akış analizine uygun soğuk bir ortamda yeniden depolayın (örneğin, akış sitometrisi için boyama işlemine devam ediyorsanız FACS tamponu).
5. Oviductal segmentlerin RNA ekstraksiyonu
- Paslanmaz çelik boncuk karışımını kullanarak 4 °C'de iki aralık (her biri 3 dk) için seviye 12'de bir boncuk mermisi blender doku homojenizatörinde 200 μL RNA ekstraksiyon reaktifinde çıtçıtlı donmuş numuneleri homojenize edin.
NOT: RNA bütünlüğünü korumak için numuneler hemen donmuş durumdan RNA ekstraksiyon reaktifine taşınmalı ve tartılmamalıdır. - Sıvıyı boncuklardan ayırmak için oda sıcaklığında yaklaşık 5 sn masa üstü santrifüjde 100-200 x g'da kısa bir süre santrifüj homojene olur. Süpernatant'ı yeni bir tüpe aktarın.
- Daha fazla numuneyi kurtarmak için boncuklara 200 μL daha RNA ekstraksiyon reaktifi ekleyin, ardından santrifüjleme (100-200 x g, 5 s, oda sıcaklığı). Üstünlükleri birleştir.
NOT: Süpernatantı çıkarırken boncuk taşımayı önlemek için küçük bir pipet ucu kullanın (çoğu p200 ucu uygundur). - RNA'yı aşamalı olarak ayırmak ve çökeltmek için üreticinin yönergelerine uyun. Temsili numuneler gece boyunca -20 °C'de %100 izopropanol (yaklaşık 2:1 hacim, izopropanol: geri kazanılan sulu faz) ile çökeltildi.
- RNA çökeltisinin tamamını, çözelti ile birlikte RNA bağlayıcı bir spin sütununa ve 9.500 x g'da 30 sn santrifüje aktarın. RNA'yı üreticinin yönergelerine göre kolon üzerinde arındırın ve ardından RNA'yı 20 μL çekirdeksiz suya boşaltın. Bir mikrovolum spektrofotometresi ve/veya biyoanalyzer üzerindeki kaliteyi/miktarı değerlendirin.
Sonuçlar
Açıklanan ayrışma protokolü, her iki yumurta kanalının birikmesiyle fare başına 100.000-120.000 hücre sağlar. Yöntem, çok siliated hücre kenarlıklarını bozulmadan bırakacak kadar naziktir, çok siliated hücreler ve salgı hücreleri arasında bir ayrım sağlar ve sindirim yönteminin farklılaşmayı önleyecek kadar nazik olduğunu doğrular. Şekil 5'teki temsili immünofluoresans görüntüleri, %4 paraformaldehit (PFA)/ DPBS'de 3 dakika sabitlenen, %1 sığır serum a...
Tartışmalar
Yumurta kanalının üç segmenti histolojik, morfolojik ve fonksiyonel olarak farklı1,2,3'tür. Epitel, yumurta kanalının bir ucundan diğerine büyük ölçüde değişir. Fimbrial/infundibular uçta siliated hücreler baskınken, istik bölgede salgı hücreleri hakimdir1. Bu genel gradyan bir süredir tanınsa da, son çalışmalar oviductal segmentler arasında daha fazla ayrım ortaya çıkardı....
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma kısmen AMW'ye DoD Breakthrough Ödülü (BCRP W81XWH-14-1-0425) tarafından desteklendi. KCR kısmen intramural burslarla desteklendi: Pease Cancer Doktora Öncesi Bursu ve Mary Galvin Burden Biyomedikal Bilimler ve Kaliforniya Üniversitesi, Riverside'daki Doktora Öncesi Bursu, intramural ödüller: Lisansüstü Konsey Burs Komitesi Tez Araştırma Hibesi ve Lisansüstü Bölüm Tez Yılı Program Ödülü. Yazarlar Gillian M. Wright ve Alyssa M. Kumari'ye bu yöntemin erken sorun giderilmesinde yardımları için teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.5 mm Stainless steel bead mix | Next Advance | SSB05 | Mix 1:1 with 1.4 mm SSB14B, sterilized |
| 1.4 mm Stainless steel bead mix | Next Advance | SSB14B | Mix 1:1 with 0.5 mm SSB05, sterilized |
| 1X Dulbecco's Phosphate Buffered Saline A, pH 7.4 (DPBS) | Gibco | 21600-010 | Cold, sterile |
| 25G needle | BD | 305122 | |
| 60 mm sterile petri dishes | Corning | 430166 | |
| 70 μm cell meshes | Fisherbrand | 22-636-548 | |
| Agilent Eukaryote Total RNA 6000 Pico Chip kit | Agilent 2100 Bioanalyzer | 5067-1513 | |
| Bead Bullet Blender Tissue Homogenizer | Next Advance | BBY24M | |
| Bioanlyzer | Agilent 2100 Bioanalyzer | ||
| Bovine serum albumin | Sigma Aldrich | A7906 | |
| Cold plate/pack/surface of choice | N/A | N/A | Kept at -20C for dissection |
| Dental wax | Polysciences Inc. | 403 | |
| Dulbecco’s Modified Eagle’s Medium (DMEM)/ Ham’s F12 | Corning | 10-090-CV | Prepare dissection medium: DMEM/ Ham’s F12, 10% FBS, 25 mM Hepes, 1% Pen-Strep |
| Fetal Bovine Serum | Corning | 35-015CV | |
| Fine point forceps of choice | N/A | N/A | |
| Glycine | Sigma Aldrich | G712b | Immunocytochemical validation images |
| Goat anti-mouse IgG Alexa Fluor 555 | Invitrogen | A-21422 | Immunocytochemical validation images |
| Goat anti-rabbit IgG Alexa Fluor 488 | Invitrogen | A-11001 | Immunocytochemical validation images |
| Hepes | Sigma Aldrich | H-3784 | |
| Hoescht 33342 | Cell Signaling Technologies | 4082S | Immunocytochemical validation images |
| Inverted compound microscope | Keyence BZ-X700 | ||
| Mouse anti-mouse Occludin | Invitrogen | 33-1500 | Immunocytochemical validation images |
| Non-enzymatic dissociation buffer | N/A | 5 mM EDTA, 1 g/L glucose, 0.4% BSA, 1X DPBS | |
| Nylon macro-mesh 1 mm x 1 mm | Thomas Scientific | 1210U04 | |
| Paraformaldehyde | Sigma Aldrich | P-6148 | Immunocytochemical validation images |
| Pen-Strep | MP Biomedicals | 10220-718 | |
| Prolong Gold Antifade Reagent | Cell Signaling Technologies | 9071S | Immunocytochemical validation images: antifade mounting medium |
| Pronase | Sigma Aldrich | 10165921001 | Prepare pronase digestion medium: 0.15% Pronase in DMEM/Ham's F12, sterile |
| Propidium Iodide | Roche | 11 348 639 001 | Viability validation images |
| Rabbit anti-mouse Acetylated-Tubulin | Abcam | ab179484 | Immunocytochemical validation images |
| RBC lysis buffer | BD Biosciences | 555899 | |
| RNeasy Mini Kit | Qiagen | 74134 | Utilized for on-column purification in text. |
| Spring form microdissection scissors | Roboz Surgical | RS-5610 | |
| Sterile 3 mL bulb pipettors | Globe Scientific | 137135 | |
| Toluidine blue | Alfa Aesar | J66015 | Prepare toluidine blue solution: 1% in 1X DPBS, sterile |
| Tris-Buffered Saline-Tween (TBST) | N/A | N/A | Immunocytochemical validation images; 0.1 N NaCl, 10 mM Tris-Cl pH 7.5, 1% Tween 20 |
| Triton-X-100 | Mallinckrodt Inc. | 3555 | Immunocytochemical validation images |
| Trizol RNA Extraction Reagent | Invitrogen | 15596026 | Referred to as RNA extraction reagent. Nucelase-free water, chloroform and isoproponal are required in supplement of performing Trizol extraction per manufacturer's guidelines |
Referanslar
- Stewart, C. A., et al., Kubiak, J. Z., et al. . Mouse oviduct developmemt in Mouse Development: From Oocyte to Stem Cells. , 247-262 (2012).
- Ford, M. J., et al. Oviduct epithelial cells constitute two developmentally distinct lineages that are spatially separated along the distal-proximal axis. Cell Reports. 36 (10), 109677 (2021).
- Harwalkar, K., et al. Anatomical and cellular heterogeneity in the mouse oviduct-its potential roles in reproduction and preimplantation development. Biology of Reproduction. 104 (6), 1249-1261 (2021).
- Agduhr, E. Studies on the structure and development of the bursa ovarica and the tuba uterina in the mouse. Acta Zoologica. 8 (1), 1 (1927).
- Pulkkinen, M. O. Oviductal function is critical for very early human life. Annals of Medicine. 27 (3), 307-310 (1995).
- Kindelberger, D. W., et al. Intraepithelial carcinoma of the fimbria and pelvic serous carcinoma: Evidence for a causal relationship. American Journal of Surgical Pathology. 31 (2), 161-169 (2007).
- Ghosh, A., Syed, S. M., Tanwar, P. S. In vivo genetic cell lineage tracing reveals that oviductal secretory cells self-renew and give rise to ciliated cells. Development. 144 (17), 3031-3041 (2017).
- Lee, Y., et al. A candidate precursor to serous carcinoma that originates in the distal fallopian tube. Journal of Pathology. 211 (1), 26-35 (2007).
- Kim, J., et al. High-grade serous ovarian cancer arises from fallopian tube in a mouse model. Proceedings of the National Academy of Sciences of the United States of America. 109 (10), 3921-3926 (2012).
- Perets, R., et al. Transformation of the fallopian tube secretory epithelium leads to high-grade serous ovarian cancer in Brca;Tp53;Pten models. Cancer Cell. 24 (6), 751-765 (2013).
- Sherman-Baust, C. A., et al. A genetically engineered ovarian cancer mouse model based on fallopian tube transformation mimics human high-grade serous carcinoma development. Journal of Pathology. 233 (3), 228-237 (2014).
- Zhai, Y. L., et al. High-grade serous carcinomas arise in the mouse oviduct via defects linked to the human disease. Journal of Pathology. 243 (1), 16-25 (2017).
- Karthikeyan, S., et al. Prolactin signaling drives tumorigenesis in human high grade serous ovarian cancer cells and in a spontaneous fallopian tube derived model. Cancer Letters. 433, 221-231 (2018).
- Shao, R., et al. Differences in prolactin receptor (PRLR) in mouse and human fallopian tubes: Evidence for multiple regulatory mechanisms controlling PRLR isoform expression in mice. Biology of Reproduction. 79 (4), 748-757 (2008).
- Alwosaibai, K., et al. PAX2 maintains the differentiation of mouse oviductal epithelium and inhibits the transition to a stem cell-like state. Oncotarget. 8 (44), 76881-76897 (2017).
- Peri, L. E., et al. A novel class of interstitial cells in the mouse and monkey female reproductive tracts. Biology of Reproduction. 92 (4), 102 (2015).
- Lõhmussaar, K., et al. Assessing the origin of high-grade serous ovarian cancer using CRISPR-modification of mouse organoids. Nature Communications. 11 (1), 2660 (2020).
- Chen, S., et al. An air-liquid interphase approach for modeling the early embryo-maternal contact zone. Scientific Reports. 7, 42298 (2017).
- Desjardins, P., Conklin, D. NanoDrop microvolume quantitation of nucleic acids. Journal of Visualized Experiments: JoVE. (45), e2565 (2010).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Molecular Biology. 7, 3 (2006).
- McGlade, E. A., et al. Cell-type specific analysis of physiological action of estrogen in mouse oviducts. The FASEB Journal. 35 (5), 21563 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır