A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניתוח מיקרו-דיסקט וניתוק של אובידוקט מורין: זיהוי מקטע בודד ובידוד תא בודד
In This Article
Summary
מוצגת שיטה למיקרודיסקציה של oviduct העכבר המאפשרת איסוף של מקטעים בודדים תוך שמירה על שלמות RNA. בנוסף, הליך פירוק תאים oviductal לא אנזימטי מתואר. השיטות מתאימות לניתוח גנים וחלבון לאחר מכן של מקטעי oviductal שונים מבחינה תפקודית ותאי oviductal מנותקים.
Abstract
מערכות מודל עכבר הם ללא תחרות לניתוח של תהליכי מחלה בגלל manipulability הגנטית שלהם ואת העלות הנמוכה של טיפולים ניסיוניים. עם זאת, בגלל גודל הגוף הקטן שלהם, כמה מבנים, כגון oviduct עם קוטר של 200-400 מיקרומטר, הוכיחו להיות קשה יחסית ללמוד אלא על ידי immunohistochemistry. לאחרונה, מחקרים אימונוהיסטוכימיים חשפו הבדלים מורכבים יותר במגזרי oviduct מאשר היו מוכרים בעבר; לפיכך, האובידוקט מחולק לארבעה מקטעים פונקציונליים עם יחסים שונים של שבעה סוגי תאי אפיתל נפרדים. המקורות והיחסים העובריים השונים של סוגי תאי האפיתל עשויים להפוך את ארבעת האזורים התפקודיים לרגישים באופן דיפרנציאלי למחלות. לדוגמה, נגעים מבשרים לקרצינומות תוך-אפיתליות serous נובעים מהאינפובולום במודלים של עכברים ומהאיזור הפימברי המתאים בחצוצרה האנושית. הפרוטוקול המתואר כאן מפרט שיטה עבור microdissection כדי לחלק את oviduct באופן כזה להניב כמות מספקת וטוהר של RNA הדרוש לניתוח במורד הזרם כגון תמלול הפוך-כמותי PCR (RT-qPCR) ורצף RNA (RNAseq). כמו כן מתוארת היא שיטת פירוק רקמות לא אנזימטית בעיקר המתאימה לציטומטריית זרימה או ניתוח RNAseq תא יחיד של תאים oviductal מובחנים לחלוטין. השיטות המתוארות יאפשרו מחקר נוסף תוך שימוש באובידוקט מורין בתחום הרבייה, הפוריות, הסרטן והאימונולוגיה.
Introduction
oviduct murine דומה בתפקוד ומורפולוגיה לחצוצרה האנושית1. שניהם מורכבים מאפיתל פסאודו-אסטרטגי, המורכב משני תאים מקומיים אפיתל המתוארים היסטורית: תאים מחוספסים ותאי הפרשה 1,2. לאובידוקט שלושה קטעים מוכרים קלאסית: האינפונדיבולום, האמפולה והאיסתמוס. במחקר שנערך לאחרונה, Harwalkar ואח '. 3 חקר מורפולוגיה oviduct וביטוי גנים המוביל להרחבת הסיווג של תאי אפיתל תושב לשבע אוכלוסיות נפרדות. בנוסף, הם הקימו את צומת אמפולרי-איסתמוס כמקטע נפרד של oviduct3. השיטה המתוארת בזאת, המתמקדת אינפונדבולום, אמפולה, ו isthmus, יכול בקלות להיות מורחב לכלול את הצומת אמפולרי-איסתמי, כמו גם 2,3. האזור הבלתי מוחרי מכיל את האוסטיום, או הפתיחה של oviduct, וכולל את האזור fimbrial, כמו גם את הגבעול הפרוקסימלי. נע לכיוון הרחם, הבא הוא אמפולה, ולאחר מכן isthmus. תאים מסוכסכים בולטים ביותר בקצה הדיסטלי של האזור, קרובים לשחלה, או אינפונבולום, בעוד שתאי הפרשה בולטים ביותר בקצה הפרוקסימלי או בקטע איסתמוס1. שלא כמו החצוצרה האנושית, oviduct murine הוא מבנה מפותל נתמך על ידי mesosalpinx, הרחבה של הרצועה הרחבה צפק 1,4. בנוסף, oviduct העכבר עטוף בשק בורסל שמגדיל את הסבירות להעברת ביציות לתוך oviduct4. האמפולה מזוהה כמיקום ההפריה, שממנו עוברים מתפתחים עוברים לאיתמוס לפני הכניסה לרחם 5. מקטעי חצובות הם בקוטר 200-400 מיקרומטר ואזורי האמפולר והאיסתמוס הארוכים יותר הם כ 0.5-1.0 ס"מ אורך4. האובידוקט נחלש במהלך המחזור האסטרוס והאמפולה והאינדיבולום נפוחים יותר מהאיתמוס1.
התפשטות יתר של תאים, במיוחד תאים הפרשה, מאפיינים נגעים קודמים לגידולים סרוסיים שנמצאו בחלל האגן6. נגעים תוך-אפיתל-אפיתליים מבשרים אלה מתעוררים באפיתל האובידוקט אך ורק באזור הפימברי; לא ידוע מדוע היווצרות נגע מוגבלת לאזור זה שבו בדרך כלל סוג התא השולט הוא ciliated, לא הפרשה2,7,8. האזוריות במונחים של תפקוד פיזיולוגי נורמלי, כמו גם עניין מוגבר במקור oviductal של סרטן השחלות9,10,10,11,12,13, מדגיש את החשיבות של הערכה נפרדת של קטעי oviduct.
השיטה המתוארת כאן מפרטת את האוסף של מקטעי oviductal נפרדים לניתוחים במורד הזרם הבאים של ביטוי גנים ספציפיים למגזר ותפקוד של תאים מנותקים. באופן מסורתי, רקמות רבות מעובדות עבור מיצוי RNA שלם בעקבות הפנול: שיטת כלורופורם או שיטת מיצוי מלאה בעמודה; עם זאת, מצאנו כי איכות RNA נשמר תוך הפקת תשואה מספקת עם שיטת השילוב המתוארת. באמצעות שיטה זו, קטעים פונקציונליים קטנים מאוד של oviduct ניתן לעבד עבור ניתוחים במורד הזרם במקום לחקור את oviduct בכללותו, אשר יכול להסוות תוצאות נציג של המקטעים השונים14.
תאי אובידוקטלי מורין מנותקים נחקרו לעתים רחוקות על ידי ציטומטריית זרימה, ככל הנראה בשל תפוקת התא המגבילה מרקמה זו. גישה אחת כדי להתגבר על בעיה זו הייתה לנתק תאים, לגדל אותם בתרבית, ולאחר מכן לעורר בידול מחדש במבחנה כדי להשיג מספרי תאים מתאימים לניתוח תאים במורד הזרם15,16,17,18. מגבלה לגישה זו היא הזמן ex vivo ושינוי microenvironment בתרבות, שניהם עשויים לשנות ביטוי גנים. יש גם הנחה כי בידול מחדש מורפולוגי יש את אותה חתימה תמלולית פרוטאומית כפי שהיה נוכח בחיה שלמה. שיטת הניתוק הנוכחית תוכננה להשיג את המספר הגבוה ביותר של תאי אפיתל באוכלוסיית תאים אובידוקטליים הטרוגניים תוך שמירה על בידול תאים בודדים. יתר על כן, הגישה הלא אנזימטית בעיקר מגבילה ככל הנראה את אובדן חלבוני פני התא.
Protocol
כל הטיפול בבעלי חיים והנהלים אושרו על ידי אוניברסיטת קליפורניה, ועדת הטיפול והשימוש בבעלי חיים המוסדיים ריברסייד והיו בהתאם להנחיות האגודה האמריקאית לטיפול בבעלי חיים במעבדה, מחלקת החקלאות של ארצות הברית ומכוני הבריאות הלאומיים. השיטה המתוארת השתמשה C57BL / 6 מבוגר, עכברים נקבות. כל בעלי החיים הומתו על ידי עריפת ראש לפני קצירת רקמות.
הערה: מבט כולל על הפרוטוקול, המשתמש בצבע כחול כדי לסייע בניתוח יעיל ובפתיחת האובידוקט, מוצג באיור הראשון (איור 1).
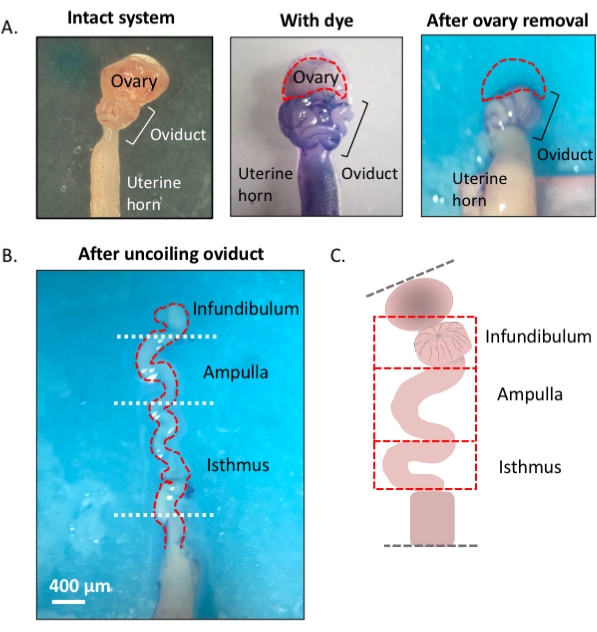
איור 1: מבט כולל על שיטת המיקרו-דיסקציה. (A) פאנל שמאלי מראה את המבנה השלם שממנו הוסרו רוב כרית השומן בשחלות ושרידי רקמת החיבור המקיפה את האובידוקט. לאחר מכן, התוספת של כחול טולואידין מסייעת להבחין בין הסלילים של oviduct (הלוח האמצעי). הלוח הימני מציג מבנים לאחר הסרת השחלה. (ב) oviduct לא מצופה עם פניות פנימיות לקביעת המקום שבו כל מקטע מתחיל ומסתיים. (ג) קריקטורה של הפילוח המשמש (לא נמשך בקנה מידה). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
1. הכנת משטח החיתוך
- מצמידים חתיכת שעווה דנטלית לצלחת פטרי עם דבק ומניחים לה להתייבש (איור 2A). לחטא את המנה עם 70% אתנול. פני השטח מוכנים לחיתוך.
2. מקרודיסקציה של השחלה, האובידוקט והרחם
- שתקו את צלחת הפטרי המכילה את השעווה הדנטלית על פלטפורמה קרה לפי בחירה (למשל, חבילת קרח שנשמרה בטמפרטורה של מינוס 20 מעלות צלזיוס לפני השימוש) תחת מיקרוסקופ ניתוח כאשר הם מוכנים לניתוח (איור 2A).
- לחטא את פני השטח הגחוני של החיה עם 70% אתנול. פתחו את חלל הבטן והאגן עם מספריים לחיתוך סטרילי והעבירו את מערכת העיכול לצד אחד כדי לאתר את הרחם הדו-קרן הגבי. עקבו אחר כל קרן ברחם כדי לאתר כל אובידוקט ושחלה עטופים במשטח השומן ברחם, שנמצא ממש מתחת לכליה (איור 2B,C).
- לחתוך הן oviducts לרוחב עם השחלות וחלק של קרן הרחם דיסטלי עדיין מחובר באמצעות מספריים ביתור. חותכים כל קרן רחם לרוחב עם כ-1-2 ס"מ מהקרן שעדיין מחוברת לאובידוקט ולשחלה המפותלים (איור 2D). להטביע את הרקמה מיד ב 2 מ"ל של מדיום ניתוח קר (ראה טבלת חומרים).
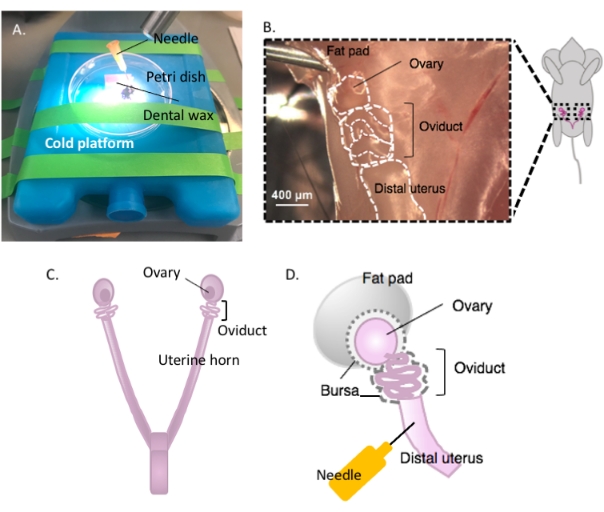
איור 2: ניתוח מאקרו של השחלה וכיוונון הניתוח. Oviduct ממוקם הגב בחלל האגן בבסיס הכליה בתוך כרית שומן השחלות (B). אתר את התפשטות הרחם בחלל האגן (C) ועקוב אחר קרן הרחם לרוחב כדי לאתר את רצף הרחם-oviduct-השחלות הרחם (B). הסר מבנים אלה על ידי חיתוך דרך קרן הרחם אחת וחיתוך גס. מניחים על פלטפורמת הניתוח (A) ומצמידים את חלק הרחם לשעווה דנטלית עם מחט (A ו- D). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
הערה: השאירו מספיק קרן רחם ללא פגע ומחוברת ל-oviduct כדי לאפשר הצמדה לפלטפורמת החיתוך (איור 2D).
- הצמידו את רקמת הרחם לשעווה הדנטלית במחט סטרילית של 25 גרם כדי לאבטח את הרקמה לניתוח (איור 2A,D ואיור 3A). בעבודה תחת מיקרוסקופ הניתוח, נקו וניתחו את כרית השומן השחלתית ואת רקמת החיבור כדי לאפשר הדמיה ברורה של האובידוקט (איור 3B).

איור 3: צעד אחר צעד oviduct microdissection. לאחר הסרת שאריות שומן ורקמת חיבור (A,B), להוסיף טולואידין כחול לרקמה (C), ולאחר מכן לשטוף כדי להקל על הדמיה ולאחר מכן הסרה של השחלה ואת unoiling של הצינור (D-H). ניתן למצוא את האינפונדיבולום ליד צומת איסתמוס פרוקסימלי ורחם-חצוצרות (UTJ). משוך קלות את הקצה הדיסטלי תוך כדי חיתוך במזוסלפינקס כדי להתיר את הרקיל ולחשוף את הסיבובים האנדוגניים של האובידוקט (H) כדי לכוון לפילוח מתאים. איור סרגל קנה מידה A-C = 500 מיקרומטר, סרגל קנה מידה D-H = 400 מיקרומטר (I) קריקטורה של המקטעים השונים (לא נמשך לקנה מידה). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- באמצעות מזרק 1 מ"ל, לחלק ולדגור את oviduct מודבק לרחם ב 1-2 טיפות של סטרילי 1% טולואידין כחול צבע פתרון במשך 30 s-1 דקה. שטפו עם תמיסת מלח (DPBS) עם אגירת פוספטים קרה של דולבקו (DPBS) והסירו את כל הנוזלים (איור 3C).
- משכו קלות את השחלה מהחוליה המפותלת וחתכו את הממברנה הבורסלית ואת הרצועה הרחבה כדי להסיר את השחלה מהאובידוקט מבלי להתפשר על רקמת החצוצרות (איור 3D,E).
הערה: השחלה אינה מחוברת לאובידקט אלא עטופה בקרום הבורסל עם האובידוקט (איור 2D) ומחוברת לצד הצדדי של הרחם דרך הרצועה הרחבה.
3. מיקרודיסקציה וסגמנטציה של האובידוקט
- אתר את הקצה הדיסטלי, הפימבריאלי של oviduct נמצא לרוחב לצומת הרחם-חצוצרות (UTJ). האובידוקט מתפתל בחזרה על עצמו; מכאן שניתן למקם את הקצה הפימברי לרוחב עד הקצה הפרוקסימלי ומהווה נקודת התחלה מתאימה לכיוון לפירוק האובידוקט (איור 3F,I).
- תוך כדי משיכה עדינה של הצינור, חתכו את המזוסלפינקס (איור 3I) בעזרת מיקרו-מספריים בצורת קפיץ כדי לשחרר את האובידוקט (איור 3G).
- לאחר הסרת הציפוי, חתכו את הצינור כדי לייצר את האזורים הפנימיים, האמפולריים והאיסתמיים (איור 3H).
- לאחר כריתה של infundibulum (קצה fimbrial וגבעול פרוקסימלי), excise את אזור אמפולרי על ידי חיתוך לאחר הסיבוב הבולט השני של הצינור (לחתוך בין פניות שתיים לשלוש, כ 1 ס"מ אורך). לבסוף, חתכו את החלק הנותר ל-UTJ, שהוא האזור האיסתמי (איור 3H).
הערה: oviduct לא יפתח לחלוטין לתוך מבנה ישר. הצינור ישמור על תורותיו (איור 3H)3. בהתבסס על הפניות הבאות בעקבות אזור האמפולרי, אפשר לפלח עוד יותר את הצינור הנותר לתוך הצומת האמפולרי-איסתמי ו isthmus3. לאחר כריתת אמפולה, לחתוך בין פניות חמש ושש כדי לקבל את הצומת אמפולרי-איסתמי; הצינור הנותר (להפוך שש לתחילת UTJ) הוא isthmus3.
- לאחר כריתה של infundibulum (קצה fimbrial וגבעול פרוקסימלי), excise את אזור אמפולרי על ידי חיתוך לאחר הסיבוב הבולט השני של הצינור (לחתוך בין פניות שתיים לשלוש, כ 1 ס"מ אורך). לבסוף, חתכו את החלק הנותר ל-UTJ, שהוא האזור האיסתמי (איור 3H).
- מיד הצמד להקפיא מקטעי רקמות ניתחו חנקן נוזלי עבור בידוד RNA או לתקן ולעבד כל קטע עבור הטבעה מכוונת וניתוח אימונוהיסטולוגי.
- הוסף 200 μL של ריאגנט מיצוי RNA קר ותערובת חרוז הומוגניזציה 1:1 (ראה טבלת חומרים) לרקמה אם ממשיכים להפקת RNA (ראה שלב 5.1).
4. ניתוק אובידוקט
- המשך משלב 3.1.1 לעיל) לניתוק אופטימלי של האפיתל, פתח את האובידוקט באזורים במידת האפשר (כלומר, אינפונביטולום ואמפולה) כדי לחשוף את האפיתל הזוהר (איור 4A).

איור 4: ניתוק תאים Oviduct, חלק 1. קריקטורה המציגה כיצד לחשוף את האפיתל הדיסטלי לניתוק תאים אופטימלי (A) ותמונה המציגה את הדרך הקלה ביותר להשתמש ברשת 1 מ"מ2 (B). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- החל באזור הפימבריאלי, באמצעות מלקחיים כמנוף, לחתוך את הצינור אורך עם מספריים בצורת קפיץ.
- טחנו את החלקים הפתוחים החריצים ואת האובידוקט הנותר למקטעים (גודל של כ-1-2 מ"מ) והוסיפו 5 מ"ל של מאגר דיסוציאציה חם ולא אנזימטי (ראו טבלת חומרים) ודגרו ב-37 מעלות צלזיוס.
- מחדש את חתיכות הרקמה ותאים מנותקים עם pipettor נורה כל 3 דקות במשך 9-10 דקות. לדלל את מאגר הדיסוציאציה 1:1 עם מדיום ביתור קר.
- לאסוף את התאים על ידי צנטריפוגה (350 x g, 3 דקות, 4 °C (50 °F). Resuspend התאים ב 2 מ"ל של מאגר תמוגה RBC במשך 2 דקות בטמפרטורת החדר, ולאחר מכן לדלל 1:1 עם מדיום ביתור קר.
- לאסוף את התאים על ידי צנטריפוגה (350 x g, 3 דקות, 4 °C (4 °F)) ו resuspend ב 5 מ"ל של פתרון פרונאז קר.
- דגר במדיום עיכול פרונאז ומחזיר את גושי התאים עם pipettor נורה כל 3-5 דקות עד השעיה תא יחיד מושגת (~ 25-30 דקות).
הערה: שלב זה מבוצע בצורה הטובה ביותר בלוח תרבית רקמות או בקבוקון כדי לאפשר התבוננות מתמדת המונעת חשיפת יתר מיותרת לפרונאז.
- דגר במדיום עיכול פרונאז ומחזיר את גושי התאים עם pipettor נורה כל 3-5 דקות עד השעיה תא יחיד מושגת (~ 25-30 דקות).
- העבירו את התאים דרך רשת מאקרו-שינוי סטרילית (רשת של 1 מ"מ x 1 מ"מ המודבקת לצינור חרוטי עם גומייה (איור 4B)) כדי להסיר את כל חלקי הרקמה הנותרים שאינם משויכים. לאסוף את התאים על ידי צנטריפוגה (350 x g, 3 דקות, 4 °C (60 °F) ו resuspend אותם במדיום קר המתאים לניתוח במורד הזרם (למשל, מאגר FACS אם ממשיכים עם כתמים עבור cytometry זרימה).
5. מיצוי RNA של מקטעי oviductal
- הומוגנייז דגימות הצמד קפוא ב 200 μL של ריאגנט מיצוי RNA ב biogenizer רקמת בלנדר כדור חרוזים ברמה 12 עבור שני מרווחים (3 דקות כל אחד) ב 4 °C (6 °F) באמצעות תערובת חרוז נירוסטה.
הערה: כדי לשמור על שלמות ה-RNA, יש להעביר דגימות באופן מיידי ממצב קפוא-הצמדה לריגנט מיצוי RNA ולא לשקול אותן. - לזמן קצר צנטריפוגה הומוגנית ב 100-200 x g בצנטריפוגה שולחן עבור כ 5 s בטמפרטורת החדר כדי להפריד את הנוזל מן החרוזים. מעבירים את הסופר-צינור לצינור טרי.
- הוסף עוד 200 μL של ריאגנט מיצוי RNA לחרוזים כדי לשחזר דגימות נוספות, ואחריו צנטריפוגה (100-200 x גרם, 5 s, טמפרטורת החדר). שלבו את הסופר-לאומיים.
הערה: השתמש בקצה פיפטה קטן (רוב הטיפים p200 מתאימים) כדי למנוע נשיאת חרוזים בעת הסרת supernatant. - פעל בהתאם להנחיות היצרן כדי לשלב RNA נפרד ומזרז. דגימות מייצגות היו מזורזים בן לילה ב -20 °C (100 °C עם 100% איזופרופנול (כ 2:1 נפח, איזופרופנול: התאושש שלב מימית).
- העבר את משקע ה- RNA המלא יחד עם הפתרון לעמודת ספין מחייבת RNA וצנטריפוגה למשך 30 שניות ב- 9,500 x g. לטהר את ה-RNA בעמודה בהתאם להנחיות היצרן, ולאחר מכן לברוח RNA ב 20 μL של מים ללא נוקלאז. להעריך את האיכות / כמות על ספקטרופוטומטר microvolume ו / או bioanalyzer.
תוצאות
פרוטוקול הניתוק המתואר מניב 100,000-120,000 תאים לעכבר עם איגום של שני oviducts. השיטה עדינה מספיק כדי להשאיר את גבולות התאים הרב-תכליתיים ללא פגע, ומאפשרת הבחנה בין תאים מרובי סיבים לתאי הפרשה, ומוודאת ששיטת העיכול עדינה מספיק כדי למנוע דה-הבחנה. תמונות אימונופלואורסצנטיות מייצגות באיור...
Discussion
שלושת המקטעים של האובידוקט הם היסטולוגיים, מורפולוגיים ונבדלים מבחינה תפקודית, 1,2,3. האפיתל משתנה מאוד מקצה אחד של oviduct למשנהו. תאים מסוכסכים שולטים בקצה הפימברי/לא-מימון, בעוד שתאי הפרשה שולטים באזור האיסתמי1. בעוד שיפוע כולל ...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה בחלקה על ידי פרס פריצת דרך של משרד ההגנה ל- AMW (BCRP W81XWH-14-1-0425). KCR נתמכה חלקית על ידי מלגות פנימיות: מלגת קדם-דוקטורט לסרטן Pease והמלגה לקדם-דוקטורט של מרי גאלווין נטל במדעים ביו-רפואיים ואוניברסיטת קליפורניה, ריברסייד, פרסים פנימיים: מענק מחקר עבודת הדוקטורט של ועדת האחווה של מועצת הבוגרים ופרס תוכנית שנת הדוקטורט של חטיבת הבוגרים. המחברים מודים לג'יליאן מ. רייט ואליסה מ. קומארי על הסיוע בפתרון בעיות מוקדם של שיטה זו.
Materials
| Name | Company | Catalog Number | Comments |
| 0.5 mm Stainless steel bead mix | Next Advance | SSB05 | Mix 1:1 with 1.4 mm SSB14B, sterilized |
| 1.4 mm Stainless steel bead mix | Next Advance | SSB14B | Mix 1:1 with 0.5 mm SSB05, sterilized |
| 1X Dulbecco's Phosphate Buffered Saline A, pH 7.4 (DPBS) | Gibco | 21600-010 | Cold, sterile |
| 25G needle | BD | 305122 | |
| 60 mm sterile petri dishes | Corning | 430166 | |
| 70 μm cell meshes | Fisherbrand | 22-636-548 | |
| Agilent Eukaryote Total RNA 6000 Pico Chip kit | Agilent 2100 Bioanalyzer | 5067-1513 | |
| Bead Bullet Blender Tissue Homogenizer | Next Advance | BBY24M | |
| Bioanlyzer | Agilent 2100 Bioanalyzer | ||
| Bovine serum albumin | Sigma Aldrich | A7906 | |
| Cold plate/pack/surface of choice | N/A | N/A | Kept at -20 °C for dissection |
| Dental wax | Polysciences Inc. | 403 | |
| Dulbecco’s Modified Eagle’s Medium (DMEM)/ Ham’s F12 | Corning | 10-090-CV | Prepare dissection medium: DMEM/ Ham’s F12, 10% FBS, 25 mM Hepes, 1% Pen-Strep |
| Fetal Bovine Serum | Corning | 35-015CV | |
| Fine point forceps of choice | N/A | N/A | |
| Glycine | Sigma Aldrich | G712b | Immunocytochemical validation images |
| Goat anti-mouse IgG Alexa Fluor 555 | Invitrogen | A-21422 | Immunocytochemical validation images |
| Goat anti-rabbit IgG Alexa Fluor 488 | Invitrogen | A-11001 | Immunocytochemical validation images |
| Hepes | Sigma Aldrich | H-3784 | |
| Hoescht 33342 | Cell Signaling Technologies | 4082S | Immunocytochemical validation images |
| Inverted compound microscope | Keyence BZ-X700 | ||
| Mouse anti-mouse Occludin | Invitrogen | 33-1500 | Immunocytochemical validation images |
| Non-enzymatic dissociation buffer | N/A | 5 mM EDTA, 1 g/L glucose, 0.4% BSA, 1X DPBS | |
| Nylon macro-mesh 1 mm x 1 mm | Thomas Scientific | 1210U04 | |
| Paraformaldehyde | Sigma Aldrich | P-6148 | Immunocytochemical validation images |
| Pen-Strep | MP Biomedicals | 10220-718 | |
| Prolong Gold Antifade Reagent | Cell Signaling Technologies | 9071S | Immunocytochemical validation images: antifade mounting medium |
| Pronase | Sigma Aldrich | 10165921001 | Prepare pronase digestion medium: 0.15% pronase in DMEM/Ham's F12, sterile |
| Propidium Iodide | Roche | 11 348 639 001 | Viability validation images |
| Rabbit anti-mouse Acetylated-Tubulin | Abcam | ab179484 | Immunocytochemical validation images |
| RBC lysis buffer | BD Biosciences | 555899 | |
| RNeasy Mini Kit | Qiagen | 74134 | Utilized for on-column purification in text |
| Spring form microdissection scissors | Roboz Surgical | RS-5610 | |
| Sterile 3 mL bulb pipettors | Globe Scientific | 137135 | |
| Toluidine blue | Alfa Aesar | J66015 | Prepare toluidine blue solution: 1% in 1X DPBS, sterile |
| Tris-Buffered Saline-Tween (TBST) | N/A | N/A | Immunocytochemical validation images; 0.1 N NaCl, 10 mM Tris-Cl pH 7.5, 1% Tween 20 |
| Triton-X-100 | Mallinckrodt Inc. | 3555 | Immunocytochemical validation images |
| Trizol RNA Extraction Reagent | Invitrogen | 15596026 | Referred to as RNA extraction reagent. Nucelase-free water, chloroform and isoproponal are required in supplement of performing Trizol extraction per manufacturer's guidelines |
References
- Stewart, C. A., et al., Kubiak, J. Z., et al. . Mouse oviduct developmemt in Mouse Development: From Oocyte to Stem Cells. , 247-262 (2012).
- Ford, M. J., et al. Oviduct epithelial cells constitute two developmentally distinct lineages that are spatially separated along the distal-proximal axis. Cell Reports. 36 (10), 109677 (2021).
- Harwalkar, K., et al. Anatomical and cellular heterogeneity in the mouse oviduct-its potential roles in reproduction and preimplantation development. Biology of Reproduction. 104 (6), 1249-1261 (2021).
- Agduhr, E. Studies on the structure and development of the bursa ovarica and the tuba uterina in the mouse. Acta Zoologica. 8 (1), 1 (1927).
- Pulkkinen, M. O. Oviductal function is critical for very early human life. Annals of Medicine. 27 (3), 307-310 (1995).
- Kindelberger, D. W., et al. Intraepithelial carcinoma of the fimbria and pelvic serous carcinoma: Evidence for a causal relationship. American Journal of Surgical Pathology. 31 (2), 161-169 (2007).
- Ghosh, A., Syed, S. M., Tanwar, P. S. In vivo genetic cell lineage tracing reveals that oviductal secretory cells self-renew and give rise to ciliated cells. Development. 144 (17), 3031-3041 (2017).
- Lee, Y., et al. A candidate precursor to serous carcinoma that originates in the distal fallopian tube. Journal of Pathology. 211 (1), 26-35 (2007).
- Kim, J., et al. High-grade serous ovarian cancer arises from fallopian tube in a mouse model. Proceedings of the National Academy of Sciences of the United States of America. 109 (10), 3921-3926 (2012).
- Perets, R., et al. Transformation of the fallopian tube secretory epithelium leads to high-grade serous ovarian cancer in Brca;Tp53;Pten models. Cancer Cell. 24 (6), 751-765 (2013).
- Sherman-Baust, C. A., et al. A genetically engineered ovarian cancer mouse model based on fallopian tube transformation mimics human high-grade serous carcinoma development. Journal of Pathology. 233 (3), 228-237 (2014).
- Zhai, Y. L., et al. High-grade serous carcinomas arise in the mouse oviduct via defects linked to the human disease. Journal of Pathology. 243 (1), 16-25 (2017).
- Karthikeyan, S., et al. Prolactin signaling drives tumorigenesis in human high grade serous ovarian cancer cells and in a spontaneous fallopian tube derived model. Cancer Letters. 433, 221-231 (2018).
- Shao, R., et al. Differences in prolactin receptor (PRLR) in mouse and human fallopian tubes: Evidence for multiple regulatory mechanisms controlling PRLR isoform expression in mice. Biology of Reproduction. 79 (4), 748-757 (2008).
- Alwosaibai, K., et al. PAX2 maintains the differentiation of mouse oviductal epithelium and inhibits the transition to a stem cell-like state. Oncotarget. 8 (44), 76881-76897 (2017).
- Peri, L. E., et al. A novel class of interstitial cells in the mouse and monkey female reproductive tracts. Biology of Reproduction. 92 (4), 102 (2015).
- Lõhmussaar, K., et al. Assessing the origin of high-grade serous ovarian cancer using CRISPR-modification of mouse organoids. Nature Communications. 11 (1), 2660 (2020).
- Chen, S., et al. An air-liquid interphase approach for modeling the early embryo-maternal contact zone. Scientific Reports. 7, 42298 (2017).
- Desjardins, P., Conklin, D. NanoDrop microvolume quantitation of nucleic acids. Journal of Visualized Experiments: JoVE. (45), e2565 (2010).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Molecular Biology. 7, 3 (2006).
- McGlade, E. A., et al. Cell-type specific analysis of physiological action of estrogen in mouse oviducts. The FASEB Journal. 35 (5), 21563 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved