É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Microdisseção e Dissociação do Ovídeo Murine: Identificação do Segmento Individual e Isolamento de Célula Única
Neste Artigo
Resumo
Um método de microdisseção do oviduto do camundongo que permite a coleta dos segmentos individuais, mantendo a integridade do RNA, é apresentado. Além disso, é descrito o procedimento de dissociação de células oviducais não enzimáticas. Os métodos são apropriados para análise genética e proteica subsequente dos segmentos oviductais funcionalmente diferentes e células oviductais dissociadas.
Resumo
Os sistemas de modelos de camundongos são incomparáveis para a análise dos processos da doença devido à sua manipulabilidade genética e ao baixo custo de tratamentos experimentais. No entanto, devido ao seu pequeno tamanho corporal, algumas estruturas, como o oviduto com diâmetro de 200-400 μm, provaram ser relativamente difíceis de estudar, exceto pela imunohistoquímica. Recentemente, estudos imunohistoquímicos descobriram diferenças mais complexas nos segmentos de oviduto do que foram reconhecidos anteriormente; assim, o oviduto é dividido em quatro segmentos funcionais com diferentes proporções de sete tipos distintos de células epiteliais. As diferentes origens embriológicas e as proporções dos tipos de células epiteliais provavelmente tornam as quatro regiões funcionais diferencialmente suscetíveis à doença. Por exemplo, lesões precursoras de carcinomas intraepiteliol são decorrentes do infundibulum em modelos de camundongos e da região fimbrial correspondente no tubo falópio humano. O protocolo descrito aqui detalha um método de microdisseção para subdividir o oviduto de forma a produzir uma quantidade e pureza suficientes de RNA necessárias para análise a jusante, como a transcrição reversa-quantitativa PCR (RT-qPCR) e o sequenciamento de RNA (RNAseq). Também é descrito um método de dissociação de tecido não enzimático apropriado para citometria de fluxo ou análise rnaseq de células totalmente diferenciadas. Os métodos descritos facilitarão novas pesquisas utilizando o oviduto murino no campo da reprodução, fertilidade, câncer e imunologia.
Introdução
O oviduto murine é semelhante em função e morfologia ao tubo de falópio humano1. Ambos consistem em um epitélio ciliado pseudoesstratificado, consistindo de duas células residentes epiteliais historicamente descritas: células ciliadas e células secretas1,2. O oviduto possui três segmentos reconhecidos clássicamente: o infundibulum, a ampulla e o istmo. Em um estudo recente, Harwalkar et al. 3 investigou morfologia oviduca e expressão genética levando à expansão da categorização das células epiteliais residentes para sete populações distintas. Além disso, estabeleceram a junção ampullary-istmo como um segmento distinto do oviduct3. O método descrito aqui, que se concentra no infundibulum, ampulla e istmo, poderia facilmente ser estendido para incluir a junção ampuloso-istmímica, bem como 2,3. A região infundibular contém o ostium, ou abertura do oviduto, e inclui a região fimbrial, bem como o talo proximal. Movendo-se em direção ao útero, em seguida é a ampola, e, em seguida, o istmo. As células ciliadas são mais proeminentes na extremidade distal da região, proximal ao ovário, ou infundibulum, enquanto as células secretary são mais proeminentes no final proximal ou segmento de istmo1. Ao contrário do tubo de falópio humano, o oviduto de murina é uma estrutura enrolada apoiada pelo mesosalpinx, uma extensão do peritônio ligamento largo1,4. Além disso, o oviduto do rato é envolto em um saco de bursal que aumenta a probabilidade de transferência de oócito para o oviduct4. A ampola é identificada como a localização da fertilização, a partir da qual embriões em desenvolvimento passam para o istmo antes de entrar no útero5. Os segmentos tubais têm 200-400 μm de diâmetro e as regiões mais longas e antumes têm aproximadamente 0,5-1,0 cm de comprimento4. Os distendes oviduto durante o ciclo estrous e a ampola e o infundibulum são mais distensíveis do que o istmo1.
Sobre a proliferação de células, especialmente células secretas, caracterizam lesões precursoras de tumores soros encontrados na cavidade pélvica6. Essas lesões intraeteliais peréluas precursoras surgem no epitélio oviduto apenas na região fimbrial; não se sabe por que a formação da lesão se restringe a essa região onde normalmente o tipo de célula predominante é ciliado, não secretor2,7,8. A regionalidade em termos de função fisiológica normal, bem como o aumento do interesse pela origem ovidutal do câncer de ovário9,10,11,12,13, ressalta a importância da avaliação separada dos segmentos de oviduto.
O método descrito aqui detalha a coleta de segmentos oviductais separados para análises subsequentes a jusante da expressão genética específica do segmento e função de células dissociadas. Tradicionalmente, muitos tecidos são processados para extração de RNA inteiro seguindo o fenol: método de clorofórmio ou um método de extração completa na coluna; no entanto, descobrimos que a qualidade do RNA foi mantida enquanto produzia rendimento suficiente com o método de combinação descrito. Utilizando esse método, segmentos funcionais muito pequenos do oviduto podem ser processados para análises a jusante em vez de investigar o oviduto como um todo, o que pode mascarar resultados representativos dos diferentes segmentos14.
As células oviductais murinas dissociadas raramente têm sido investigadas pela citometria de fluxo, provavelmente devido ao rendimento celular limitante deste tecido. Uma abordagem para superar esse problema tem sido dissociar as células, cultivá-las na cultura e, em seguida, estimular a re-diferenciação in vitro para obter números celulares apropriados para análise celular a jusante15,16,17,18. Uma limitação a essa abordagem é o tempo ex vivo e microambiente alterado na cultura, ambos os quais provavelmente mudam a expressão genética. Há também a suposição de que a reeferirrecialidade morfológica tem a mesma assinatura transcricional e proteômica que estava presente no animal intacto. O método de dissociação atual foi projetado para alcançar o maior número de células epiteliais em uma população de células ovidutoras heterogêneas, mantendo a diferenciação de células únicas. Além disso, a abordagem não enzimática provavelmente limita a perda de proteínas da superfície celular.
Protocolo
Todos os procedimentos e manejo de animais foram aprovados pela Universidade da Califórnia, pelo comitê institucional de cuidados e uso de animais de Riverside e estavam de acordo com as diretrizes da Associação Americana de Cuidados de Animais de Laboratório, do Departamento de Agricultura dos Estados Unidos e dos Institutos Nacionais de Saúde. O método descrito utilizou camundongos adultos C57BL/6. Todos os animais foram eutanizados por decapitação antes da colheita de tecidos.
NOTA: Uma visão geral do protocolo, que usa um corante azul para auxiliar na dissecção eficiente e descoilação do oviduto, é mostrada na primeira figura (Figura 1).
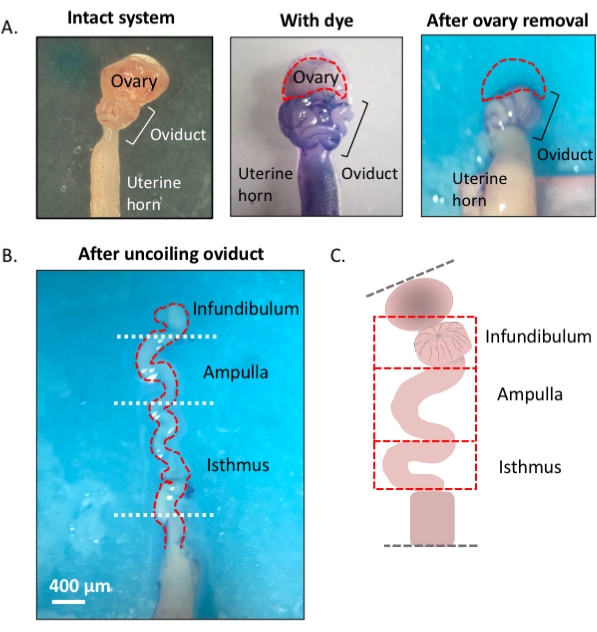
Figura 1: Visão geral do método de microdisseção. (A) O painel esquerdo mostra a estrutura intacta da qual a maior parte da almofada de gordura ovariana e os restos de tecido conjuntivo ao redor do oviduto foram removidos. Depois disso, a adição de azul toluidina ajuda a distinguir as bobinas do oviduto (painel médio). O painel direito mostra estruturas após a remoção do ovário. (B) Um oviduto descamado com curvas internas para determinar onde cada segmento começa e termina. c Desenho animado da segmentação utilizada (não desenhada para escala). Clique aqui para ver uma versão maior desta figura.
1. Preparação da superfície de dissecção
- Fixar um pedaço de cera dentária em uma placa de Petri com adesivo e deixá-lo secar (Figura 2A). Higienize o prato com 70% de etanol. A superfície está pronta para dissecção.
2. Macrodisseção do ovário, oviduto e útero
- Imobilize a placa de Petri contendo a cera dentária em uma plataforma fria de escolha (por exemplo, uma bolsa de gelo mantida a -20 °C antes do uso) sob um microscópio de dissecção quando pronta para dissecção (Figura 2A).
- Desinfete a superfície ventral do animal com 70% de etanol. Abra a cavidade abdominal e pélvica com uma tesoura de dissecção estéril e mova o trato gastrointestinal para um lado para localizar o útero bihornal dorsal. Siga cada chifre uterino rostrally para localizar cada oviduto e ovário envolto na almofada de gordura uterina, encontrada logo abaixo do rim (Figura 2B,C).
- Extirpa ambos os ovidutos laterais com os ovários e uma porção do chifre uterino distal ainda preso usando tesoura de dissecção. Corte cada chifre uterino lateral com aproximadamente 1-2 cm da buzina ainda presa ao ovídeo enrolado e ovário (Figura 2D). Submergir o tecido imediatamente em 2 mL de meio de dissecção a frio (ver Tabela de materiais).
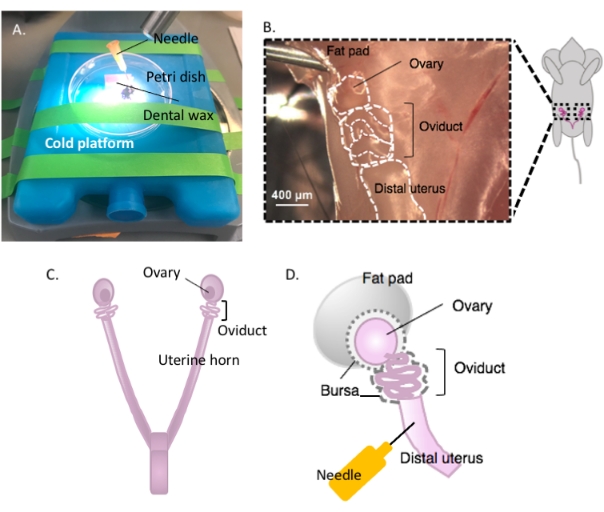
Figura 2: Macrodisseção do ovário e da configuração de dissecção. O oviduto está localizado dorsalmente na cavidade pélvica na base do rim dentro da almofada de gordura ovariana (B). Localize a bifurcação uterina na cavidade pélvica (C) e siga o chifre uterino lateral para localizar o contínuo uterino-ovulo (B). Remova essas estruturas cortando através de um chifre uterino e dissecção grosseira. Coloque na plataforma de dissecação (A) e afixe a porção uterina à cera dentária com uma agulha (A e D). Clique aqui para ver uma versão maior desta figura.
NOTA: Deixe chifre uterino suficiente intacto e anexado ao oviduto para permitir a fixação à plataforma de dissecção (Figura 2D).
- Fixar o tecido uterino à cera dentária com uma agulha estéril de 25 G para fixar tecido para dissecção (Figura 2A,D e Figura 3A). Trabalhando sob o microscópio de dissecção, limpe e disseca o bloco de gordura ovariana e o tecido conjuntivo para permitir uma visualização clara do oviduto (Figura 3B).

Figura 3: Passo a passo oviduto microdissection. Após a remoção de gordura remanescente e tecido conjuntivo (A,B), adicione azul toluidina ao tecido (C) e depois lave para facilitar a visualização e posterior remoção do ovário e descoilamento do tubo (D-H). O infundibulum pode ser encontrado ao lado do istmo proximal e junção uterina-tubal (UTJ). Puxe levemente a extremidade distal enquanto corta no mesosalpinx para desenrolar e revelar as voltas endógenas do oviduto (H) para orientar para a segmentação adequada. Figura A-C barra de escala = 500 μm, barra de escala D-H = 400 μm (I) Desenho animado dos vários segmentos (não atraídos para escala). Clique aqui para ver uma versão maior desta figura.
- Utilizando uma seringa de 1 mL, dispense e incuba o oviduto afixado no útero em 1-2 gotas de solução de corante azul toluidina de 1% para 30 s-1 min. Enxágüe com soro fisiológico a frio tamponado de Fosfato (DPBS) e remova todo o líquido (Figura 3C).
- Puxe levemente o ovário do oviduto enrolado e corte na membrana bursal e ligamento largo para remover o ovário do ovídio sem comprometer o tecido tubal (Figura 3D,E).
NOTA: O ovário não está ligado ao oviduto, mas envolto na membrana bursal com o oviduto (Figura 2D) e conectado ao lado lateral do útero através do ligamento largo.
3. Microdisseção e segmentação do oviduto
- Localize a extremidade distal e fimbrial do oviduto encontrado lateralmente à junção uterina-tubal (UTJ). O oviduto coils de volta em si mesmo; portanto, a extremidade fimbrial pode ser localizada lateralmente à extremidade proximal e é um ponto de partida apropriado para orientar para a descoilação do oviduto (Figura 3F,I).
- Enquanto puxa suavemente o tubo, corte o mesosalpinx (Figura 3I) com micro-tesoura de forma de mola para desenrolar o oviduto (Figura 3G).
- Uma vez desembrado, corte o tubo para produzir as regiões infundibular, ampullary e ítmica (Figura 3H).
- Após a excisão do infundibulum (extremidade fimbrial e talo proximal), extirgue a região ampullary cortando após a segunda curva proeminente do tubo (corte entre as curvas dois e três, aproximadamente 1 cm de comprimento). Por fim, corte a parte restante para a UTJ, que é a região ítmica (Figura 3H).
NOTA: O oviduto não vai desenrolar completamente em uma estrutura reta. O tubo manterá suas curvas (Figura 3H)3. Com base nas curvas subsequentes após a região amprária, pode-se segmentar ainda mais o tubo restante para a junção ampulo-istmímica e isthmus3. Após a excisão de ampulla, corte entre as curvas cinco e seis para obter a junção ampulo-ítmica; o tubo restante (gire seis para o início do UTJ) é o isthmus3.
- Após a excisão do infundibulum (extremidade fimbrial e talo proximal), extirgue a região ampullary cortando após a segunda curva proeminente do tubo (corte entre as curvas dois e três, aproximadamente 1 cm de comprimento). Por fim, corte a parte restante para a UTJ, que é a região ítmica (Figura 3H).
- Imediatamente o congelamento de segmentos de tecido dissecado em nitrogênio líquido para isolamento ou correção de RNA e processe cada segmento para incorporação orientada e análise imunohistológica.
- Adicione 200 μL de reagente de extração de RNA frio e 1:1 mistura de contas de homogeneização (ver Tabela de materiais) ao tecido se proceder à extração de RNA (ver passo 5.1).
4. Dissociação de Oviduto
- Continuado a partir da etapa 3.1.1 acima) Para a dissociação ideal do epitélio, abra o oviduto nas áreas sempre que possível (ou seja, infundibulum e ampulla) para expor o epitélio luminal (Figura 4A).

Figura 4: Dissociação celular oviduto, parte 1. Desenho animado mostrando como expor o epitélio distal para a dissociação celular ideal (A) e uma imagem mostrando a maneira mais fácil de usar a malha de 1 mm2 (B). Clique aqui para ver uma versão maior desta figura.
- Começando na região fimbrial, usando fórceps como alavanca, corte o tubo longitudinalmente com uma tesoura em forma de mola.
- Pique as porções abertas e o restante em segmentos (~1-2 mm de tamanho) e adicione 5 mL de tampão de dissociação quente e não enzimático (ver Tabela de Materiais) e incubar a 37 °C.
- Resuspenda as peças de tecido e células dissociadas com um pipettor de lâmpada a cada 3 minutos por 9-10 min. Diluir o tampão de dissociação 1:1 com meio de dissecção a frio.
- Recolher as células por centrifugação (350 x g, 3 min, 4 °C). Resuspenquei as células em 2 mL de tampão de lise RBC por 2 min a temperatura ambiente e, em seguida, dilua 1:1 com meio de dissecção a frio.
- Colete as células por centrifugação (350 x g, 3 min, 4 °C) e resuspende em 5 mL de solução de pronase fria.
- Incubar em meio de digestão de pronase e resuspenir os aglomerados celulares com um pipettor de lâmpada a cada 3-5 minutos até que uma única suspensão celular seja alcançada (~25-30 min).
NOTA: Esta etapa é melhor executada em uma placa de cultura de tecido ou frasco para permitir observação constante prevenindo a superexposição desnecessária à pronase.
- Incubar em meio de digestão de pronase e resuspenir os aglomerados celulares com um pipettor de lâmpada a cada 3-5 minutos até que uma única suspensão celular seja alcançada (~25-30 min).
- Passe as células através de uma macro-malha estéril (malha de 1 mm x 1 mm afixada em um tubo cônico com um elástico (Figura 4B)) para remover quaisquer pedaços de tecido não dissociados restantes. Colete as células por centrifugação (350 x g, 3 min, 4 °C) e resuspensá-las em um meio frio apropriado para análise a jusante (por exemplo, tampão FACS se continuar com a coloração para citometria de fluxo).
5. Extração de RNA de segmentos ovidutores
- Homogeneize amostras congeladas em 200 μL de reagente de extração de RNA em um homogeneizador de tecido de liquidificador de bala de contas no nível 12 para dois intervalos (3 min cada) a 4 °C usando a mistura de contas de aço inoxidável.
NOTA: Para preservar a integridade do RNA, as amostras devem ser imediatamente movidas do estado congelado por snap para o reagente de extração de RNA e não pesadas. - Resumidamente centrífuga homogeneizar a 100-200 x g em uma centrífuga de mesa por aproximadamente 5 s à temperatura ambiente para separar o líquido das contas. Transfira o supernatante para um tubo fresco.
- Adicione mais 200 μL de reagente de extração de RNA às contas para recuperar mais amostras, seguido de centrifugação (100-200 x g, 5 s, temperatura ambiente). Combine os supernantes.
NOTA: Use uma pequena ponta de pipeta (a maioria das pontas p200 são adequadas) para evitar a recostura das contas ao remover o supernatante. - Siga as diretrizes do fabricante para separar e precipitar o RNA. Amostras representativas foram precipitadas durante a noite a -20 °C com isopropanol 100% (aproximadamente 2:1 volume, isopropanol: fase aquosa recuperada).
- Transfira o RNA completo precipitado juntamente com a solução para uma coluna de giro de ligação RNA e centrífuga para 30 s a 9.500 x g. Purifique o RNA na coluna de acordo com as diretrizes do fabricante e, em seguida, elute o RNA em 20 μL de água livre de nuclease. Avalie a qualidade/quantidade em um espectrofotômetro microvolume e/ou bioanalítulo.
Resultados
O protocolo de dissociação descrito produz 100.000-120.000 células por rato com agrupamento de ambos os ovidutos. O método é suave o suficiente para deixar intactas as bordas celulares multi-ciliadas, permitindo uma distinção entre células multi-ciliadas e células secretas, e verificando se o método de digestão é suave o suficiente para evitar a desfagnáslica. Imagens representativas de imunofluorescência na Figura 5 mostram pequenos aglomerados de células após a etapa 4.2.1,...
Discussão
Os três segmentos do oviduto são histologicamente, morfologicamente, e funcionalmente distintos1,2,3. O epitélio varia muito de uma extremidade do oviduto para a outra. As células ciliadas dominam na extremidade fimbrial/infundibular, enquanto as células secretas dominam na região ítmica1. Embora este gradiente geral tenha sido reconhecido há algum tempo, o trabalho recente tem descoberto mais dis...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado em parte por um DoD Breakthrough Award para a AMW (BCRP W81XWH-14-1-0425). A KCR foi parcialmente apoiada por bolsas intramuros: a Pease Cancer Pre-Doctoral Fellowship e a Mary Galvin Burden Pre-Doctoral Fellowship in Biomedical Sciences and University of California, Riverside, intramural awards: the Graduate Council Fellowship Committee Dissertation Research Grant and the Graduate Division Dissertation Year Program Award. Os autores agradecem a Gillian M. Wright e Alyssa M. Kumari pela ajuda na solução precoce de problemas deste método.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.5 mm Stainless steel bead mix | Next Advance | SSB05 | Mix 1:1 with 1.4 mm SSB14B, sterilized |
| 1.4 mm Stainless steel bead mix | Next Advance | SSB14B | Mix 1:1 with 0.5 mm SSB05, sterilized |
| 1X Dulbecco's Phosphate Buffered Saline A, pH 7.4 (DPBS) | Gibco | 21600-010 | Cold, sterile |
| 25G needle | BD | 305122 | |
| 60 mm sterile petri dishes | Corning | 430166 | |
| 70 μm cell meshes | Fisherbrand | 22-636-548 | |
| Agilent Eukaryote Total RNA 6000 Pico Chip kit | Agilent 2100 Bioanalyzer | 5067-1513 | |
| Bead Bullet Blender Tissue Homogenizer | Next Advance | BBY24M | |
| Bioanlyzer | Agilent 2100 Bioanalyzer | ||
| Bovine serum albumin | Sigma Aldrich | A7906 | |
| Cold plate/pack/surface of choice | N/A | N/A | Kept at -20 °C for dissection |
| Dental wax | Polysciences Inc. | 403 | |
| Dulbecco’s Modified Eagle’s Medium (DMEM)/ Ham’s F12 | Corning | 10-090-CV | Prepare dissection medium: DMEM/ Ham’s F12, 10% FBS, 25 mM Hepes, 1% Pen-Strep |
| Fetal Bovine Serum | Corning | 35-015CV | |
| Fine point forceps of choice | N/A | N/A | |
| Glycine | Sigma Aldrich | G712b | Immunocytochemical validation images |
| Goat anti-mouse IgG Alexa Fluor 555 | Invitrogen | A-21422 | Immunocytochemical validation images |
| Goat anti-rabbit IgG Alexa Fluor 488 | Invitrogen | A-11001 | Immunocytochemical validation images |
| Hepes | Sigma Aldrich | H-3784 | |
| Hoescht 33342 | Cell Signaling Technologies | 4082S | Immunocytochemical validation images |
| Inverted compound microscope | Keyence BZ-X700 | ||
| Mouse anti-mouse Occludin | Invitrogen | 33-1500 | Immunocytochemical validation images |
| Non-enzymatic dissociation buffer | N/A | 5 mM EDTA, 1 g/L glucose, 0.4% BSA, 1X DPBS | |
| Nylon macro-mesh 1 mm x 1 mm | Thomas Scientific | 1210U04 | |
| Paraformaldehyde | Sigma Aldrich | P-6148 | Immunocytochemical validation images |
| Pen-Strep | MP Biomedicals | 10220-718 | |
| Prolong Gold Antifade Reagent | Cell Signaling Technologies | 9071S | Immunocytochemical validation images: antifade mounting medium |
| Pronase | Sigma Aldrich | 10165921001 | Prepare pronase digestion medium: 0.15% pronase in DMEM/Ham's F12, sterile |
| Propidium Iodide | Roche | 11 348 639 001 | Viability validation images |
| Rabbit anti-mouse Acetylated-Tubulin | Abcam | ab179484 | Immunocytochemical validation images |
| RBC lysis buffer | BD Biosciences | 555899 | |
| RNeasy Mini Kit | Qiagen | 74134 | Utilized for on-column purification in text |
| Spring form microdissection scissors | Roboz Surgical | RS-5610 | |
| Sterile 3 mL bulb pipettors | Globe Scientific | 137135 | |
| Toluidine blue | Alfa Aesar | J66015 | Prepare toluidine blue solution: 1% in 1X DPBS, sterile |
| Tris-Buffered Saline-Tween (TBST) | N/A | N/A | Immunocytochemical validation images; 0.1 N NaCl, 10 mM Tris-Cl pH 7.5, 1% Tween 20 |
| Triton-X-100 | Mallinckrodt Inc. | 3555 | Immunocytochemical validation images |
| Trizol RNA Extraction Reagent | Invitrogen | 15596026 | Referred to as RNA extraction reagent. Nucelase-free water, chloroform and isoproponal are required in supplement of performing Trizol extraction per manufacturer's guidelines |
Referências
- Stewart, C. A., et al., Kubiak, J. Z., et al. . Mouse oviduct developmemt in Mouse Development: From Oocyte to Stem Cells. , 247-262 (2012).
- Ford, M. J., et al. Oviduct epithelial cells constitute two developmentally distinct lineages that are spatially separated along the distal-proximal axis. Cell Reports. 36 (10), 109677 (2021).
- Harwalkar, K., et al. Anatomical and cellular heterogeneity in the mouse oviduct-its potential roles in reproduction and preimplantation development. Biology of Reproduction. 104 (6), 1249-1261 (2021).
- Agduhr, E. Studies on the structure and development of the bursa ovarica and the tuba uterina in the mouse. Acta Zoologica. 8 (1), 1 (1927).
- Pulkkinen, M. O. Oviductal function is critical for very early human life. Annals of Medicine. 27 (3), 307-310 (1995).
- Kindelberger, D. W., et al. Intraepithelial carcinoma of the fimbria and pelvic serous carcinoma: Evidence for a causal relationship. American Journal of Surgical Pathology. 31 (2), 161-169 (2007).
- Ghosh, A., Syed, S. M., Tanwar, P. S. In vivo genetic cell lineage tracing reveals that oviductal secretory cells self-renew and give rise to ciliated cells. Development. 144 (17), 3031-3041 (2017).
- Lee, Y., et al. A candidate precursor to serous carcinoma that originates in the distal fallopian tube. Journal of Pathology. 211 (1), 26-35 (2007).
- Kim, J., et al. High-grade serous ovarian cancer arises from fallopian tube in a mouse model. Proceedings of the National Academy of Sciences of the United States of America. 109 (10), 3921-3926 (2012).
- Perets, R., et al. Transformation of the fallopian tube secretory epithelium leads to high-grade serous ovarian cancer in Brca;Tp53;Pten models. Cancer Cell. 24 (6), 751-765 (2013).
- Sherman-Baust, C. A., et al. A genetically engineered ovarian cancer mouse model based on fallopian tube transformation mimics human high-grade serous carcinoma development. Journal of Pathology. 233 (3), 228-237 (2014).
- Zhai, Y. L., et al. High-grade serous carcinomas arise in the mouse oviduct via defects linked to the human disease. Journal of Pathology. 243 (1), 16-25 (2017).
- Karthikeyan, S., et al. Prolactin signaling drives tumorigenesis in human high grade serous ovarian cancer cells and in a spontaneous fallopian tube derived model. Cancer Letters. 433, 221-231 (2018).
- Shao, R., et al. Differences in prolactin receptor (PRLR) in mouse and human fallopian tubes: Evidence for multiple regulatory mechanisms controlling PRLR isoform expression in mice. Biology of Reproduction. 79 (4), 748-757 (2008).
- Alwosaibai, K., et al. PAX2 maintains the differentiation of mouse oviductal epithelium and inhibits the transition to a stem cell-like state. Oncotarget. 8 (44), 76881-76897 (2017).
- Peri, L. E., et al. A novel class of interstitial cells in the mouse and monkey female reproductive tracts. Biology of Reproduction. 92 (4), 102 (2015).
- Lõhmussaar, K., et al. Assessing the origin of high-grade serous ovarian cancer using CRISPR-modification of mouse organoids. Nature Communications. 11 (1), 2660 (2020).
- Chen, S., et al. An air-liquid interphase approach for modeling the early embryo-maternal contact zone. Scientific Reports. 7, 42298 (2017).
- Desjardins, P., Conklin, D. NanoDrop microvolume quantitation of nucleic acids. Journal of Visualized Experiments: JoVE. (45), e2565 (2010).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Molecular Biology. 7, 3 (2006).
- McGlade, E. A., et al. Cell-type specific analysis of physiological action of estrogen in mouse oviducts. The FASEB Journal. 35 (5), 21563 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados