Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Microdisección y disociación del oviducto murino: identificación de segmentos individuales y aislamiento unicelular
En este artículo
Resumen
Se presenta un método para la microdisección del oviducto de ratón que permite la recolección de los segmentos individuales mientras se mantiene la integridad del ARN. Además, se describe el procedimiento de disociación de células oviductales no enzimáticas. Los métodos son apropiados para el posterior análisis de genes y proteínas de los segmentos oviductales funcionalmente diferentes y las células oviductales disociadas.
Resumen
Los sistemas modelo de ratón son inigualables para el análisis de procesos de enfermedad debido a su manipulabilidad genética y al bajo costo de los tratamientos experimentales. Sin embargo, debido a su pequeño tamaño corporal, algunas estructuras, como el oviducto con un diámetro de 200-400 μm, han demostrado ser relativamente difíciles de estudiar excepto por inmunohistoquímica. Recientemente, los estudios inmunohistoquímicos han descubierto diferencias más complejas en los segmentos del oviducto de lo que se reconocía anteriormente; por lo tanto, el oviducto se divide en cuatro segmentos funcionales con diferentes proporciones de siete tipos distintos de células epiteliales. Los diferentes orígenes embriológicos y las proporciones de los tipos de células epiteliales probablemente hacen que las cuatro regiones funcionales sean diferencialmente susceptibles a la enfermedad. Por ejemplo, las lesiones precursoras de los carcinomas intraepiteliales serosos surgen del infundíbulo en modelos de ratón y de la región fimbrial correspondiente en la trompa de Falopio humana. El protocolo descrito aquí detalla un método de microdisección para subdividir el oviducto de tal manera que produzca una cantidad y pureza suficientes de ARN necesarias para el análisis posterior, como la transcripción inversa-PCR cuantitativa (RT-qPCR) y la secuenciación de ARN (RNAseq). También se describe un método de disociación tisular en su mayoría no enzimático apropiado para la citometría de flujo o el análisis RNAseq unicelular de células oviductales totalmente diferenciadas. Los métodos descritos facilitarán la investigación adicional utilizando el oviducto murino en el campo de la reproducción, la fertilidad, el cáncer y la inmunología.
Introducción
El oviducto murino es similar en función y morfología a la trompa de Falopio humana1. Ambos consisten en un epitelio ciliado pseudoestratificado, formado por dos células residentes epiteliales históricamente descritas: células ciliadas y células secretoras1,2. El oviducto tiene tres segmentos clásicamente reconocidos: el infundíbulo, la ampolla y el istmo. En un estudio reciente, Harwalkar et al. 3 investigó la morfología del oviducto y la expresión génica que condujo a la expansión de la categorización de las células epiteliales residentes a siete poblaciones distintas. Además, establecieron la unión ampular-istmo como un segmento distinto del oviducto3. El método aquí descrito, que se centra en el infundíbulo, la ampolla y el istmo, podría ampliarse fácilmente para incluir también la unión ampular-ístmica2,3. La región infundibular contiene el ostium, o abertura del oviducto, e incluye la región fimbrial, así como el tallo proximal. Moviéndose hacia el útero, luego está la ampolla y luego el istmo. Las células ciliadas son más prominentes en el extremo distal de la región, proximal al ovario o infundíbulo, mientras que las células secretoras son más prominentes en el extremo proximal o segmento del istmo1. A diferencia de la trompa de Falopio humana, el oviducto murino es una estructura en espiral sostenida por el mesosalpinx, una extensión del ligamento ancho peritoneo1,4. Además, el oviducto del ratón está encerrado en un saco bursal que aumenta la probabilidad de transferencia de ovocitos al oviducto4. La ampolla se identifica como la ubicación de la fertilización, desde la cual los embriones en desarrollo pasan al istmo antes de entrar en el útero5. Los segmentos tubáricos tienen un diámetro de 200-400 μm y las regiones ampulares e istmo más largas tienen aproximadamente 0,5-1,0 cm de longitud4. El oviducto se distiende durante el ciclo estral y la ampolla y el infundíbulo son más distensibles que el istmo1.
La sobreproliferación de células, especialmente las células secretoras, caracterizan lesiones precursoras de tumores serosos que se encuentran en la cavidad pélvica6. Estas lesiones intraepiteliales serosas precursoras surgen en el epitelio del oviducto únicamente en la región fimbrial; se desconoce por qué la formación de lesiones se restringe a esta región donde normalmente el tipo celular predominante es ciliado, no secretor2,7,8. La regionalidad en términos de función fisiológica normal, así como el mayor interés en el origen oviductal del cáncer de ovario9,10,11,12,13, subraya la importancia de la evaluación separada de los segmentos del oviducto.
El método descrito aquí detalla la recolección de segmentos oviductales separados para posteriores análisis posteriores de la expresión génica específica del segmento y la función de las células disociadas. Tradicionalmente, muchos tejidos se procesan para la extracción de ARN completo siguiendo el método de fenol: cloroformo o un método de extracción completa en columna; sin embargo, se encontró que la calidad del ARN se mantuvo mientras se producía un rendimiento suficiente con el método de combinación descrito. Utilizando este método, se pueden procesar segmentos funcionales muy pequeños del oviducto para análisis posteriores en lugar de investigar el oviducto en su conjunto, lo que puede enmascarar resultados representativos de los diferentes segmentos14.
Las células oviductales murinas disociadas rara vez se han investigado mediante citometría de flujo, muy probablemente debido a la limitación del rendimiento celular de este tejido. Un enfoque para superar este problema ha sido disociar las células, cultivarlas en cultivo y luego estimular la rediferenciación in vitro para obtener números celulares apropiados para el análisis celular aguas abajo15,16,17,18. Una limitación de este enfoque es el tiempo ex vivo y el microambiente alterado en cultivo, los cuales probablemente cambian la expresión génica. También se supone que la rediferenciación morfológica tiene la misma firma transcripcional y proteómica que estaba presente en el animal intacto. El método de disociación actual fue diseñado para lograr el mayor número de células epiteliales en una población heterogénea de células oviductales mientras se mantiene la diferenciación de una sola célula. Además, el enfoque en su mayoría no enzimático probablemente limita la pérdida de proteínas de la superficie celular.
Protocolo
Todos los manejos y procedimientos de animales fueron aprobados por el comité institucional de cuidado y uso de animales de la Universidad de California, Riverside y estuvieron de acuerdo con las pautas de la Asociación Americana para el Cuidado de Animales de Laboratorio, el Departamento de Agricultura de los Estados Unidos y los Institutos Nacionales de Salud. El método descrito utilizó C57BL / 6 ratones adultos, hembras. Todos los animales fueron sacrificados por decapitación antes de la recolección de tejidos.
NOTA: En la primera figura (Figura 1) se muestra una descripción general del protocolo, que utiliza un tinte azul para ayudar a la disección eficiente y el desenrollamiento del oviducto.
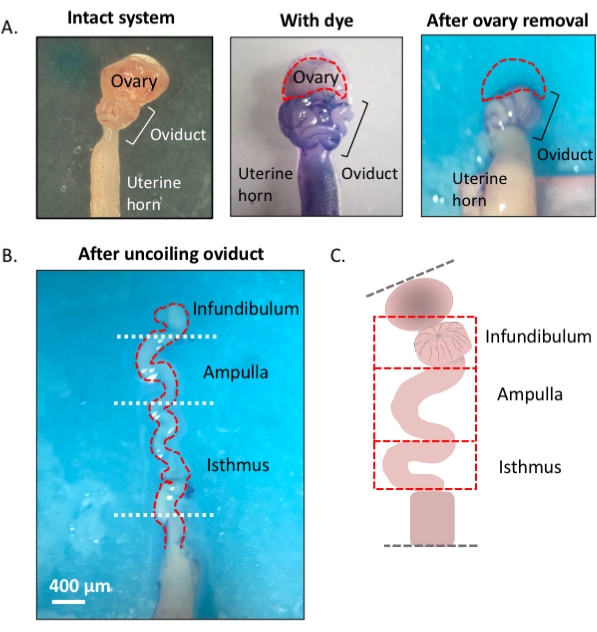
Figura 1: Descripción general del método de microdisección. (A) El panel izquierdo muestra la estructura intacta de la que se han eliminado la mayor parte de la almohadilla de grasa ovárica y los restos de tejido conectivo que rodean el oviducto. Después de esto, la adición de azul toluidina ayuda a distinguir las bobinas del oviducto (panel central). El panel derecho muestra las estructuras después de la extirpación del ovario. (B) Un oviducto sin enrollar con giros internos para determinar dónde comienza y termina cada segmento. (C) Caricatura de la segmentación utilizada (no dibujada a escala). Haga clic aquí para ver una versión más grande de esta figura.
1. Preparación de la superficie de disección
- Coloque un trozo de cera dental en una placa de Petri con adhesivo y déjelo secar (Figura 2A). Desinfectar el plato con etanol al 70%. La superficie está lista para la disección.
2. Macrodisección del ovario, oviducto y útero
- Inmovilizar la placa de Petri que contiene la cera dental en una plataforma fría de elección (por ejemplo, una bolsa de hielo mantenida a -20 °C antes de su uso) bajo un microscopio de disección cuando esté lista para la disección (Figura 2A).
- Desinfectar la superficie ventral del animal con etanol al 70%. Abra la cavidad abdominal y pélvica con tijeras de disección estériles y mueva el tracto gastrointestinal hacia un lado para localizar el útero bihornal dorsal. Siga cada cuerno uterino rostralmente para localizar cada oviducto y ovario envuelto en la almohadilla de grasa uterina, que se encuentra justo debajo del riñón (Figura 2B, C).
- Extirpar ambos oviductos laterales con los ovarios y una porción del cuerno uterino distal todavía unido usando tijeras de disección. Corte cada cuerno uterino lateral con aproximadamente 1-2 cm del cuerno aún unido al oviducto en espiral y al ovario (Figura 2D). Sumergir el tejido inmediatamente en 2 ml de medio de disección en frío (ver Tabla de materiales).
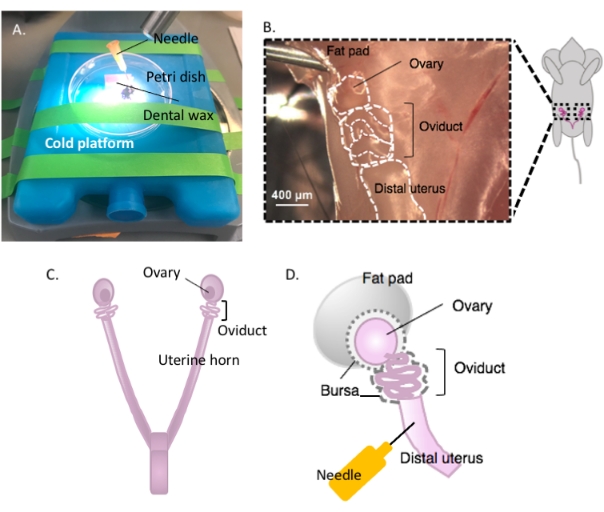
Figura 2: Macrodisección del ovario y configuración de la disección. El oviducto se encuentra dorsalmente en la cavidad pélvica en la base del riñón dentro de la almohadilla de grasa ovárica (B). Localice la bifurcación uterina en la cavidad pélvica (C) y siga el cuerno uterino lateral para localizar el continuo útero-oviducto-ovario (B). Elimine estas estructuras cortando a través de un cuerno uterino y una disección gruesa. Coloque en la plataforma de disección (A) y fije la porción uterina a la cera dental con una aguja (A y D). Haga clic aquí para ver una versión más grande de esta figura.
NOTA: Deje suficiente cuerno uterino intacto y unido al oviducto para permitir la fijación a la plataforma de disección (Figura 2D).
- Coloque el tejido uterino en la cera dental con una aguja estéril de 25 G para asegurar el tejido para la disección (Figura 2A, D y Figura 3A). Trabajando bajo el microscopio de disección, limpie y diseccione la almohadilla de grasa ovárica y el tejido conectivo para permitir una visualización clara del oviducto (Figura 3B).

Figura 3: Microdisección paso a paso del oviducto. Después de la extracción de la grasa remanente y el tejido conectivo (A, B), agregue azul de toluidina al tejido (C) y luego lávese para facilitar la visualización y la posterior extirpación del ovario y el desenrollamiento del tubo (D-H). El infundíbulo se puede encontrar junto al istmo proximal y la unión uterino-tubárica (UTJ). Tire ligeramente del extremo distal mientras corta en el mesosalpinx para desenrollar y revelar los giros endógenos del oviducto (H) para orientarse para una segmentación adecuada. Figura A-C barra de escala = 500 μm, barra de escala D-H = 400 μm (I) Caricatura de los diversos segmentos (no dibujada a escala). Haga clic aquí para ver una versión más grande de esta figura.
- Usando una jeringa de 1 ml, dispense e incube el oviducto fijado al útero en 1-2 gotas de solución estéril de tinte azul de toluidina al 1% durante 30 s-1 min. Enjuague con solución salina tamponada con fosfato (DPBS) fría de Dulbecco y retire todo el líquido (Figura 3C).
- Extraiga ligeramente el ovario del oviducto en espiral y corte la membrana bursal y el ligamento ancho para extraer el ovario del oviducto sin comprometer el tejido tubárico (Figura 3D, E).
NOTA: El ovario no está unido al oviducto, sino encerrado en la membrana bursal con el oviducto (Figura 2D) y conectado al lado lateral del útero a través del ligamento ancho.
3. Microdisección y segmentación del oviducto
- Localice el extremo distal y fimbrial del oviducto que se encuentra lateral a la unión uterino-tubárica (UTJ). El oviducto se enrolla sobre sí mismo; por lo tanto, el extremo fimbrial puede ubicarse lateral al extremo proximal y es un punto de partida apropiado para orientar el desenrollamiento del oviducto (Figura 3F, I).
- Mientras tira suavemente del tubo, corte el mesosalpinx (Figura 3I) con microcisíparas en forma de resorte para desenrollar el oviducto (Figura 3G).
- Una vez desenrollado, corte el tubo para producir las regiones infundibular, ampular e ístmica (Figura 3H).
- Después de la escisión del infundíbulo (extremo fimbrial y tallo proximal), extirpe la región ampular cortando después del segundo giro prominente del tubo (corte entre las vueltas dos y tres, aproximadamente 1 cm de longitud). Finalmente, corte la porción restante a la UTJ, que es la región ístmica (Figura 3H).
NOTA: El oviducto no se desenrollará completamente en una estructura recta. El tubo mantendrá sus giros (Figura 3H)3. Sobre la base de los giros posteriores que siguen a la región ampular, se puede segmentar aún más el tubo restante en la unión ampular-ístmica y el istmo3. Después de la escisión de la ampolla, cortar entre las curvas cinco y seis para obtener la unión ampular-ístmica; el tubo restante (vuelta seis al inicio de la UTJ) es el istmo3.
- Después de la escisión del infundíbulo (extremo fimbrial y tallo proximal), extirpe la región ampular cortando después del segundo giro prominente del tubo (corte entre las vueltas dos y tres, aproximadamente 1 cm de longitud). Finalmente, corte la porción restante a la UTJ, que es la región ístmica (Figura 3H).
- Congela inmediatamente los segmentos de tejido disecado en nitrógeno líquido para el aislamiento de ARN o fija y procesa cada segmento para la incrustación orientada y el análisis inmunohistológico.
- Añadir 200 μL de reactivo de extracción de ARN en frío y mezcla de perlas de homogeneización 1:1 (ver Tabla de materiales) al tejido si se procede a la extracción de ARN (ver paso 5.1).
4. Disociación del oviducto
- Continuando con el paso 3.1.1 anterior) Para una disociación óptima del epitelio, abra el oviducto en las áreas donde sea posible (es decir, infundíbulo y ampolla) para exponer el epitelio luminal (Figura 4A).

Figura 4: Disociación de células del oviducto, parte 1. Dibujos animados que muestran cómo exponer el epitelio distal para una disociación celular óptima (A) y una imagen que muestra la forma más fácil de usar la malla de 1 mm2 (B). Haga clic aquí para ver una versión más grande de esta figura.
- Comenzando en la región fimbrial, usando pinzas como palanca, corte el tubo longitudinalmente con tijeras en forma de resorte.
- Picar las porciones abiertas y el oviducto restante en segmentos (~1-2 mm de tamaño) y añadir 5 ml de tampón de disociación caliente y no enzimática (ver Tabla de Materiales) e incubar a 37 °C.
- Resuspender las piezas de tejido y las células disociadas con un pipetador de bulbo cada 3 minutos durante 9-10 minutos. Diluir el tampón de disociación 1:1 con medio de disección en frío.
- Recoger las células por centrifugación (350 x g, 3 min, 4 °C). Resuspender las células en 2 ml de tampón de lisis de glóbulos rojos durante 2 minutos a temperatura ambiente, y luego diluir 1: 1 con medio de disección en frío.
- Recoger las células por centrifugación (350 x g, 3 min, 4 °C) y resuspend en 5 ml de solución fría de pronasa.
- Incubar en medio de digestión pronasa y resuspendir los grupos celulares con un pipeteador de bulbo cada 3-5 min hasta que se logre una suspensión de una sola célula (~25-30 min).
NOTA: Este paso se realiza mejor en una placa o matraz de cultivo de tejidos para permitir la observación constante evitando la sobreexposición innecesaria a la pronasa.
- Incubar en medio de digestión pronasa y resuspendir los grupos celulares con un pipeteador de bulbo cada 3-5 min hasta que se logre una suspensión de una sola célula (~25-30 min).
- Pase las células a través de una macromalla estéril (malla de 1 mm x 1 mm fijada a un tubo cónico con una banda elástica (Figura 4B)) para eliminar cualquier pieza de tejido no disociada restante. Recoger las células por centrifugación (350 x g, 3 min, 4 °C) y resuspendirlas en un medio frío apropiado para el análisis aguas abajo (por ejemplo, tampón FACS si se procede con la tinción para citometría de flujo).
5. Extracción de ARN de segmentos oviductales
- Homogeneice muestras congeladas al instante en 200 μL de reactivo de extracción de ARN en un homogeneizador de tejido de licuadora de balas de cuentas en el nivel 12 durante dos intervalos (3 min cada uno) a 4 °C utilizando la mezcla de perlas de acero inoxidable.
NOTA: Para preservar la integridad del ARN, las muestras deben moverse inmediatamente del estado de congelación instantánea al reactivo de extracción de ARN y no pesarse. - Homogeneizar brevemente la centrífuga a 100-200 x g en una centrífuga de mesa durante aproximadamente 5 s a temperatura ambiente para separar el líquido de las perlas. Transfiera el sobrenadante a un tubo nuevo.
- Agregue otros 200 μL de reactivo de extracción de ARN a las perlas para recuperar más muestras, seguido de centrifugación (100-200 x g, 5 s, temperatura ambiente). Combina los sobrenadantes.
NOTA: Use una punta de pipeta pequeña (la mayoría de las puntas p200 son adecuadas) para evitar el arrastre de perlas al quitar el sobrenadante. - Siga las pautas del fabricante para separar y precipitar el ARN en fase. Las muestras representativas se precipitaron durante la noche a -20 °C con 100% de isopropanol (aproximadamente 2:1 de volumen, isopropanol: fase acuosa recuperada).
- Transfiera el precipitado de ARN completo junto con la solución a una columna de espín y centrífuga de unión a ARN durante 30 s a 9.500 x g. Purifique el ARN en la columna según las pautas del fabricante y luego eluya el ARN en 20 μL de agua libre de nucleasa. Evaluar la calidad/cantidad en un espectrofotómetro de microvolumen y/o bioanalizador.
Resultados
El protocolo de disociación descrito produce 100.000-120.000 células por ratón con agrupación de ambos oviductos. El método es lo suficientemente suave como para dejar intactos los bordes celulares multiciliados, lo que permite una distinción entre las células multiciliadas y las células secretoras, y verifica que el método de digestión sea lo suficientemente suave como para evitar la desdiferenciación. Las imágenes representativas de inmunofluorescencia en la Figura 5 muestran g...
Discusión
Los tres segmentos del oviducto son histológica, morfológica y funcionalmente distintos1,2,3. El epitelio varía mucho de un extremo del oviducto al otro. Las células ciliadas dominan en el extremo fimbrial/infundibular, mientras que las células secretoras dominan en la región ístmica1. Si bien este gradiente general ha sido reconocido durante algún tiempo, trabajos recientes han descubierto más d...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado en parte por un Premio Al Avance del Departamento de Defensa a AMW (BCRP W81XWH-14-1-0425). KCR fue parcialmente apoyado por becas intramuros: la Beca Predoctoral Pease Cancer y la Beca Predoctoral Mary Galvin Burden en Ciencias Biomédicas y la Universidad de California, Riverside, premios intramuros: la Beca de Investigación de Disertación del Comité de Becas del Consejo de Graduados y el Premio del Programa de Año de Disertación de la División de Graduados. Los autores agradecen a Gillian M. Wright y Alyssa M. Kumari por su ayuda en la solución temprana de problemas de este método.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.5 mm Stainless steel bead mix | Next Advance | SSB05 | Mix 1:1 with 1.4 mm SSB14B, sterilized |
| 1.4 mm Stainless steel bead mix | Next Advance | SSB14B | Mix 1:1 with 0.5 mm SSB05, sterilized |
| 1X Dulbecco's Phosphate Buffered Saline A, pH 7.4 (DPBS) | Gibco | 21600-010 | Cold, sterile |
| 25G needle | BD | 305122 | |
| 60 mm sterile petri dishes | Corning | 430166 | |
| 70 μm cell meshes | Fisherbrand | 22-636-548 | |
| Agilent Eukaryote Total RNA 6000 Pico Chip kit | Agilent 2100 Bioanalyzer | 5067-1513 | |
| Bead Bullet Blender Tissue Homogenizer | Next Advance | BBY24M | |
| Bioanlyzer | Agilent 2100 Bioanalyzer | ||
| Bovine serum albumin | Sigma Aldrich | A7906 | |
| Cold plate/pack/surface of choice | N/A | N/A | Kept at -20C for dissection |
| Dental wax | Polysciences Inc. | 403 | |
| Dulbecco’s Modified Eagle’s Medium (DMEM)/ Ham’s F12 | Corning | 10-090-CV | Prepare dissection medium: DMEM/ Ham’s F12, 10% FBS, 25 mM Hepes, 1% Pen-Strep |
| Fetal Bovine Serum | Corning | 35-015CV | |
| Fine point forceps of choice | N/A | N/A | |
| Glycine | Sigma Aldrich | G712b | Immunocytochemical validation images |
| Goat anti-mouse IgG Alexa Fluor 555 | Invitrogen | A-21422 | Immunocytochemical validation images |
| Goat anti-rabbit IgG Alexa Fluor 488 | Invitrogen | A-11001 | Immunocytochemical validation images |
| Hepes | Sigma Aldrich | H-3784 | |
| Hoescht 33342 | Cell Signaling Technologies | 4082S | Immunocytochemical validation images |
| Inverted compound microscope | Keyence BZ-X700 | ||
| Mouse anti-mouse Occludin | Invitrogen | 33-1500 | Immunocytochemical validation images |
| Non-enzymatic dissociation buffer | N/A | 5 mM EDTA, 1 g/L glucose, 0.4% BSA, 1X DPBS | |
| Nylon macro-mesh 1 mm x 1 mm | Thomas Scientific | 1210U04 | |
| Paraformaldehyde | Sigma Aldrich | P-6148 | Immunocytochemical validation images |
| Pen-Strep | MP Biomedicals | 10220-718 | |
| Prolong Gold Antifade Reagent | Cell Signaling Technologies | 9071S | Immunocytochemical validation images: antifade mounting medium |
| Pronase | Sigma Aldrich | 10165921001 | Prepare pronase digestion medium: 0.15% Pronase in DMEM/Ham's F12, sterile |
| Propidium Iodide | Roche | 11 348 639 001 | Viability validation images |
| Rabbit anti-mouse Acetylated-Tubulin | Abcam | ab179484 | Immunocytochemical validation images |
| RBC lysis buffer | BD Biosciences | 555899 | |
| RNeasy Mini Kit | Qiagen | 74134 | Utilized for on-column purification in text. |
| Spring form microdissection scissors | Roboz Surgical | RS-5610 | |
| Sterile 3 mL bulb pipettors | Globe Scientific | 137135 | |
| Toluidine blue | Alfa Aesar | J66015 | Prepare toluidine blue solution: 1% in 1X DPBS, sterile |
| Tris-Buffered Saline-Tween (TBST) | N/A | N/A | Immunocytochemical validation images; 0.1 N NaCl, 10 mM Tris-Cl pH 7.5, 1% Tween 20 |
| Triton-X-100 | Mallinckrodt Inc. | 3555 | Immunocytochemical validation images |
| Trizol RNA Extraction Reagent | Invitrogen | 15596026 | Referred to as RNA extraction reagent. Nucelase-free water, chloroform and isoproponal are required in supplement of performing Trizol extraction per manufacturer's guidelines |
Referencias
- Stewart, C. A., et al., Kubiak, J. Z., et al. . Mouse oviduct developmemt in Mouse Development: From Oocyte to Stem Cells. , 247-262 (2012).
- Ford, M. J., et al. Oviduct epithelial cells constitute two developmentally distinct lineages that are spatially separated along the distal-proximal axis. Cell Reports. 36 (10), 109677 (2021).
- Harwalkar, K., et al. Anatomical and cellular heterogeneity in the mouse oviduct-its potential roles in reproduction and preimplantation development. Biology of Reproduction. 104 (6), 1249-1261 (2021).
- Agduhr, E. Studies on the structure and development of the bursa ovarica and the tuba uterina in the mouse. Acta Zoologica. 8 (1), 1 (1927).
- Pulkkinen, M. O. Oviductal function is critical for very early human life. Annals of Medicine. 27 (3), 307-310 (1995).
- Kindelberger, D. W., et al. Intraepithelial carcinoma of the fimbria and pelvic serous carcinoma: Evidence for a causal relationship. American Journal of Surgical Pathology. 31 (2), 161-169 (2007).
- Ghosh, A., Syed, S. M., Tanwar, P. S. In vivo genetic cell lineage tracing reveals that oviductal secretory cells self-renew and give rise to ciliated cells. Development. 144 (17), 3031-3041 (2017).
- Lee, Y., et al. A candidate precursor to serous carcinoma that originates in the distal fallopian tube. Journal of Pathology. 211 (1), 26-35 (2007).
- Kim, J., et al. High-grade serous ovarian cancer arises from fallopian tube in a mouse model. Proceedings of the National Academy of Sciences of the United States of America. 109 (10), 3921-3926 (2012).
- Perets, R., et al. Transformation of the fallopian tube secretory epithelium leads to high-grade serous ovarian cancer in Brca;Tp53;Pten models. Cancer Cell. 24 (6), 751-765 (2013).
- Sherman-Baust, C. A., et al. A genetically engineered ovarian cancer mouse model based on fallopian tube transformation mimics human high-grade serous carcinoma development. Journal of Pathology. 233 (3), 228-237 (2014).
- Zhai, Y. L., et al. High-grade serous carcinomas arise in the mouse oviduct via defects linked to the human disease. Journal of Pathology. 243 (1), 16-25 (2017).
- Karthikeyan, S., et al. Prolactin signaling drives tumorigenesis in human high grade serous ovarian cancer cells and in a spontaneous fallopian tube derived model. Cancer Letters. 433, 221-231 (2018).
- Shao, R., et al. Differences in prolactin receptor (PRLR) in mouse and human fallopian tubes: Evidence for multiple regulatory mechanisms controlling PRLR isoform expression in mice. Biology of Reproduction. 79 (4), 748-757 (2008).
- Alwosaibai, K., et al. PAX2 maintains the differentiation of mouse oviductal epithelium and inhibits the transition to a stem cell-like state. Oncotarget. 8 (44), 76881-76897 (2017).
- Peri, L. E., et al. A novel class of interstitial cells in the mouse and monkey female reproductive tracts. Biology of Reproduction. 92 (4), 102 (2015).
- Lõhmussaar, K., et al. Assessing the origin of high-grade serous ovarian cancer using CRISPR-modification of mouse organoids. Nature Communications. 11 (1), 2660 (2020).
- Chen, S., et al. An air-liquid interphase approach for modeling the early embryo-maternal contact zone. Scientific Reports. 7, 42298 (2017).
- Desjardins, P., Conklin, D. NanoDrop microvolume quantitation of nucleic acids. Journal of Visualized Experiments: JoVE. (45), e2565 (2010).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Molecular Biology. 7, 3 (2006).
- McGlade, E. A., et al. Cell-type specific analysis of physiological action of estrogen in mouse oviducts. The FASEB Journal. 35 (5), 21563 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados