需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用eGFP标记的蛋白质研究 果蝇 光感受器细胞中的膜蛋白运输
摘要
在这里,描述了非侵入性方法,用于光感受器膜蛋白的定位和使用eGFP荧光评估 果蝇 复眼中的视网膜变性。
摘要
膜蛋白运输调节受体和离子通道在质膜中的掺入和去除。这个过程对于神经元的细胞功能和细胞完整性至关重要。 果蝇 光感受器细胞已成为研究膜蛋白运输的模型。除了视紫红质,其在照明时从光感受器膜内化并降解外, 果蝇 中的瞬时受体电位样(TRPL)离子通道在横纹肌光感受器膜(位于黑暗中)和光感受器细胞体(在照明时被输送到)之间表现出光依赖性易位。TRPL的这种细胞内运输可以通过在光感受器细胞中表达eGFP标记的TRPL,以简单和非侵入性的方式进行研究。然后可以在深假瞰孔中或通过水浸显微镜观察eGFP荧光。这些方法允许在完整的眼睛中检测荧光,因此可用于高通量测定和遗传筛查在TRPL易位中有缺陷的 果蝇 突变体。在这里,详细解释了苍蝇的制备,微观技术以及用于研究TRPL的这种光触发易位的定量方法。这些方法也可用于其他 果蝇 光感受器蛋白的贩运研究,例如视紫红质。此外,通过使用eGFP标记的横纹肌蛋白,这些方法可用于评估光感受器细胞的变性。
引言
通过向质膜输送和去除蛋白质,神经元中的膜蛋白运输通过受体和离子通道控制质膜设备,从而调节神经元功能。蛋白质运输中的失调错误或缺陷通常会对细胞产生不利影响,并导致神经元变性。在人类中,这可能导致神经退行性疾病,如阿尔茨海默氏症和帕金森病或 色素性视网膜炎1。 黑腹果蝇 复眼中的光感受器已成为研究膜蛋白运输的 体内 模型系统2。这不仅是由于 果蝇 的遗传多功能性允许有效的遗传筛选,而且还因为吸收光的光感受器膜的所有基本成分都得到了非常详细的表征,并且可以使用有效的微观技术应用于苍蝇眼。这些技术是本文的重点。
在果蝇光感受器细胞中,顶端质膜沿着细胞的一侧形成密集堆积的微绒毛堆叠,称为横纹肌。光感受器细胞R1-6的横纹肌以特征梯形模式排列,而光感受器细胞R7和R8在该梯形3的中心形成单个横纹肌。膜蛋白运输对于调节横纹肌膜蛋白(如视紫红质)和光激活TRP(瞬时受体电位)和TRPL(TRP样)离子通道的周转是必需的,以确保横纹肌中这些光转导蛋白的适当量。光感受器膜蛋白在内质网中合成,并通过高尔基体运输到横纹肌。在通过光激活视紫红质后,视紫红质分子可以通过吸收第二个光子而失活,或者可以通过克拉氏介导的内吞作用从横纹肌中除去。内吞视紫红质要么在溶酶体中降解,要么被回收回横纹肌4,5。离子通道TRPL在光转导级联激活后也被内化,并在横纹肌(当苍蝇保持在黑暗中时它位于那里)和细胞体内富含ER的储物箱(在照明后数小时内运输到该储物室)之间经历光依赖性易位6,7,8,9,10.与内吞视紫红质相反,只有少量的TRPL通过内溶酶体途径降解,并且大多数在细胞内储存并在黑暗适应时循环回横纹肌6。因此,TRPL可用于分析光触发的质膜蛋白运输。果蝇光感受器细胞也用于研究神经元变性。光感受器细胞变性通常通过评估横纹肌的结构来确定,横纹肌由于退行性过程而分解5。
为了研究TRPL和视紫红质在光感受器细胞或光感受器细胞变性中的亚细胞定位,这里应用了两种在分析速度和分辨率方面不同的荧光显微镜方法。一种非常快速,非侵入性的方法可用于遗传筛选,但空间分辨率有限,是检测深部假性pupil(DPP)中的荧光。DPP是节肢动物复眼的光学现象,其几何起源已被Franceschini和Kirschfeld在1971年详细解释过11。简而言之,在视网膜下方的几个光学平面上,可以观察到来自相邻卵形的横纹肌的叠加图像。在穿过眼睛曲率中心的焦平面上,这些叠加的投影形成一个图像,类似于横纹肌的梯形布局,在单个ommatidium中仅大几个数量级。这种现象也可以独立于荧光蛋白的外源性表达(例如TRPL::eGFP8)观察到,这使得DPP更容易检测(图1A-A'')12。第二种非侵入性方法是水浸显微镜,该显微镜依赖于用水光学中和眼睛的屈光度装置后对荧光标记的蛋白质进行成像(图1B-C'')12。使用水浸法,可以定量评估单个光感受器细胞在横纹肌或细胞体中TRPL::eGFP的相对量。此外,非易位荧光标记蛋白可用于评估横纹体完整性并以定量方式确定潜在变性的时间过程,如此处所述。
虽然民进党的记录是迄今为止这些方法中最简单,最快捷的,但它们生成的数据的空间分辨率是有限的。此外,DPP缺席的原因有很多,这些原因不一定可以通过DPP成像本身来识别。由于DPP表示几个ommatidia的总和,因此有关单个细胞的信息丢失。因此,低分辨率DPP成像在筛选大量苍蝇方面起着重要作用,但通常应通过水浸显微镜进行更高分辨率的记录。水浸显微照片可以解释单个细胞,发育缺陷,眼睛形态,蛋白质错位或视网膜变性以及这些效应的量化。该协议详细描述了这两种技术。
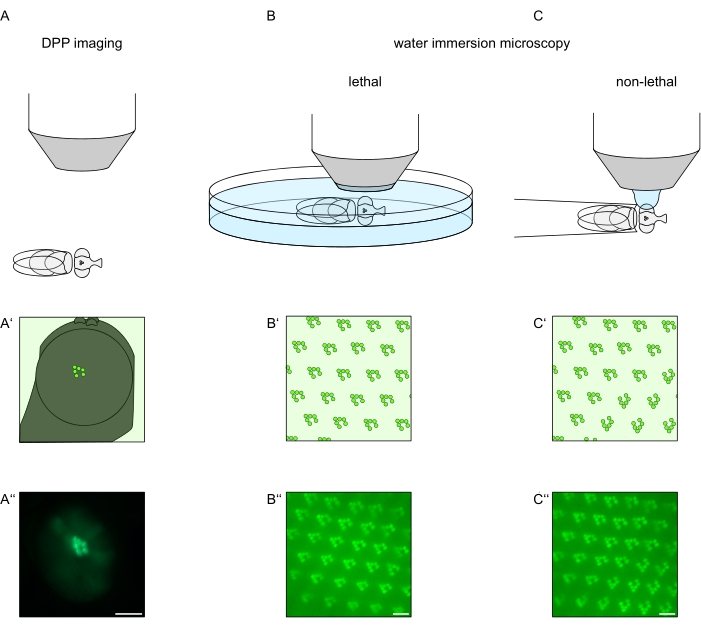
图1:本方案中介绍的果蝇眼的显微镜变化概述。(A-A'')荧光深假性假单胞菌(DPP)成像,(B-B'')荧光横纹肌的致死水浸显微镜和(C-C'')荧光横纹肌的非致命水滴显微镜的示意图和示例性显微照片。比例尺(A''):100 μm。比例尺(B''-C''):10 μm。该图已从参考文献13修改而来。请点击此处查看此图的大图。
研究方案
1. 一般注意事项
- 使用表达永久横纹肌位置荧光蛋白的 果蝇 储备进行形态学分析(例如,TRP::eGFP,eGFP::NINAC),并将易位蛋白用于蛋白质运输分析(例如,TRPL::eGFP,Arr2::eGFP)。
- 预先确定所选苍蝇的光照条件,用于实验方法。
- 为了适应黑暗,将苍蝇保存在25°C的暗箱中所需的时间。 对于易位实验中长达16小时的照明(例如,TRPL::eGFP表达苍蝇),将苍蝇保持在室温下的荧光灯管下。
- 在评估光感受器变性的实验中(例如,TRP::eGFP表达苍蝇),将苍蝇保持在荧光灯管下,在12小时光照/ 12小时黑暗循环中,在25°C下长期照明长达28天。
- 对于有色光的发光苍蝇,请使用不同颜色的透明塑料盒和荧光灯管。
- 如果使用有色素眼的苍蝇,则精确地对动物进行年龄比较分析,因为眼睛色素沉着可能随着年龄的增长而显着增加。
注意:对于数据解释,重要的是要注意,由于横纹肌结构的光波引导作用,存在信号偏差。因此,在DPP成像和水浸显微镜中,来自横纹肌的荧光信号相对于从细胞体获得的信号总是被放大到一定程度。这在色素沉着的眼睛中最为突出,其中来自横纹肌外的荧光被这些色素吸收,并且在检测细胞内易位融合蛋白时特别重要。因此,关于关键步骤,本研究分别考虑了白眼苍蝇和红眼苍蝇。 - 关于水浸显微镜,描述了两种变化。更快的致死变异以及非致死变异允许后续研究的恢复。
2. DPP成像
- 使用所需的设备和试剂准备工作空间,如图 2所示。麻醉一种基因型的苍蝇(1-3天大),该基因型在苍蝇垫上用CO2 表达荧光蛋白。选择动物在具有传统光源和低放大倍率(例如,10x)的体视显微镜下成像。

图 2:DPP 映像工作区。 所需的材料是(A)CO2 麻醉设备,(B)带有紫外灯和荧光滤光片组的立体显微镜,(C)光源,(D)带有(E)软件的显微镜安装相机,(F)油漆刷,(G)黑色纸板和(H)飞瓶。 请点击此处查看此图的大图。
- 对于DPP成像,保持选定的苍蝇麻醉,并将其中的一只置于显微镜物镜中心的侧面,以便左眼或右眼精确地径向物镜(图3A)。
注意:由于感光细胞的椭圆形布局在背中线上显示出镜像对称性,因此最好在眼睛赤道的上方或下方观察到DPP(图3B)。
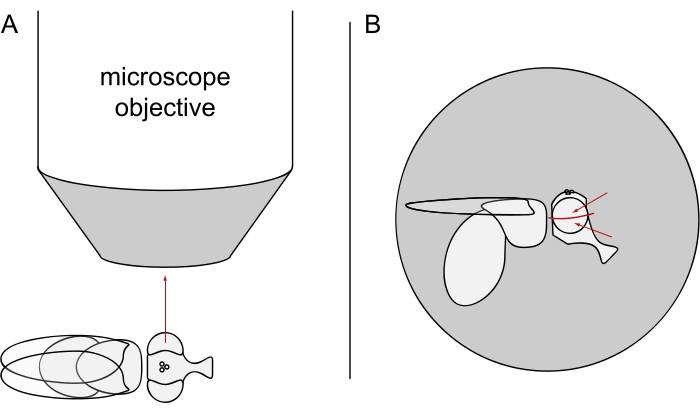
图3:苍蝇在立体显微镜下的位置,用于DPP成像。 (A)苍蝇侧的图示,一只眼睛径向显微镜物镜。(B)需要稍微向上或向下转动蝇头,以便物镜聚焦在眼睛赤道上方或下方的点上,如红色箭头所示。 请点击此处查看此图的大图。
- 增加放大倍率以适合整个眼睛(例如,100x),并使眼睛的中心眼睑居中。降低显微镜的景深,例如,通过将双光圈振膜调整到浅设置(图4A-B')。
- 关闭常规光源并以最大强度打开显微镜紫外灯,并根据眼睛中表达的荧光蛋白选择显微镜的荧光滤光片组(图4C-E)。设置指向显微镜安装相机的光路。
- 使用软件中的实时成像功能,通过调整曝光时间和增益值(例如,分别为80 ms和12x),将图像的亮度调整为仅检测来自眼睛的特定信号的设置。重新调整显微镜焦点"进入"眼睛(角膜下方)以生成DPP的叠加图像(图4C-E')。
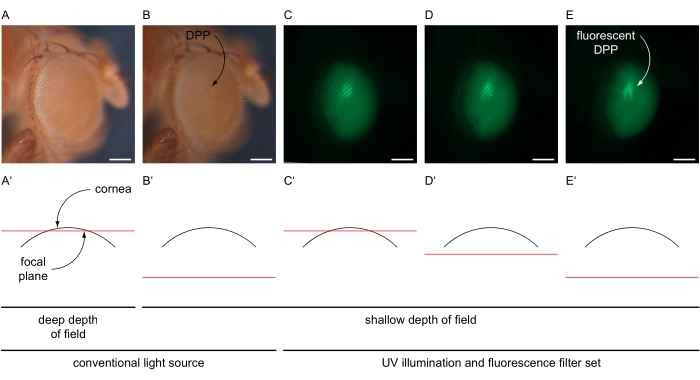
图4:DPP和荧光DPP成像的图示。 果蝇眼睛的示例性图像在传统和紫外线照明下使用GFP滤光片组,以不同的焦平面拍摄,以示意图横截面所示通过眼睛。(A)使用传统光源的明亮设置,30 ms曝光时间,1倍增益,深景深和角膜表面附近的焦平面记录的显微照片,如(A')所示。(B)使用传统光源的明亮设置,30 ms曝光时间,1x增益,浅景深和角膜表面以下约180μm的焦平面记录的显微照片,如(B')所示。民进党表示。(C-E)使用UV光源和GFP滤光片集的高强度设置,80 ms曝光时间,12倍增益,浅景深和焦平面(C')附近,(D')略低于或(E')角膜表面以下约180μm记录的显微照片。荧光 DPP 用弯曲的箭头表示。比例尺 100 μm。请点击此处查看此图的大图。
- 拍摄荧光 DPP 的快照。将显微镜切换回可见光,并将光路切换回目镜。在苍蝇小瓶中回收成像的动物,以根据其DPP表型(例如,杂交)进行进一步处理。继续处理步骤 2.2 中的下一只动物。
3. 水浸显微镜
- 苍蝇准备
- 使用所需的设备和试剂准备工作空间,如图 5所示。将具有预定年龄和光照条件的苍蝇转移到预冷的15mL离心管中,并通过在冰上孵育15至30分钟进行麻醉。
注意:携带1天大的深色苍蝇作为参考。一般来说,适应黑暗的苍蝇应该被转移到黑暗中盖上盖子的冰箱里。适应光线的苍蝇可以在室内光线下转移到冰上。
- 使用所需的设备和试剂准备工作空间,如图 5所示。将具有预定年龄和光照条件的苍蝇转移到预冷的15mL离心管中,并通过在冰上孵育15至30分钟进行麻醉。

图5:水浸式显微镜工作区。 所需材料包括:(A)15 mL离心管,(B)冰片,(C)冷冻蒸馏水,(D)立体显微镜,(E)培养皿,(F)橡皮泥,(G)物体载玻片,(H)昆虫针或移液器吸头和手术刀,(I)带有(J)软件的荧光显微镜。 请点击此处查看此图的大图。
- 从下面描述的两种(3.1.3致死变异或3.1.7非致死变异)中选择适当的制剂,并且每当对色素眼和非色素眼进行区分时,请遵循相应的步骤。
- 为致命的变化准备苍蝇,如下所示。
- 将一块橡皮泥粘在物体载玻片上,另一块粘在培养皿的中心(例如,94毫米直径),并暂时将它们分开。用冰冷的蒸馏水和一些冰片填充培养皿(图6A)。
- 将一只冰麻醉的苍蝇放在涂有橡皮泥的物体载玻片顶部的立体显微镜下。转动苍蝇的背部,刺穿昆虫针穿过胸部中心(图6B)。将针脚水平固定在涂有橡皮泥的物体滑块上,并将苍蝇的左眼或右眼向上定向(图6C)。
- 小心地将物体滑块固定在培养皿中,使其无橡皮泥的一面朝下,防止苍蝇旋转。确保飞眼被水覆盖(图6D)。使用制备针仔细去除眼睛周围可能形成的任何气泡,并立即进行图像采集以获得最佳效果。
注意:图像采集的显著延迟会导致苍蝇的重新觉醒和运动,这可能导致图像模糊。
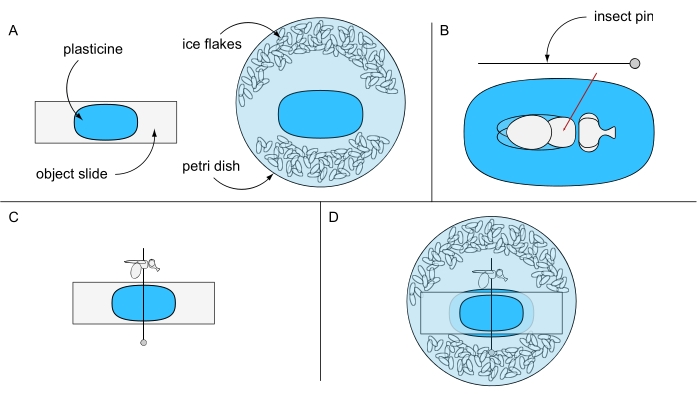
图6:制备致命的水浸显微镜。 图示:(A)橡皮泥涂层物体载玻片和培养皿,(B)将苍蝇穿过胸部固定在橡皮泥地面上,(C)在橡皮泥涂层物体载玻片上飞行方向,以及(D)最终实验设置。 请点击此处查看此图的大图。
- 为非致命变异准备苍蝇,如下所示。
- 将一只冰麻醉的苍蝇头头转移到200μL移液器吸头中,然后用压缩空气小心地将苍蝇推向吸头。
- 使用手术刀切除头部正前方的移液器尖端。使用镊子小心地将苍蝇推离尖端几毫米。再次切断移液器吸头,并用压缩空气将苍蝇推回吸头,以便只有苍蝇的头部从移液器吸头突出。
- 将一块橡皮泥粘在物体载玻片上,然后将移液器尖端按入其中,使苍蝇的左眼或右眼朝上(图7A)。在图像采集之前,使用实验室移液器将一大滴冷冻水粘附到水浸物镜的底面(图7B)。立即进行图像采集以获得最佳效果。
注意:图像采集的显著延迟会导致苍蝇的重新觉醒和运动,这可能导致图像模糊。
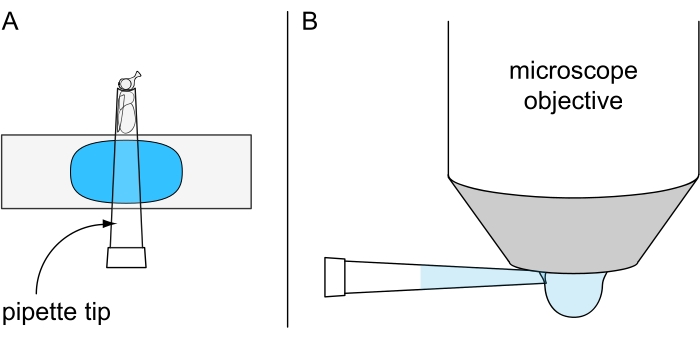
图7:非致命水滴显微镜的制备。 图示(A)将冷麻醉的苍蝇固定在安装在橡皮泥涂层物体载玻片上的200μL移液器吸头内,以及(B)在水浸物镜的底面上施加冷冻水滴。 请点击此处查看此图的大图。
- 图像采集
- 小心地将培养皿(步骤3.1.3)或装有准备好的飞物的物体载玻片(步骤3.1.7)放在显微镜载物台上,并选择水浸物镜。
- 手动降低水浸物镜,直到它接触到水面(步骤3.1.3)或苍蝇的眼睛接触到水滴(步骤3.1.7)(图8A,B)。
- 打开显微镜紫外灯并选择合适的滤光片组。使用目镜将苍蝇定位在物镜下方,并将显微镜聚焦在眼睛表面。
- 切换指向显微镜相机的光路,并在相应的软件中生成实时图像。重新调整相机的焦点并评估眼睛的方向,考虑到眼睛必须径向面对显微镜物镜,如图8C-E中更详细地所示。
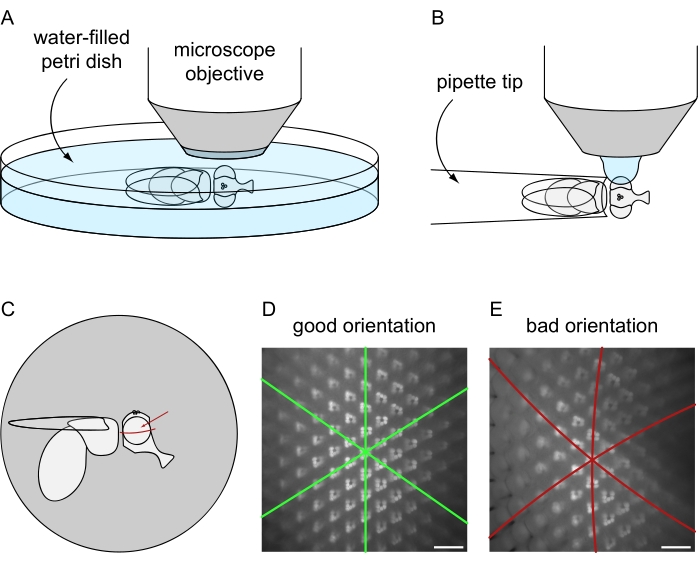
图8:将苍蝇定位在荧光显微镜下进行水浸成像。 使用(A)致命或(B)非致命苍蝇制备方案进行图像采集的设置和最终方向。(C)飞向图,以获得水浸显微镜图像的最佳效果。聚焦于眼睛的理想点不是相对于前/后轴和背轴/腹轴的确切中心,而是略高于眼睛的赤道,如红色箭头所示。(D) 完美定位的眼睛的水浸图像示例。六边形椭圆平铺的所有三个对称轴都显示为直线,并且可以同时聚焦最大数量的异形。(E)眼睛位置不正确的水浸图像示例。图像包含弯曲的轴和较浅的景深。比例尺:20 μm。 请点击此处查看此图的大图。
- 在成像软件中使用适当的LUT(查找表)来检测过饱和度(表示为红色像素)。
- 对于无色素的苍蝇,请调整曝光时间,使最亮的像素略低于每个图像的饱和度限制。
- 在有色素苍蝇和致命变化的情况下,调整曝光时间,使至少五只单独的1天大,适应黑暗的苍蝇的所有最亮像素都略低于饱和度限制。将计算出的平均曝光时间应用于所有其他实验条件(基因型,照明条件,时间点等)。
- 对于有色素的苍蝇(例如,红眼苍蝇)和非致命变化,请调整曝光时间,使所有最亮的像素都刚好低于每个1天大、适应黑暗的苍蝇的饱和度限制。将此曝光时间应用于该苍蝇的所有其他实验条件(照明条件,时间点等)。
- 记录图像并将其另存为原始文件,以存档记录的所有相应元数据。以.tif格式导出图像以进行以下量化。
注意:在非致死性变化的情况下,如果它们打算用于进一步的实验,则在图像采集后立即用红光(例如,630nm)照亮苍蝇5分钟。红光使光转换级联失活,该级联在图像采集过程中被强烈的短波光过度激活。
- 水浸显微照片中相对eGFP荧光的数据分析和定量
- 下载,安装和执行软件ImageJ /Fiji。
- 通过单击" 分析">"设置"来调整 ImageJ 设置...,然后仅选中" 平均灰度值"框。通过单击"文件"导入.tif图像 > 打开... 或通过拖放。选择图像中具有代表性的焦点区域,然后通过反复按 Ctrl 和 + 将其放大到 200%-300%。
- 选择" 椭圆形 "工具,同时按 Shift 键,在图像中生成一个明显小于一个荧光横纹肌的圆形选区。在释放鼠标按钮之前,请在 ImageJ 主窗口中查找工具栏下方显示的确切大小。对所有分析使用相同大小的圆形选区。
注:圆形选区的确切大小(以像素或微米为单位)取决于特定设置。使用大约1天大的横纹体直径的1/3或1/4的圆圈,适应黑暗的对照蝇。 - 通过鼠标单击圆形选区并拖动或按键盘上的箭头键来移动圆形选区。
- 要测量圆形选择中的荧光强度,请将圆圈移动到第一个横纹肌(r1),然后单击" 分析>测量 "或使用快捷键 Ctrl + M。将弹出 一个结果 窗口,其中列出了测量的灰度值。
- 继续测量 r2-r6 作为重复测量和测量背景信号 (b)。在无色素苍蝇的情况下,对相应的细胞体区域(c1-c6)进行额外的测量(图9)。
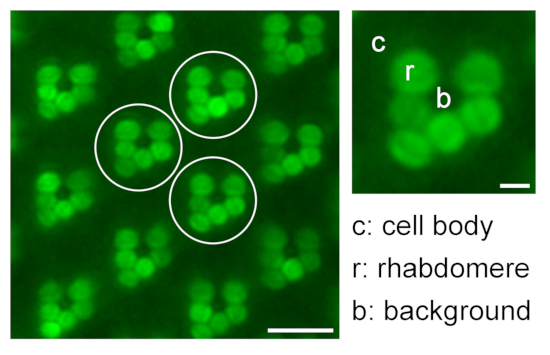
图9:用于易位研究的相对横纹体荧光的定量。 通过在一个水浸显微镜图像中测量横纹肌(r),细胞体(c)和背景(b)的三种不同代表性ommatidia(白色圆圈)的荧光强度来量化横纹肌中相对eGFP荧光的图示;比例尺:10 μm。放大的ommatidium显示在右侧;比例尺:2 μm。 请点击此处查看此图的大图。
- 重复步骤 3.3.5 和 3.3.6,再进行两次 ommatidia,从而进行三次技术重复。使用 铅笔 工具标记分析的 ommatidia,并保存此图像以供文档记录。
- 从" 结果 "窗口中选择并复制测量的灰度值,然后将其粘贴到电子表格软件中以进行进一步计算。根据其来源对荧光强度值进行排序,分为横纹肌(r),细胞 体(c)和背景(b)类别。计算每个类别的平均强度(Ir,Ic,Ib)。
- 计算横纹肌(R)中存在的eGFP的相对量,使用以下公式(1)表示非色素沉着的眼睛,公式(2)表示色素沉着的眼睛:
 (1)
(1) (2)
(2) - 继续执行步骤 3.3.3 中的下一个映像。建议使用每个实验组至少五个个体的图像作为生物重复,以获得可靠的测量结果。
- 通过eGFP荧光在水浸显微照片中对眼睛形态进行数据分析和量化
- 下载、安装和执行 ImageJ/Fiji 软件。通过单击"文件"> "打开..." 或拖放来导入.tif图像。在焦点图像的代表性区域中选择三个相邻的 ommatidia。
- 根据其eGFP强度,边缘清晰度以及与周围背景信号的对比度分别评估所选的18种横纹肌,以产生退化指数。评分清晰可见的横纹肌值为2,弱可见的横纹肌值为1,不存在的横纹肌值为0(图10)。
注意:这种量化方式使完全完整的眼睛得分为36分,完全退化的眼睛得分为0分。建议将退化指数的分数设置为36%至100%。

图10: 通过 横纹肌评估进行定量,用于变性研究。 通过在一张水浸显微镜图像中对三种不同的代表性ommatidia(白色圆圈)的横纹肌进行评分来量化眼睛形态的插图,其值为2(清晰可见;蓝色圆圈),1(弱可见;橙色圆圈)或0(不存在;红色圆圈)。比例尺:10 μm。放大的ommatidium显示在右侧;比例尺:2 μm。 请点击此处查看此图的大图。
- 打开下一个映像并继续执行步骤 3.4.2。建议使用每个实验组至少八个人的图像作为生物重复,以获得可靠的测量结果。
注意:由于这种定量方法不如通过荧光强度定量易位的方法客观,因此推荐的重复次数更高。
结果
在视紫红质1启动子的控制下,已经产生了表达TRPL::eGFP融合蛋白的转基因 果 蝇。在这些苍蝇中,TRPL::eGFP在复眼的光感受器细胞R1-6中表达,并显示照明依赖性定位。当苍蝇被保存在黑暗中时,TRPL::eGFP被纳入外部的横纹肌中。照明数小时后,TRPL易位到细胞体内,将其储存在富含ER的隔室中。8,10 当TRPL::eGFP位于横纹肌中时,其荧光可以在DPP中观察?...
讨论
荧光蛋白的适用性以及通过DPP成像和视网膜水浸显微镜筛选的简单性已被许多组12证明是成功的。与这里介绍的策略类似的策略已被用于几种遗传筛选中,以在Rh1::eGFP 17,18,19,20,21的帮助下检测视紫红质表达水平,稳态,视网膜组织或细胞完整性的缺陷。
披露声明
作者没有什么可透露的。
致谢
我们要感谢多年来我们的学生研究人员。特别是Nina Meyer,Sibylle Mayer,Juliane Kaim和Laura Jaggy,他们的数据已在该协议中用作代表性结果。我们小组在这里介绍的研究是由德国法院(Hu 839/2-4,Hu 839/7-1)向Armin Huber提供的赠款资助的。
材料
| Name | Company | Catalog Number | Comments |
| 15 mL centrifuge tube | Greiner Bio-One | 188271 | |
| CO2 anaesthesia fly pad | Flystuff | 59-172 | |
| Cold light lamp (KL 1500 LCD) | Zeiss | ||
| Fiji/ImageJ | NIH | ||
| Fluorescence microscope with UV lamp, camera, filter set and software (AxioImager.Z1m, Axiocam 530 mono, 38 HE, ZEN2 blue edition) | Zeiss | ||
| Fluorescent tube (Lumilux T8, L 30W/840, 4000 K, G13) [1750 Lux, Ee470nm = 298 µW cm-2, Ee590nm = 215 µW cm-2] and [760 Lux, Ee470nm = 173 µW cm-2, Ee590nm = 147 µW cm-2] | Osram | 4050300518039 | |
| Laboratory pipette (20-200 µL) | Eppendorf | ||
| Object slide | Roth | 0656.1 | |
| Petri dish (94 mm) | Greiner Bio-One | 633102 | |
| Pipette tips (200 µL) | Labsolute | 7695844 | |
| Plasticine (Blu-Tack) | Bostik | 30811745 | |
| Stereo microscope (SMZ445) | Nikon | ||
| Stereo microscope with UV lamp, camera, filer set and software (MZ16F, MC170 HD, GFP3, LAS 4.12) | Leica |
参考文献
- Wang, X., Huang, T., Bu, G., Xu, H. Dysregulation of protein trafficking in neurodegeneration. Molecular Neurodegeneration. 9. 9, 31 (2014).
- Schopf, K., Huber, A. Membrane protein trafficking in Drosophila photoreceptor cells. European Journal of Cell Biology. 96 (5), 391-401 (2017).
- Hardie, R. C. The photoreceptor array of the dipteran retina. Trends in Neurosciences. 9, 419-423 (1986).
- Wang, T., Montell, C. Phototransduction and retinal degeneration in Drosophila. Pflügers Archiv - European Journal of Physiology. 454 (5), 821-847 (2007).
- Xiong, B., Bellen, H. J. Rhodopsin homeostasis and retinal degeneration: lessons from the fly. Trends in Neurosciences. 36 (11), 652-660 (2013).
- Bähner, M., et al. Light-regulated subcellular translocation of Drosophila TRPL channels induces long-term adaptation and modifies the light-induced current. Neuron. 34 (1), 83-93 (2002).
- Cronin, M. A., Lieu, M. -. H., Tsunoda, S. Two stages of light-dependent TRPL-channel translocation in Drosophila photoreceptors. Journal of Cell Science. 119, 2935-2944 (2006).
- Meyer, N., Joel-Almagor, T., Frechter, S., Minke, B., Huber, A. Subcellular translocation of the eGFP-tagged TRPL channel in Drosophila photoreceptors requires activation of the phototransduction cascade. Journal of Cell Science. 119, 2592-2603 (2006).
- Oberegelsbacher, C., Schneidler, C., Voolstra, O., Cerny, A., Huber, A. The Drosophila TRPL ion channel shares a Rab-dependent translocation pathway with rhodopsin. European Journal of Cell Biology. 90 (8), 620-630 (2011).
- Wagner, K., Smylla, T. K., Lampe, M., Krieg, J., Huber, A. Phospholipase D and retromer promote recycling of TRPL ion channel via the endoplasmic reticulum. Traffic. , (2021).
- Franceschini, N., Kirschfeld, K. Les phénoménes de pseudopupille dans l'oeil compose de Drosophila. Kybernetik. 9 (5), 159-182 (1971).
- Pichaud, F., Desplan, C. A new visualization approach for identifying mutations that affect differentiation and organization of the Drosophila ommatidia. Development. 128 (6), 815-826 (2001).
- Smylla, T. K., Wagner, K., Huber, A. Application of fluorescent proteins for functional dissection of the Drosophila visual system. International Journal of Molecular Sciences. 22 (16), (2021).
- Meyer, N. Mechanisms of the light-dependent translocation of the ion channel TRPL in the photoreceptors of Drosophila melanogaster: Dissertation for obtaining the academic degree Dr. rer. nat. University of Karlsruhe (TH). , (2005).
- Meyer, N., Oberegelsbacher, C., Dürr, T. D., Schäfer, A., Huber, A. An eGFP-based genetic screen for defects in light-triggered subcelluar translocation of the Drosophila photoreceptor channel TRPL. Fly. 2 (1), 36-46 (2008).
- Zheng, L., Carthew, R. W. Lola regulates cell fate by antagonizing Notch induction in the Drosophila eye. Mechanisms of Development. 125 (1-2), 18-29 (2008).
- Hibbard, K. L., O'Tousa, J. E. A role for the cytoplasmic DEAD box helicase Dbp21E2 in rhodopsin maturation and photoreceptor viability. Journal of Neurogenetics. 26 (2), 177-188 (2012).
- Huang, Y., Xie, J., Wang, T. A Fluorescence-based genetic screen to study retinal degeneration in Drosophila. PloS One. 10 (12), 0144925 (2015).
- Zhao, H., Wang, J., Wang, T. The V-ATPase V1 subunit A1 is required for rhodopsin anterograde trafficking in Drosophila. Molecular Biology of the Cell. 29 (13), 1640-1651 (2018).
- Xiong, L., et al. ER complex proteins are required for rhodopsin biosynthesis and photoreceptor survival in Drosophila and mice. Cell Death and Differentiation. 27 (2), 646-661 (2020).
- Zhao, H., Wang, T. PE homeostasis rebalanced through mitochondria-ER lipid exchange prevents retinal degeneration in Drosophila. PLoS Genetics. 16 (10), 1009070 (2020).
- Cerny, A. C., et al. The GTP- and phospholipid-binding protein TTD14 regulates trafficking of the TRPL ion channel in Drosophila photoreceptor cells. PLoS Genetics. 11 (10), 1005578 (2015).
- Richter, D. Structural and functional analyses of TRP ion channels in the photoreceptor cells of Drosophila melanogaster: Dissertation for obtaining the academic degree Dr. rer, nat. University of Karlsruhe (TH). , (2007).
- Gambis, A., Dourlen, P., Steller, H., Mollereau, B. Two-color in vivo imaging of photoreceptor apoptosis and development in Drosophila. Developmental Biology. 351 (1), 128-134 (2011).
- Hardie, R. C., Liu, C. -. H., Randall, A. S., Sengupta, S. In vivo tracking of phosphoinositides in Drosophila photoreceptors. Journal of Cell Science. 128 (23), 4328-4340 (2015).
- Chakrabarti, P., et al. A dPIP5K dependent pool of phosphatidylinositol 4,5 bisphosphate (PIP2) is required for G-protein coupled signal transduction in Drosophila photoreceptors. PLoS Genetics. 11 (1), 1004948 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。