このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
eGFPタグ付きタンパク質を用いた ショウジョウバエ 光受容体細胞における膜タンパク質トラフィッキングの研究
要約
ここでは、eGFP蛍光を用いた ショウジョウバエ 複眼における視細胞膜タンパク質の局在化および網膜変性の評価について、非侵襲的方法について説明する。
要約
膜タンパク質のトラフィッキングは、原形質膜への受容体およびイオンチャネルの取り込みおよび除去を調節する。このプロセスは、ニューロンの細胞機能および細胞完全性にとって根本的に重要である。 ショウジョウバエ の視細胞は、膜タンパク質の輸送を研究するためのモデルとなっている。照明時に感光膜から内在化して分解されるロドプシンの他に、 ショウジョウバエ の一過性受容器電位様(TRPL)イオンチャネルは、横紋体視細胞膜(暗所に位置する)と感光細胞体(照明時に輸送される)との間に光依存性の転座を示す。TRPLのこの細胞内輸送は、eGFPタグ付きTRPLを視細胞で発現させることによって、単純かつ非侵襲的な方法で研究することができる。eGFP蛍光は、その後、深い擬似瞳孔内または水浸漬顕微鏡によって観察することができる。これらの方法は、無傷の眼における蛍光の検出を可能にし、したがって、TRPL転座に欠損した ショウジョウバエ 変異体のハイスループットアッセイおよび遺伝子スクリーニングに有用である。ここでは、ハエの調製、顕微鏡的手法、ならびにTRPLのこの光誘発転座を研究するために使用される定量化方法が詳細に説明される。これらの方法は、他の ショウジョウバエ の感光体タンパク質、例えばロドプシンのトラフィッキング研究にも適用することができる。加えて、eGFPタグ付きラブドメラルタンパク質を使用することにより、これらの方法は、視細胞の変性を評価するために使用することができる。
概要
原形質膜との間でタンパク質を送達および除去することにより、ニューロンにおける膜タンパク質の輸送は、受容体およびイオンチャネルを有する原形質膜装置を制御し、その結果、ニューロン機能を調節する。タンパク質の輸送における調節ミスや欠陥は、通常、細胞に有害な影響を及ぼし、ニューロン変性をもたらす。ヒトでは、これはアルツハイマー病およびパーキンソン病または網膜色素変性症1などの神経変性疾患を引き起こし得る。ショウジョウバエの複眼における光受容体は、膜タンパク質のトラフィッキングを研究するためのin vivoモデル系となっている2。これは、効果的な遺伝子スクリーニングを可能にするショウジョウバエの遺伝的汎用性に起因するだけでなく、光吸収感光体膜のすべての必須成分が非常に詳細に特徴付けられ、フライアイに適用できる効率的な顕微鏡技術が利用可能であるためでもある。これらの手法は、この記事の焦点です。
ショウジョウバエの視細胞では、頂端原形質膜は、横紋と呼ばれる細胞の片側に沿って微絨毛の密集したスタックを形成する。視細胞R1-6のラブドメアは特徴的な台形パターンで配列され、視細胞R7およびR8はこの台形3の中心に単一のラブドメアを形成している。膜タンパク質のトラフィッキングは、ラブドーム内のこれらの光導入タンパク質の適切な量を保証するために、ロドプシンおよび光活性化TRP(一過性受容器電位)およびTRPL(TRP様)イオンチャネルなどのラブドメラ膜タンパク質の調節された代謝回転に必要である。光受容体膜タンパク質は小胞体で合成され、ゴルジ体を介して横紋岩に輸送される。光によるロドプシンの活性化に続いて、ロドプシン分子は、第2の光子の吸収によって不活性化されるか、またはクラスリン媒介性エンドサイトーシスによってラブドメアから除去され得る。エンドサイトーシスされたロドプシンは、リソソーム中で分解されるか、またはラブドミア4、5に戻ってリサイクルされる。イオンチャネルTRPLはまた、光伝達カスケードの活性化に続いて内在化され、ラブドミア(ハエが暗闇に保たれているときに位置する場所)と細胞体内のER富化貯蔵区画(照明時に数時間以内に輸送される)との間の光依存性転座を受ける6,7,8,9,10 .エンドサイトーシスされたロドプシンとは対照的に、少量のTRPLのみがエンドリソソーム経路を介して分解され、大部分は代わりに細胞内に貯蔵され、暗順応時にラブドミアにリサイクルされる6。したがって、TRPLは、原形質膜タンパク質の光トリガー輸送を分析するために使用することができる。ショウジョウバエの視細胞は、神経細胞の変性を研究するためにも使用されている。視細胞変性は、変性プロセスの結果として崩壊するラブドメアの構造を評価することによって頻繁に決定される5。
視細胞または視細胞変性におけるTRPLおよびロドプシンの細胞内局在を研究するために、ここでは分析速度および分解能に関して異なる2つの蛍光顕微鏡法が適用されてきた。遺伝子スクリーニングに使用できるが空間分解能が限られている非常に高速で非侵襲的な方法は、深い偽瞳孔(DPP)における蛍光の検出である。DPPは節足動物複眼の光学現象であり、その幾何学的起源は197111年にFranceschiniとKirschfeldによって詳細に説明されている。要するに、網膜オーバーレイの下のいくつかの光学面上に、隣接するオンマチジアからのラブドメアの画像が観察され得る。眼の湾曲の中心を通る焦点面上で、これらの重畳された投影は、わずか桁大きい単一のオンマチジウム内のラブドメアの台形レイアウトに似た画像を形成する。この現象は、蛍光タンパク質の外因性発現(例えばTRPL::eGFP8)とは無関係に観察することもでき、それにもかかわらずDPPの検出が容易になる(図1A-A'')12。第2の非侵襲的方法は、眼の視光学装置を水で光学的に中和した後、蛍光標識されたタンパク質を画像化することに依存する水浸漬顕微鏡法である(図1B-C'')12。水浸漬法を用いて、横筋腫または細胞体中のTRPL::eGFPの相対量を、個々の視細胞について定量的に評価することができる。さらに、非転座蛍光タグ付きタンパク質は、ここに記載されるように、横紋体の完全性を評価し、潜在的な変性の経時変化を定量的に決定するために利用することができる。
DPPの記録は、これらの方法の中で最も簡単で最速ですが、生成されるデータの空間分解能は限られています。さらに、DPPが存在しない理由は数多くありますが、DPPイメージング自体では必ずしも識別できません。DPPはいくつかのオンマチジアの総和を表すので、個々の細胞に関する情報は失われる。したがって、低解像度のDPPイメージングは、多数のハエをスクリーニングする上で重要な機能を果たすが、一般に、水浸漬顕微鏡による高解像度の記録が続くべきである。水浸漬顕微鏡写真は、個々の細胞、発生欠陥、眼の形態、タンパク質の誤局在化または網膜変性、ならびにこれらの影響の定量化に関する解釈を可能にする。このプロトコルでは、これら 2 つの手法について詳しく説明します。
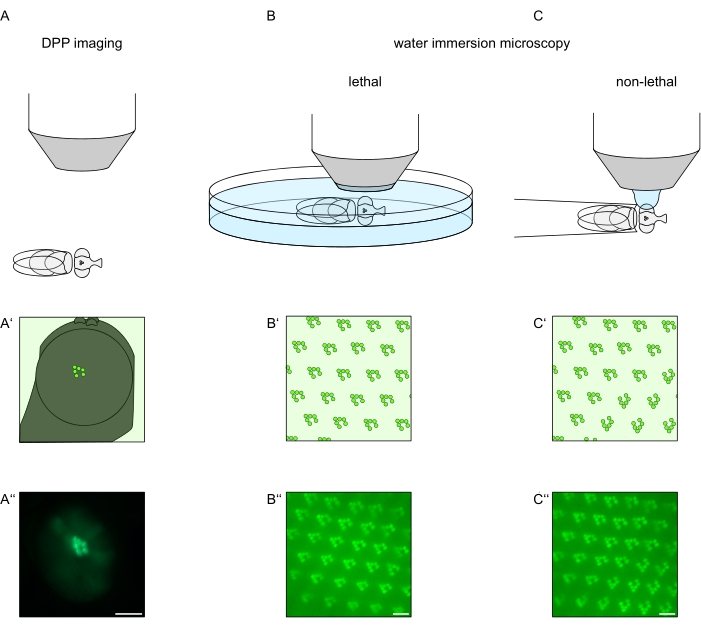
図1:この議定書に提示されたショウジョウバエ眼の顕微鏡検査のバリエーションの概要。(A−A'')蛍光深部擬似瞳孔(DPP)画像化、(B−B'')蛍光ラブドメアの致死水浸漬顕微鏡、および(C−C'')蛍光ラブドメアの非致死水滴顕微鏡の概略表現および例示的な顕微鏡写真。スケールバー(A ́'):100μm。スケールバー(B''-C''):10μm。この図は参考文献13から修正されている。この図の拡大版を表示するには、ここをクリックしてください。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. 留意すべき事項
- 形態学的解析には横紋体に恒久的に位置する蛍光タンパク質を発現する ショウジョウバエ 株(例:TRP::eGFP、eGFP::NINAC)を使用し、転座タンパク質はタンパク質のトラフィッキングに関する解析に使用(例:TRPL::eGFP、Arr2::eGFP)を使用します。
- 実験的アプローチのために選択されたハエの光露光条件を予め決定する。
- 暗順応のために、ハエを暗い箱に25°Cで所望の期間保管する。 転座実験(例えば、TRPL::eGFP発現ハエ)で最大16時間照明する場合は、室温で蛍光管の下にハエを保管してください。
- 感光体の変性(例えば、TRP::eGFP発現ハエ)を評価する実験では、ハエを25°Cの蛍光管の下に12時間の光/12時間の暗サイクルで保持し、白色光で最大28日間の長期照明を行う。
- 色のついた光でハエを照らすには、蛍光管と一緒に異なる色の透明なプラスチック製の箱を使用してください。
- 色素沈着した目を持つフライストックが使用される場合、目の色素沈着は年齢とともに有意に増加する可能性があるため、比較分析のために正確に年齢動物。
注:データの解釈のためには、横紋体構造の光導波効果による信号バイアスが存在することに注意することが重要です。したがって、ラブドミアからの蛍光シグナルは、細胞体から得られるシグナルに対してDPPイメージングおよび水浸漬顕微鏡において常にある程度増幅されるであろう。これは、ラブドメアの外側からの蛍光がこれらの色素によって吸収され、細胞内に転座する融合タンパク質が検出される場合に特に重要である色素沈着した眼において最も顕著に観察される。したがって、重要なステップに関して、この研究は白目と赤目のハエを別々に考慮する。 - 水浸漬顕微鏡法に関しては、2つの変形例が記載されている。より速い致死的変動と非致死的変動により、その後の研究のための回復を可能にする。
2. DPPイメージング
- 図 2 に示すように、必要な機器と試薬で作業スペースを準備します。フライパッド上のCO2を有する視細胞において蛍光タンパク質を発現する遺伝子型のハエ(1〜3日齢)を麻酔する。従来の光源および低倍率(例えば、10倍)を有する実体顕微鏡下で画像化するために動物を選択する。

図2:DPPイメージングワークスペース 必要な材料は、(A)CO2麻酔装置、(B)UVランプと蛍光フィルターセットを備えた実体顕微鏡、(C)光源、(D)ソフトウェア付き顕微鏡搭載カメラ、(F)ペイントブラシ、(G)黒い段ボール、および(H)フライバイアルです。この図の拡大版を表示するには、ここをクリックしてください。
- DPPイメージングでは、選択したハエを麻酔をかけたままにし、左目または右目のいずれかが対物レンズに正確に放射状に向くように、顕微鏡対物レンズの中央にそれらの1つをその側に置きます(図3A)。
注:視細胞のオンマチジウム配列は背側腹正中線で鏡面対称性を示すので、DPPは眼の赤道のわずかに上または下で最もよく観察される(図3B)。
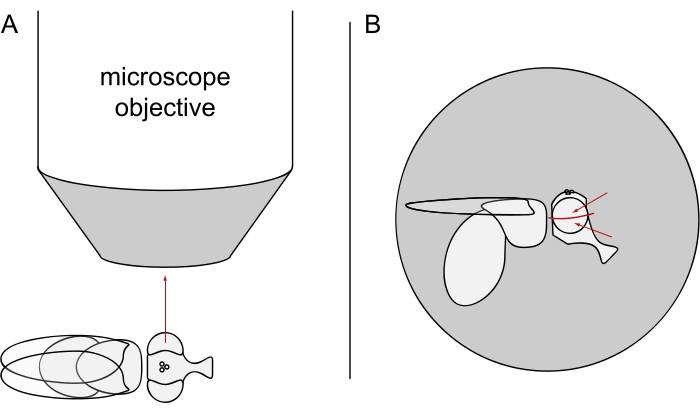
図3:DPPイメージングのための実体顕微鏡下でのフライの位置決め。(A)片目を顕微鏡対物レンズ放射状に向けさせたフライの側面の図。(B)フライヘッドは、赤い矢印で示すように、目標が目の赤道の少し上または下の点に焦点を合わせるように、わずかに上または下に向ける必要があります。この図の拡大版を表示するには、ここをクリックしてください。
- 目全体に収まるように倍率を上げ(例えば、100倍)、眼の中央のオンマチディアを中央に配置します。顕微鏡の被写界深度を下げるには、例えば、二重虹彩絞りを浅い設定に調整します(図4A-B ́)。
- 従来の光源をオフにし、顕微鏡のUVランプを最大強度でオンにし、目に発現する蛍光タンパク質に応じて顕微鏡の蛍光フィルターセットを選択します(図4C-E)。顕微鏡に取り付けられたカメラに向かって光路を設定します。
- ソフトウェア内のライブイメージング機能を使用して、露出時間とゲイン値(それぞれ80ミリ秒と12倍)を調整して、目からの特定の信号のみを検出する設定に画像の明るさを調整します。顕微鏡の焦点を眼(角膜の下)の「内側」に再調整して、DPPの重畳画像を生成します(図4C-E ́)。
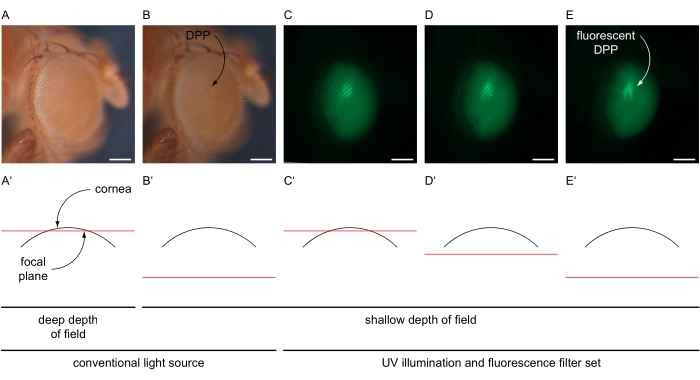
図4:DPPおよび蛍光DPPイメージングの説明図。 ショウジョウバエの眼の例示的な画像は、GFPフィルタセットを用いた従来のUV照明下で、眼を通る概略断面に図示される様々な焦点面で撮影される。(A)(A ́)に例示されているように、従来の光源の明るい設定、30msの露光時間、1倍のゲイン、深い被写界深度、および角膜の表面近くの焦点面で記録された顕微鏡写真。(B)(B ́)に示すように、従来の光源の明るい設定、露光時間30ms、ゲイン1倍、被写界深度が浅く、焦点面が角膜表面より約180μm低い位置で記録された顕微鏡写真。民進党が示された。(C-E)UV光源とGFPフィルターセットの高輝度設定、80ms露光時間、12倍ゲイン、浅い被写界深度、および焦点面(C ́)近傍、(D')わずかに下方、または(E')角膜表面の約180μm下に記録された顕微鏡写真。蛍光DPPは湾曲した矢印で示されている。スケール バー 100 μm。この図の拡大版を表示するには、ここをクリックしてください。
- 蛍光DPPのスナップショットを撮ります。顕微鏡を可視光線に戻し、光路を眼球に戻します。画像化された動物をハエバイアルに回収し、そのDPP表現型(例えば、交配)に従ってさらなる手続を行う。ステップ 2.2 の次の動物に進みます。
3. 水浸漬顕微鏡
- フライの準備
- 図 5 に示すように、必要な機器と試薬で作業スペースを準備します。予め冷却された15mL遠沈管に所定の年齢および照明条件でハエを移し、氷上で15〜30分間インキュベートすることによって麻酔をかける。
注:1日齢の暗く適応したハエを参考にして持ち運んでください。一般的に、暗く適応したハエは、暗闇の中で蓋をしたアイスボックスに移されるべきです。光に適応したハエは、部屋の光の中で氷に移すことができます。
- 図 5 に示すように、必要な機器と試薬で作業スペースを準備します。予め冷却された15mL遠沈管に所定の年齢および照明条件でハエを移し、氷上で15〜30分間インキュベートすることによって麻酔をかける。

図5:水浸漬顕微鏡ワークスペース。 必要な材料は、(A)15mL遠沈管、(B)アイスフレーク、(C)チルド蒸留水、(D)実体顕微鏡、(E)ペトリ皿、(F)プラスティシン、(G)オブジェクトスライド、(H)昆虫ピンまたはピペットチップおよびメス、(I)ソフトウェア付き蛍光顕微鏡です。この図の拡大版を表示するには、ここをクリックしてください。
- 以下に説明する2つの調製物(3.1.3致死的変動または3.1.7非致死的変動)から適切な調製物を選択し、色素沈着眼と非色素眼の区別が行われるときはいつでも、それぞれの手順に従ってください。
- 次のように致命的なバリエーションのためにハエを準備します。
- プラスティックの断片を物体のスライドに付着させ、別の部分をペトリ皿の中央(例えば、94mmØ)に接着し、今のところそれらを別々に保ちます。氷冷した蒸留水といくつかの氷フレークでペトリ皿を満たします(図6A)。
- 氷麻酔フライ1匹を実体顕微鏡下に置き、プラスティシンコーティングされた物体スライドの上に置きます。フライを背中に回し、胸郭の中心に昆虫のピンを突き刺します(図6B)。プラスティシンでコーティングされた物体スライドにピンを水平に固定し、フライの左目または右目を上向きにします(図6C)。
- プラスティックを含まない側を下に向けて、フライの回転を防ぐペトリ皿にオブジェクトスライドを慎重に固定します。フライアイが水で覆われていることを確認します(図6D)。準備針を使用して、目の周りに形成された可能性のある気泡を慎重に取り除き、最良の結果を得るためにすぐに画像取得に進みます。
注:画像取得が大幅に遅れると、ハエの再覚醒や動きが発生し、画像がぼやける可能性があります。
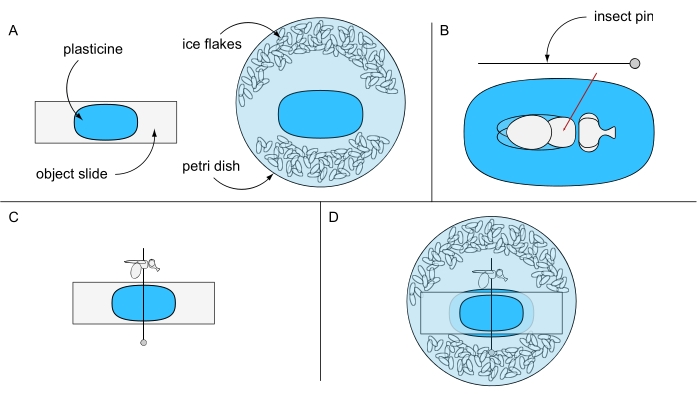
図6:致死水浸漬顕微鏡のための準備。 (A)プラスティシン被覆物体スライドおよびシャーレ、(B)プラスティック研磨地面に胸郭を通るフライの固定、(C)プラスティック被覆物体スライド上のフライ配向、および(D)最終実験セットアップの図。 この図の拡大版を表示するには、ここをクリックしてください。
- 次のように非致死的な変動のためにハエを準備してください。
- 氷麻酔をかけたハエ 1 匹をヘッドファーストで 200 μL のピペットチップに移し、圧縮空気でハエを先端に向かって慎重に押し込みます。
- 頭のすぐ前のピペットチップをメスで切り落とします。ピンセットを使用して、ハエを先端から数ミリメートル離して慎重に押します。ピペットチップを再び切断し、フライの頭部のみがピペットチップから突出するように、圧縮空気でフライを先端に向かって押し戻します。
- プラスティシン片を物体のスライドに付着させ、フライの左目または右目が上を向くようにピペットチップを押し込みます(図7A)。画像取得の直前に、実験用ピペットを使用して、水浸漬対物レンズの下側に大量の冷水滴を付着させます(図7B)。最良の結果を得るには、すぐに画像取得に進みます。
注:画像取得が大幅に遅れると、ハエの再覚醒や動きが発生し、画像がぼやける可能性があります。
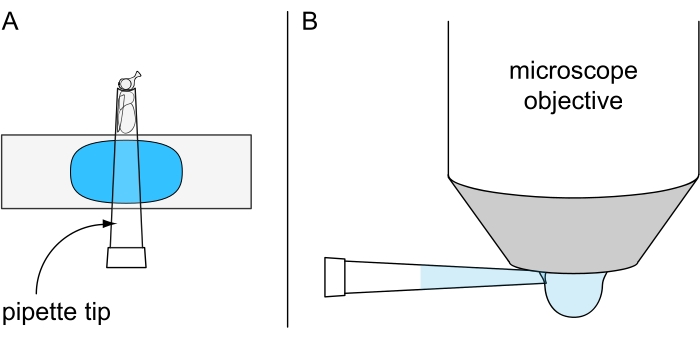
図7:非致死的な水滴顕微鏡検査のための準備。 (A)プラスティシンコーティングされた物体スライドに取り付けられた200μLのピペットチップ内に固定された冷麻酔フライ、および(B)水浸漬対物の下側に冷水滴を塗布する図。 この図の拡大版を表示するには、ここをクリックしてください。
- 画像取得
- 準備したフライでペトリ皿(ステップ3.1.3)またはオブジェクトスライド(ステップ3.1.7)を顕微鏡ステージ上に慎重に置き、水浸漬対物レンズを選択します。
- 水浸対物レンズが水面に接触するまで(ステップ3.1.3)、フライズアイが落下物に触れるまで(ステップ3.1.7)、水没目標を手動で下げます(図8A、B)。
- 顕微鏡UVランプをオンにし、適切なフィルターセットを選択します。接眼レンズを使用してフライを対物レンズの下に置き、顕微鏡を目の表面に焦点を合わせます。
- 顕微鏡カメラへの光路を切り替え、対応するソフトウェアでライブ画像を生成します。カメラの焦点を再調整し、図8C-Eに詳細に示すように、目が顕微鏡の対物レンズを放射状に向けなければならないことを考慮して、目の向きを評価します。
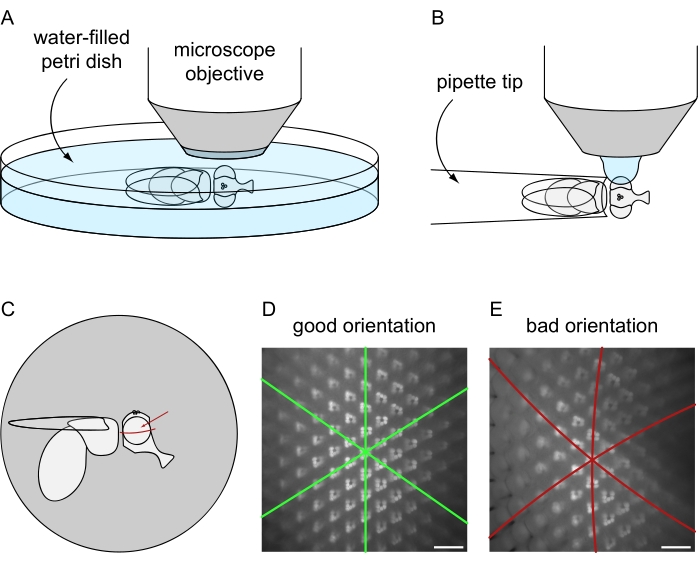
図8:水浸漬イメージング用の蛍光顕微鏡下でのフライの位置決め。 (A)致死的または(B)非致死的なハエ準備プロトコルを使用した画像取得のセットアップと最終的な向き。(C)水浸漬顕微鏡画像の最良の結果を得るためのハエの向きの説明図。目に焦点を当てるのに理想的なポイントは、前/後軸および背/腹軸に対する正確な中心ではなく、赤い矢印で示すように、目の赤道よりわずかに上にあります。(d)完全に位置決めされた眼のための水浸漬画像の例。六角形オンマチジウムタイルの3つの対称軸はすべて直線として表示され、オンマチジアの最大量を同時に焦点を合わせることができます。(e)不適切に配置された眼の水浸漬画像の例。画像には、湾曲した軸と浅い被写界深度が含まれています。スケール バー: 20 μm。 この図の拡大版を表示するには、ここをクリックしてください。
- イメージングソフトウェア内の適切なLUT(ルックアップテーブル)を使用して、過飽和(赤色ピクセルで表示)を検出します。
- 色素沈着していないハエの場合は、最も明るいピクセルがすべての画像の彩度制限のすぐ下になるように露光時間を調整します。
- 色素沈着したハエと致命的な変動の場合、最も明るいすべてのピクセルが少なくとも5匹の1日齢の暗い適応ハエの彩度限界のすぐ下になるように露光時間を調整します。計算された平均露光時間を他のすべての実験条件(遺伝子型、照明条件、時間点など)に適用します。
- 色素沈着したハエ(例えば、赤目)および非致死的な変動の場合、すべての最も明るいピクセルが、1日齢の暗く適応したハエごとに彩度限界をわずかに下回るように露光時間を調整する。この露光時間を、このハエの他のすべての実験条件(照明条件、時間点など)に適用します。
- 画像を記録し、生のファイルとして保存して、記録の対応するすべてのメタデータをアーカイブします。次の定量化のために、画像を.tif形式でエクスポートします。
注:致死的でない変動の場合、ハエがさらなる実験に使用することを意図している場合は、画像取得直後に赤色光(例えば、630nm)でハエを5分間照らす。赤色光は、画像取得時に強烈な短波光によって過度に活性化された光伝達カスケードを失活させる。
- 水浸漬顕微鏡写真の横紋体における相対eGFP蛍光のデータ分析と定量化
- ソフトウェアImageJ /Fijiをダウンロード、インストール、実行します。
- ImageJ の設定を調整するには、[ 分析] > [測定値の設定] をクリックします。 をクリックし、[ 平均グレー値] のボックスのみをオンにします。.tif画像をインポートするには、[ 開く] をクリックして>ます。 またはドラッグアンドドロップによって。ピントが合っている画像の代表的な領域を選択し、 Ctrl キー と + を同時に繰り返し押すことで 200% ~ 300% に拡大します。
- 楕円形ツールを選択し、Shift キーを押しながら、1 つの蛍光横紋より大幅に小さい円形の選択範囲を画像内に生成します。マウスボタンを放す前に、ImageJメインウィンドウのツールバーの下に表示される正確なサイズを探します。すべての解析に同じサイズの円形選択を使用します。
メモ: 円形選択範囲の正確なサイズ (ピクセルまたはミクロン単位) は、特定の設定によって異なります。1日齢の暗く適応した対照ハエの横紋体の直径の約1/3または1/4の円を使用する。 - 円形の選択範囲を移動するには、マウスキーを押しながら選択範囲内をドラッグするか、キーボードの矢印キーを押します。
- 円形選択範囲内の蛍光強度を測定するには、円を最初のラブドミア(r1)に移動し、[ 分析]>[測定] をクリックするか、ショートカット Ctrl + Mを使用します。測定されたグレー値を一覧表示する 結果 ウィンドウがポップアップ表示されます。
- r2-r6の測定をバックグラウンド信号の測定(b)と繰り返し測定として継続する。色素沈着していないハエの場合は、対応する細胞体領域(c1-c6)の追加測定を行います(図9)。
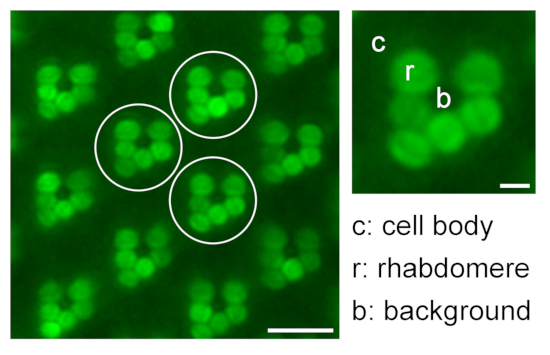
図9:転座研究のための相対的横紋蛍光の定量化。 1つの水浸漬顕微鏡画像において、3つの異なる代表的オンマチジウム(白丸)のラブドメア(r)、細胞体(c)、およびバックグラウンド(b)の蛍光強度を測定することによって、ラブドメアにおける相対的なeGFP蛍光の定量化に関する例示;スケールバー:10μm。拡大されたオンマチジウムが右側に示されています。スケール バー: 2 μm。 この図の拡大版を表示するには、ここをクリックしてください。
- 手順 3.3.5 と 3.3.6 をさらに 2 つのオンマチディアに対して繰り返し、3 つのテクニカル レプリケートを作成します。 鉛筆 ツールを使用して分析されたオンマティディアにマークを付け、この画像をドキュメント用に保存します。
- 結果ウィンドウから測定されたグレー値を選択してコピーし、スプレッドシートソフトウェアに貼り付けてさらに計算します。蛍光強度の値を、その起源に従って、ラブドメア(r)、細胞体(c)、およびバックグラウンド(b)のカテゴリにソートします。各カテゴリ(Ir、Ic、Ib)から平均強度を計算します。
- 非色素沈着眼については下記式(1)を使用し、ラブドメア(登録商標)中に存在するeGFPの相対量を計算する:
 (1)
(1) (2)
(2) - ステップ 3.3.3 の次のイメージに進みます。信頼性の高い測定値を得るためには、各実験群の少なくとも5人の個体からの画像を生物学的複製として使用することをお勧めします。
- 水浸顕微鏡写真におけるeGFP蛍光による眼形態のデータ解析と定量化
- ImageJ/Fijiソフトウェアをダウンロード、インストール、実行します。.tif画像をインポートするには、[ 開く>ファイル ]をクリックするか、ドラッグアンドドロップします。焦点が合っている画像の代表的な領域で隣接する3つのオンマチジアを選択します。
- 選択対象の18個のラブドメアを、周囲のバックグラウンド信号に対するeGFP強度、エッジシャープネス、およびコントラストに従って個別に評価し、変性指数を生成します。値が2のはっきりと見えるラブドメア、値が1の弱く見えるラブドメア、および値が0の存在しないラブドメアにスコアを付けます(図10)。
注: この定量化方法では、完全に無傷の目でスコアが 36 になり、完全に退化した目ではスコアが 0 になります。変性指数のスコアを36〜100%に設定することをお勧めします。

図10:変性研究のためのラブドミア評価 による 定量化。 1つの水浸漬顕微鏡画像における3つの異なる代表的オンマチジウム(白丸)の横紋体を2(はっきりと見える;青い円)、1(弱く見える;オレンジの円)、または0(存在しない;赤い円)の値でスコアリングすることによって、眼形態の定量化に関する図。スケールバー:10μm。拡大されたオンマチジウムが右側に示されています。スケール バー: 2 μm。 この図の拡大版を表示するには、ここをクリックしてください。
- 次のイメージを開き、ステップ 3.4.2 に進みます。信頼性の高い測定値を得るためには、生物学的複製として各実験群の少なくとも8人の個人からの画像を使用することをお勧めします。
注:この定量化方法は、蛍光強度による転座を定量する方法よりも目的が低いため、推奨される反復数は高くなります。
Access restricted. Please log in or start a trial to view this content.
結果
ロドプシン1プロモーターの制御下でTRPL::eGFP融合タンパク質を発現するトランスジェニックショウジョウバエが生成されている。これらのハエでは、TRPL::eGFPは複眼の視細胞R1-6に発現し、照明依存的な局在を示す。ハエが暗闇の中で飼われると、TRPL::eGFPは外側のラブドメアに組み込まれます。数時間の照明の後、TRPLは細胞体に転移し、そこでER濃縮コンパートメントに貯蔵される。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
蛍光タンパク質の適用性とDPPイメージングおよび網膜水浸漬顕微鏡によるスクリーニングの単純さは、多くのグループによって成功していることが証明されています12。ここに提示されたものと同様の戦略は、Rh1::eGFP 17、18、19、20、21の助けを借りて、?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは開示するものは何もありません。
謝辞
私たちは長年にわたる学生研究者に感謝したいと思います。特に、ニーナ・マイヤー、シビル・メイヤー、ジュリアン・カイム、ローラ・ジャギーは、そのデータが代表的な結果としてこのプロトコルで利用されています。ここで紹介する私たちのグループの研究は、ドイツ連邦共和国(Hu 839/2-4, Hu 839/7-1)からArmin Huberへの助成金によって資金提供されました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 15 mL centrifuge tube | Greiner Bio-One | 188271 | |
| CO2 anaesthesia fly pad | Flystuff | 59-172 | |
| Cold light lamp (KL 1500 LCD) | Zeiss | ||
| Fiji/ImageJ | NIH | ||
| Fluorescence microscope with UV lamp, camera, filter set and software (AxioImager.Z1m, Axiocam 530 mono, 38 HE, ZEN2 blue edition) | Zeiss | ||
| Fluorescent tube (Lumilux T8, L 30W/840, 4000 K, G13) [1750 Lux, Ee470nm = 298 µW cm-2, Ee590nm = 215 µW cm-2] and [760 Lux, Ee470nm = 173 µW cm-2, Ee590nm = 147 µW cm-2] | Osram | 4050300518039 | |
| Laboratory pipette (20-200 µL) | Eppendorf | ||
| Object slide | Roth | 0656.1 | |
| Petri dish (94 mm) | Greiner Bio-One | 633102 | |
| Pipette tips (200 µL) | Labsolute | 7695844 | |
| Plasticine (Blu-Tack) | Bostik | 30811745 | |
| Stereo microscope (SMZ445) | Nikon | ||
| Stereo microscope with UV lamp, camera, filer set and software (MZ16F, MC170 HD, GFP3, LAS 4.12) | Leica |
参考文献
- Wang, X., Huang, T., Bu, G., Xu, H. Dysregulation of protein trafficking in neurodegeneration. Molecular Neurodegeneration. 9. 9, 31(2014).
- Schopf, K., Huber, A. Membrane protein trafficking in Drosophila photoreceptor cells. European Journal of Cell Biology. 96 (5), 391-401 (2017).
- Hardie, R. C. The photoreceptor array of the dipteran retina. Trends in Neurosciences. 9, 419-423 (1986).
- Wang, T., Montell, C. Phototransduction and retinal degeneration in Drosophila. Pflügers Archiv - European Journal of Physiology. 454 (5), 821-847 (2007).
- Xiong, B., Bellen, H. J. Rhodopsin homeostasis and retinal degeneration: lessons from the fly. Trends in Neurosciences. 36 (11), 652-660 (2013).
- Bähner, M., et al. Light-regulated subcellular translocation of Drosophila TRPL channels induces long-term adaptation and modifies the light-induced current. Neuron. 34 (1), 83-93 (2002).
- Cronin, M. A., Lieu, M. -H., Tsunoda, S. Two stages of light-dependent TRPL-channel translocation in Drosophila photoreceptors. Journal of Cell Science. 119, 2935-2944 (2006).
- Meyer, N., Joel-Almagor, T., Frechter, S., Minke, B., Huber, A. Subcellular translocation of the eGFP-tagged TRPL channel in Drosophila photoreceptors requires activation of the phototransduction cascade. Journal of Cell Science. 119, Pt 12 2592-2603 (2006).
- Oberegelsbacher, C., Schneidler, C., Voolstra, O., Cerny, A., Huber, A. The Drosophila TRPL ion channel shares a Rab-dependent translocation pathway with rhodopsin. European Journal of Cell Biology. 90 (8), 620-630 (2011).
- Wagner, K., Smylla, T. K., Lampe, M., Krieg, J., Huber, A. Phospholipase D and retromer promote recycling of TRPL ion channel via the endoplasmic reticulum. Traffic. , (2021).
- Franceschini, N., Kirschfeld, K. Les phénoménes de pseudopupille dans l'oeil compose de Drosophila. Kybernetik. 9 (5), 159-182 (1971).
- Pichaud, F., Desplan, C. A new visualization approach for identifying mutations that affect differentiation and organization of the Drosophila ommatidia. Development. 128 (6), 815-826 (2001).
- Smylla, T. K., Wagner, K., Huber, A. Application of fluorescent proteins for functional dissection of the Drosophila visual system. International Journal of Molecular Sciences. 22 (16), (2021).
- Meyer, N. Mechanisms of the light-dependent translocation of the ion channel TRPL in the photoreceptors of Drosophila melanogaster: Dissertation for obtaining the academic degree Dr. rer. nat. University of Karlsruhe (TH). , Karlsruhe. (2005).
- Meyer, N., Oberegelsbacher, C., Dürr, T. D., Schäfer, A., Huber, A. An eGFP-based genetic screen for defects in light-triggered subcelluar translocation of the Drosophila photoreceptor channel TRPL. Fly. 2 (1), 36-46 (2008).
- Zheng, L., Carthew, R. W. Lola regulates cell fate by antagonizing Notch induction in the Drosophila eye. Mechanisms of Development. 125 (1-2), 18-29 (2008).
- Hibbard, K. L., O'Tousa, J. E. A role for the cytoplasmic DEAD box helicase Dbp21E2 in rhodopsin maturation and photoreceptor viability. Journal of Neurogenetics. 26 (2), 177-188 (2012).
- Huang, Y., Xie, J., Wang, T. A Fluorescence-based genetic screen to study retinal degeneration in Drosophila. PloS One. 10 (12), 0144925(2015).
- Zhao, H., Wang, J., Wang, T. The V-ATPase V1 subunit A1 is required for rhodopsin anterograde trafficking in Drosophila. Molecular Biology of the Cell. 29 (13), 1640-1651 (2018).
- Xiong, L., et al. ER complex proteins are required for rhodopsin biosynthesis and photoreceptor survival in Drosophila and mice. Cell Death and Differentiation. 27 (2), 646-661 (2020).
- Zhao, H., Wang, T. PE homeostasis rebalanced through mitochondria-ER lipid exchange prevents retinal degeneration in Drosophila. PLoS Genetics. 16 (10), 1009070(2020).
- Cerny, A. C., et al. The GTP- and phospholipid-binding protein TTD14 regulates trafficking of the TRPL ion channel in Drosophila photoreceptor cells. PLoS Genetics. 11 (10), 1005578(2015).
- Richter, D. Structural and functional analyses of TRP ion channels in the photoreceptor cells of Drosophila melanogaster: Dissertation for obtaining the academic degree Dr. rer, nat. University of Karlsruhe (TH). , Karlsruhe. (2007).
- Gambis, A., Dourlen, P., Steller, H., Mollereau, B. Two-color in vivo imaging of photoreceptor apoptosis and development in Drosophila. Developmental Biology. 351 (1), 128-134 (2011).
- Hardie, R. C., Liu, C. -H., Randall, A. S., Sengupta, S. In vivo tracking of phosphoinositides in Drosophila photoreceptors. Journal of Cell Science. 128 (23), 4328-4340 (2015).
- Chakrabarti, P., et al. A dPIP5K dependent pool of phosphatidylinositol 4,5 bisphosphate (PIP2) is required for G-protein coupled signal transduction in Drosophila photoreceptors. PLoS Genetics. 11 (1), 1004948(2015).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved