Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Untersuchung des Membranproteintransports in Drosophila-Photorezeptorzellen unter Verwendung von eGFP-markierten Proteinen
In diesem Artikel
Zusammenfassung
Hier werden nicht-invasive Methoden zur Lokalisation von Photorezeptormembranproteinen und zur Beurteilung der Netzhautdegeneration im Drosophila-Facettenauge mittels eGFP-Fluoreszenz beschrieben.
Zusammenfassung
Der Membranproteintransport reguliert den Einbau und die Entfernung von Rezeptoren und Ionenkanälen in die Plasmamembran. Dieser Prozess ist grundlegend wichtig für die Zellfunktion und die Zellintegrität von Neuronen. Drosophila-Photorezeptorzellen sind zu einem Modell für die Untersuchung des Membranproteintransports geworden. Neben Rhodopsin, das bei Beleuchtung aus der Photorezeptormembran internalisiert und abgebaut wird, weist der transiente Rezeptorpotential-ähnliche (TRPL) Ionenkanal in Drosophila eine lichtabhängige Translokation zwischen der rhabdomeralen Photorezeptormembran (wo es sich im Dunkeln befindet) und dem Photorezeptorzellkörper (zu dem es bei Beleuchtung transportiert wird) auf. Dieser intrazelluläre Transport von TRPL kann auf einfache und nicht-invasive Weise untersucht werden, indem eGFP-markiertes TRPL in Photorezeptorzellen exprimiert wird. Die eGFP-Fluoreszenz kann dann entweder in der tiefen Pseudopupille oder mittels Wasserimmersionsmikroskopie beobachtet werden. Diese Methoden ermöglichen den Nachweis der Fluoreszenz im intakten Auge und sind daher nützlich für Hochdurchsatz-Assays und genetische Screens für Drosophila-Mutanten , die bei der TRPL-Translokation defekt sind. Hier werden die Herstellung von Fliegen, die mikroskopischen Techniken sowie Quantifizierungsmethoden, mit denen diese lichtgetriggerte Translokation von TRPL untersucht wird, ausführlich erläutert. Diese Methoden können auch für Handelsstudien an anderen Drosophila-Photorezeptorproteinen , zum Beispiel Rhodopsin, angewendet werden. Darüber hinaus können diese Methoden durch die Verwendung von eGFP-markierten rhabdomeralen Proteinen verwendet werden, um die Degeneration von Photorezeptorzellen zu beurteilen.
Einleitung
Durch die Abgabe und Entfernung von Proteinen zur und von der Plasmamembran steuert der Membranproteintransport in Neuronen die Plasmamembranausrüstung mit Rezeptoren sowie Ionenkanälen und reguliert dadurch die neuronale Funktion. Fehlregulationen oder Defekte im Proteintransport haben typischerweise schädliche Auswirkungen auf Zellen und führen zu neuronaler Degeneration. Beim Menschen kann dies neurodegenerative Erkrankungen wie Alzheimer und Parkinson oder Retinitis pigmentosa1 verursachen. Photorezeptoren im Facettenauge von Drosophila melanogaster sind zu einem In-vivo-Modellsystem für die Untersuchung des Membranproteintransportsgeworden 2. Dies liegt nicht nur an der genetischen Vielseitigkeit von Drosophila , die effektive genetische Screens ermöglicht, sondern auch daran, dass alle wesentlichen Bestandteile der lichtabsorbierenden Photorezeptormembran sehr detailliert charakterisiert sind und effiziente mikroskopische Techniken zur Verfügung stehen, die auf das Fliegenauge angewendet werden können. Diese Techniken stehen im Mittelpunkt dieses Artikels.
In Drosophila-Photorezeptorzellen bildet die apikale Plasmamembran einen dicht gepackten Stapel von Mikrovilli entlang einer Seite der Zelle, der als Rhabdomere bezeichnet wird. Die Rhabdomere der Photorezeptorzellen R1-6 sind in einem charakteristischen trapezförmigen Muster angeordnet, während die Photorezeptorzellen R7 und R8 ein einzelnes Rhabdomere in der Mitte diesesTrapezes 3 bilden. Der Membranproteintransport wird für einen regulierten Umsatz von rhabdomeralen Membranproteinen wie Rhodopsin und den lichtaktivierten Ionenkanälen TRP (transient receptor potential) und TRPL (TRP-like) benötigt, um die richtige Menge dieser Phototransduktionsproteine im Rhabdomere sicherzustellen. Photorezeptormembranproteine werden im endoplasmatischen Retikulum synthetisiert und über den Golgi-Apparat zum Rhabdomere transportiert. Nach der Aktivierung von Rhodopsin durch Licht kann ein Rhodopsinmolekül entweder durch Absorption eines zweiten Photons inaktiviert oder durch Clathrin-vermittelte Endozytose aus dem Rhabdomere entfernt werden. Endozytosiertes Rhodopsin wird entweder im Lysosom abgebaut oder in den Rhabdomerezurückgeführt 4,5. Der Ionenkanal TRPL wird nach Aktivierung der Phototransduktionskaskade ebenfalls internalisiert und durchläuft eine lichtabhängige Translokation zwischen dem Rhabdomere (wo er sich befindet, wenn Fliegen im Dunkeln gehalten werden) und einem ER-angereicherten Staufach im Zellkörper (zu dem er bei Beleuchtung innerhalb weniger Stunden transportiert wird)6,7,8,9,10 . Im Gegensatz zu endozytosiertem Rhodopsin werden nur geringe Mengen TRPL über den endolysosomalen Weg abgebaut, und der Großteil wird stattdessen intrazellulär gespeichert und bei dunkler Anpassung wieder in den Rhabdomer zurückgeführt6. TRPL kann somit zur Analyse des lichtgetriggerten Transports von Plasmamembranproteinen verwendet werden. Drosophila-Photorezeptorzellen werden auch zur Untersuchung der neuronalen Degeneration eingesetzt. Die Degeneration von Photorezeptorzellen wird häufig durch die Beurteilung der Struktur von Rhabdomeren bestimmt, die infolge degenerativer Prozesse zerfallen5.
Um die subzelluläre Lokalisation von TRPL und Rhodopsin in Photorezeptorzellen oder die Degeneration von Photorezeptorzellen zu untersuchen, wurden hier zwei Fluoreszenzmikroskopie-Methoden angewendet, die sich hinsichtlich Analysegeschwindigkeit und Auflösung unterscheiden. Eine sehr schnelle, nicht-invasive Methode, die für genetische Screens verwendet werden kann, jedoch mit einer begrenzten räumlichen Auflösung, ist der Nachweis der Fluoreszenz in der tiefen Pseudopupille (DPP). Das DPP ist ein optisches Phänomen von Arthropoden-Facettenaugen, dessen geometrischer Ursprung1971 von Franceschini und Kirschfeld ausführlich erklärt wurde 11. Kurz gesagt, auf mehreren optischen Ebenen unterhalb der Netzhautüberlagerung können Bilder von Rhabdomeren aus benachbarten Ommatidien beobachtet werden. Auf einer Fokusebene durch die Mitte der Augenkrümmung bilden diese überlagerten Projektionen ein Bild, das dem trapezförmigen Layout von Rhabdomeren in einem einzigen Ommatidium ähnelt, das nur um Größenordnungen größer ist. Dieses Phänomen kann auch unabhängig von der exogenen Expression von Fluoreszenzproteinen (z.B. TRPL::EGFP 8) beobachtet werden, was den Nachweis des DPP jedoch erleichtert (Abbildung 1A-A'')12. Eine zweite nicht-invasive Methode ist die Wasserimmersionsmikroskopie, die auf der Abbildung fluoreszierend markierter Proteine beruht, nachdem der Dioptrienapparat der Augen optisch mit Wasser neutralisiert wurde (Abbildung 1B-C'')12. Mit der Wasserimmersionsmethode kann die relative Menge an TRPL::eGFP in den Rhabdomeren oder im Zellkörper für einzelne Photorezeptorzellen quantitativ beurteilt werden. Darüber hinaus können nicht-translozierende fluoreszenzmarkierte Proteine verwendet werden, um die rhabdomerale Integrität zu bewerten und den zeitlichen Verlauf einer möglichen Degeneration quantitativ zu bestimmen, wie hier beschrieben.
Während Aufzeichnungen des DPP bei weitem die einfachste und schnellste dieser Methoden sind, ist die räumliche Auflösung der von ihnen generierten Daten begrenzt. Darüber hinaus gibt es zahlreiche Gründe, warum ein DPP fehlen kann, die für die DPP-Bildgebung selbst nicht unbedingt erkennbar sind. Da der DPP eine Summe mehrerer Ommatidien darstellt, gehen Informationen über einzelne Zellen verloren. Daher erfüllt die DPP-Bildgebung mit niedriger Auflösung eine wichtige Funktion beim Screening einer großen Anzahl von Fliegen, sollte jedoch im Allgemeinen von Aufnahmen mit höherer Auflösung mittels Wasserimmersionsmikroskopie gefolgt werden. Wasserimmersionsmikroskope erlauben Interpretationen über einzelne Zellen, Entwicklungsdefekte, Augenmorphologie, Proteinfehllokalisation oder Netzhautdegeneration sowie die Quantifizierung dieser Effekte. Dieses Protokoll beschreibt diese beiden Techniken im Detail.
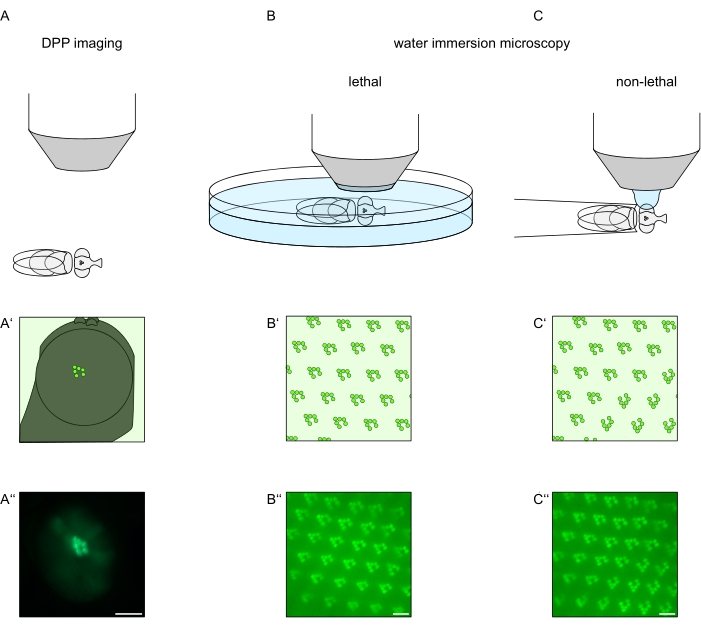
Abbildung 1: Übersicht über die in diesem Protokoll dargestellten Mikroskopievariationen für das Drosophila-Auge. Schematische Darstellungen und exemplarische Mikroaufnahmen der (A-A'') fluoreszierenden tiefen Pseudopupillenbildgebung (DPP), (B-B'') der tödlichen Wasserimmersionsmikroskopie von fluoreszierenden Rhabdomeren und (C-C'') der nicht-tödlichen Wassertropfenmikroskopie von fluoreszierenden Rhabdomeren. Maßstabsleiste (A''): 100 μm. Maßstabsstäbe (B''-C''): 10 μm Die Abbildung wurde gegenüber Referenz13 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protokoll
1. Allgemeine Erwägungen
- Verwenden Sie Drosophila-Bestände , die ein dauerhaft rhabdomeral lokalisiertes Fluoreszenzprotein exprimieren, für morphologische Analysen (z. B. TRP::EGFP, EGFP::NINAC) und translozierende Proteine für Analysen bezüglich Proteintransports (z. B. TRPL::EGFP, ARR2::eGFP).
- Bestimmen Sie die Lichtexpositionsbedingungen ausgewählter Fliegen für den experimentellen Ansatz vor.
- Zur Dunkelanpassung die Fliegen für den gewünschten Zeitraum bei 25 °C in dunklen Boxen aufbewahren. Für eine Beleuchtung von bis zu 16 h in Translokationsexperimenten (z. B. TRPL::eGFP-exprimierende Fliegen) halten Sie Fliegen bei Raumtemperatur unter einer Leuchtstoffröhre.
- In Experimenten zur Beurteilung der Photorezeptordegeneration (z. B. TRP::EGFP-exprimierende Fliegen) halten Sie die Fliegen unter einer Leuchtstoffröhre bei 25 °C in einem 12 h hellen / 12 h dunklen Zyklus für eine Langzeitbeleuchtung von bis zu 28 Tagen mit weißem Licht.
- Um Fliegen mit farbigem Licht zu beleuchten, verwenden Sie verschiedenfarbige transparente Kunststoffboxen zusammen mit der Leuchtstoffröhre.
- Wenn Fliegenbestände mit pigmentierten Augen verwendet werden, altern Sie die Tiere genau für die vergleichende Analyse, da die Augenpigmentierung mit zunehmendem Alter signifikant zunehmen kann.
HINWEIS: Für die Dateninterpretation ist es wichtig zu beachten, dass aufgrund des optischen Wellenführungseffekts der rhabdomeralen Struktur eine Signalverzerrung besteht. Dementsprechend wird das Fluoreszenzsignal aus dem Rhabdomere in der DPP-Bildgebung und Wasserimmersionsmikroskopie immer bis zu einem gewissen Grad im Verhältnis zu den vom Zellkörper erhaltenen Signalen verstärkt. Dies wird am deutlichsten bei pigmentierten Augen beobachtet, wo Fluoreszenz von außerhalb der Rhabdomere von diesen Pigmenten absorbiert wird und von besonderer Bedeutung ist, wenn intrazellulär translozierende Fusionsproteine nachgewiesen werden sollen. In Bezug auf kritische Schritte betrachtet diese Studie daher weiß- und rotäugige Fliegen getrennt. - In Bezug auf die Wasserimmersionsmikroskopie werden zwei Variationen beschrieben. Eine schnellere tödliche Variation sowie eine nicht-tödliche Variation, die eine Genesung für nachfolgende Studien ermöglicht.
2. DPP-Bildgebung
- Bereiten Sie den Arbeitsbereich mit der erforderlichen Ausrüstung und den benötigten Reagenzien vor, wie in Abbildung 2 dargestellt. Anästhesieren Sie Fliegen (1-3 Tage alt) eines Genotyps, der ein Fluoreszenzprotein in Photorezeptorzellen mit CO2 auf einem Flypad exprimiert. Wählen Sie Tiere für die Bildgebung unter einem Stereomikroskop mit einer herkömmlichen Lichtquelle und geringer Vergrößerung (z. B. 10x) aus.

Abbildung 2: DPP-Imaging-Arbeitsbereich Benötigte Materialien sind (A) CO2 Anästhesiegerät, (B) Stereomikroskop mit UV-Lampe und Fluoreszenzfilter-Set, (C) Lichtquelle, (D) mikroskopisch montierte Kamera mit (E) Software, (F) Pinsel, (G) schwarzer Karton und (H) Fliegenfläschchen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Für die DPP-Bildgebung halten Sie die ausgewählten Fliegen betäubt und positionieren Sie eine von ihnen in der Mitte des Mikroskopobjektivs auf der Seite, so dass entweder das linke oder das rechte Auge dem Objektiv genau radial zugewandt ist (Abbildung 3A).
HINWEIS: Da das ommatidiale Layout von Photorezeptorzellen eine Spiegelsymmetrie an der dorsoventralen Mittellinie aufweist, wird der DPP am besten leicht über oder unter dem Äquator des Auges beobachtet (Abbildung 3B).
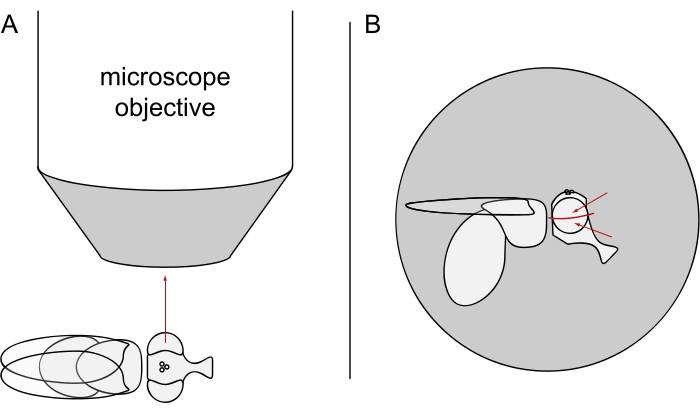
Abbildung 3: Positionierung der Fliege unter dem Stereomikroskop für DPP-Bildgebung . (A) Darstellung der Fliege auf der Seite mit einem Auge zum Mikroskopobjektiv radial. (B) Der Fliegenkopf muss leicht nach oben oder unten gedreht werden, so dass das Objektiv auf einen Punkt leicht über oder unter dem Äquator des Auges gerichtet ist, wie durch die roten Pfeile angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Erhöhen Sie die Vergrößerung, um das gesamte Auge anzupassen (z. B. 100x) und zentrieren Sie die zentralen Ommatidien des Auges. Verringern Sie die Schärfentiefe des Mikroskops, z. B. indem Sie die Doppelblende der Blende auf eine flache Einstellung einstellen (Abbildung 4A-B').
- Schalten Sie die herkömmliche Lichtquelle aus und schalten Sie die UV-Lampe des Mikroskops bei maximaler Intensität ein und wählen Sie den Fluoreszenzfiltersatz des Mikroskops entsprechend dem in den Augen exprimierten Fluoreszenzprotein aus (Abbildung 4C-E). Stellen Sie den Lichtweg in Richtung der am Mikroskop montierten Kamera ein.
- Verwenden Sie die Live-Imaging-Funktion innerhalb der Software, um die Helligkeit des Bildes an eine Einstellung anzupassen, die nur bestimmte Signale vom Auge erkennt, indem Sie die Belichtungszeit und den Verstärkungswert anpassen (z. B. 80 ms bzw. 12x). Richten Sie den Mikroskopfokus "in" das Auge (unterhalb der Hornhaut) um, um das überlagerte Bild des DPP zu erzeugen (Abbildung 4C-E').
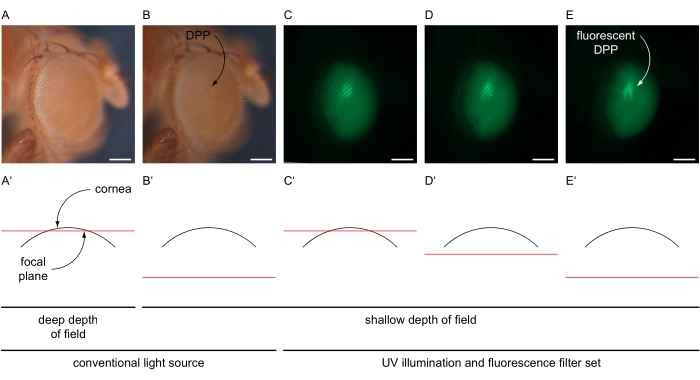
Abbildung 4: Abbildung der DPP- und fluoreszierenden DPP-Bildgebung. Beispielhafte Aufnahmen von Drosophila-Augen unter konventioneller und UV-Beleuchtung mit GFP-Filterset, aufgenommen mit unterschiedlichen Fokusebenen, dargestellt in schematischen Querschnitten durch das Auge. (A) Mikroskopische Aufnahmen mit hellen Einstellungen einer herkömmlichen Lichtquelle, 30 ms Belichtungszeit, 1x Verstärkung, tiefer Schärfentiefe und Brennebene in der Nähe der Oberfläche der Hornhaut, wie in (A') dargestellt. (B) Mikroskopische Aufnahmen mit hellen Einstellungen einer herkömmlichen Lichtquelle, 30 ms Belichtungszeit, 1x Verstärkung, geringer Schärfentiefe und Brennebene etwa 180 μm unter der Oberfläche der Hornhaut, wie in (B') dargestellt. DPP angegeben. (C-E) Mikroskopische Aufnahmen mit hochintensiven Einstellungen der UV-Lichtquelle und des GFP-Filtersatzes, 80 ms Belichtungszeit, 12-facher Verstärkung, geringer Schärfentiefe und der Brennebene (C') in der Nähe, (D') etwas darunter oder (E') etwa 180 μm unter der Oberfläche der Hornhaut. Fluoreszierender DPP wird mit einem gekrümmten Pfeil angezeigt. Maßstabsleiste 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Machen Sie einen Schnappschuss des fluoreszierenden DPP. Schalten Sie das Mikroskop zurück auf sichtbares Licht und den Lichtweg zurück zum Okular. Das abgebildete Tier wird in einer Fliegendurchstechflasche für weitere Verfahren entsprechend seinem DPP-Phänotyp (z. B. Kreuzungen) sichergestellt. Fahren Sie mit dem nächsten Tier in Schritt 2.2 fort.
3. Wasserimmersionsmikroskopie
- Fliegenvorbereitung
- Bereiten Sie den Arbeitsbereich mit den erforderlichen Geräten und Reagenzien vor, wie in Abbildung 5 dargestellt. Fliegen mit vorgegebenem Alter und Beleuchtungsbedingungen in ein vorgekühltes 15 ml Zentrifugenröhrchen überführen und durch Inkubieren auf Eis für 15 bis 30 min betäuben.
HINWEIS: Nehmen Sie 1 Tag alte, dunkel angepasste Fliegen als Referenz mit. Im Allgemeinen sollten dunkel angepasste Fliegen in eine Eisbox mit einem Deckel im Dunkeln gebracht werden. Lichtangepasste Fliegen können im Raumlicht auf das Eis übertragen werden.
- Bereiten Sie den Arbeitsbereich mit den erforderlichen Geräten und Reagenzien vor, wie in Abbildung 5 dargestellt. Fliegen mit vorgegebenem Alter und Beleuchtungsbedingungen in ein vorgekühltes 15 ml Zentrifugenröhrchen überführen und durch Inkubieren auf Eis für 15 bis 30 min betäuben.

Abbildung 5: Arbeitsbereich Wasserimmersionsmikroskopie. Die benötigten Materialien sind: (A) 15 ml Zentrifugenröhrchen, (B) Eisflocken, (C) gekühltes destilliertes Wasser, (D) Stereomikroskop, (E) Petrischale, (F) Plastilin, (G) Objektobjektträger, (H) Insektenstifte oder Pipettenspitzen und Skalpell, (I) Fluoreszenzmikroskop mit (J) Software. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Wählen Sie aus den beiden unten beschriebenen (3.1.3 tödliche Variation oder 3.1.7 nicht-letale Variation) das geeignete Präparat aus, und wenn zwischen pigmentierten und nicht pigmentierten Augen unterschieden wird, befolgen Sie die entsprechenden Schritte.
- Bereiten Sie Fliegen wie folgt auf die tödliche Variation vor.
- Kleben Sie ein Stück Plastilin auf einen Objektträger und ein weiteres Stück in die Mitte einer Petrischale (z. B. 94 mm Ø) und halten Sie sie vorerst getrennt. Füllen Sie die Petrischale mit eisgekühltem destilliertem Wasser und einigen Eisflocken (Abbildung 6A).
- Legen Sie eine eisbetäubte Fliege unter ein Stereomikroskop auf den mit Plastilin beschichteten Objektträger. Drehen Sie die Fliege auf den Rücken und durchbohren Sie eine Insektennadel durch die Mitte des Thorax (Abbildung 6B). Befestigen Sie den Stift horizontal auf dem mit Plastilin beschichteten Objektschieber, und richten Sie entweder das linke oder das rechte Auge der Fliege nach oben aus (Abbildung 6C).
- Befestigen Sie vorsichtig den Objektschieber mit seiner plastinfreien Seite nach unten in der Petrischale, die eine Rotation der Fliege verhindert. Stellen Sie sicher, dass das Fliegenauge mit Wasser bedeckt ist (Abbildung 6D). Verwenden Sie eine Präparationsnadel, um sorgfältig alle Luftblasen zu entfernen, die sich möglicherweise um das Auge gebildet haben, und fahren Sie sofort mit der Bildaufnahme fort, um die besten Ergebnisse zu erzielen.
HINWEIS: Eine signifikante Verzögerung bei der Bildaufnahme führt zu einem Wiedererwachen und Bewegungen der Fliege, was zu verschwommenen Bildern führen kann.
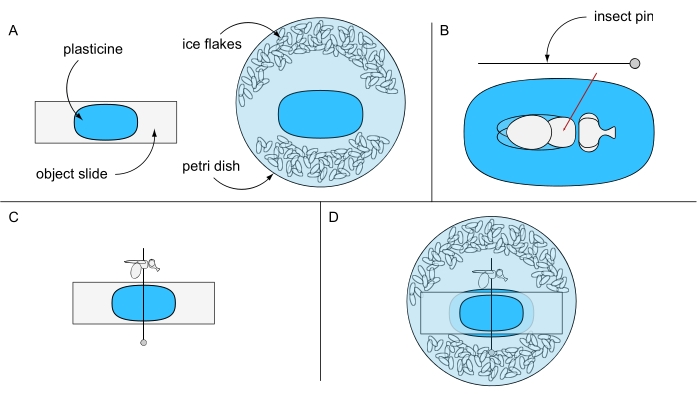
Abbildung 6: Vorbereitung für die Mikroskopie des Eintauchens in tödliches Wasser. Abbildung von (A) mit Plastilin beschichtetem Objektträger und Petrischale, (B) Heften einer Fliege durch Thorax auf Plastilinboden, (C) Fliegenorientierung auf dem mit Plastilin beschichteten Objektträger und (D) endgültiger Versuchsaufbau. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Bereiten Sie Fliegen wie folgt auf die nicht-tödliche Variation vor.
- Übertragen Sie eine eisbetäubte Fliege kopfüber in eine 200 μL Pipettenspitze und drücken Sie die Fliege vorsichtig mit Druckluft in Richtung Spitze.
- Schneiden Sie die Pipettenspitze direkt vor dem Kopf mit einem Skalpell ab. Drücken Sie die Fliege mit einer Pinzette vorsichtig einige Millimeter von der Spitze weg. Schneiden Sie die Pipettenspitze wieder ab und drücken Sie die Fliege mit Druckluft zurück zur Spitze, so dass nur der Kopf der Fliege aus der Pipettenspitze herausragt.
- Kleben Sie ein Stück Plastilin auf einen Objektträger und drücken Sie die Pipettenspitze hinein, so dass entweder das linke oder das rechte Auge der Fliege nach oben zeigt (Abbildung 7A). Verwenden Sie kurz vor der Bildaufnahme eine Laborpipette, um einen großen Tropfen gekühlten Wassers an der Unterseite eines Wassertauchobjektivs zu verkleben (Abbildung 7B). Fahren Sie sofort mit der Bildaufnahme fort, um beste Ergebnisse zu erzielen.
HINWEIS: Eine signifikante Verzögerung bei der Bildaufnahme führt zu einem Wiedererwachen und Bewegungen der Fliege, was zu verschwommenen Bildern führen kann.
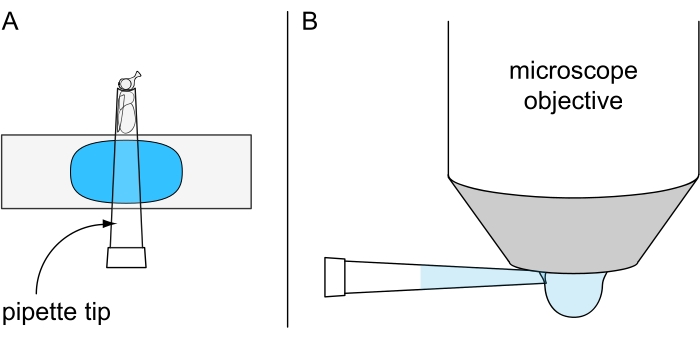
Abbildung 7: Vorbereitung für die nicht-tödliche Wassertropfenmikroskopie. Abbildung von (A) einer kaltnarzierten Fliege, die in einer 200-μL-Pipettenspitze befestigt ist, die auf einem mit Plastilin beschichteten Objektträger montiert ist, und (B) dem Auftragen eines gekühlten Wassertropfens auf die Unterseite des Wassertauchobjektivs. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Bildaufnahme
- Legen Sie die Petrischale (Schritt 3.1.3) oder den Objektträger (Schritt 3.1.7) mit der vorbereiteten Fliege vorsichtig auf die Mikroskopstufe und wählen Sie ein Wassertauchobjektiv aus.
- Senken Sie das Wassertauchobjektiv manuell ab, bis es die Wasseroberfläche berührt (Schritt 3.1.3) oder das Auge der Fliege den Tropfen berührt (Schritt 3.1.7) (Abbildung 8A,B).
- Schalten Sie die UV-Mikroskoplampe ein und wählen Sie das entsprechende Filterset aus. Positionieren Sie die Fliege mit den Okularen unter dem Objektiv und fokussieren Sie das Mikroskop auf die Augenoberfläche.
- Schalten Sie den Lichtweg in Richtung Mikroskopkamera um und erzeugen Sie ein Live-Bild in der entsprechenden Software. Stellen Sie den Fokus für die Kamera neu ein und bewerten Sie die Ausrichtung des Auges, wobei zu berücksichtigen ist, dass das Auge dem Mikroskopobjektiv radial zugewandt sein muss, wie in Abbildung 8C-E ausführlicher dargestellt.
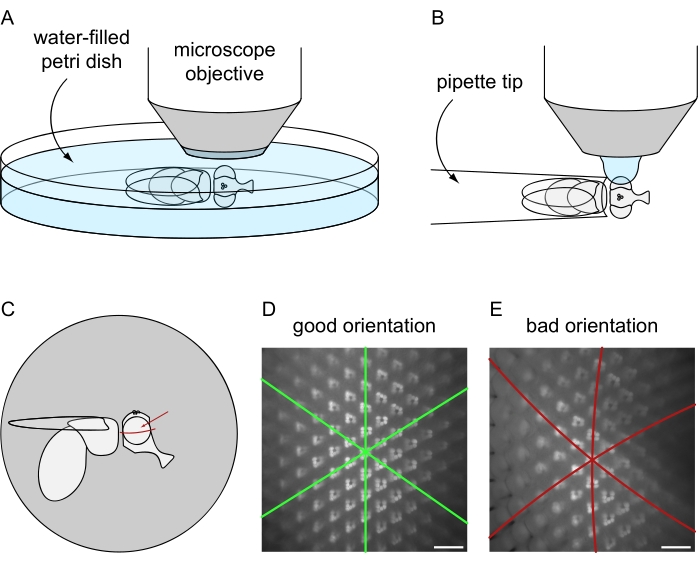
Abbildung 8: Positionierung der Fliege unter dem Fluoreszenzmikroskop für die Wasserimmersionsbildgebung. Einrichtung und endgültige Ausrichtung für die Bildaufnahme unter Verwendung der (A) tödlichen oder (B) nicht-tödlichen Fliegenvorbereitungsprotokolle. (C) Darstellung der Fliegenorientierung zur Erzielung der besten Ergebnisse von Wasserimmersionsmikroskopie-Bildern. Der ideale Punkt, um sich auf das Auge zu konzentrieren, ist nicht das genaue Zentrum in Bezug auf die vordere / hintere und dorsale / ventrale Achse, sondern liegt leicht über dem Äquator des Auges, wie durch den roten Pfeil angezeigt. (D) Beispiel für ein Wasserimmersionsbild für ein perfekt positioniertes Auge. Alle drei Symmetrieachsen der hexagonalen ommatidialen Kachelung erscheinen als gerade Linien und die maximale Menge an Ommatidien kann gleichzeitig im Fokus sein. (E) Beispiel für ein Wasserimmersionsbild eines falsch positionierten Auges. Das Bild enthält gekrümmte Achsen und eine geringe Schärfentiefe. Maßstabsbalken: 20 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Verwenden Sie die entsprechende LUT (Look-up-Tabelle) in der Bildverarbeitungssoftware, um eine Übersättigung (als rote Pixel gekennzeichnet) zu erkennen.
- Bei nicht pigmentierten Fliegen sollten Sie die Belichtungszeit so einstellen, dass die hellsten Pixel für jedes Bild knapp unter der Sättigungsgrenze liegen.
- Bei pigmentierten Fliegen und der tödlichen Variation sollte die Belichtungszeit so eingestellt werden, dass alle hellsten Pixel bei mindestens fünf einzelnen 1 Tag alten, dunkel angepassten Fliegen knapp unter der Sättigungsgrenze liegen. Wenden Sie die berechnete durchschnittliche Belichtungszeit auf alle anderen experimentellen Bedingungen (Genotypen, Beleuchtungsbedingungen, Zeitpunkte usw.) an.
- Bei pigmentierten Fliegen (z. B. rotäugig) und der nicht-tödlichen Variation sollten Sie die Belichtungszeit so einstellen, dass alle hellsten Pixel für jede 1 Tag alte, dunkel angepasste Fliege einzeln knapp unter der Sättigungsgrenze liegen. Wenden Sie diese Belichtungszeit auf alle anderen experimentellen Bedingungen (Beleuchtungsbedingungen, Zeitpunkte usw.) dieser Fliege an.
- Nehmen Sie ein Bild auf und speichern Sie es als Rohdatei, um alle entsprechenden Metadaten der Aufnahme zu archivieren. Exportieren Sie das Bild in einem .tif Format für die folgende Quantifizierung.
HINWEIS: Im Falle der nicht-tödlichen Variation beleuchten Sie die Fliegen unmittelbar nach der Bildaufnahme 5 Minuten lang mit rotem Licht (z. B. 630 nm), wenn sie für weitere Experimente verwendet werden sollen. Rotes Licht deaktiviert die Fototransduktionskaskade, die durch intensives kurzwelliges Licht während der Bildaufnahme übermäßig aktiviert wurde.
- Datenanalyse und Quantifizierung der relativen eGFP-Fluoreszenz in den Rhabdomeren von Wasserimmersionsmikroskopen
- Laden Sie die Software ImageJ/Fiji herunter, installieren Sie sie und führen Sie sie aus.
- Passen Sie die ImageJ-Einstellungen an, indem Sie auf Analyze > Set Measurements klicken... und aktivieren Sie nur das Kontrollkästchen für Mittlerer Grauwert. Importieren Sie ein .tif Bild, indem Sie auf Datei > Öffnen... oder per Drag & Drop. Wählen Sie einen repräsentativen Bereich des Bildes, der scharf ist, und vergrößern Sie ihn auf 200%-300%, indem Sie wiederholt Strg und + zusammen drücken.
- Wählen Sie das Oval-Werkzeug aus und erzeugen Sie beim Drücken der Umschalttaste eine kreisförmige Auswahl im Bild, die deutlich kleiner als ein fluoreszierender Rhabdomere ist. Bevor Sie die Maustaste loslassen, suchen Sie nach der genauen Größe, die unter der Symbolleiste im ImageJ-Hauptfenster angezeigt wird. Verwenden Sie für alle Analysen die gleiche Größe der kreisförmigen Auswahl.
HINWEIS: Die genaue Größe der kreisförmigen Auswahl in Pixeln oder Mikrometern hängt vom spezifischen Setup ab. Verwenden Sie einen Kreis von etwa 1/3 oder 1/4 des Rhabdomeraldurchmessers von 1 Tag alten, dunkel angepassten Kontrollfliegen. - Verschieben Sie die kreisförmige Auswahl entweder durch Mausklick und Ziehen oder durch Drücken der Pfeiltasten auf der Tastatur.
- Um die Fluoreszenzintensitäten innerhalb der Kreisselektion zu messen, bewegen Sie den Kreis zum ersten Rhabdomere (r1) und klicken Sie auf Analysieren > Messen oder verwenden Sie die Tastenkombination Strg + M. Ein Ergebnisfenster mit dem gemessenen Grauwert wird angezeigt.
- Fahren Sie mit Messungen von r2-r6 als wiederholte Messungen und einer Messung des Hintergrundsignals (b) fort. Bei nicht pigmentierten Fliegen führen Sie zusätzliche Messungen der entsprechenden Zellkörperbereiche (c1-c6) durch (Abbildung 9).
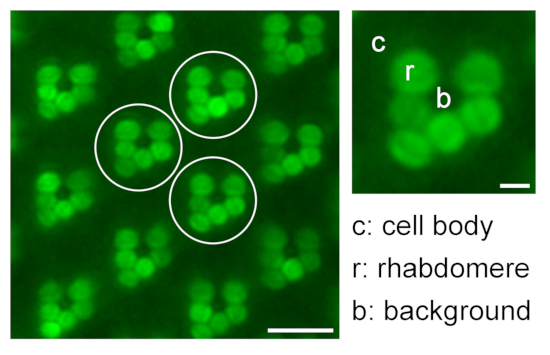
Abbildung 9: Quantifizierung der relativen rhabdomeralen Fluoreszenz für Translokationsstudien. Eine Illustration zur Quantifizierung der relativen eGFP-Fluoreszenz in den Rhabdomeren durch Messung der Fluoreszenzintensität von Rhabdomere (r), Zellkörper (c) und Hintergrund (b) von drei verschiedenen repräsentativen Ommatidien (weiße Kreise) in einem Wasserimmersionsmikroskopie-Bild; Skalenbalken: 10 μm. Ein vergrößertes Ommatidium ist auf der rechten Seite zu sehen; Maßstabsstab: 2 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Wiederholen Sie die Schritte 3.3.5 und 3.3.6 für zwei weitere Ommatidien, was zu drei technischen Replikaten führt. Markieren Sie die analysierten Ommatidien mit dem Bleistiftwerkzeug und speichern Sie dieses Bild zur Dokumentation.
- Wählen und kopieren Sie die gemessenen Grauwerte aus dem Ergebnisfenster und fügen Sie sie zur weiteren Berechnung in die Tabellenkalkulationssoftware ein. Sortieren Sie die Werte der Fluoreszenzintensität nach ihrer Herkunft in die Kategorien Rhabdomere (r), Zellkörper (c) und Hintergrund (b). Berechnen Sie die mittlere Intensität aus jeder Kategorie (I r, Ic, Ib).
- Berechnen Sie die relative Menge an eGFP, die im Rhabdomere (R) vorhanden ist, unter Verwendung der folgenden Formel (1) für nicht pigmentierte Augen und der Formel (2) für pigmentierte Augen:
 (1)
(1) (2)
(2) - Fahren Sie mit dem nächsten Bild in Schritt 3.3.3 fort. Es wird empfohlen, Bilder von mindestens fünf Individuen jeder experimentellen Gruppe als biologische Replikate zu verwenden, um eine zuverlässige Messung zu erhalten.

Abbildung 10: Quantifizierung mittels Rhabdomere-Auswertung für Degenerationsstudien. Eine Illustration zur Quantifizierung der Augenmorphologie durch Bewertung der Rhabdomere von drei verschiedenen repräsentativen Ommatidien (weiße Kreise) in einem Wasserimmersionsmikroskopie-Bild mit Werten von 2 (deutlich sichtbar; blauer Kreis), 1 (schwach sichtbar; oranger Kreis) oder 0 (abwesend; roter Kreis). Maßstab: 10 μm. Ein vergrößertes Ommatidium ist auf der rechten Seite zu sehen; Maßstabsstab: 2 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Öffnen Sie das nächste Bild und fahren Sie mit Schritt 3.4.2 fort. Es wird empfohlen, Bilder von mindestens acht Individuen jeder experimentellen Gruppe als biologische Replikate zu verwenden, um eine zuverlässige Messung zu erhalten.
HINWEIS: Da diese Quantifizierungsmethode weniger objektiv ist als die Methode zur Quantifizierung der Translokation durch Fluoreszenzintensität, ist die empfohlene Anzahl von Replikaten höher.
Ergebnisse
Transgene Drosophila-Fliegen, die ein TRPL::eGFP-Fusionsprotein unter der Kontrolle des Rhodopsin-1-Promotors exprimieren, wurden erzeugt. Bei diesen Fliegen wird TRPL::eGFP in den Photorezeptorzellen R1-6 des Facettenauges exprimiert und zeigt eine beleuchtungsabhängige Lokalisation. Wenn Fliegen im Dunkeln gehalten werden, wird TRPL::eGFP in die äußeren Rhabdomere eingearbeitet. Nach mehrstündiger Beleuchtung transloziert TRPL in den Zellkörper, wo es in einem ER-angereicherten Kompartiment gespeichert wi...
Diskussion
Die Anwendbarkeit von Fluoreszenzproteinen und die Einfachheit des Screenings durch DPP-Bildgebung und retinale Wasserimmersionsmikroskopie haben sich in vielen Gruppen12 als erfolgreich erwiesen. Ähnliche Strategien wie die hier vorgestellten wurden in mehreren genetischen Screens verwendet, um Defekte in der Rhodopsinexpression, Homöostase, Netzhautorganisation oder zellulären Integrität mit Hilfe von Rh1::eGFP17,18,19,20,21
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Wir danken unseren studentischen Forschern im Laufe der Jahre. Insbesondere Nina Meyer, Sibylle Mayer, Juliane Kaim und Laura Jaggy, deren Daten in diesem Protokoll als repräsentative Ergebnisse verwendet wurden. Die Forschung unserer hier vorgestellten Gruppe wurde durch Zuschüsse der Deutschen Forschungsgemeinschaft (Hu 839/2-4, Hu 839/7-1) an Armin Huber gefördert.
Materialien
| Name | Company | Catalog Number | Comments |
| 15 mL centrifuge tube | Greiner Bio-One | 188271 | |
| CO2 anaesthesia fly pad | Flystuff | 59-172 | |
| Cold light lamp (KL 1500 LCD) | Zeiss | ||
| Fiji/ImageJ | NIH | ||
| Fluorescence microscope with UV lamp, camera, filter set and software (AxioImager.Z1m, Axiocam 530 mono, 38 HE, ZEN2 blue edition) | Zeiss | ||
| Fluorescent tube (Lumilux T8, L 30W/840, 4000 K, G13) [1750 Lux, Ee470nm = 298 µW cm-2, Ee590nm = 215 µW cm-2] and [760 Lux, Ee470nm = 173 µW cm-2, Ee590nm = 147 µW cm-2] | Osram | 4050300518039 | |
| Laboratory pipette (20-200 µL) | Eppendorf | ||
| Object slide | Roth | 0656.1 | |
| Petri dish (94 mm) | Greiner Bio-One | 633102 | |
| Pipette tips (200 µL) | Labsolute | 7695844 | |
| Plasticine (Blu-Tack) | Bostik | 30811745 | |
| Stereo microscope (SMZ445) | Nikon | ||
| Stereo microscope with UV lamp, camera, filer set and software (MZ16F, MC170 HD, GFP3, LAS 4.12) | Leica |
Referenzen
- Wang, X., Huang, T., Bu, G., Xu, H. Dysregulation of protein trafficking in neurodegeneration. Molecular Neurodegeneration. 9. 9, 31 (2014).
- Schopf, K., Huber, A. Membrane protein trafficking in Drosophila photoreceptor cells. European Journal of Cell Biology. 96 (5), 391-401 (2017).
- Hardie, R. C. The photoreceptor array of the dipteran retina. Trends in Neurosciences. 9, 419-423 (1986).
- Wang, T., Montell, C. Phototransduction and retinal degeneration in Drosophila. Pflügers Archiv - European Journal of Physiology. 454 (5), 821-847 (2007).
- Xiong, B., Bellen, H. J. Rhodopsin homeostasis and retinal degeneration: lessons from the fly. Trends in Neurosciences. 36 (11), 652-660 (2013).
- Bähner, M., et al. Light-regulated subcellular translocation of Drosophila TRPL channels induces long-term adaptation and modifies the light-induced current. Neuron. 34 (1), 83-93 (2002).
- Cronin, M. A., Lieu, M. -. H., Tsunoda, S. Two stages of light-dependent TRPL-channel translocation in Drosophila photoreceptors. Journal of Cell Science. 119, 2935-2944 (2006).
- Meyer, N., Joel-Almagor, T., Frechter, S., Minke, B., Huber, A. Subcellular translocation of the eGFP-tagged TRPL channel in Drosophila photoreceptors requires activation of the phototransduction cascade. Journal of Cell Science. 119, 2592-2603 (2006).
- Oberegelsbacher, C., Schneidler, C., Voolstra, O., Cerny, A., Huber, A. The Drosophila TRPL ion channel shares a Rab-dependent translocation pathway with rhodopsin. European Journal of Cell Biology. 90 (8), 620-630 (2011).
- Wagner, K., Smylla, T. K., Lampe, M., Krieg, J., Huber, A. Phospholipase D and retromer promote recycling of TRPL ion channel via the endoplasmic reticulum. Traffic. , (2021).
- Franceschini, N., Kirschfeld, K. Les phénoménes de pseudopupille dans l'oeil compose de Drosophila. Kybernetik. 9 (5), 159-182 (1971).
- Pichaud, F., Desplan, C. A new visualization approach for identifying mutations that affect differentiation and organization of the Drosophila ommatidia. Development. 128 (6), 815-826 (2001).
- Smylla, T. K., Wagner, K., Huber, A. Application of fluorescent proteins for functional dissection of the Drosophila visual system. International Journal of Molecular Sciences. 22 (16), (2021).
- Meyer, N. Mechanisms of the light-dependent translocation of the ion channel TRPL in the photoreceptors of Drosophila melanogaster: Dissertation for obtaining the academic degree Dr. rer. nat. University of Karlsruhe (TH). , (2005).
- Meyer, N., Oberegelsbacher, C., Dürr, T. D., Schäfer, A., Huber, A. An eGFP-based genetic screen for defects in light-triggered subcelluar translocation of the Drosophila photoreceptor channel TRPL. Fly. 2 (1), 36-46 (2008).
- Zheng, L., Carthew, R. W. Lola regulates cell fate by antagonizing Notch induction in the Drosophila eye. Mechanisms of Development. 125 (1-2), 18-29 (2008).
- Hibbard, K. L., O'Tousa, J. E. A role for the cytoplasmic DEAD box helicase Dbp21E2 in rhodopsin maturation and photoreceptor viability. Journal of Neurogenetics. 26 (2), 177-188 (2012).
- Huang, Y., Xie, J., Wang, T. A Fluorescence-based genetic screen to study retinal degeneration in Drosophila. PloS One. 10 (12), 0144925 (2015).
- Zhao, H., Wang, J., Wang, T. The V-ATPase V1 subunit A1 is required for rhodopsin anterograde trafficking in Drosophila. Molecular Biology of the Cell. 29 (13), 1640-1651 (2018).
- Xiong, L., et al. ER complex proteins are required for rhodopsin biosynthesis and photoreceptor survival in Drosophila and mice. Cell Death and Differentiation. 27 (2), 646-661 (2020).
- Zhao, H., Wang, T. PE homeostasis rebalanced through mitochondria-ER lipid exchange prevents retinal degeneration in Drosophila. PLoS Genetics. 16 (10), 1009070 (2020).
- Cerny, A. C., et al. The GTP- and phospholipid-binding protein TTD14 regulates trafficking of the TRPL ion channel in Drosophila photoreceptor cells. PLoS Genetics. 11 (10), 1005578 (2015).
- Richter, D. Structural and functional analyses of TRP ion channels in the photoreceptor cells of Drosophila melanogaster: Dissertation for obtaining the academic degree Dr. rer, nat. University of Karlsruhe (TH). , (2007).
- Gambis, A., Dourlen, P., Steller, H., Mollereau, B. Two-color in vivo imaging of photoreceptor apoptosis and development in Drosophila. Developmental Biology. 351 (1), 128-134 (2011).
- Hardie, R. C., Liu, C. -. H., Randall, A. S., Sengupta, S. In vivo tracking of phosphoinositides in Drosophila photoreceptors. Journal of Cell Science. 128 (23), 4328-4340 (2015).
- Chakrabarti, P., et al. A dPIP5K dependent pool of phosphatidylinositol 4,5 bisphosphate (PIP2) is required for G-protein coupled signal transduction in Drosophila photoreceptors. PLoS Genetics. 11 (1), 1004948 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten