Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Estudio del tráfico de proteínas de membrana en células fotorreceptoras de Drosophila utilizando proteínas marcadas con eGFP
En este artículo
Resumen
Aquí, se describen métodos no invasivos para la localización de proteínas de membrana fotorreceptoras y la evaluación de la degeneración retiniana en el ojo compuesto de Drosophila utilizando fluorescencia eGFP.
Resumen
El tráfico de proteínas de membrana regula la incorporación y eliminación de receptores y canales iónicos en la membrana plasmática. Este proceso es fundamentalmente importante para la función celular y la integridad celular de las neuronas. Las células fotorreceptoras de Drosophila se han convertido en un modelo para estudiar el tráfico de proteínas de membrana. Además de la rodopsina, que tras la iluminación se internaliza desde la membrana del fotorreceptor y se degrada, el canal iónico similar al potencial del receptor transitorio (TRPL) en Drosophila exhibe una translocación dependiente de la luz entre la membrana del fotorreceptor rabdomeral (donde se encuentra en la oscuridad) y el cuerpo celular fotorreceptor (al que se transporta tras la iluminación). Este transporte intracelular de TRPL se puede estudiar de una manera simple y no invasiva mediante la expresión de TRPL marcado con eGFP en células fotorreceptoras. La fluorescencia eGFP se puede observar en el pseudopúplo profundo o mediante microscopía de inmersión en agua. Estos métodos permiten la detección de fluorescencia en el ojo intacto y, por lo tanto, son útiles para ensayos de alto rendimiento y pruebas genéticas para mutantes de Drosophila defectuosos en la translocación de TRPL. Aquí, se explican en detalle la preparación de moscas, las técnicas microscópicas, así como los métodos de cuantificación utilizados para estudiar esta translocación de TRPL desencadenada por la luz. Estos métodos se pueden aplicar también para estudios de tráfico en otras proteínas fotorreceptoras de Drosophila , por ejemplo, rodopsina. Además, mediante el uso de proteínas rabdomerales marcadas con eGFP, estos métodos se pueden utilizar para evaluar la degeneración de las células fotorreceptoras.
Introducción
Al entregar y eliminar proteínas hacia y desde la membrana plasmática, el tráfico de proteínas de membrana en las neuronas controla el equipo de membrana plasmática con receptores y canales iónicos y, como resultado, regula la función neuronal. La mala regulación o los defectos en el tráfico de proteínas suelen tener efectos perjudiciales en las células y provocar una degeneración neuronal. En los seres humanos, esto puede causar enfermedades neurodegenerativas como la enfermedad de Alzheimer y Parkinson o la retinosis pigmentaria1. Los fotorreceptores en el ojo compuesto de Drosophila melanogaster se han convertido en un sistema modelo in vivo para estudiar el tráfico de proteínas de membrana2. Esto no solo se debe a la versatilidad genética de Drosophila que permite exámenes genéticos efectivos, sino también a que todos los componentes esenciales de la membrana fotorreceptora absorbente de luz se caracterizan con gran detalle y se dispone de técnicas microscópicas eficientes que se pueden aplicar al ojo de mosca. Estas técnicas son el foco de este artículo.
En las células fotorreceptoras de Drosophila, la membrana plasmática apical forma una pila densamente empaquetada de microvellosidades a lo largo de un lado de la célula, denominada rabdomero. Los rabdomeros de las células fotorreceptoras R1-6 están dispuestos en un patrón trapezoidal característico, mientras que las células fotorreceptoras R7 y R8 forman un solo rabdomero en el centro de este trapecio3. El tráfico de proteínas de membrana es necesario para un recambio regulado de proteínas de membrana rabdomeral como la rodopsina y los canales iónicos TRP (potencial de receptor transitorio) y TRPL (similar a TRP) activados por la luz para asegurar la cantidad adecuada de estas proteínas de fototransducción en el rabdomero. Las proteínas de membrana fotorreceptoras se sintetizan en el retículo endoplásmico y se transportan a través del aparato de Golgi al rabdomero. Después de la activación de la rodopsina por la luz, una molécula de rodopsina puede inactivarse por absorción de un segundo fotón o puede ser eliminada del rabdomero por endocitosis mediada por clatrina. La rodopsina endocitosa se degrada en el lisosoma o se recicla de nuevo al rabdomero 4,5. El canal iónico TRPL también se internaliza tras la activación de la cascada de fototransducción y sufre una translocación dependiente de la luz entre el rabdomero (donde se encuentra cuando las moscas se mantienen en la oscuridad) y un compartimento de almacenamiento enriquecido con ER en el cuerpo celular (al que se transporta dentro de varias horas después de la iluminación)6,7,8,9,10 . A diferencia de la rodopsina endocitosa, solo pequeñas cantidades de TRPL se degradan a través de la vía endolisosomal, y la mayoría se almacena intracelularmente en su lugar y se recicla de nuevo al rabdomero tras la adaptación oscura6. Por lo tanto, TRPL se puede utilizar para analizar el tráfico de proteínas de membrana plasmática desencadenado por la luz. Las células fotorreceptoras de Drosophila también se emplean para estudiar la degeneración neuronal. La degeneración de las células fotorreceptoras se determina con frecuencia mediante la evaluación de la estructura de los rabdomeros, que se desintegran como resultado de procesos degenerativos5.
Con el fin de estudiar la localización subcelular de TRPL y rodopsina en células fotorreceptoras o degeneración de células fotorreceptoras, se han aplicado aquí dos métodos de microscopía de fluorescencia que difieren con respecto a la velocidad de análisis y la resolución. Un método muy rápido y no invasivo que se puede utilizar para cribados genéticos pero con una resolución espacial limitada es la detección de fluorescencia en el pseudopúpilo profundo (DPP). El DPP es un fenómeno óptico de ojos compuestos de artrópodos cuyo origen geométrico ha sido explicado en detalle por Franceschini y Kirschfeld en 197111. En resumen, en varios planos ópticos debajo de la superposición de retina se pueden observar imágenes de rabdomeros de ommatidios adyacentes. En un plano focal a través del centro de la curvatura del ojo, estas proyecciones superpuestas forman una imagen que se asemeja al diseño trapezoidal de rabdomeros en un solo ommatidio solo órdenes de magnitud más grande. Este fenómeno también se puede observar independientemente de la expresión exógena de proteínas de fluorescencia (por ejemplo, TRPL::eGFP8), que sin embargo hacen que el DPP sea más fácil de detectar (Figura 1A-A'')12. Un segundo método no invasivo es la microscopía de inmersión en agua que se basa en la obtención de imágenes de proteínas marcadas con fluorescencia después de neutralizar ópticamente el aparato dióptrico de los ojos con agua (Figura 1B-C'')12. Utilizando el método de inmersión en agua, la cantidad relativa de TRPL::eGFP en los rabdomeros o cuerpo celular se puede evaluar cuantitativamente para células fotorreceptoras individuales. Además, las proteínas marcadas con fluorescencia no translocadoras se pueden utilizar para evaluar la integridad rabdomeral y determinar el curso temporal de una degeneración potencial de manera cuantitativa, como se describe aquí.
Si bien las grabaciones del DPP son, con mucho, los métodos más fáciles y rápidos de realizar, la resolución espacial de los datos que generan es limitada. Además, hay numerosas razones por las que un DPP puede estar ausente, que no son necesariamente discernibles por las propias imágenes de DPP. Dado que el DPP representa una suma de varios ommatidios, se pierde información sobre células individuales. Por lo tanto, las imágenes DPP de baja resolución cumplen una función importante en la detección de un gran número de moscas, pero generalmente deben ir seguidas de grabaciones de mayor resolución a través de microscopía de inmersión en agua. Las micrografías de inmersión en agua permiten interpretaciones sobre células individuales, defectos del desarrollo, morfología ocular, mala localización de proteínas o degeneración de la retina, así como la cuantificación de estos efectos. Este Protocolo describe estas dos técnicas en detalle.
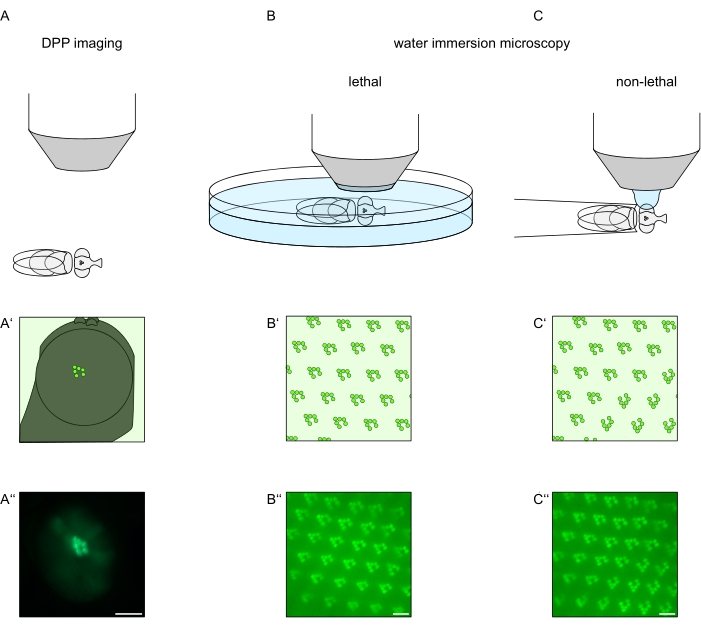
Figura 1: Descripción general de las variaciones de microscopía para el ojo de Drosophila presentadas en este Protocolo. Representaciones esquemáticas y micrografías ejemplares de imágenes de pseudopúpodo profundo fluorescente (DPP) (A-A''), microscopía letal de inmersión en agua (B-B'') de rabdomeros fluorescentes y (C-C'') microscopía de gota de agua no letal de rabdomeros fluorescentes. Barra de escala (A''): 100 μm. Barras de escala (B''-C''): 10 μm. La figura ha sido modificada a partir de la referencia13. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
1. Consideraciones generales
- Utilice las existencias de Drosophila que expresan una proteína de fluorescencia localizada rabdomeralmente de forma permanente para el análisis morfológico (por ejemplo, TRP::eGFP, eGFP::NINAC) y la translocación de proteínas para análisis relacionados con el tráfico de proteínas (por ejemplo, TRPL::eGFP, Arr2::eGFP).
- Predeterminar las condiciones de exposición a la luz de moscas seleccionadas para el enfoque experimental.
- Para la adaptación a la oscuridad, mantenga las moscas en cajas oscuras durante el período deseado a 25 ° C. Para iluminación de hasta 16 h en experimentos de translocación (por ejemplo, moscas que expresan TRPL: eGFP), mantenga las moscas debajo de un tubo fluorescente a temperatura ambiente.
- En experimentos que evalúan la degeneración de los fotorreceptores (por ejemplo, moscas que expresan TRP: eGFP), mantenga las moscas debajo de un tubo fluorescente a 25 ° C en un ciclo de luz de 12 h / 12 h de oscuridad para una iluminación a largo plazo de hasta 28 días con luz blanca.
- Para iluminar moscas con luz de color, use cajas de plástico transparente de diferentes colores junto con el tubo fluorescente.
- Si se utilizan poblaciones de moscas con ojos pigmentados, envejecen los animales precisamente para el análisis comparativo, ya que la pigmentación ocular puede aumentar significativamente con la edad.
NOTA: Para la interpretación de datos, es importante tener en cuenta que existe un sesgo de señal debido al efecto de guiado de onda óptica de la estructura rabdomeral. En consecuencia, la señal de fluorescencia del rabdomero siempre se amplificará hasta cierto punto en las imágenes DPP y la microscopía de inmersión en agua en relación con las señales obtenidas del cuerpo celular. Esto se observa más prominentemente en los ojos pigmentados, donde la fluorescencia del exterior de los rabdomeros es absorbida por estos pigmentos y es de particular importancia cuando se van a detectar proteínas de fusión translocalizadas intracelularmente. Por lo tanto, con respecto a los pasos críticos, este estudio considera las moscas de ojos blancos y rojos por separado. - En cuanto a la microscopía de inmersión en agua, se describen dos variaciones. Una variación letal más rápida, así como una variación no letal que permite la recuperación para estudios posteriores.
2. Imágenes DPP
- Prepare el espacio de trabajo con el equipo y los reactivos necesarios como se muestra en la Figura 2. Anestesiar moscas (1-3 días de edad) de un genotipo que expresa una proteína de fluorescencia en células fotorreceptoras con CO2 en una almohadilla volante. Seleccione animales para obtener imágenes bajo un microscopio estereoscópico con una fuente de luz convencional y un aumento bajo (por ejemplo, 10x).

Figura 2: Espacio de trabajo de imágenes DPP. Los materiales necesarios son (A) aparato de anestesia de CO2 , (B) microscopio estereoscópico con lámpara UV y juego de filtro de fluorescencia, (C) fuente de luz, (D) cámara montada en microscopio con software (E), (F) pincel, (G) cartón negro y (H) vial de mosca. Haga clic aquí para ver una versión más grande de esta figura.
- Para las imágenes DPP, mantenga las moscas seleccionadas anestesiadas y coloque una de ellas en el centro del objetivo del microscopio de lado para que el ojo izquierdo o derecho esté mirando el objetivo con precisión radialmente (Figura 3A).
NOTA: Dado que el diseño ommaquial de las células fotorreceptoras muestra simetría de espejo en la línea media dorsoventral, el DPP se observa mejor ligeramente por encima o por debajo del ecuador del ojo (Figura 3B).
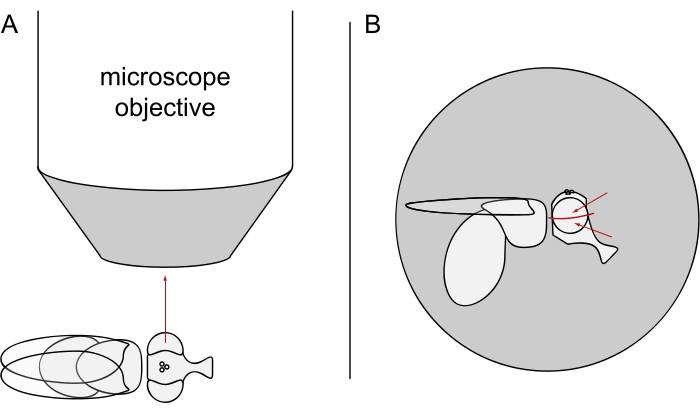
Figura 3: Colocación de la mosca debajo del estereomicroscopio para imágenes DPP. (A) Ilustración de la mosca de lado con un ojo mirando radialmente el objetivo del microscopio. (B) La cabeza de la mosca debe girarse ligeramente hacia arriba o hacia abajo de modo que el objetivo se centre en un punto ligeramente por encima o por debajo del ecuador del ojo, como lo indican las flechas rojas. Haga clic aquí para ver una versión más grande de esta figura.
- Aumente la ampliación para que se ajuste a todo el ojo (por ejemplo, 100x) y centre la ommatidio central del ojo. Disminuya la profundidad de campo del microscopio, por ejemplo, ajustando el diafragma de doble iris a un ajuste poco profundo (Figura 4A-B').
- Apague la fuente de luz convencional y encienda la lámpara UV del microscopio a máxima intensidad y seleccione el conjunto de filtros de fluorescencia del microscopio de acuerdo con la proteína de fluorescencia expresada en los ojos (Figura 4C-E). Establezca la trayectoria de la luz hacia la cámara montada en el microscopio.
- Utilice la función de imágenes en vivo dentro del software para ajustar el brillo de la imagen a una configuración que detecte solo señales específicas del ojo ajustando el tiempo de exposición y el valor de ganancia (por ejemplo, 80 ms y 12x, respectivamente). Reajuste el foco del microscopio "en" el ojo (debajo de la córnea) para generar la imagen superpuesta del DPP (Figura 4C-E').
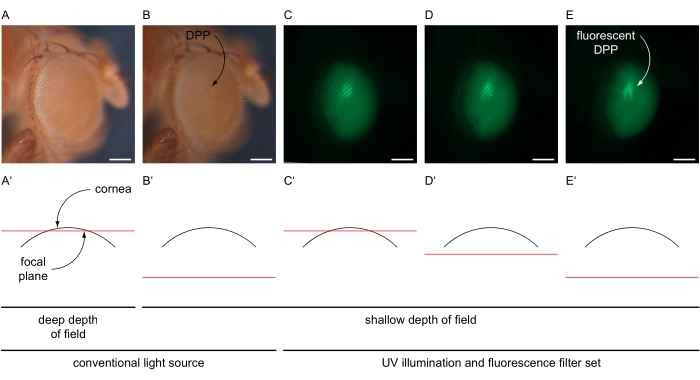
Figura 4: Ilustración de imágenes DPP y DPP fluorescentes. Imágenes ejemplares de los ojos de Drosophila bajo iluminación convencional y UV con conjunto de filtros GFP, tomadas con diferentes planos focales ilustrados en secciones transversales esquemáticas a través del ojo. (A) Micrografía grabada con ajustes brillantes de una fuente de luz convencional, tiempo de exposición de 30 ms, ganancia de 1x, profundidad de campo profunda y plano focal cerca de la superficie de la córnea como se ilustra en (A'). (B) Micrografía grabada con ajustes brillantes de una fuente de luz convencional, tiempo de exposición de 30 ms, ganancia de 1x, poca profundidad de campo y plano focal aproximadamente 180 μm por debajo de la superficie de la córnea como se ilustra en (B'). DPP indicado. (C-E) Micrografía registrada con ajustes de alta intensidad de fuente de luz UV y conjunto de filtros GFP, tiempo de exposición de 80 ms, ganancia de 12x, poca profundidad de campo y el plano focal (C') cerca, (D') ligeramente por debajo, o (E') aproximadamente 180 μm por debajo de la superficie de la córnea. El DPP fluorescente se indica con una flecha curva. Barra de escala 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
- Tome una instantánea del DPP fluorescente. Vuelva a cambiar el microscopio a la luz visible y la trayectoria de la luz de regreso hacia los oculares. Recupere el animal fotografiado en un vial de mosca para procedimientos adicionales de acuerdo con su fenotipo DPP (por ejemplo, cruces). Continúe con el siguiente animal en el paso 2.2.
3. Microscopía de inmersión en agua
- Preparación de la mosca
- Prepare el espacio de trabajo con el equipo y los reactivos necesarios como se muestra en la Figura 5. Transfiera moscas con condiciones predeterminadas de edad e iluminación a un tubo de centrífuga de 15 ml preenfriado y anestesialas incubándolas en hielo durante 15 a 30 minutos.
NOTA: Lleve moscas de 1 día de edad, adaptadas a la oscuridad como referencia. En general, las moscas adaptadas a la oscuridad deben transferirse a una nevera con una tapa en la oscuridad. Las moscas adaptadas a la luz se pueden transferir al hielo en la luz de la habitación.
- Prepare el espacio de trabajo con el equipo y los reactivos necesarios como se muestra en la Figura 5. Transfiera moscas con condiciones predeterminadas de edad e iluminación a un tubo de centrífuga de 15 ml preenfriado y anestesialas incubándolas en hielo durante 15 a 30 minutos.

Figura 5: Espacio de trabajo de microscopía de inmersión en agua. Los materiales necesarios son: (A) tubo de centrífuga de 15 ml, (B) escamas de hielo, (C) agua destilada refrigerada, (D) estereomicroscopio, (E) placa de Petri, (F) plastilina, (G) portaobjetos de objetos, (H) pasadores de insectos o puntas de pipeta y bisturí, (I) microscopio de fluorescencia con (J) software. Haga clic aquí para ver una versión más grande de esta figura.
- Seleccione la preparación adecuada de las dos descritas a continuación (3.1.3 variación letal o 3.1.7 variación no letal) y siempre que se haga una diferenciación entre ojos pigmentados y no pigmentados, siga los pasos respectivos.
- Prepare a las moscas para la variación letal de la siguiente manera.
- Adhiera un trozo de plastilina en un portaobjetos de objeto y otro trozo en el centro de una placa de Petri (por ejemplo, 94 mm Ø) y manténgalos separados por ahora. Llene la placa de Petri con agua destilada helada y algunos copos de hielo (Figura 6A).
- Coloque una mosca anestesiada con hielo debajo de un estereomicroscopio en la parte superior del portaobjetos recubierto de plastilina. Gire la mosca sobre su espalda y perfore un alfiler de insecto a través del centro del tórax (Figura 6B). Fije el pasador horizontalmente en la diapositiva del objeto recubierto de plastilina y oriente el ojo izquierdo o derecho de la mosca hacia arriba (Figura 6C).
- Fije cuidadosamente la corredera del objeto, con su lado libre de plastilina hacia abajo, en la placa de Petri evitando la rotación de la mosca. Asegúrese de que el ojo de mosca esté cubierto de agua (Figura 6D). Use una aguja de preparación para eliminar cuidadosamente cualquier burbuja de aire que pueda haberse formado alrededor del ojo, e inmediatamente proceda a la adquisición de imágenes para obtener los mejores resultados.
NOTA: Un retraso significativo en la adquisición de imágenes da como resultado el despertar y los movimientos de la mosca, lo que puede conducir a imágenes borrosas.
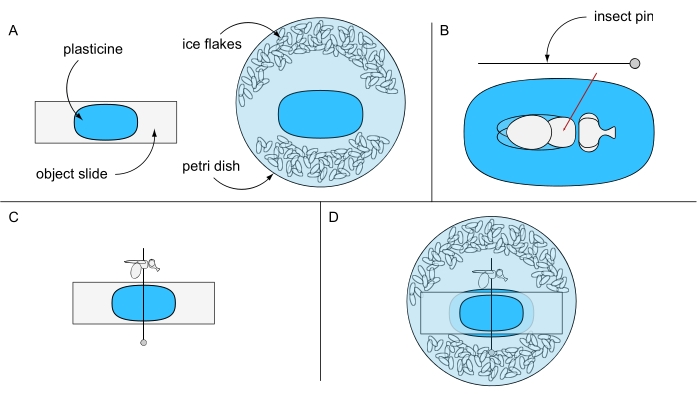
Figura 6: Preparación para microscopía letal de inmersión en agua. Ilustración de (A) diapositiva de objeto recubierta de plastilina y placa de Petri, (B) fijación de una mosca a través del tórax en el suelo de plastilina, (C) orientación de la mosca en la diapositiva de objeto recubierta de plastilina, y (D) configuración experimental final. Haga clic aquí para ver una versión más grande de esta figura.
- Prepare las moscas para la variación no letal de la siguiente manera.
- Transfiera una mosca anestesiada con hielo de cabeza a una punta de pipeta de 200 μL y empuje la mosca hacia la punta con cuidado con aire comprimido.
- Corta la punta de la pipeta justo delante de la cabeza con un bisturí. Usando pinzas, empuje cuidadosamente la mosca a unos milímetros de distancia de la punta. Corte la punta de la pipeta nuevamente y empuje la mosca hacia la punta con aire comprimido para que solo la cabeza de la mosca sobresalga de la punta de la pipeta.
- Adhiera un trozo de plastilina sobre un objeto deslizante y presione la punta de la pipeta de modo que el ojo izquierdo o derecho de la mosca mire hacia arriba (Figura 7A). Justo antes de la adquisición de la imagen, use una pipeta de laboratorio para adherir una gran gota de agua fría a la parte inferior de un objetivo de inmersión en agua (Figura 7B). Proceda inmediatamente a la adquisición de imágenes para obtener los mejores resultados.
NOTA: Un retraso significativo en la adquisición de imágenes da como resultado el despertar y los movimientos de la mosca, lo que puede conducir a imágenes borrosas.
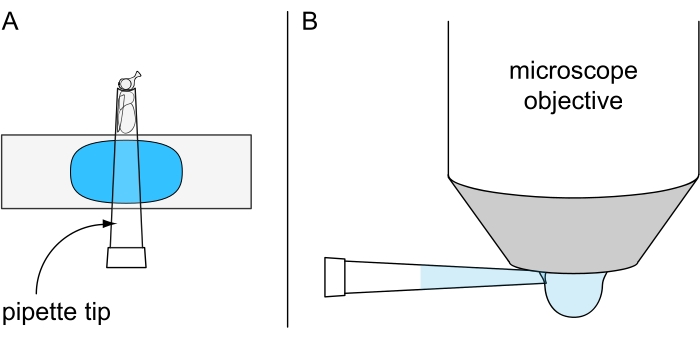
Figura 7: Preparación para microscopía de gota de agua no letal. Ilustración de (A) una mosca anestesiada en frío fijada dentro de una punta de pipeta de 200 μL montada en un portaobjetos recubierto de plastilina y (B) la aplicación de gota de agua fría en la parte inferior del objetivo de inmersión en agua. Haga clic aquí para ver una versión más grande de esta figura.
- Adquisición de imágenes
- Coloque cuidadosamente la placa de Petri (paso 3.1.3) o el portaobjetos del objeto (paso 3.1.7) con la mosca preparada en la etapa del microscopio y seleccione un objetivo de inmersión en agua.
- Baje el objetivo de inmersión en agua manualmente hasta que entre en contacto con la superficie del agua (paso 3.1.3) o el ojo de la mosca toque la gota (paso 3.1.7) (Figura 8A, B).
- Encienda la lámpara UV del microscopio y seleccione el conjunto de filtros adecuado. Use los oculares para colocar la mosca debajo del objetivo y enfocar el microscopio en la superficie del ojo.
- Cambie la trayectoria de la luz hacia la cámara del microscopio y genere una imagen en vivo en el software correspondiente. Reajuste el enfoque para la cámara y evalúe la orientación del ojo, considerando que el ojo tiene que mirar radialmente hacia el objetivo del microscopio como se ilustra con más detalle en la Figura 8C-E.
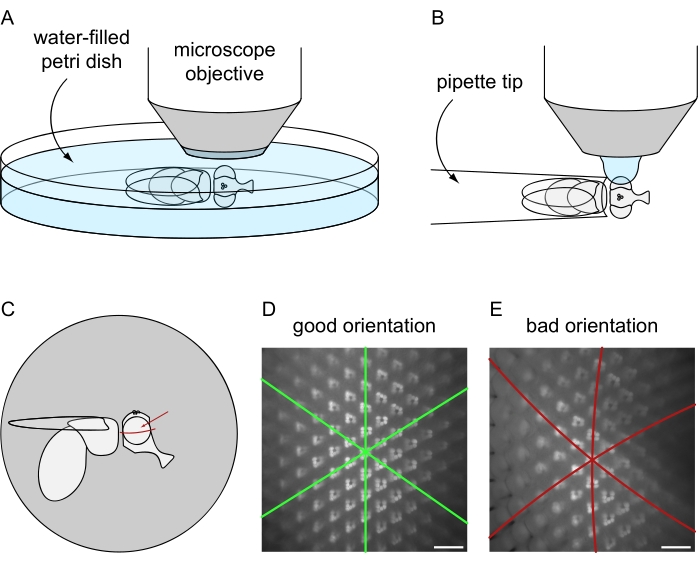
Figura 8: Posicionamiento de la mosca bajo el microscopio de fluorescencia para imágenes de inmersión en agua. Configuración y orientación final para la adquisición de imágenes utilizando los protocolos de preparación de moscas (A) letales o (B) no letales. (C) Ilustración de la orientación de la mosca para obtener los mejores resultados de las imágenes de microscopía de inmersión en agua. El punto ideal para enfocar el ojo no es el centro exacto con respecto a los ejes anterior/posterior y dorsal/ventral sino que está ligeramente por encima del ecuador del ojo, como indica la flecha roja. (D) Ejemplo de imagen de inmersión en agua para un ojo perfectamente posicionado. Los tres ejes de simetría del mosaico ommatidial hexagonal aparecen como líneas rectas y la cantidad máxima de ommatidios puede estar enfocada al mismo tiempo. (E) Ejemplo de imagen de inmersión en agua de un ojo mal posicionado. La imagen contiene ejes curvos y una profundidad de campo poco profunda. Barra de escala: 20 μm. Haga clic aquí para ver una versión más grande de esta figura.
- Utilice la LUT (tabla de búsqueda) adecuada dentro del software de imágenes para detectar la sobresaturación (indicada como píxeles rojos).
- En el caso de moscas no pigmentadas, ajuste el tiempo de exposición de modo que los píxeles más brillantes estén justo por debajo del límite de saturación para cada imagen.
- En el caso de las moscas pigmentadas y la variación letal, ajuste el tiempo de exposición de tal manera que todos los píxeles más brillantes estén justo por debajo del límite de saturación en al menos cinco moscas individuales de 1 día de edad, adaptadas a la oscuridad. Aplicar el tiempo de exposición medio calculado a todas las demás condiciones experimentales (genotipos, condiciones de iluminación, puntos de tiempo, etc.).
- En el caso de las moscas pigmentadas (por ejemplo, de ojos rojos) y la variación no letal, ajuste el tiempo de exposición de modo que todos los píxeles más brillantes estén justo por debajo del límite de saturación para cada mosca adaptada a la oscuridad de 1 día de edad individualmente. Aplique este tiempo de exposición a todas las demás condiciones experimentales (condiciones de iluminación, puntos de tiempo, etc.) de esta mosca.
- Grabe una imagen y guárdela como un archivo sin procesar para archivar todos los metadatos correspondientes de la grabación. Exporte la imagen en un formato .tif para la siguiente cuantificación.
NOTA: En el caso de la variación no letal, ilumine las moscas durante 5 minutos con luz roja (por ejemplo, 630 nm) inmediatamente después de la adquisición de la imagen, si están destinadas a ser utilizadas para experimentos posteriores. La luz roja desactiva la cascada de fototransducción que ha sido activada excesivamente por la luz intensa de onda corta durante la adquisición de la imagen.
- Análisis de datos y cuantificación de la fluorescencia relativa de eGFP en los rabdomeros de micrografías de inmersión en agua
- Descargue, instale y ejecute el software ImageJ/Fiji.
- Ajuste la configuración de ImageJ haciendo clic en Analizar > Establecer medidas... y marque solo la casilla Valor gris medio. Importe una imagen .tif haciendo clic en Archivo > Abrir... o arrastrando y soltando. Elija una región representativa de la imagen que esté enfocada y agréguela al 200%-300% presionando repetidamente Ctrl y + juntos.
- Seleccione la herramienta Óvalo y, al presionar la tecla Mayús , genere una selección circular en la imagen que sea significativamente más pequeña que un rabdomero fluorescente. Antes de soltar el botón del ratón, busque el tamaño exacto que se muestra debajo de la barra de herramientas en la ventana principal de ImageJ. Utilice el mismo tamaño de selección circular para todos los análisis.
NOTA: El tamaño exacto de la selección circular en píxeles o micras depende de la configuración específica. Use un círculo de aproximadamente 1/3 o 1/4 del diámetro rabdomeral de las moscas de control adaptadas a la oscuridad de 1 día de edad. - Mueva la selección circular haciendo clic con el ratón en ella y arrastrándola o presionando las teclas de flecha del teclado.
- Para medir las intensidades de fluorescencia dentro de la selección circular, mueva el círculo al primer rabdomero (r1) y haga clic en Analizar > Medir o use el acceso directo Ctrl + M. Aparecerá una ventana de resultados que enumera el valor gris medido.
- Continuar con las mediciones de r2-r6 como mediciones repetidas y una medición de la señal de fondo (b). En el caso de moscas no pigmentadas, realice mediciones adicionales de las áreas del cuerpo celular correspondientes (c1-c6) (Figura 9).
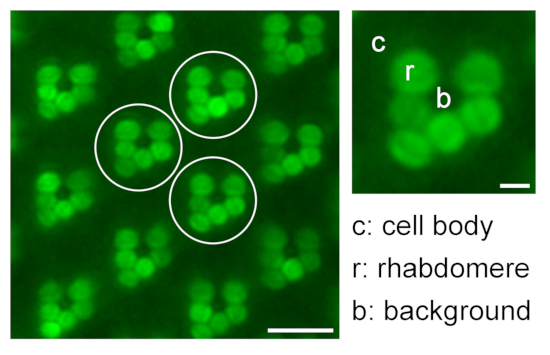
Figura 9: Cuantificación de la fluorescencia rabdomeral relativa para estudios de translocación. Una ilustración sobre la cuantificación de la fluorescencia relativa de eGFP en los rabdomeros midiendo la intensidad de fluorescencia del rabdomero (r), el cuerpo celular (c) y el fondo (b) de tres ommatidia representativos diferentes (círculos blancos) en una imagen de microscopía de inmersión en agua; barra de escala: 10 μm. A la derecha se muestra un ommatidio magnificado; barra de escala: 2 μm. Haga clic aquí para ver una versión más grande de esta figura.
- Repita los pasos 3.3.5 y 3.3.6 para dos ommatidios más, lo que dará como resultado tres réplicas técnicas. Marque los ommatidios analizados mediante la herramienta Lápiz y guarde esta imagen para la documentación.
- Seleccione y copie los valores grises medidos desde la ventana Resultado y péguelos en el software de hoja de cálculo para realizar cálculos adicionales. Ordene los valores de intensidad de fluorescencia según su origen en las categorías rabdomero (r), cuerpo celular (c) y fondo (b). Calcular la intensidad media de cada categoría (Ir, Ic, Ib).
- Calcule la cantidad relativa de eGFP presente en el rabdomero (R), utilizando la siguiente fórmula (1) para ojos no pigmentados y fórmula (2) para ojos pigmentados:
 (1)
(1) (2)
(2) - Continúe con la siguiente imagen en el paso 3.3.3. Se recomienda utilizar imágenes de al menos cinco individuos de cada grupo experimental como réplicas biológicas para obtener una medición confiable.
- Análisis de datos y cuantificación de la morfología ocular mediante fluorescencia eGFP en micrografías de inmersión en agua
- Descargue, instale y ejecute el software ImageJ/Fiji. Importe una imagen .tif haciendo clic en Archivo > Abrir... o arrastrando y soltando. Elija tres ommatidios adyacentes en una región representativa de la imagen que está enfocada.
- Evaluar los 18 rabdomeros de la selección individualmente según su intensidad eGFP, nitidez de borde y contraste con respecto a la señal de fondo circundante para generar un índice de degeneración. Puntúe los rabdomeros claramente visibles con un valor de 2, los rabdomeros débilmente visibles con un valor de 1 y los rabdomeros ausentes con un valor de 0 (Figura 10).
NOTA: Esta forma de cuantificación da como resultado una puntuación de 36 para los ojos completamente intactos y una puntuación de 0 para los ojos completamente degenerados. Se recomienda establecer la puntuación de 36 a 100% en el índice de degeneración.

Figura 10: Cuantificación mediante evaluación del rabdomero para estudios de degeneración. Una ilustración sobre la cuantificación de la morfología ocular mediante la puntuación de los rabdomeros de tres ommatidios representativos diferentes (círculos blancos) en una imagen de microscopía de inmersión en agua con valores de 2 (claramente visible; círculo azul), 1 (débilmente visible; círculo naranja) o 0 (ausente; círculo rojo). Barra de escala: 10 μm. A la derecha se muestra un ommatidio magnificado; barra de escala: 2 μm. Haga clic aquí para ver una versión más grande de esta figura.
- Abra la siguiente imagen y continúe con el paso 3.4.2. Se recomienda utilizar imágenes de al menos ocho individuos de cada grupo experimental como réplicas biológicas para obtener una medición confiable.
NOTA: Dado que este método de cuantificación es menos objetivo que el método para cuantificar la translocación por intensidad de fluorescencia, el número recomendado de réplicas es mayor.
Resultados
Se han generado moscas Drosophila transgénicas que expresan una proteína de fusión TRPL::eGFP bajo el control del promotor de rodopsina 1. En estas moscas, TRPL::eGFP se expresa en las células fotorreceptoras R1-6 del ojo compuesto y muestra una localización dependiente de la iluminación. Cuando las moscas se mantienen en la oscuridad, TRPL::eGFP se incorpora a los rabdomeros externos. Después de la iluminación durante varias horas, TRPL se transloca en el cuerpo celular donde se almacena en un compartim...
Discusión
La aplicabilidad de las proteínas de fluorescencia y la simplicidad de la detección mediante imágenes DPP y microscopía de inmersión en agua de la retina han demostrado ser exitosas por muchos grupos12. Estrategias similares a las aquí presentadas se han utilizado en varios cribados genéticos para detectar defectos en los niveles de expresión de rodopsina, homeostasis, organización retiniana o integridad celular con la ayuda de Rh1::eGFP 17,18,19,20,21.<...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Nos gustaría agradecer a nuestros estudiantes investigadores a lo largo de los años. En particular, Nina Meyer, Sibylle Mayer, Juliane Kaim y Laura Jaggy, cuyos datos se han utilizado en este protocolo como resultados representativos. La investigación de nuestro grupo presentada aquí fue financiada por subvenciones de la Deutsche Forschungsgemeinschaft (Hu 839/2-4, Hu 839/7-1) a Armin Huber.
Materiales
| Name | Company | Catalog Number | Comments |
| 15 mL centrifuge tube | Greiner Bio-One | 188271 | |
| CO2 anaesthesia fly pad | Flystuff | 59-172 | |
| Cold light lamp (KL 1500 LCD) | Zeiss | ||
| Fiji/ImageJ | NIH | ||
| Fluorescence microscope with UV lamp, camera, filter set and software (AxioImager.Z1m, Axiocam 530 mono, 38 HE, ZEN2 blue edition) | Zeiss | ||
| Fluorescent tube (Lumilux T8, L 30W/840, 4000 K, G13) [1750 Lux, Ee470nm = 298 µW cm-2, Ee590nm = 215 µW cm-2] and [760 Lux, Ee470nm = 173 µW cm-2, Ee590nm = 147 µW cm-2] | Osram | 4050300518039 | |
| Laboratory pipette (20-200 µL) | Eppendorf | ||
| Object slide | Roth | 0656.1 | |
| Petri dish (94 mm) | Greiner Bio-One | 633102 | |
| Pipette tips (200 µL) | Labsolute | 7695844 | |
| Plasticine (Blu-Tack) | Bostik | 30811745 | |
| Stereo microscope (SMZ445) | Nikon | ||
| Stereo microscope with UV lamp, camera, filer set and software (MZ16F, MC170 HD, GFP3, LAS 4.12) | Leica |
Referencias
- Wang, X., Huang, T., Bu, G., Xu, H. Dysregulation of protein trafficking in neurodegeneration. Molecular Neurodegeneration. 9. 9, 31 (2014).
- Schopf, K., Huber, A. Membrane protein trafficking in Drosophila photoreceptor cells. European Journal of Cell Biology. 96 (5), 391-401 (2017).
- Hardie, R. C. The photoreceptor array of the dipteran retina. Trends in Neurosciences. 9, 419-423 (1986).
- Wang, T., Montell, C. Phototransduction and retinal degeneration in Drosophila. Pflügers Archiv - European Journal of Physiology. 454 (5), 821-847 (2007).
- Xiong, B., Bellen, H. J. Rhodopsin homeostasis and retinal degeneration: lessons from the fly. Trends in Neurosciences. 36 (11), 652-660 (2013).
- Bähner, M., et al. Light-regulated subcellular translocation of Drosophila TRPL channels induces long-term adaptation and modifies the light-induced current. Neuron. 34 (1), 83-93 (2002).
- Cronin, M. A., Lieu, M. -. H., Tsunoda, S. Two stages of light-dependent TRPL-channel translocation in Drosophila photoreceptors. Journal of Cell Science. 119, 2935-2944 (2006).
- Meyer, N., Joel-Almagor, T., Frechter, S., Minke, B., Huber, A. Subcellular translocation of the eGFP-tagged TRPL channel in Drosophila photoreceptors requires activation of the phototransduction cascade. Journal of Cell Science. 119, 2592-2603 (2006).
- Oberegelsbacher, C., Schneidler, C., Voolstra, O., Cerny, A., Huber, A. The Drosophila TRPL ion channel shares a Rab-dependent translocation pathway with rhodopsin. European Journal of Cell Biology. 90 (8), 620-630 (2011).
- Wagner, K., Smylla, T. K., Lampe, M., Krieg, J., Huber, A. Phospholipase D and retromer promote recycling of TRPL ion channel via the endoplasmic reticulum. Traffic. , (2021).
- Franceschini, N., Kirschfeld, K. Les phénoménes de pseudopupille dans l'oeil compose de Drosophila. Kybernetik. 9 (5), 159-182 (1971).
- Pichaud, F., Desplan, C. A new visualization approach for identifying mutations that affect differentiation and organization of the Drosophila ommatidia. Development. 128 (6), 815-826 (2001).
- Smylla, T. K., Wagner, K., Huber, A. Application of fluorescent proteins for functional dissection of the Drosophila visual system. International Journal of Molecular Sciences. 22 (16), (2021).
- Meyer, N. Mechanisms of the light-dependent translocation of the ion channel TRPL in the photoreceptors of Drosophila melanogaster: Dissertation for obtaining the academic degree Dr. rer. nat. University of Karlsruhe (TH). , (2005).
- Meyer, N., Oberegelsbacher, C., Dürr, T. D., Schäfer, A., Huber, A. An eGFP-based genetic screen for defects in light-triggered subcelluar translocation of the Drosophila photoreceptor channel TRPL. Fly. 2 (1), 36-46 (2008).
- Zheng, L., Carthew, R. W. Lola regulates cell fate by antagonizing Notch induction in the Drosophila eye. Mechanisms of Development. 125 (1-2), 18-29 (2008).
- Hibbard, K. L., O'Tousa, J. E. A role for the cytoplasmic DEAD box helicase Dbp21E2 in rhodopsin maturation and photoreceptor viability. Journal of Neurogenetics. 26 (2), 177-188 (2012).
- Huang, Y., Xie, J., Wang, T. A Fluorescence-based genetic screen to study retinal degeneration in Drosophila. PloS One. 10 (12), 0144925 (2015).
- Zhao, H., Wang, J., Wang, T. The V-ATPase V1 subunit A1 is required for rhodopsin anterograde trafficking in Drosophila. Molecular Biology of the Cell. 29 (13), 1640-1651 (2018).
- Xiong, L., et al. ER complex proteins are required for rhodopsin biosynthesis and photoreceptor survival in Drosophila and mice. Cell Death and Differentiation. 27 (2), 646-661 (2020).
- Zhao, H., Wang, T. PE homeostasis rebalanced through mitochondria-ER lipid exchange prevents retinal degeneration in Drosophila. PLoS Genetics. 16 (10), 1009070 (2020).
- Cerny, A. C., et al. The GTP- and phospholipid-binding protein TTD14 regulates trafficking of the TRPL ion channel in Drosophila photoreceptor cells. PLoS Genetics. 11 (10), 1005578 (2015).
- Richter, D. Structural and functional analyses of TRP ion channels in the photoreceptor cells of Drosophila melanogaster: Dissertation for obtaining the academic degree Dr. rer, nat. University of Karlsruhe (TH). , (2007).
- Gambis, A., Dourlen, P., Steller, H., Mollereau, B. Two-color in vivo imaging of photoreceptor apoptosis and development in Drosophila. Developmental Biology. 351 (1), 128-134 (2011).
- Hardie, R. C., Liu, C. -. H., Randall, A. S., Sengupta, S. In vivo tracking of phosphoinositides in Drosophila photoreceptors. Journal of Cell Science. 128 (23), 4328-4340 (2015).
- Chakrabarti, P., et al. A dPIP5K dependent pool of phosphatidylinositol 4,5 bisphosphate (PIP2) is required for G-protein coupled signal transduction in Drosophila photoreceptors. PLoS Genetics. 11 (1), 1004948 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados