Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Изучение незаконного оборота мембранных белков в фоторецепторных клетках дрозофилы с использованием белков, помеченных eGFP
В этой статье
Резюме
Здесь описаны неинвазивные методы локализации белков фоторецепторной мембраны и оценки дегенерации сетчатки в глазу с помощью флуоресценции eGFP.
Аннотация
Мембранный промысел белка регулирует включение и удаление рецепторов и ионных каналов в плазматическую мембрану. Этот процесс принципиально важен для клеточной функции и клеточной целостности нейронов. Фоторецепторные клетки Drosophila стали моделью для изучения трафика мембранного белка. Помимо родопсина, который при освещении интернализуется из фоторецепторной мембраны и деградирует, ионный канал транзиторного рецепторного потенциала (TRPL) у дрозофилы демонстрирует светозависимую транслокацию между рабдомеральной фоторецепторной мембраной (где она расположена в темноте) и телом фоторецепторной клетки (в которую он транспортируется при освещении). Этот внутриклеточный транспорт TRPL может быть изучен простым и неинвазивным способом путем экспрессии TRPL с тегами eGFP в фоторецепторных клетках. Затем флуоресценцию eGFP можно наблюдать либо в глубоком псевдопупиле, либо с помощью микроскопии погружения в воду. Эти методы позволяют обнаруживать флуоресценцию в интактном глазу и поэтому полезны для высокопроизводительных анализов и генетических скринингов мутантов Drosophila , дефектных транслокации TRPL. Здесь подробно объясняются подготовка мух, микроскопические методы, а также методы количественной оценки, используемые для изучения этой световой транслокации TRPL. Эти методы могут быть применены также для исследований незаконного оборота других фоторецепторных белков Drosophila , например, родопсина. Кроме того, используя рэбдомеральные белки, помеченные eGFP, эти методы могут быть использованы для оценки дегенерации фоторецепторных клеток.
Введение
Доставляя и удаляя белки в плазматическую мембрану и из нее, мембранный белковый трафик в нейронах контролирует оборудование плазматической мембраны с рецепторами, а также ионными каналами и, как следствие, регулирует функцию нейронов. Неправильная регуляция или дефекты в торговле белком обычно оказывают пагубное воздействие на клетки и приводят к дегенерации нейронов. У людей это может вызвать нейродегенеративные заболевания, такие как болезнь Альцгеймера и Паркинсона или пигментный ретинит1. Фоторецепторы в составном глазу Drosophila melanogaster стали модельной системой in vivo для изучения мембранного трафика белка2. Это связано не только с генетической универсальностью дрозофилы , которая позволяет проводить эффективные генетические скрининги, но и с тем, что все основные компоненты светопоглощающей фоторецепторной мембраны характеризуются очень подробно, и доступны эффективные микроскопические методы, которые могут быть применены к глазу мухи. Эти методы находятся в центре внимания этой статьи.
В фоторецепторных клетках Drosophila апикальная плазматическая мембрана образует плотно упакованный стек микроворсинок вдоль одной стороны клетки, называемый рабдомером. Рабдомеры фоторецепторных клеток R1-6 расположены в характерном трапециевидном рисунке, в то время как фоторецепторные клетки R7 и R8 образуют единый рабдомер в центре этой трапеции3. Мембранный промысел белка необходим для регулируемого оборота рабдомеральных мембранных белков, таких как родопсин и светоактивированные каналы TRP (переходный рецепторный потенциал) и TRPL (TRP-подобные), чтобы обеспечить надлежащее количество этих белков фототрансдукции в рабдомере. Белки фоторецепторной мембраны синтезируются в эндоплазматическом ретикулуме и транспортируются через аппарат Гольджи в рабдомер. После активации родопсина светом молекула родопсина может либо инактивироваться путем поглощения второго фотона, либо может быть удалена из рабдомера с помощью клатрин-опосредованного эндоцитоза. Эндоцитозированный родопсин либо деградирует в лизосоме, либо перерабатывается обратно в рабдомер 4,5. Ионный канал TRPL также интернализуется после активации каскада фототрансдукции и подвергается светозависимой транслокации между рабдомером (где он находится, когда мухи содержатся в темноте) и обогащенным ER-обогащенным отсеком хранения в теле клетки (в который он транспортируется в течение нескольких часов при освещении)6,7,8,9,10 . В отличие от эндоцитозированного родопсина, только небольшие количества TRPL разлагаются через эндолизосомальный путь, и большинство хранится внутриклеточным образом и рециркулируется обратно в рабдомер после темновой адаптации6. Таким образом, TRPL может быть использован для анализа светового трафика белков плазматической мембраны. Фоторецепторные клетки Drosophila также используются для изучения дегенерации нейронов. Дегенерация фоторецепторных клеток часто определяется путем оценки структуры рабдомеров, которые распадаются в результате дегенеративных процессов5.
Для изучения субклеточной локализации TRPL и родопсина в фоторецепторных клетках или дегенерации фоторецепторных клеток здесь применены два метода флуоресцентной микроскопии, отличающиеся по скорости и разрешению анализа. Очень быстрым, неинвазивным методом, который может быть использован для генетических скринингов, но с ограниченным пространственным разрешением, является обнаружение флуоресценции в глубоком псевдопупиле (DPP). DPP — это оптическое явление составных глаз членистоногих, геометрическое происхождение которого было подробно объяснено Франческини и Киршфельдом в 1971году 11. Короче говоря, на нескольких оптических плоскостях ниже наложения сетчатки можно наблюдать изображения рабдомеров из соседних омматидий. На фокальной плоскости через центр искривления глаза эти наложенные проекции образуют изображение, напоминающее трапециевидное расположение рабдомеров в одном омматидии только на порядки больше. Это явление также можно наблюдать независимо от экзогенной экспрессии флуоресцентных белков (например, TRPL::eGFP8), которые, тем не менее, облегчают обнаружение DPP (рисунок 1A-A'')12. Вторым неинвазивным методом является микроскопия погружения в воду, которая опирается на визуализацию флуоресцентно меченых белков после оптической нейтрализации диоптрического аппарата глаз водой (рисунок 1B-C'')12. Используя метод погружения в воду, относительное количество TRPL::eGFP в рабдомерах или теле клетки может быть количественно оценено для отдельных фоторецепторных клеток. Кроме того, нетранслокационные флуоресцентные белки могут быть использованы для оценки рабдомерной целостности и определения временного хода потенциальной дегенерации количественным образом, как описано здесь.
Хотя записи DPP на сегодняшний день являются самым простым и быстрым из этих методов, пространственное разрешение данных, которые они генерируют, ограничено. Кроме того, существует множество причин, по которым DPP может отсутствовать, которые не обязательно различимы по самой визуализации DPP. Поскольку ДПП представляет собой суммирование нескольких омматидий, информация об отдельных клетках теряется. Таким образом, визуализация DPP с низким разрешением выполняет важную функцию при скрининге большого количества мух, но, как правило, должна сопровождаться записями с более высоким разрешением с помощью микроскопии погружения в воду. Микроснимки погружения в воду позволяют интерпретировать отдельные клетки, дефекты развития, морфологию глаз, неправильную локализацию белка или дегенерацию сетчатки, а также количественно оценивать эти эффекты. В настоящем Протоколе подробно описываются эти два метода.
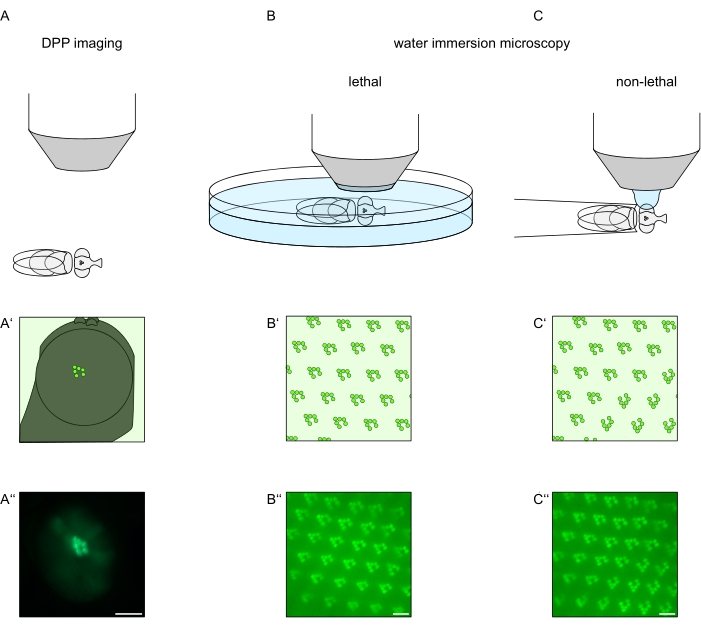
Рисунок 1: Обзор вариаций микроскопии для глаза дрозофилы, представленных в настоящем Протоколе. Схематические изображения и примерные микроснимки (A-A'') флуоресцентной глубокой псевдопупильной (DPP) визуализации (B-B'') летального погружения в воду флуоресцентных рабдомеров и (C-C'') нелетальной капельной микроскопии флуоресцентных рабдомеров. Шкала (A''): 100 мкм. Шкала стержней (B''-C''): 10 мкм. Этот показатель был изменен по сравнению со ссылкой13. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
1. Общие соображения
- Используйте запасы дрозофилы , экспрессирующие постоянно рабдомерно расположенный флуоресцентный белок для морфологического анализа (например, TRP::eGFP, eGFP::NINAC) и транслокационные белки для анализа относительно незаконного оборота белка (например, TRPL::eGFP, Arr2::eGFP).
- Предопределить условия освещенности отобранных мух для экспериментального подхода.
- Для темной адаптации держите мух в темных ящиках в течение желаемого периода при 25 °C. Для освещения до 16 ч в экспериментах по транслокации (например, TRPL::eGFP, экспрессирующих мухи), держите мух под люминесцентной трубкой при комнатной температуре.
- В экспериментах, оценивающих дегенерацию фоторецепторов (например, TRP::eGFP, экспрессирующие мухи), держите мух под люминесцентной трубкой при 25 °C в темном цикле 12 ч / 12 ч для длительного освещения до 28 дней белым светом.
- Для освещения мух цветным светом используйте разноцветные прозрачные пластиковые коробки вместе с люминесцентной трубкой.
- Если используются запасы мух с пигментированными глазами, возраст животных именно для сравнительного анализа, так как пигментация глаз может значительно увеличиваться с возрастом.
ПРИМЕЧАНИЕ: Для интерпретации данных важно отметить, что существует смещение сигнала из-за оптического волноводального эффекта рабдомерной структуры. Соответственно, флуоресцентный сигнал от рабдомера всегда будет усилен в определенной степени при визуализации DPP и микроскопии погружения в воду относительно сигналов, полученных от тела клетки. Это наиболее заметно наблюдается в пигментированных глазах, где флуоресценция извне рабдомеров поглощается этими пигментами и имеет особое значение при обнаружении внутриклеточных транслоцирующих белков слияния. Таким образом, что касается критических шагов, это исследование рассматривает белоглазых и красноглазых мух отдельно. - Что касается микроскопии погружения в воду, описаны два варианта. Более быстрая летальная вариация, а также нелетальная вариация, позволяющая восстановиться для последующих исследований.
2. Визуализация DPP
- Подготовьте рабочее пространство с необходимым оборудованием и реагентами, как показано на рисунке 2. Обезболивайте мух (1-3 дня) генотипа, который экспрессирует флуоресцентный белок в фоторецепторных клетках с CO2 на флайпаде. Выберите животных для визуализации под стереомикроскопом с обычным источником света и низким увеличением (например, 10x).

Рисунок 2: Рабочая область обработки изображений DPP. Необходимые материалы: (A) аппарат для анестезии CO2 , (B) стереомикроскоп с УФ-лампой и флуоресцентным фильтром, (C) источник света, (D) камера, установленная на микроскопе с программным обеспечением (E), (F) кисть для краски, (G) черный картон и (H) флакон. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Для визуализации DPP держите выбранных мух обезболенными и расположите одну из них в центре объектива микроскопа на боку так, чтобы левый или правый глаз был обращен к объекту точно радиально (рисунок 3A).
ПРИМЕЧАНИЕ: Поскольку омматидиальная компоновка фоторецепторных клеток отображает зеркальную симметрию на дорсовентральной средней линии, DPP лучше всего наблюдать немного выше или ниже экватора глаза (рисунок 3B).
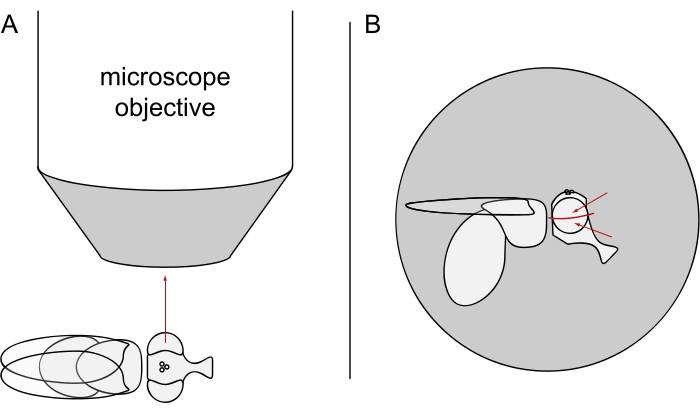
Рисунок 3: Позиционирование мухи под стереомикроскопом для визуализации DPP. (A) Иллюстрация мухи на боку с одним глазом, обращенным к объективу микроскопа радиально. (B) Голова мухи должна быть слегка повернута вверх или вниз таким образом, чтобы цель фокусировалась на точке немного выше или ниже экватора глаза, как указано красными стрелками. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Увеличьте увеличение, чтобы оно соответствовало всему глазу (например, в 100 раз) и центрировало центральную омматидию глаза. Уменьшите глубину резкости микроскопа, например, путем регулировки диафрагмы с двойной радужкой до неглубокой установки (рисунок 4A-B').
- Выключите обычный источник света и включите ультрафиолетовую лампу микроскопа с максимальной интенсивностью и выберите набор флуоресцентных фильтров микроскопа в соответствии с флуоресцентным белком, выраженным в глазах (рисунок 4C-E). Установите световой путь к камере, установленной на микроскопе.
- Используйте функцию визуализации в реальном времени в программном обеспечении, чтобы настроить яркость изображения до настройки, которая обнаруживает только определенные сигналы от глаза, регулируя время экспозиции и значение усиления (например, 80 мс и 12x соответственно). Перенастройте фокус микроскопа «в» глаз (ниже роговицы) для генерации наложенного изображения DPP (рисунок 4C-E').
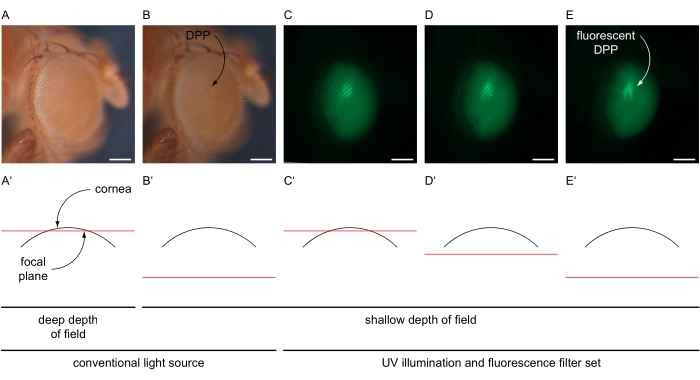
Рисунок 4: Иллюстрация DPP и флуоресцентной визуализации DPP. Примерные изображения глаз дрозофилы при обычном и УФ-освещении с набором фильтров GFP, сделанные с различными фокальными плоскостями, проиллюстрированными в схематических поперечных сечениях через глаз. (A) Микрофотография, записанная с яркими настройками обычного источника света, временем экспозиции 30 мс, 1-кратным усилением, глубокой глубиной резкости и фокальной плоскостью вблизи поверхности роговицы, как показано в (A'). (B) Микрофотография, записанная с яркими настройками обычного источника света, временем экспозиции 30 мс, 1-кратным усилением, малой глубиной резкости и фокальной плоскостью примерно на 180 мкм ниже поверхности роговицы, как показано в (B'). УказанО ДПП. (С-Е) Микрофотография, записанная с высокоинтенсивными настройками источника ультрафиолетового света и набора фильтра GFP, времени экспозиции 80 мс, 12-кратного усиления, малой глубины резкости и фокальной плоскости (C') вблизи, (D') немного ниже или (E') примерно на 180 мкм ниже поверхности роговицы. Флуоресцентный ДПП обозначается изогнутой стрелкой. Шкала 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Сделайте снимок флуоресцентного DPP. Переключите микроскоп обратно на видимый свет и световой путь обратно к окулям. Восстановите изображенное животное в флаконе мухи для дальнейшего разбирательства в соответствии с его фенотипом DPP (например, кресты). Продолжайте со следующим животным на шаге 2.2.
3. Микроскопия погружения в воду
- Подготовка мухи
- Подготовьте рабочее пространство необходимым оборудованием и реагентами, как показано на рисунке 5. Переведите мух с заданным возрастом и условиями освещения в предварительно охлажденную 15-литровую центрифужную трубку и обезболите, инкубируя их на льду в течение 15-30 минут.
ПРИМЕЧАНИЕ: Возьмите с собой 1-дневных, адаптированных к темноте мух в качестве ориентира. Как правило, адаптированные к темноте мухи должны быть перенесены в ледяной ящик с крышкой в темноте. Адаптированные к свету мухи могут быть перенесены на лед в комнатном свете.
- Подготовьте рабочее пространство необходимым оборудованием и реагентами, как показано на рисунке 5. Переведите мух с заданным возрастом и условиями освещения в предварительно охлажденную 15-литровую центрифужную трубку и обезболите, инкубируя их на льду в течение 15-30 минут.

Рисунок 5: Рабочее пространство для микроскопии погружения в воду. Необходимые материалы: (A) центрифужная трубка объемом 15 мл, (B) ледяные хлопья, (C) охлажденная дистиллированная вода, (D) стереомикроскоп, (E) чашка Петри, (F) пластилин, (G) предметный слайд, (H) булавки насекомых или наконечники пипеток и скальпель, (I) флуоресцентный микроскоп с программным обеспечением (J). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Выберите соответствующий препарат из двух, описанных ниже (смертельная вариация 3.1.3 или нелетальная вариация 3.1.7) и всякий раз, когда проводится дифференциация между пигментированными и непигментированными глазами, следуйте соответствующим шагам.
- Подготовьте мух к смертельной вариации следующим образом.
- Приклейте кусок пластилина к предмету, а другой кусок к центру чашки Петри (например, 94 мм Ø) и держите их отдельно на данный момент. Наполните чашку Петри охлажденной льдом дистиллированной водой и ледяными хлопьями (рисунок 6А).
- Поместите одну обезболенную льдом муху под стереомикроскоп поверх предметного предмета, покрытого пластилином. Поверните муху на спину и проткните булавку насекомого через центр грудной клетки (рисунок 6B). Закрепите штифт горизонтально на слайде объекта, покрытого пластилином, и наведите левый или правый глаз мухи вверх (рисунок 6C).
- Осторожно зафиксируйте предметную горку, его пластилиновую сторону, обращенную вниз, в чашке Петри, предотвращая вращение мухи. Убедитесь, что глаз мухи покрыт водой (рисунок 6D). Используйте подготовительную иглу, чтобы аккуратно удалить любые пузырьки воздуха, которые могли образоваться вокруг глаза, и немедленно приступайте к получению изображения для достижения наилучших результатов.
ПРИМЕЧАНИЕ: Значительная задержка в получении изображения приводит к пробуждению и движениям мухи, что может привести к размытию изображений.
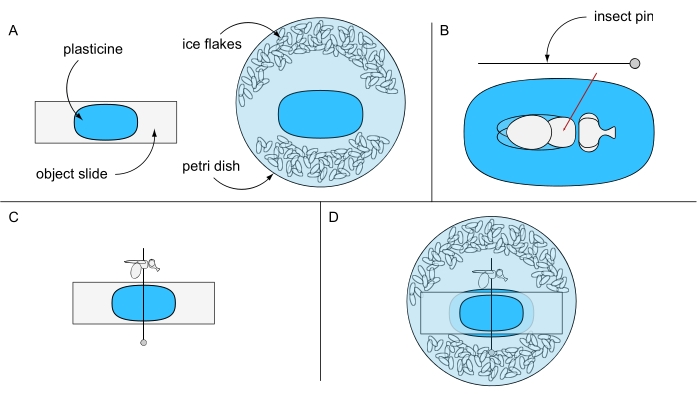
Рисунок 6: Подготовка к смертельной микроскопии погружения в воду. Иллюстрация (A) слайда объекта с пластилиновым покрытием и чашки Петри, (B) закрепления мухи через грудную клетку на пластилиновой земле, (C) ориентации мухи на слайде объекта с пластилиновым покрытием и (D) окончательной экспериментальной установки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Подготовьте мух к нелетальному варианту следующим образом.
- Переложите одну обезболенную льдом муху головой вперед в наконечник пипетки объемом 200 мкл и осторожно толкните муху к наконечнику сжатым воздухом.
- Отрежьте кончик пипетки прямо перед головой скальпелем. Используя пинцет, осторожно оттолкните муху на несколько миллиметров от кончика. Снова отрежьте наконечник пипетки и сожмите сжатым воздухом муху обратно к кончику так, чтобы из кончика пипетки выступала только головка мухи.
- Приклейте кусок пластилина к предметному слайду и прижмите к нему кончик пипетки так, чтобы левый или правый глаз мухи был направлен вверх (рисунок 7А). Непосредственно перед получением изображения используйте лабораторную пипетку, чтобы приклеить большую каплю охлажденной воды к нижней стороне объектива погружения в воду (рисунок 7B). Немедленно приступайте к получению изображения для достижения наилучших результатов.
ПРИМЕЧАНИЕ: Значительная задержка в получении изображения приводит к пробуждению и движениям мухи, что может привести к размытию изображений.
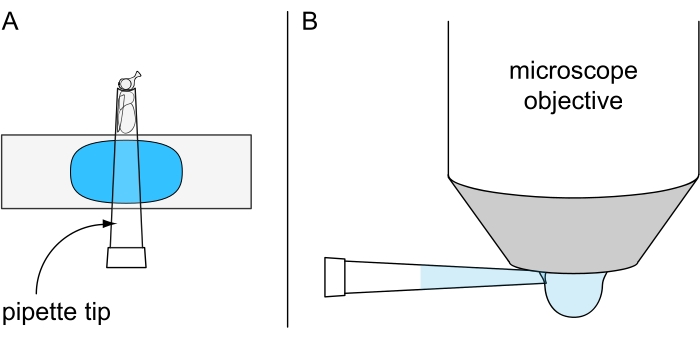
Рисунок 7: Подготовка к нелетальной микроскопии капли воды. Иллюстрация (А) холодно-обезболенной мухи, закрепленной внутри наконечника пипетки объемом 200 мкл, установленного на предметной горке с пластилиновым покрытием, и (В) нанесения капли охлажденной воды на нижнюю сторону объектива погружения в воду. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Получение изображений
- Осторожно поместите чашку Петри (шаг 3.1.3) или предметный слайд (шаг 3.1.7) с подготовленной мухой на ступень микроскопа и выберите цель погружения в воду.
- Опустите цель погружения в воду вручную до тех пор, пока она не соприкоснется с поверхностью воды (шаг 3.1.3) или глаз мухи не коснется капли (этап 3.1.7) (рисунок 8A,B).
- Включите УФ-лампу микроскопа и выберите соответствующий набор фильтров. Используйте окуляры, чтобы расположить муху под объективом и сфокусировать микроскоп на поверхности глаза.
- Переключите световой путь в сторону камеры микроскопа и сгенерируйте живое изображение в соответствующем программном обеспечении. Перенастройте фокусировку для камеры и оцените ориентацию глаза, учитывая, что глаз должен смотреть на объектив микроскопа радиально, как показано более подробно на рисунке 8C-E.
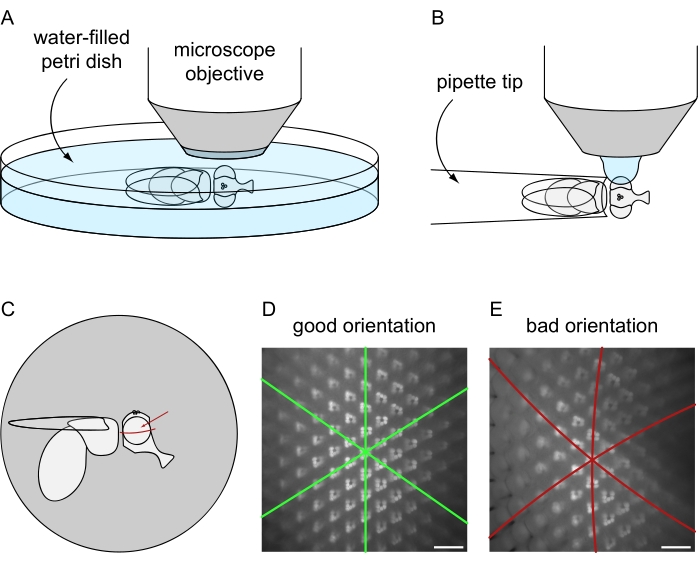
Рисунок 8: Позиционирование мухи под флуоресцентным микроскопом для визуализации погружения в воду. Настройка и окончательная ориентация для получения изображения с использованием (A) летальных или (B) нелетальных протоколов подготовки мух. (C) Иллюстрация ориентации мухи для получения наилучших результатов изображений микроскопии погружения в воду. Идеальной точкой для фокусировки на глазу является не точный центр по отношению к передней/задней и дорсальной/вентральной осям, а немного выше экватора глаза, как указано красной стрелкой. (D) Пример изображения погружения в воду для идеально расположенного глаза. Все три оси симметрии гексагональной омматидиальной плитки выглядят как прямые линии, и максимальное количество омматидий может быть в фокусе одновременно. (E) Пример погружения в воду изображения неправильно расположенного глаза. Изображение содержит изогнутые оси и небольшую глубину резкости. Шкала: 20 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Используйте соответствующий LUT (таблицу поиска) в программном обеспечении для обработки изображений, чтобы обнаружить перенасыщенность (обозначенную красными пикселями).
- В случае непигментированных мух отрегулируйте время экспозиции таким образом, чтобы самые яркие пиксели были чуть ниже предела насыщенности для каждого изображения.
- В случае пигментированных мух и летальных вариаций отрегулируйте время экспозиции таким образом, чтобы все самые яркие пиксели были чуть ниже предела насыщения, по крайней мере, у пяти отдельных 1-дневных, адаптированных к темноте мух. Применяйте расчетное среднее время воздействия ко всем остальным экспериментальным условиям (генотипы, условия освещения, временные точки и т.д.).
- В случае пигментированных мух (например, красноглазых) и нелетальных вариаций отрегулируйте время экспозиции таким образом, чтобы все самые яркие пиксели были чуть ниже предела насыщенности для каждой 1-дневной, адаптированной к темноте мухи индивидуально. Примените это время воздействия ко всем другим экспериментальным условиям (условиям освещения, временным точкам и т. д.) этой мухи.
- Запишите изображение и сохраните его в виде необработанного файла для архивации всех соответствующих метаданных записи. Экспортируйте изображение в формате .tif для следующей количественной оценки.
ПРИМЕЧАНИЕ: В случае нелетального изменения освещайте мух в течение 5 минут красным светом (например, 630 нм) сразу после получения изображения, если они предназначены для использования в дальнейших экспериментах. Красный свет деактивирует каскад фототрансдукции, который был чрезмерно активирован интенсивным коротковолновым светом во время получения изображения.
- Анализ данных и количественная оценка относительной флуоресценции eGFP в рабдомерах микроснимков погружения в воду
- Загрузите, установите и запустите программное обеспечение ImageJ/Fiji.
- Отрегулируйте параметры ImageJ, щелкнув Анализ > Набор измерений... и установите флажок Среднее серое значение. Импортируйте .tif изображение, нажав на Файл > Открыть... или перетаскиванием. Выберите репрезентативную область изображения, находящуюся в фокусе, и увеличьте ее до 200%-300%, многократно нажав клавиши CTRL и + вместе.
- Выберите инструмент «Овал» и при нажатии клавиши «Shift» создайте круговое выделение на изображении, которое значительно меньше одного флуоресцентного рабдомера. Прежде чем отпустить кнопку мыши, найдите точный размер, отображаемый под панелью инструментов в главном окне ImageJ. Используйте одинаковый размер кругового отбора для всех анализов.
ПРИМЕЧАНИЕ: Точный размер кругового выделения в пикселях или микронах зависит от конкретной настройки. Используйте круг примерно 1/3 или 1/4 рабдомера диаметра 1-дневных, адаптированных к темноте контрольных мух. - Переместите круговой выделенный фрагмент либо щелчком мыши в него и перетаскиванием, либо нажатием клавиш со стрелками на клавиатуре.
- Чтобы измерить интенсивность флуоресценции в круговом выделении, переместите круг к первому рабдомеру (r1) и нажмите «Анализировать > измерение» или используйте сочетание клавиш Ctrl + M. Появится окно Результат со списком измеренного серого значения.
- Продолжайте измерения r2-r6 в виде повторных измерений и измерения фонового сигнала (b). В случае непигментированных мух произведите дополнительные измерения соответствующих участков тела клеток (c1-c6) (рисунок 9).
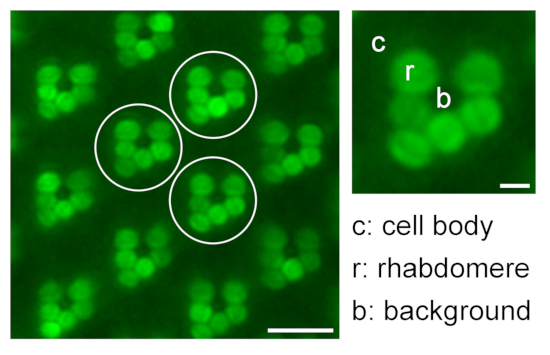
Рисунок 9: Количественная оценка относительной рабдомерной флуоресценции для исследований транслокации. Иллюстрация, касающаяся количественной оценки относительной флуоресценции eGFP в рабдомерах путем измерения интенсивности флуоресценции рабдомера (r), тела клетки (c) и фона (b) трех различных репрезентативных омматидий (белых кругов) в одном изображении микроскопии погружения в воду; шкала: 10 мкм. Увеличенный омматидий показан справа; шкала: 2 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Повторите шаги 3.3.5 и 3.3.6 для еще двух омматидий, в результате чего будут получены три технических репликации. Отметьте анализируемую омматидию с помощью инструмента «Карандаш» и сохраните это изображение для документации.
- Выберите и скопируйте измеренные серые значения из окна Результат и вставьте их в программное обеспечение для работы с электронными таблицами для дальнейших вычислений. Отсортируйте значения интенсивности флуоресценции в соответствии с их происхождением по категориям рабдомер (r), тело клетки (c) и фон (b). Рассчитайте среднюю интенсивность по каждой категории (Ir, Ic, Ib).
- Рассчитайте относительное количество eGFP, присутствующего в рабдомере (R), используя следующую формулу (1) для непигментированных и формулу (2) для пигментированных глаз:
 (1)
(1) (2)
(2) - Перейдите к следующему изображению на шаге 3.3.3. Рекомендуется использовать изображения не менее пяти особей каждой экспериментальной группы в качестве биологических реплик для получения достоверного измерения.
- Анализ данных и количественная оценка морфологии глаза флуоресценцией eGFP на микроснимках погружения в воду
- Загрузите, установите и запустите программное обеспечение ImageJ/Fiji. Импортируйте .tif изображение, щелкнув Файл > Открыть... или перетащив. Выберите три смежные омматидии в репрезентативной области изображения, находящейся в фокусе.
- Оцените 18 рабдомеров выделения по отдельности в соответствии с их интенсивностью eGFP, резкостью края и контрастом по отношению к окружающему фоновому сигналу для получения индекса дегенерации. Оценка отчетливо видимых рабдомеров со значением 2, слабо видимых рабдомеров со значением 1 и отсутствующих рабдомеров со значением 0 (рисунок 10).
ПРИМЕЧАНИЕ: Этот способ количественной оценки приводит к оценке 36 для полностью неповрежденных глаз и оценке 0 для полностью дегенеративных глаз. Рекомендуется установить оценку от 36 до 100% по индексу дегенерации.

Рисунок 10: Количественная оценка с помощью оценки рабдомера для исследований дегенерации. Иллюстрация, касающаяся количественной оценки морфологии глаза путем оценки рабдомеров трех различных репрезентативных омматидий (белых кругов) в одном изображении микроскопии погружения в воду со значениями 2 (хорошо видимый; синий круг), 1 (слабо видимый; оранжевый круг) или 0 (отсутствующий; красный круг). Шкала: 10 мкм. Увеличенный омматидий показан справа; шкала: 2 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Откройте следующее изображение и перейдите к шагу 3.4.2. Рекомендуется использовать изображения по крайней мере восьми особей каждой экспериментальной группы в качестве биологических реплик для получения достоверного измерения.
ПРИМЕЧАНИЕ: Поскольку этот метод количественной оценки является менее объективным, чем метод количественной оценки транслокации по интенсивности флуоресценции, рекомендуемое число реплик выше.
Результаты
Были сгенерированы трансгенные мухи Drosophila, экспрессирующие слитый белок TRPL::eGFP под контролем промотора родопсина 1. У этих мух TRPL::eGFP экспрессируется в фоторецепторных клетках R1-6 сложного глаза и отображает зависимую от освещения локализацию. Когда мухи содержатся в темноте, TRPL::eGFP...
Обсуждение
Применимость флуоресцентных белков и простота скрининга с помощью DPP-визуализации и микроскопии погружения в воду сетчатки доказали свою успешность многими группами12. Стратегии, аналогичные представленным здесь, использовались в нескольких генетических скринингах для ?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы хотели бы поблагодарить наших студентов-исследователей на протяжении многих лет. В частности, Нина Мейер, Сибилла Майер, Джулиана Каим и Лаура Джагги, чьи данные были использованы в этом протоколе в качестве репрезентативных результатов. Исследования нашей группы, представленные здесь, финансировались за счет грантов Deutsche Forschungsgemeinschaft (Hu 839/2-4, Hu 839/7-1) Армину Хуберу.
Материалы
| Name | Company | Catalog Number | Comments |
| 15 mL centrifuge tube | Greiner Bio-One | 188271 | |
| CO2 anaesthesia fly pad | Flystuff | 59-172 | |
| Cold light lamp (KL 1500 LCD) | Zeiss | ||
| Fiji/ImageJ | NIH | ||
| Fluorescence microscope with UV lamp, camera, filter set and software (AxioImager.Z1m, Axiocam 530 mono, 38 HE, ZEN2 blue edition) | Zeiss | ||
| Fluorescent tube (Lumilux T8, L 30W/840, 4000 K, G13) [1750 Lux, Ee470nm = 298 µW cm-2, Ee590nm = 215 µW cm-2] and [760 Lux, Ee470nm = 173 µW cm-2, Ee590nm = 147 µW cm-2] | Osram | 4050300518039 | |
| Laboratory pipette (20-200 µL) | Eppendorf | ||
| Object slide | Roth | 0656.1 | |
| Petri dish (94 mm) | Greiner Bio-One | 633102 | |
| Pipette tips (200 µL) | Labsolute | 7695844 | |
| Plasticine (Blu-Tack) | Bostik | 30811745 | |
| Stereo microscope (SMZ445) | Nikon | ||
| Stereo microscope with UV lamp, camera, filer set and software (MZ16F, MC170 HD, GFP3, LAS 4.12) | Leica |
Ссылки
- Wang, X., Huang, T., Bu, G., Xu, H. Dysregulation of protein trafficking in neurodegeneration. Molecular Neurodegeneration. 9. 9, 31 (2014).
- Schopf, K., Huber, A. Membrane protein trafficking in Drosophila photoreceptor cells. European Journal of Cell Biology. 96 (5), 391-401 (2017).
- Hardie, R. C. The photoreceptor array of the dipteran retina. Trends in Neurosciences. 9, 419-423 (1986).
- Wang, T., Montell, C. Phototransduction and retinal degeneration in Drosophila. Pflügers Archiv - European Journal of Physiology. 454 (5), 821-847 (2007).
- Xiong, B., Bellen, H. J. Rhodopsin homeostasis and retinal degeneration: lessons from the fly. Trends in Neurosciences. 36 (11), 652-660 (2013).
- Bähner, M., et al. Light-regulated subcellular translocation of Drosophila TRPL channels induces long-term adaptation and modifies the light-induced current. Neuron. 34 (1), 83-93 (2002).
- Cronin, M. A., Lieu, M. -. H., Tsunoda, S. Two stages of light-dependent TRPL-channel translocation in Drosophila photoreceptors. Journal of Cell Science. 119, 2935-2944 (2006).
- Meyer, N., Joel-Almagor, T., Frechter, S., Minke, B., Huber, A. Subcellular translocation of the eGFP-tagged TRPL channel in Drosophila photoreceptors requires activation of the phototransduction cascade. Journal of Cell Science. 119, 2592-2603 (2006).
- Oberegelsbacher, C., Schneidler, C., Voolstra, O., Cerny, A., Huber, A. The Drosophila TRPL ion channel shares a Rab-dependent translocation pathway with rhodopsin. European Journal of Cell Biology. 90 (8), 620-630 (2011).
- Wagner, K., Smylla, T. K., Lampe, M., Krieg, J., Huber, A. Phospholipase D and retromer promote recycling of TRPL ion channel via the endoplasmic reticulum. Traffic. , (2021).
- Franceschini, N., Kirschfeld, K. Les phénoménes de pseudopupille dans l'oeil compose de Drosophila. Kybernetik. 9 (5), 159-182 (1971).
- Pichaud, F., Desplan, C. A new visualization approach for identifying mutations that affect differentiation and organization of the Drosophila ommatidia. Development. 128 (6), 815-826 (2001).
- Smylla, T. K., Wagner, K., Huber, A. Application of fluorescent proteins for functional dissection of the Drosophila visual system. International Journal of Molecular Sciences. 22 (16), (2021).
- Meyer, N. Mechanisms of the light-dependent translocation of the ion channel TRPL in the photoreceptors of Drosophila melanogaster: Dissertation for obtaining the academic degree Dr. rer. nat. University of Karlsruhe (TH). , (2005).
- Meyer, N., Oberegelsbacher, C., Dürr, T. D., Schäfer, A., Huber, A. An eGFP-based genetic screen for defects in light-triggered subcelluar translocation of the Drosophila photoreceptor channel TRPL. Fly. 2 (1), 36-46 (2008).
- Zheng, L., Carthew, R. W. Lola regulates cell fate by antagonizing Notch induction in the Drosophila eye. Mechanisms of Development. 125 (1-2), 18-29 (2008).
- Hibbard, K. L., O'Tousa, J. E. A role for the cytoplasmic DEAD box helicase Dbp21E2 in rhodopsin maturation and photoreceptor viability. Journal of Neurogenetics. 26 (2), 177-188 (2012).
- Huang, Y., Xie, J., Wang, T. A Fluorescence-based genetic screen to study retinal degeneration in Drosophila. PloS One. 10 (12), 0144925 (2015).
- Zhao, H., Wang, J., Wang, T. The V-ATPase V1 subunit A1 is required for rhodopsin anterograde trafficking in Drosophila. Molecular Biology of the Cell. 29 (13), 1640-1651 (2018).
- Xiong, L., et al. ER complex proteins are required for rhodopsin biosynthesis and photoreceptor survival in Drosophila and mice. Cell Death and Differentiation. 27 (2), 646-661 (2020).
- Zhao, H., Wang, T. PE homeostasis rebalanced through mitochondria-ER lipid exchange prevents retinal degeneration in Drosophila. PLoS Genetics. 16 (10), 1009070 (2020).
- Cerny, A. C., et al. The GTP- and phospholipid-binding protein TTD14 regulates trafficking of the TRPL ion channel in Drosophila photoreceptor cells. PLoS Genetics. 11 (10), 1005578 (2015).
- Richter, D. Structural and functional analyses of TRP ion channels in the photoreceptor cells of Drosophila melanogaster: Dissertation for obtaining the academic degree Dr. rer, nat. University of Karlsruhe (TH). , (2007).
- Gambis, A., Dourlen, P., Steller, H., Mollereau, B. Two-color in vivo imaging of photoreceptor apoptosis and development in Drosophila. Developmental Biology. 351 (1), 128-134 (2011).
- Hardie, R. C., Liu, C. -. H., Randall, A. S., Sengupta, S. In vivo tracking of phosphoinositides in Drosophila photoreceptors. Journal of Cell Science. 128 (23), 4328-4340 (2015).
- Chakrabarti, P., et al. A dPIP5K dependent pool of phosphatidylinositol 4,5 bisphosphate (PIP2) is required for G-protein coupled signal transduction in Drosophila photoreceptors. PLoS Genetics. 11 (1), 1004948 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены