Method Article
利用开源移液机器人的高效SARS-CoV-2定量逆转录酶PCR唾液诊断策略
* 这些作者具有相同的贡献
摘要
该协议描述了一种SARS-CoV-2诊断方法,该方法利用开源自动化对唾液样本进行RT-qPCR分子检测。这种可扩展的方法可以应用于临床公共卫生监测,也可以用于提高小型大学实验室的能力。
摘要
最近SARS-CoV-2全球健康危机的出现给流行病学研究和临床试验带来了重大挑战。COVID-19大流行的特点是传播率高,死亡率低,需要准确有效的诊断检测,特别是在寄宿大学等封闭人群中。核酸检测(如鼻咽拭子)的初始可用性受到限制,因为供应链压力也延迟了检测结果的报告。基于唾液的逆转录酶定量聚合酶链反应 (RT-qPCR) 检测已被证明在敏感性和特异性上与其他检测方法相当,并且唾液收集对参与者的物理侵入性较小。因此,我们开发了一种多重RT-qPCR诊断检测方法,用于克莱姆森大学和周围社区的人口监测。该测定利用开源液体处理机器人和热循环仪代替复杂的临床自动化系统来优化工作流程和系统灵活性。基于唾液的 RT-qPCR 的自动化能够快速准确地检测各种病毒 RNA 浓度,满足大规模和小规模的检测需求。对于95%的样品,自动化系统的平均周转时间为9小时<,对于99%的样品,<24小时。当所有试剂都是批量购买时,单次测试的成本为2.80美元。
引言
严重急性呼吸系统综合征相关冠状病毒-2(SARS-CoV-2)是一种新型冠状病毒,于2019年底出现,并迅速在全球人群中传播1。SARS-CoV-2感染导致2019年冠状病毒病(COVID-19),这是一种高度传染性疾病,可能伴有严重的呼吸道和炎症症状。高传播性加上低死亡率表明,该病毒将在人群中迅速传播,需要增加诊断检测2,3。公共卫生建议鼓励进行大规模人群筛查,以隔离病例并随后降低传播率4,5,6。此外,人群监测模型显示,增加检测频率和缩短报告时间对减少传播的影响大于提高检测灵敏度7。这可能是因为受感染的个体可以更早地被隔离,从而打破感染链。
最初的核酸扩增试验(NAAT)标准品是通过RT-qPCR8处理的鼻咽(NP)拭子。然而,这种针对大量人群的测试形式会产生并发症,例如相对成本增加和供应链压力加剧9,10。此外,常见NAAT方法(包括NP拭子,口咽拭子,鼻中拭子和鼻拭子)的标本采集和处理都依赖于专业设备,试剂和医务人员9,10。
基于唾液的检测是NP拭子RT-qPCR检测的充分替代品,这是SARS-CoV-2检测的准确诊断工具11,12,13,14。直接对唾液样品进行RT-qPCR可产生与NP拭子相似的敏感性和特异性15。与NP拭子测试相比,唾液检测的一个主要优点是它允许自我收集标本16。这最大限度地减少了对医务人员的需求,并通过比NP拭子的侵入性更小,最大限度地提高了患者样本收集的便利性。此外,由于唾液样品不需要缓冲液即可从拭子中取出样品(如NP样品),因此基于唾液的测试可以直接利用热基核糖核酸(RNA)提取,从而通过消除对额外缓冲液,转运介质和/或RNA提取试剂的需求来降低测试成本14,17。
克莱姆森大学疾病诊断与干预研究与教育(REDDI)实验室的成立是为了满足该大学对COVID-19检测和监测的需求。在包括大学在内的封闭人群中,频繁的监测检测加上保持社交距离,在疾病流行率流行病学模型中产生了最有利的结果18。调整了合并后的CDC 2019-nCOV RT-qPCR19和SalivaDirect14方案,并在临床工作流程中利用自动化来降低成本并缩短周转时间。之前的小组曾使用开源液体处理机器人进行SARS-CoV-2 RNA提取步骤20,21,但我们最大限度地利用机器人来准备测试板和加载标本22。在这里,我们表明,适应的方案和开源液体处理系统的利用(图1)允许快速准确地基于唾液的RT-qPCR,并且是大规模公共卫生监测的有效策略。
研究方案
所有研究均符合克莱姆森大学和Prisma健康机构审查委员会(Prisma Health IRB # Pro00099491,2020年7月1日)的规定。
1. 设置开源液体处理机器人
- 根据制造商的说明,将高效微粒空气(HEPA)过滤模块(见 材料表)安装到每个液体处理机器人的顶部。
- 根据制造商的说明,将 8 通道 P20 移液器连接到预混板制备机器人的左侧安装座上。
- 按照制造商的说明,将P20移液器连接到样品装载机器人的右侧安装座上。
- 在相应的计算机上下载自定义 Python 脚本(补充文件 1 和 补充文件 2)。
- 打开 TigerSaliva Full 384 Loading.py 在桌面应用程序中的样品加载机器人计算机。 单击校准 ,然后根据软件说明设置移液器和程序。
- 在主混音机器人计算机的桌面应用程序中打开 12 完整 Plates.py 。 单击校准 ,然后根据软件说明设置移液器和程序。
- 使用计算机辅助设计 (CAD) 文件 (https://www.myminifactory.com/object/3d-print-141363) 使用熔融沉积建模三维 (3D) 打印机打印自定义样品架。每个样品装载机器人打印16个架子,用于两套八个架子。
2. 制备20倍多路复用N1+P1探针/底漆混合物
- 在远离合成SARS-CoV-2 RNA或患者标本的无菌环境中,在50 mL锥形管中制备一批20x多重N1 + P1探针/引物混合物(总体积为20 mL, 表1)。
- 使用血清学移液管将1.6mL混合物等分到无菌的2.0 mL离心管中并适当标记。
- 将等分试样储存在-20°C冰箱中,直到准备使用。
3. 阳性对照混合物的制备
注意:阳性对照混合物不应在与探针/底漆混合物或其他预混料组分相同的无菌环境中制备。应使用单独的无核酸酶水容器。
- 通过将10μL储备溶液加入990μL无核酸酶水中,将SARS-CoV-2合成RNA(N1)从1,000,000个基因拷贝/μL(cpμ)稀释至10,000 cpμ。将25μL10,000 cpμ等分到无菌的0.2mL管中并适当标记。将未使用的等分试样储存在-80°C。
注意:合成RNA必须储存在-80°C以防止降解。 - 通过将50μL储备溶液加入950μL无核酸酶水中,将合成DNA(P1)从200,000 cpμ稀释至10,000 cpμ Hs_RPP30合成DNA(P1)。将25μL10,000 cpμ等分到无菌的0.2mL管中并适当标记。将未使用的等分试样储存在-80°C。
- 将20μLSARS-CoV-2和Hs_RPP30 10,000cpμ储备液加入960μ无核酸酶水中,将每种组分稀释至最终浓度为200 cpμ,共1000μL。将等分试样储存在-80°C,直到准备使用。
4. 预混板的制备
注意:在远离合成SARS-CoV-2 RNA或患者标本的无菌环境中制备预混液。所有组分在添加到混合物之前必须完全解冻;如果没有适当的解冻,浓度可能不正确。解冻不足表现为存在冰或试剂颜色不均匀。在准备混合物时储存在冷冻块上。
- 在50 mL锥形管中准备一批多重预混液(总体积为48 mL, 表2)。
- 通过将管翻转3倍来均质化混合物。不要通过上下移液或涡流来混合,因为这会损害酶。
- 通过将1.48 mL预混液转移到每个孔中,填充无菌96孔深井储液器的1-4柱。一个 50 mL 锥形柱填充四个色谱柱,足够 12 个板。
- 用铝箔密封覆盖深井储层,并将其放置在专用的预混液处理机器人中。将填充的深井储层放置在甲板10上,在甲板1-6上放置六个空的384孔板,将P20尖端箱放在甲板11上。揭开深孔板和尖端箱并关闭机器人。
- 通过单击机器人桌面应用程序中的 "开始运行" 来初始化自定义 Python 操作协议。
- 40分钟后,跑步将暂停。用铝箔密封覆盖填充的384孔板,同时它们留在机器人中,并用滚筒向下按压以确保粘附。使用批次标识符标记每个印版的边缘。
- 将六个新的空384孔板放在甲板1-6上,然后单击恢复 运行来恢复操作协议。运行完成后,用箔密封覆盖最后一组384孔板。
- 将剩余的2μL预混液移入空的384孔板的1-3柱和22-24柱中,用于批量质量控制。用光学透明密封并在热循环器上运行(第10.1-10.2节)。如果任何油井具有 N1 阈值循环 (Ct) 值,或者如果超过 10 口油井具有 P1 Ct 值,则该批次受到污染,无法使用。
- 将制备的预混板储存在4°C,并在制备后7天内使用。
5. 样品采集、进取和热处理
- 指导参与者在收集唾液前30分钟避免进食,饮水,吸烟或进行牙齿卫生。指导参与者收集至少1毫升天然积聚在口腔中的唾液,并将其沉积到不含防腐剂的无菌50毫升锥形管中,然后盖上管子(补充文件3)。
- 用70%乙醇或消毒湿巾消毒唾液收集管的外部,并将其转移到实验室进行测试。
- 通过将每个样品条形码扫描到每日摄入量电子表格(补充文件4)中来记录样品到达情况。
- 在95°C的烘箱中对扫描的样品进行30分钟的热处理。戴上耐热手套时取出样品。
注:未经处理的样品在室温(23°C)下稳定长达72小时。一旦热处理,如果不立即处理,样品必须储存在4°C。
6. 示例分配
- 在样品分配站的计算机上打开每个样品装载机器人的每日样品装载电子表格(补充文件5)。
- 将188个样品分配给每个384孔板,如下所示:样品1-48被视为第1季度,样品49-96被视为第2季度,样品97-144被视为第3季度,样品145-188被视为第4季度。样品一式两份分析。
- 为托盘贴上标签,并附上印版名称、日期和季度编号。将样品按顺序扫描到样品加载电子表格中。
注意:早期板的样品可能需要手动运行,如图 3所示。有关手动样品分配和加载说明,请参阅第 8.1-8.3 节。
7. 操作样品装载机器人
- 在样品装载站,排列两套完整的八个3D打印架,对应于机器人中的甲板位置。
- 拆下四分之一管的盖子并放置在3D打印的机架中,从机架1中的位置A1开始。从左到右,从上到下填充每个机架。在机架 2 中继续此加载模式,然后转到机架 4 和 5(请参阅 图 2C)。
注:由于机器人程序参数,机架不连续编号。 - 将装载的四分之一样品架放在甲板1,2,4,5,7,8,10,11上。将 P20 吸头放在甲板 3 和 9 上。为了简化设置过程,将材料从后到前装载到机器人中。
- 从4°C取一个预制的预混料板,用板名标记它,并使用锋利的刀片在控制井周围的箔片上切割一条线(N23 /24,O23/24和P23/24)。
- 将预混板放在甲板6上,剥开铝箔盖,留下覆盖控制孔的小矩形。揭开吸头盒并关闭机器人。
- 通过机器人桌面应用程序单击 "开始运行" 来初始化自定义 Python 操作协议。每个季度需要24.5分钟才能加载到盘子上;设置计时器作为提醒。
- 当机器人运行时,如第7.2节所述,将第四分之一的2个样品管打开并加载到第二组3D打印架中。
- 当机器人暂停时,取下第 1 季度机架,并用第 2 季度机架替换它们。单击桌面应用程序中的 恢复运行 。
- 回顾第1季度样品管,并将其储存在4°C冰箱中,同时等待结果。
对季度 3 和 4 重复此加载过程。 - 将装载的板转移到生物安全柜中。为尽量减少污染,请在转移过程中盖上板材。
8. 手动上样
注意:在机器人加载不足的情况下,对重复样品执行一次手动运行(N1重选或重试,见 图3)。
- 收集所有重复的样本,并将其指定为第 4 季度的最后一个样本(请参见第 6.2 节)。对样品进行编号,扫描条形码,并在样品加载电子表格中输入原始样品位置和结果。
- 将重复样品转移到生物安全柜中。不要将重复的样品管装载到机器人装载架中。
- 按照板布局图将每个重复样品的2μL移液到正确的孔中(补充文件6)。使用指定的移液器添加患者样本。在添加样品时,保持控制孔覆盖铝箔,以尽量减少污染。
9. 在测试板上添加控制装置
- 使用镊子剥离控制孔上的铝箔盖。
- 将2μL无核酸酶水(无模板对照)移液到N23-N24孔中,将2μL200 cpμ混合阳性对照(参见第3节)移液到O23-O24孔中。将2μL确认阳性患者样品移入M23-M24孔中作为附加对照。将孔P23-P24留空以监测预混料批次质量。
- 用光学透明密封覆盖板,并使用涂药辊将密封粘附在所有孔上。以2500 rpm的速度涡旋板30秒以彻底混合。将板以500× g 离心1分钟。
10. 执行 RT-qPCR
- 根据所述条件在热循环器软件中创建协议程序(表3)。保存实验方案以备将来使用。将密封板放入热循环器中并运行协议。
- 将 Ct 值导出为 .xslx 文件,并将这些值复制到示例加载电子表格(补充文件 5)中。
注:这些图纸是为制造商软件的Ct输出文件定制设计的,可能需要修改才能接受其他格式。
11. 确定板的有效性
- 验证阳性对照和/或已知的阳性样品以及阴性对照,以将板结果视为有效。使用以下标准评估对照井。
- 对于阳性对照,检查是否至少有一个阳性对照孔(O23 / O24)为P1和N1探针产生22-28之间的Ct值。或者,已知的阳性样品孔(M23/M24)在P1和N1探头上产生<33的P1和N1 Ct值。
- 对于阴性对照,检查两个阴性对照孔(N23/N24)中的任何一个中没有N1或P1 Ct值。在使板失效之前,请确认Ct值具有有效的扩增曲线。
12. 解释示例结果
- 按照图表(图3)确定患者结果并报告解决的样本。
- 将 P1 结果评估为有效或无效。如果 P1 产生 Ct <33 的结果,则考虑有效井,然后继续得到 N1 的结果。如果 P1 产生 Ct >=33 或无 Ct 值的结果,则认为井 INVALID。
- 将 N1 结果评估为"是"、"否"或"否"*。如果 N1 产生 Ct <33 的结果,则该井为 YES。如果 N1 不产生 Ct 值,则井为 NO。如果 N1 产生 Ct >=33,则该井为 NO*。确认所有 N1 Ct 值都与实际扩增曲线相关联。如果 N1 的 Ct 值没有扩增曲线,则孔为 NO。
- 识别重复样品(N1重选或重试),用内部样品编号和样品类型标记它们,并将它们返回到加载工作流程(第8.1-8.3节)。
- 将 P1 结果评估为有效或无效。如果 P1 产生 Ct <33 的结果,则考虑有效井,然后继续得到 N1 的结果。如果 P1 产生 Ct >=33 或无 Ct 值的结果,则认为井 INVALID。
13. 实验室清理
- 液体处理机器人
- 用中级消毒剂清洁所有侧面。不要使用乙醇,因为它会降解塑料。
- 用酒精(70%乙醇或100%异丙醇)擦拭移液器吸头端和垃圾箱。擦拭键盘和鼠标。
- 生物安全柜
- 用中级消毒剂清洁所有表面。打开紫外线15分钟。
结果
我们确定了RT-qPCR探针和引物对SARS-CoV-2(N1)和Hs_RPP30(P1)的合成核酸含量的检测范围。对水中已知浓度的合成SARS-CoV-2 RNA和合成Hs_RPP30 DNA进行了10倍连续稀释。使用以下公式将分子量转换为基因拷贝数
基因拷贝数 = (ng * 6.0221 x 1023)/(碱基对长度*660 g/摩尔) *1 x 109 ng/g)
并进行了RT-qPCR。在进行RT-qPCR后,N1检测(图4A)和P1检测(图4B)的线性曲线在广泛的基因拷贝浓度范围内显示出良好的相关系数(分别为R2 = 0.9975和R2 = 0.9884)。该结果表明,引物和探针组的组合不是抑制性的,可以在一个基因拷贝/μL(Cq=33)下准确检测SARS-CoV-2 RNA。一个基因拷贝大致相当于一个病毒拷贝;然而,由于RT-qPCR的半定量性质,我们没有确定唾液中的定量病毒拷贝数。我们试图通过将已知浓度的合成SARS-CoV-2 RNA峰值到无病毒唾液(热处理和非热处理)中来模拟阳性唾液样品,但无法在低浓度RNA下产生N1扩增(数据未显示)。这可能是由于RNase降解或其他混杂因素。
还评估了自动和手动上样方法之间的测定间和测定内差异。为了评估测定间的变异性,使用手动(在第8.1-8.3节中描述的)和自动(如第7.1-7.11节所述)方法上样20个独特的阳性样品。比较N1 Ct值以确定液体处理机器人和手动样品装载是否产生等效结果(图5A)。手动和自动方法之间的线性关系产生了高相关系数(R2 = 0.9088),表明两种方法在功能上是等效的。随着N1 Ct值的增加,Ct值的变异性也随之增加。这种趋势可能是由于唾液中病毒颗粒的非均质分布,当存在较少的颗粒时,这种分布更为明显。为了评估测定内的变异性,使用两种样品上样方法对来自独特唾液样品的重复孔的N1 Ct值进行了比较(图5B)。自动上样重复(R2= 0.9622)之间的线性关系产生的相关系数略高于手动上样(R2= 0.9589),表明SARS-CoV-2检测对于两种上样方法都具有很高的再现性。
最后,根据热处理方法对唾液粘度降低进行了评估(图6)。唾液来自单一来源,以消除样品变异性。在一种热处理方法中,P1 Ct 值的较大变异性可能表明样品粘度较高,因为粘性唾液无法精确吸出和分配。与无处理对照相比,30分钟和60分钟热处理方法产生的样品变异性显着降低(分别为p = 0.0006和p = 0.0429)。30分钟和60分钟治疗之间没有显着差异(p = 0.2245);因此,实施了30分钟的热处理方法,以减少处理时间。
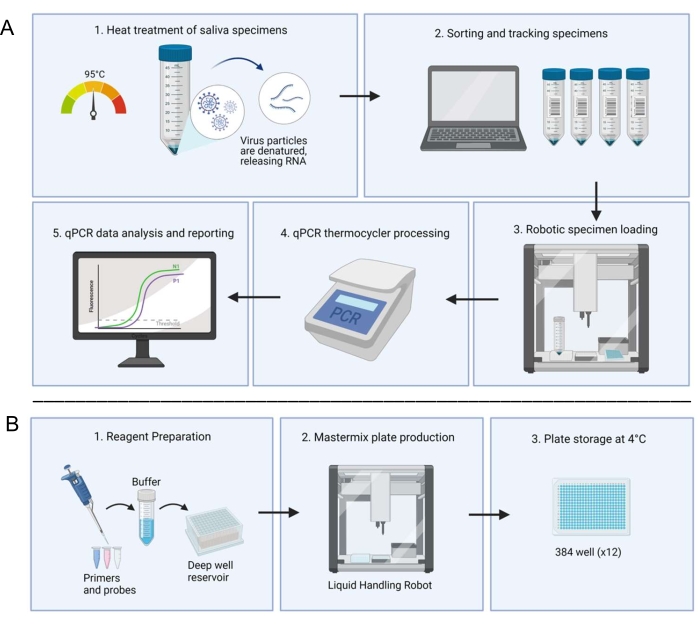
图1:利用基于唾液的RT-qPCR诊断系统的实验室工作流程 。(A)收集样品并在95°C下热处理30分钟。通过内部电子表格系统对处理过的样本进行分类,并根据患者信息进行跟踪。液体处理机器人将样品加载到制备的预混板的重复孔中。技术人员手动加载控制装置,密封板,然后将板放入热循环仪中进行处理。结果通过自动计算机系统进行分析,并由技术人员进行验证。(B)技术人员准备预混液的试剂,这些试剂被添加到无菌生物安全柜中的深井储液器中。填充的深井储层被装载到专用的液体处理机器人中。完成的板用箔密封,贴上标签,储存在4°C。 请点击这里查看此图的大图。
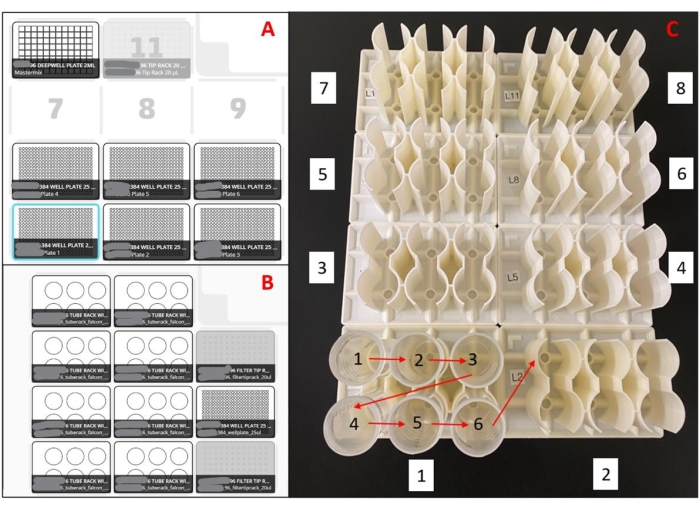
图 2:用于液体处理机器人的布局。 (A) 预混板制备机器人的甲板布局。使用八通道移液器,机器人被编程为拾取移液器吸头,从96孔深井储液器中吸入预混液,将预混液分配到空的384孔板中,并将移液器吸头喷射到垃圾箱中。每次运行重复六个板。(B) 样品装载机器人的甲板设置。使用单通道移液器,机器人被编程为拾取移液器吸头,吸出唾液样品,将唾液样品分配到384孔预混合板的重复孔中,并将移液器吸头喷射到垃圾箱中。每次运行重复 48 个样本。(C)3D打印架的样品管装载订单。红色箭头表示机架内的装载顺序,白色框内的数字表示整套机架的装载顺序。整个装置将一式两份的188个样品加载到384孔板中。 请点击此处查看此图的放大版本。
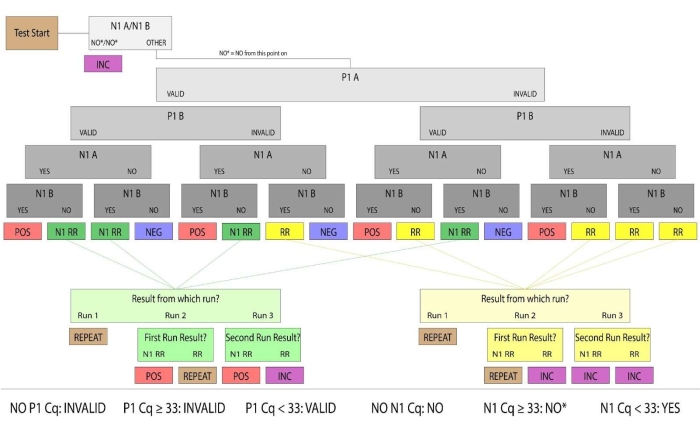
图 3:示例生成的流程图。 具有有效P1和阳性N1的样本被确定为SARS-CoV-2阳性的人唾液样本。有效和阳性/阴性样本结果被认为是决定性的。在第一次运行中未产生结论性结果的样本被归类为重新运行(表示为 RR)或 N1 重新运行(表示为 N1 RR)。重选样本没有有效的P1扩增,N1重选样本在单个重复中具有阳性N1扩增。如果随后的手动运行无法产生有效的P1扩增,或者两次重复的N1 Ct值都高于正阈值(Ct >33),则样品结果被认为是不确定的。出于临床目的,未到达实验室,唾液量不足或受损的患者样本被视为无效。 请点击此处查看此图的放大版本。
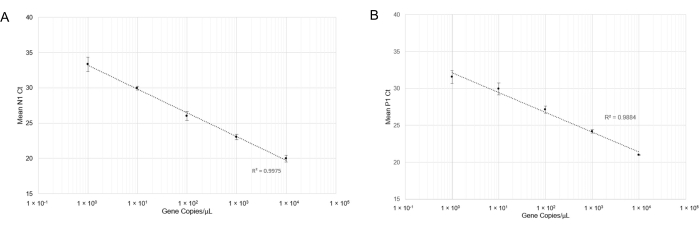
图4:N1(SARS-CoV-2)合成RNA和P1(Hs_RPP 30)合成DNA的RT-qPCR检测。使用标准偏差绘制标准曲线,以确定使用此探针/引物组合的精确检测范围。(A)将各自稀释液中获得的平均Ct值(n = 4)与合成RNA的估计数量(10μLRT-qPCR反应中的1x100至1x104 RNA拷贝)绘制对比图。(B)将各自稀释液中获得的平均Ct值(n = 3)与合成DNA的估计数量(10μLRT-qPCR反应中的1×100至1×104个基因拷贝)绘制。请点击此处查看此图的放大版本。
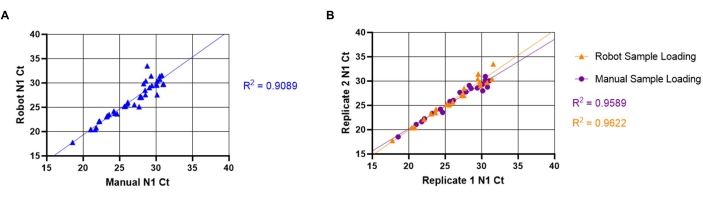
图5:手动和自动唾液转移SARS-CoV-2(N1)Ct值之间的比较。已知的SARS-CoV-2阳性唾液样品(n = 20)由液体处理机器人一式两份加载到RT-qPCR预混板中。对于 N1,样品的 Ct 值范围为 18-32。然后将相同的样品手动加载到不同板位的重复孔中。(A)使用机器人和手动样品上样从独特样品中获得的N1 Ct值被转置,以确定手动和机器人上样之间的测定间变异性。(B)通过使用从机器人和手动样品上样获得的N1 Ct值的转置重复来确定测定内变异性。请点击此处查看此图的放大版本。
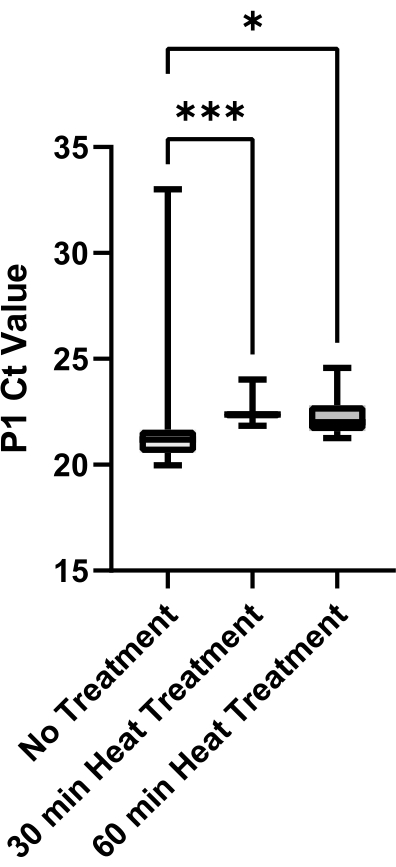
图6:唾液降粘热处理方法的评价。 从单一来源收集SARS-CoV-2阴性唾液,并在95°C下对等分试样进行0分钟,30分钟或60分钟热处理。 绘制来自每种条件的技术重复(n = 12)的P1 Ct值,以确定治疗方法之间的差异。使用不成对的t检验评估组间的成对比较(***表示p <0.001,*表示p <0.05)。 请点击此处查看此图的放大版本。
补充图1:低P1 Ct唾液样品中N1 Ct的比较。 选择P1 Ct含量低的阳性样品,并与N1 Ct (n = 106)进行比较。N1 Ct值的范围为14-33,表明该测定在唾液样品中的动态范围与标准曲线相当。 请点击此处下载此文件。
| 元件 | 序列 (5'→3') | 库存集中度 | 卷 | ||
| 2019-nCoV-N1 探头 | /5FAM/ACCCCGCAT/ZEN/TACGTTTGGTGGACC/3IABkFQ | 50 微米 | 500 μL | ||
| 2019-nCoV-N1-用于 | 加克斯卡亚特卡加特 | 100 微米 | 2000 μL | ||
| 2019-nCoV-N1-修订版 | TCTGGTTACTGCCAGTTGAATCTG | 100 微米 | 2000 μL | ||
| Hs RPP30 Cy5 探头 | /5Cy5/TTCTGACCT/ZEN/GAAGGCTCTGCG/3IABkFQ | 50 微米 | 500 μL | ||
| Hs-RPP30-用于 | AGATTTGGACCTGCGAGCG | 100 微米 | 2000 μL | ||
| Hs-RPP30 修订版 | GAGCGGCTGTCTCCACAAGT | 100 微米 | 2000 μL | ||
| 水 | - | - | 11000 μL | ||
表1:N1 + P1探针/底漆混合物的成分。
| 元件 | 库存集中度 | 每次反应体积 | 最终浓度 | 批量量 | ||
| Luna WarmStart RT Enzyme Mix | 20 倍 | 0.5 μL | 1 倍 | 3 毫升 | ||
| Luna缓冲液反应混合物 | 2 倍 | 5.0 μL | 1 倍 | 30 毫升 | ||
| N1+P1 底漆/探头混合物 | nCoV N1 F: 10 μM | 0.5 μL | 500 毫安 | 3 毫升 | ||
| nCoV N1 R: 10 μM | 500 毫安 | |||||
| 探头 nCoV N1: 2.5 μM | 125 纳米 | |||||
| RPP_30 P1 F: 10 μM | 500 毫安 | |||||
| RPP_30 P1 R: 10 μM | 500 毫安 | |||||
| 探头RPP_30 P1: 2.5 μM | 125 纳米 | |||||
| 无核酸酶水 | --- | 2 μL | --- | 12 毫升 | ||
| 小计 | --- | 8 μL | --- | 48 毫升 | ||
| 模板 | 2 μL | |||||
表2:多重SARS-CoV-2预混液的组分。
| 阶段 | 温度(°C) | 期间 | 周期数 |
| 反转录 | 55 | 10 分 | 1 |
| 初始变性 | 95 | 1 分钟 | 1 |
| 触地得分 | 95 | 10 秒 | 3 |
| 72 | 30 秒 | ||
| 95 | 10 秒 | 3 | |
| 69 | 30 秒 | ||
| 95 | 10 秒 | 3 | |
| 66 | 30 秒 | ||
| 主扩增 | 95 | 10 秒 | 40 |
| 65 | 30 秒 |
表3:触地RT-qPCR协议。一步法RT-qPCR SARS-CoV-2诊断测定的热循环条件。
| 着陆步骤 | 无触地步骤 | |||
| 平均 N1 Ct | 平均 P1 Ct | 平均 N1 Ct | 平均 P1 Ct | |
| 示例 1 | 19.65 | 22.7 | 27.8 | 28.3 |
| 示例 2 | 22.24 | 24.9 | 28.77 | 30.5 |
| 示例 3 | 18.85 | 19.2 | 24.65 | 25.9 |
| 示例 4 | 25.56 | 22.8 | 31.93 | 29.2 |
| 示例 5 | 22.34 | 24.8 | 38.48 | 40.0(失败检测) |
表4:五个阳性样本的着地Ct值与无触地Ct值的比较。
| 样本 | 老虎萨利瓦 | 市售唾液基SARS-CoV-2检测 | ||
| N1 克拉 | P1 克拉 | 新冠肺炎价值 | RNaseP 值 | |
| D11型 | 16.4 | 18.1 | 20.86 | 23.4 |
| E11 | 18.9 | 19.1 | 25.6 | 21.2 |
| F11系列 | 19.5 | 18.4 | 22.8 | 22.2 |
| G11 | 22.2 | 19.1 | 23.7 | 22.9 |
| H11 | 26.4 | 21.3 | 32.2 | 26.7 |
| 答12 | 14.8 | 16.5 | 29.15 | 19 |
| 维生素 B12 | 24 | 19.6 | 31.05 | 21.35 |
| C12型 | 14.9 | 17.5 | 20.84 | 18.9 |
表5:TigerSaliva Ct结果与市售唾液类SARS-CoV-2测定结果的比较。两种测定均在相同的唾液样品上进行(n = 8)。
补充文件 1:用于创建机器人预混板的自定义脚本。请单击此处下载此文件。
补充文件 2:用于在样品装载机器人上进行唾液处理的自定义脚本。请单击此处下载此文件。
补充文件3:参与者自我收集高质量唾液样本的说明。 有关更多详细信息,请参阅 https://www.clemson.edu/centers-institutes/reddilab/index.html 提供的测试过程的简短视频说明。 请点击此处下载此文件。
补充文件 4:样本摄入电子表格。请单击此处下载此文件。
补充文件 5:加载电子表格示例。请单击此处下载此文件。
补充文件6:样本384孔板布局图。请点击此处下载此文件。
讨论
通过独立的验证研究评估方案中描述的测定。发现,当对同时采集的配对鼻咽拭子进行评估时,该测定具有98.9%的特异性(1.1%假阳性)和90.0%的敏感性(10.0%假阴性)(n = 837;817阴性,20阳性)。重要的是,三名TigerSaliva检测呈阳性,鼻咽拭子检测呈阴性的参与者在48小时后用拭子重新检测并返回阳性结果,表明TigerSaliva可能能够在病程的早期检测到SARS-CoV-2感染。
我们通过用已知浓度的SARS-CoV-2合成RNA对无病毒唾液(热处理和非热处理)进行峰值来模拟阳性唾液样本,并进行10倍稀释以确定唾液中的Ct限值。在模拟阳性样本中,N1基因在10,000个基因拷贝(约Ct = 28)以下无法检测到。我们怀疑这是由于RNase降解或其他混杂因素。然而,唾液RNases与裸合成RNA的相互作用可能与与病毒颗粒的相互作用不同,即使它们已被热变性。Ct >30 鉴定出阳性唾液样本,外部实验室从这些样本中获得了 SARS-CoV-2 基因序列数据。我们推测,病毒蛋白可以防止患者唾液样本中的RNA降解。
该协议中最关键的步骤是实施预混液制备和唾液样品处理的自动化(分别为第4节和第7节)。这允许重叠的任务流程,从而大大减少了周转时间。另一个关键步骤是临床结果解释(第11节和第12节)。建立中间结果类别(重新运行和 N1 重新运行)也最大限度地减少了不确定测试结果的发生。
我们证明了手动和自动唾液样品上样方法之间的差异可以忽略不计(图5A),并且自动化可以提高SARS-CoV-2检测的可重复性(图5B)。在设计和扩展临床实验室时,应优先采用自动化,以方便测试25。通过实施机器人自动化任务,实验室工作流程得到改进26。液体处理机器人的开源功能允许实现协议设计的自定义脚本。与传统的临床自动化方法相比,这使得液体处理机器人成为一种廉价且高度可修改的系统。它也是执行高度重复性实验室任务的理想策略。该系统的高度可定制性转化为在短缺的情况下自由更换实验室器具(例如,收集管,移液器吸头或384孔板)。因此,使用液体处理机器人的自动化对于大规模和小规模的监测和研究都是可行的。
这种测试策略的一个主要优点是相对于其他临床实验室的周转时间要短得多。自动液体处理机器人的利用在缩短周转时间方面起着关键作用,但同时使用机器人和热循环器也有助于最大限度地提高测试效率。一个机器人和热循环器应成对操作,其中两台机器串联使用,以实现不间断的样品上样和样品结果分析。一旦建立了稳定的指定样品流,所有机器对就可以同时操作。机器人和热力循环仪的持续同时使用大大提高了测试能力和效率,这对于适应高测试量至关重要。
与其他已建立的SARS-CoV-2 RT-qPCR方案相比,我们在热循环器方案中加入了一个触地步骤,以改善探针和引物组对靶基因的退火27,从而降低扩增失败的风险。结果表明,着陆改善了阳性样品的检测,而不会有失去特异性引物结合的风险(表 4)。我们确定,RT-qPCR测定可以同时检测广泛的SARS-CoV-2 RNA拷贝(图4A)和Hs_RPP30 DNA拷贝(图4B)。
液体处理机器人的一个局限性是在唾液转移过程中可能从阳性样品中交叉污染。唾液是一种粘弹性液体28,从移液器吸头分配后,可能会穿过相邻的孔。此外,唾液29的异质性可能导致病毒颗粒在整个样品中的分布不均匀。这增加了假阳性和假阴性的可能性,需要指定 N1 重新运行和重新运行样本。然而,最初被指定为N1 Rerun的样本中有14.1%被解析为SARS-CoV-2阳性,并且在重新检测后比重新运行样本解析为阳性的可能性高出30倍以上。因此,将Rerun与N1 Rerun(图3)区分开来可以更准确地分离潜在的阳性样品,从而提高诊断测定的灵敏度和特异性。用于诊断性唾液检测的其他结果参数没有做出这种区分12,14,24,30,31。
由于异质性和粘度,唾液样本可能难以移液32。热处理可充分使唾液生物母细胞中的蛋白质变性,降低粘度并消除对RNA提取试剂的需求9,而RNA提取试剂在大流行的早期阶段是稀缺的10。扩展的热处理还可以灭活现有的病毒33,从而允许在较低的生物安全水平上进行实验室处理。因此,实施了基于热的RNA提取(如第5.4节所述)以通过蛋白质变性降低粘度(图6)。根据结果,我们假设热处理除了使蛋白质生物矩阵变性外,还可以使唾液样品变质。其他组将热处理和蛋白酶K处理相结合,以增加均质性9,14,34。我们选择不实施这一步骤,因为它可能会使病毒粒子蛋白变性,其速度会使病毒RNA暴露于热降解35。此外,用蛋白酶K稀释样品可以掩盖含有较少病毒颗粒的阳性样品,从而降低灵敏度。此外,将测定结果与使用磁珠RNA提取的市售唾液基SARS-CoV-2测定(Logix Smart COVID-19)进行了比较(表 5)。研究发现,与市售检测方法相比,目前的检测方法更适合检测弱阳性样品。
仅使用RT-qPCR很难量化唾液中的病毒拷贝数,因为qPCR是半定量的。由于技术限制,Ct 值之间存在固有的差异。基因拷贝数可以从Ct值确定(图4),大致相当于病毒拷贝数。确定唾液样品中病毒拷贝数的一种可能的解决方案是ddPCR,它可以对反应中的基因拷贝进行硬定量。但是,我们认为,向临床医生提供定性结果是足够的,并且可以在使用我们的方法处理的样本中比较相对病毒含量。
尽管在使用唾液时会出现一些限制,但通过基于唾液的RT-qPCR进行的SARS-CoV-2测定被证明是在任何测试规模下快速可靠地检测病毒RNA的有效方法。当结合使用开源液体处理系统时,尤其如此。可以修改此检测方法以检测与诊断相关的其他核酸序列,例如传染病病原体,疾病标志物或其他病毒。这使得该测定适用于临床和研究诊断工作。
披露声明
作者没有什么可透露的。协议中描述的测定属于耶鲁大学公共卫生学院提交的SalivaDirect EUA。
致谢
作者感谢克莱姆森的行政部门,医务人员和REDDI实验室的临床实验室员工,他们帮助实施和管理SARS-CoV-2检测。我们感谢南卡罗来纳大学的Phillip Buckhaults博士和Carolyn Bannister博士为设备采购提供初步项目咨询和行业联系。我们感谢许多学生,教授和工作人员在样本收集方面的帮助。感谢创意探究学生的标准曲线数据收集。这项研究的资金来自美国国立卫生研究院拨款P20GM121342(授予DD和LGP),克莱姆森体育系,克莱姆森大学研究副总裁以及南卡罗来纳州州长和联合债券审查委员会。
材料
| Name | Company | Catalog Number | Comments |
| 100% EtOH | Fisher scientific | 22-032-601 | |
| 20 uL Filtered Pipette Tips | Opentrons | 20uL tips | |
| 2mL Microcentrifuge Tubes | Fisher Scientific | 14-666-313 | Alternate product may be used |
| Armadillo PCR Plate, 384-well, clear, white wells | Thermo Scientific | AB3384 | Alternate product may be used |
| Celltreat 2mL 96 Deep Well Plates | Fisher Scientific | 50-828-743 | For mastermix preparation |
| Clear PCR Sealing Sheets | Thermo Scientific | AB0558 | Alternate product may be used |
| DPEC Treated Water | Ambion (Thermo Scientific) | AM9916 | |
| Flip Cap 50 mL Conical Tubes | VWR | 75845-210 | For sample collection |
| Foil PCR Sealing Sheets | Thermo Scientific | AB0626 | For storage of mastermix plates, Alternate product may be used |
| HS_RPP30 Synthetic DNA | Integrated DNA Technologies | 299788131 | P1 positive control |
| Luna Buffer Probe One-Step Reaction | New England Biolabs | M3006B | |
| Luna WarmStart RT Enzyme Mix | New England Biolabs | M3002B | |
| nCOV_N1 Forward Primer, 100 nmol | Integrated DNA Technologies | 10006830 | |
| nCOV_N1 Probe Aliquot, 50 nmol | Integrated DNA Technologies | 10006832 | Probe can be synthesized by other vendors with SYBR or FAM fluophores |
| nCOV_N1 Reverse Primer, 100 nmol | Integrated DNA Technologies | 10006831 | |
| Opentron HEPA Filter Module | Opentrons | N/A | Not required, but useful to reduce contamination |
| Opentron Multichannel Attachment, P20 | Opentrons | 999-00005 | For mastermix preparation |
| Opentron OT-2 Liquid Handling Robot | Opentrons | OT-2 | |
| Opentron Pipette Attachment, P20 | Opentrons | 999-0000215 | For sample loading |
| Oven | Memmert | UF450 PLUS 208V-3PH | |
| PCR Tubes (rnase, dnase free) | Fisher Scientific | 14-230-225 | For aliquots of positive and neg controls |
| PolarSafe Aluminum Cooling Block, 15-Well (1.5/2.0 mL Tubes) | VWR | 10808-952 | |
| PolarSaf Aluminum Cooling Block, 24-Well (0.5mL tubes) | VWR | 10808-956 | |
| RNAse P (ATTO 647) Probe, 50 nmol | Integrated DNA Technologies | 10007062 | Probe can be synthesized by other vendors with Cy5 fluorophore |
| RNAse P Forward Primer, 100nmol | Integrated DNA Technologies | 10006836 | |
| RNAse P Reverse Primer, 100 nmol | Integrated DNA Technologies | 10006837 | |
| Sars-CoV-2 Synthetic RNA Control 2 | Twist Biosciences | 102024 / 103907 / 103909 | N1 Positive Control |
| Scanners | Code | CR1500 | Only required when scaling up |
| Small HEPA Filtered Hood | Erlab | Captair Bio 321 | For mastermix preparation |
| Thermocycler CFX384 Touch | Biorad | CFX384 Touch | Alternate models can be used, e.g. CFX384 Opus |
| X-acto Knife Set | Staples | N/A | To cut foil for keeping control wells covered |
参考文献
- Zhu, N., et al. A novel coronavirus from patients with pneumonia in China, 2019. New England Journal Medicine. 382 (8), 727-733 (2020).
- Chen, J. Pathogenicity and transmissibility of 2019-nCoV-A quick overview and comparison with other emerging viruses. Microbes and Infection. 22 (2), 69-71 (2020).
- Petersen, E., et al. Comparing SARS-CoV-2 with SARS-CoV and influenza pandemics. The Lancet. Infectious Diseases. 20 (9), 238-244 (2020).
- Honein, M. A., et al. Summary of Guidance for Public Health Strategies to Address High Levels of Community Transmission of SARS-CoV-2 and Related Deaths, December 2020. MMWR. Morbidity and Mortality Weekly Report. 69 (49), 1860-1867 (2020).
- World Health Organization. Surveillance strategies for COVID-19 human infection: interim guidance. World Health Organization. , Available from: https://apps.who.int/iris/handle/10665/332051 (2020).
- Screening testing for early detection of SARS-CoV-2 infection. Division of viral diseases. Centers for Disease Control. , Available from: https://www.cdc.gov/coronavirus/2019-ncov/hcp/tsting-overview.html#PublicHealthSurveillance (2020).
- Larremore, D. B., et al. Test sensitivity is secondary to frequency and turnaround time for COVID-19 screening. Science Advances. 7 (1), 5393(2021).
- Sethuraman, N., Jeremiah, S. S., Ryo, A. Interpreting Diagnostic Tests for SARS-CoV-2. JAMA. 323 (22), 2249-2251 (2020).
- Chu, A. W., et al. Evaluation of simple nucleic acid extraction methods for the detection of SARS-CoV-2 in nasopharyngeal and saliva specimens during global shortage of extraction kits. Journal of clinical virology: the official publication of the Pan American Society for Clinical Virology. 129, 104519(2020).
- Guan, D., et al. Global supply-chain effects of COVID-19 control measures. Nature Human Behaviour. 4 (6), 577-587 (2020).
- Bastos, M. L., Perlman-Arrow, S., Menzies, D., Campbell, J. R. The Sensitivity and Costs of Testing for SARS-CoV-2 Infection With Saliva Versus Nasopharyngeal Swabs: A Systematic Review and Meta-analysis. Annals of Internal Medicine. 174 (4), 501-510 (2021).
- Pasomsub, E., et al. Saliva sample as a non-invasive specimen for the diagnosis of coronavirus disease 2019: a cross-sectional study. Clinical Microbiology and Infection: The Official Publication of The European Society of Clinical Microbiology and Infectious Diseases. 27 (2), (2021).
- To, K. K., et al. Consistent Detection of 2019 Novel Coronavirus in Saliva. Clinical Infectious Diseases: An Official Publication of The Infectious Diseases Society of America. 71 (15), 841-843 (2020).
- Vogels, C. B., et al. SalivaDirect: A simplified and flexible platform to enhance SARS-CoV-2 testing capacity. Med (New York, N.Y.). 2 (3), 263-280 (2021).
- Griesemer, S. B., et al. Evaluation of Specimen Types and Saliva Stabilization Solutions for SARS-CoV-2 Testing. Journal of Clinical Microbiology. 59 (5), 1418-1420 (2021).
- Wehrhahn, M. C., et al. Self-collection: An appropriate alternative during the SARS-CoV-2 pandemic. Journal of Clinical Virology: The Official Publication of The Pan American Society for Clinical Virology. 128, 104417(2020).
- Barza, R., Patel, P., Sabatini, L., Singh, K. Use of a simplified sample processing step without RNA extraction for direct SARS-CoV-2 RT-PCR detection. Journal of Clinical Virology: The Official Publication of the Pan American Society for Clinical Virology. 132, 104587(2020).
- Paltiel, A. D., Zheng, A., Walensky, R. P. Assessment of SARS-CoV-2 Screening Strategies to Permit the Safe Reopening of College Campuses in the United States. JAMA Network Open. 3 (7), 2016818(2020).
- Centers for Disease Control. 2019-Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Primers and Probes. U.S. Department of Health and Human Services. , Available from: https://www.cdc.gov/coronavirus/2019-ncov/lab/rt-pcr-panel-primer-probes.html (2020).
- Cresswell, K., Ramalingam, S., Sheikh, A. Can Robots Improve Testing Capacity for SARS-CoV-2. Journal of Medical Internet Research. 22 (8), 20169(2020).
- Villanueva-Cañas, J. L., et al. Implementation of an open-source robotic platform for SARS-CoV-2 testing by real-time RT-PCR. PLoS One. 16 (7), 0252509(2021).
- Robot Boosts COVID-19 Testing Efficiency. University of South Carolina College of Pharmacy. , Available from: https://sc.edu/study/colleges_schools/pharmacy/about/news/2020/robot-boosts-testing-effort.php (2020).
- Matic, N., et al. Practical challenges to the clinical implementation of saliva for SARS-CoV-2 detection. European Journal of Clinical Microbiology & Infectious Diseases: Official Publication of The European Society of Clinical Microbiology. 40 (2), 447-450 (2021).
- Sahajpal, N. S., et al. SalivaSTAT: Direct-PCR and Pooling of Saliva Samples Collected in Healthcare and Community Setting for SARS-CoV-2 Mass Surveillance. Diagnostics. 11 (5), Basel, Switzerland. 904(2021).
- Genzen, J. R., et al. Challenges and Opportunities in Implementing Total Laboratory Automation. Clinical Chemistry. 64 (2), 259-264 (2018).
- Archetti, C., Montanelli, A., Finazzi, D., Caimi, L., Garrafa, E. Clinical Laboratory Automation: A Case Study. Journal of Public Health Research. 6 (1), 881(2017).
- Hecker, K. H., Roux, K. H. High and low annealing temperatures increase both specificity and yield in touchdown and stepdown PCR. BioTechniques. 20 (3), 478-485 (1996).
- Bhat, P. P., et al. Formation of beads-on-a-string structures during break-up of viscoelastic filaments. Nature Physics. 6, 625-631 (2010).
- Miller, C. S., et al. Current developments in salivary diagnostics. Biomarkers in Medicine. 4 (1), 171-189 (2010).
- Moreno-Contreras, J., et al. Saliva Sampling and Its Direct Lysis, an Excellent Option To Increase the Number of SARS-CoV-2 Diagnostic Tests in Settings with Supply Shortages. Journal of Clinical Microbiology. 58 (10), 01659(2020).
- Wang, W., et al. Detection of SARS-CoV-2 in Different Types of Clinical Specimens. JAMA. 323 (18), 1843-1844 (2020).
- Landry, M. L., Criscuolo, J., Peaper, D. R. Challenges in use of saliva for detection of SARS CoV-2 RNA in symptomatic outpatients. Journal of Clinical Virology: The Official Publication of The Pan American Society for Clinical Virology. 130, 104567(2020).
- Lista, M. J., et al. Resilient SARS-CoV-2 diagnostics workflows including viral heat inactivation. PLoS One. 16 (9), 0256813(2021).
- Brotons, P., et al. Validation and implementation of a direct RT-qPCR method for rapid screening of SARS-CoV-2 infection by using non-invasive saliva samples. International Journal of Infectious Diseases: IJID: Official Publication of The International Society for Infectious Diseases. 110, 363-370 (2021).
- Batéjat, C., Grassin, Q., Manuguerra, J. C., Leclercr, I. Heat inactivation of the severe acute respiratory syndrome coronavirus 2. Journal of Biosafety and Biosecurity. 3 (1), 1-3 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。