Method Article
Effiziente SARS-CoV-2 quantitative Reverse Transkriptase PCR Speicheldiagnostikstrategie unter Verwendung von Open-Source-Pipettierrobotern
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Das Protokoll beschreibt eine SARS-CoV-2-Diagnosemethode, die Open-Source-Automatisierung nutzt, um RT-qPCR-molekulare Tests von Speichelproben durchzuführen. Dieser skalierbare Ansatz kann sowohl auf die klinische Überwachung der öffentlichen Gesundheit als auch auf die Erhöhung der Kapazität kleinerer Universitätslabors angewendet werden.
Zusammenfassung
Das Aufkommen der jüngsten globalen Gesundheitskrise SARS-CoV-2 stellte die epidemiologische Forschung und klinische Tests vor zentrale Herausforderungen. Die COVID-19-Pandemie, die durch eine hohe Übertragungsrate und eine niedrige Mortalität gekennzeichnet ist, erforderte genaue und effiziente diagnostische Tests, insbesondere in geschlossenen Bevölkerungsgruppen wie Wohnuniversitäten. Die anfängliche Verfügbarkeit von Nukleinsäuretests, wie Nasopharynxabstrichen, war aufgrund des Drucks in der Lieferkette, der auch die Meldung der Testergebnisse verzögerte, begrenzt. Speichelbasierte quantitative Transkriptase-Kettenreaktion (RT-qPCR) -Tests haben gezeigt, dass sie in Sensitivität und Spezifität mit anderen Testmethoden vergleichbar sind, und die Speichelentnahme ist für die Teilnehmer weniger physikalisch invasiv. Aus diesem Grund haben wir einen multiplen RT-qPCR-Diagnoseassay für die Bevölkerungsüberwachung der Clemson University und der umliegenden Gemeinde entwickelt. Der Assay verwendete Open-Source-Liquid-Handling-Roboter und Thermocycler anstelle komplexer klinischer Automatisierungssysteme, um den Workflow und die Systemflexibilität zu optimieren. Die Automatisierung der speichelbasierten RT-qPCR ermöglicht den schnellen und genauen Nachweis einer Vielzahl von viralen RNA-Konzentrationen für große und kleine Testanforderungen. Der durchschnittliche Turnaround für das automatisierte System betrug < 9 h für 95% der Proben und < 24 h für 99% der Proben. Die Kosten für einen einzelnen Test betrugen 2,80 US-Dollar, wenn alle Reagenzien in großen Mengen gekauft wurden.
Einleitung
Das schwere akute respiratorische Syndrom-assoziierte Coronavirus-2 (SARS-CoV-2), ein neuartiges Coronavirus, trat Ende 2019 auf und breitete sich schnell in der Weltbevölkerung aus1. Die SARS-CoV-2-Infektion verursacht die Coronavirus-Krankheit 2019 (COVID-19), eine hochansteckende Krankheit mit potenziell schweren Atemwegs- und Entzündungssymptomen. Eine hohe Übertragbarkeit in Verbindung mit einer niedrigen Mortalität deutete darauf hin, dass sich das Virus rasch in den Populationen ausbreiten und verstärkte diagnostische Tests erfordern würde2,3. In den Empfehlungen im Bereich der öffentlichen Gesundheit wurde ein breit angelegtes Bevölkerungsscreening gefördert, um Fälle zu isolieren und anschließend die Übertragungsraten zu senken4,5,6. Darüber hinaus zeigten Modelle der Bevölkerungsüberwachung, dass die Erhöhung der Testhäufigkeit und die Verringerung der Meldezeit einen größeren Effekt auf die Verringerung der Übertragung hatten als die Erhöhung der Testempfindlichkeit7. Dies liegt wahrscheinlich daran, dass infizierte Personen früher unter Quarantäne gestellt werden könnten, wodurch Infektionsketten unterbrochen werden.
Der ursprüngliche Standard für Nukleinsäureamplifikationstests (NAAT) waren Nasopharynxabstriche (NP), die von RT-qPCR8 verarbeitet wurden. Bei dieser Form des Testens für sehr große Populationen treten jedoch Komplikationen auf, wie z. B. erhöhte relative Kosten und verschärfter Druck in der Lieferkette9,10. Darüber hinaus sind sowohl die Probensammlung als auch die Verarbeitung gängiger NAAT-Methoden (einschließlich NP-Tupfer, Oropharynxabstriche, Mittelturbinatabstriche und Nasenabstriche) auf spezielle Ausrüstung, Reagenzien und medizinisches Personal angewiesen9,10.
Ein geeigneter Ersatz für NP-Tupfer RT-qPCR-Tests sind Speichel-basierte Tests, die ein genaues Diagnosewerkzeug für den SARS-CoV-2-Nachweis sind11,12,13,14. Die direkte Durchführung der RT-qPCR an Speichelproben ergibt eine ähnliche Sensitivität und Spezifität wie NP-Tupfer15. Ein großer Vorteil der Speichelprüfung gegenüber der NP-Tupferprüfung besteht darin, dass sie die Selbstentnahme von Proben ermöglicht16. Dies minimiert den Bedarf an medizinischem Personal und maximiert die einfache Probenentnahme für Patienten, da es weniger invasiv ist als NP-Abstriche. Da Speichelproben keine Puffer benötigen, um die Probe aus einem Tupfer zu entfernen (wie im Fall von NP-Proben), können speichelbasierte Tests die hitzebasierte Ribonukleinsäure (RNA)-Extraktion direkt nutzen, was die Testkosten senkt, indem zusätzliche Puffer, Transportmedien und/oder RNA-Extraktionsreagenzien überflüssig werden14,17.
Das Clemson University Research and Education in Disease Diagnostics and Intervention (REDDI) Lab wurde eingerichtet, um den Bedarf der Universität an COVID-19-Tests und -Überwachung zu decken. In geschlossenen Bevölkerungsgruppen, einschließlich Universitäten, führten häufige Überwachungstests in Verbindung mit sozialer Distanzierung zu den günstigsten Ergebnissen in epidemiologischen Modellen der Krankheitsprävalenz18. Die konsolidierten Protokolle CDC 2019-nCOV RT-qPCR19 und SalivaDirect14 wurden angepasst, und die Automatisierung wurde im klinischen Workflow eingesetzt, um die Kosten zu senken und die Durchlaufzeit zu verbessern. Frühere Gruppen hatten Open-Source-Liquid-Handling-Roboter für SARS-CoV-2-RNA-Extraktionsschritte20,21 verwendet, aber wir haben den Einsatz der Roboter zur Vorbereitung von Testplatten und Ladeproben maximiert22. Hier zeigen wir, dass das angepasste Protokoll und der Einsatz von Open-Source-Liquid-Handling-Systemen (Abbildung 1) eine schnelle und genaue speichelbasierte RT-qPCR ermöglicht und eine effektive Strategie für die groß angelegte Überwachung der öffentlichen Gesundheit darstellt.
Protokoll
Alle Untersuchungen wurden in Übereinstimmung mit den Clemson University und den Prisma Health Institutional Review Boards durchgeführt (Prisma Health IRB # Pro00099491, 1. Juli 2020).
1. Einrichtung eines Open-Source-Liquid-Handling-Roboters
- Installieren Sie hocheffiziente Partikelluftfiltermodule (HEPA) (siehe Materialtabelle) an der Oberseite jedes Liquid-Handling-Roboters gemäß den Anweisungen des Herstellers.
- Befestigen Sie eine 8-Kanal-P20-Pipette gemäß den Anweisungen des Herstellers an der linken Halterung des/der Master-Mischplattenvorbereitungsroboters.
- Befestigen Sie eine P20-Pipette gemäß den Anweisungen des Herstellers an der rechten Halterung des/der Probenladeroboters/-roboter.
- Laden Sie die benutzerdefinierten Python-Skripts (Supplemental File 1 und Supplemental File 2) auf die entsprechenden Computer herunter.
- Öffnen Sie TigerSaliva Full 384 Loading.py in der Desktop-Anwendung an den Beispiel-Laderoboter-Computern. Klicken Sie auf Kalibrieren und richten Sie sowohl die Pipette als auch das Programm gemäß den Anweisungen der Software ein.
- Öffnen Sie 12 Full Plates.py in der Desktop-Anwendung am Master-Mix-Robotercomputer. Klicken Sie auf Kalibrieren und richten Sie sowohl die Pipette als auch das Programm gemäß den Anweisungen der Software ein.
- Drucken Sie benutzerdefinierte Musterregale mit einem fusionierten dreidimensionalen (3D)-Drucker mit einer CAD-Datei (Computer-Aided Design, https://www.myminifactory.com/object/3d-print-141363). Drucken Sie 16 Racks pro Probenladeroboter für zwei Sätze von acht Racks.
2. Vorbereitung von 20x Multiplex-Sonden-/Primer-Mix N1+P1
- Bereiten Sie eine Charge eines 20-fachen Multiplex-N1+P1-Sonden-/Primer-Mixes (Gesamtvolumen von 20 ml, Tabelle 1) in einem konischen 50-ml-Röhrchen in einer sterilen Umgebung fern von synthetischer SARS-CoV-2-RNA oder Patientenproben vor.
- Aliquot 1,6 ml der Mischung mit einer serologischen Pipette in sterile 2,0 ml Zentrifugenröhrchen und entsprechend etikettieren.
- Bewahren Sie Aliquots in einem -20 °C Gefrierschrank auf, bis sie gebrauchsfertig sind.
3. Herstellung eines positiven Kontrollmixes
HINWEIS: Die Positivkontrollmischung sollte nicht in derselben sterilen Umgebung wie die Sonde / Primer-Mischung oder andere Master-Mix-Komponenten hergestellt werden. Es sollte ein separater Behälter mit nukleasefreiem Wasser verwendet werden.
- Verdünnen Sie die synthetische SARS-CoV-2-RNA (N1) von 1.000.000 Genkopien/μL (cpμ) auf 10.000 cpμ, indem Sie 10 μL Stammlösung zu 990 μL nukleasefreiem Wasser hinzufügen. Aliquot 25 μL von 10.000 cpμ in sterile 0,2 mL Röhrchen und entsprechend etikettieren. Lagern Sie ungenutzte Aliquots bei -80°C.
HINWEIS: Synthetische RNA muss bei -80 ° C gelagert werden, um einen Abbau zu verhindern. - Verdünnen Sie Hs_RPP30 synthetische DNA (P1) von 200.000 cpμ auf 10.000 cpμ, indem Sie 50 μL Stammlösung zu 950 μL nukleasefreiem Wasser hinzufügen. Aliquot 25 μL von 10.000 cpμ in sterile 0,2 mL Röhrchen und entsprechend etikettieren. Lagern Sie ungenutzte Aliquots bei -80°C.
- Verdünnen Sie jede Komponente auf eine Endkonzentration von 200 cpμ, indem Sie 20 μL SARS-CoV-2 und Hs_RPP30 10.000 cpμ-Bestände zu 960 μL nukleasefreiem Wasser hinzufügen, was insgesamt 1000 μL entspricht. Aliquot 20 μL gemischte 200 cpμ positive Kontrolle in 0,2 ml-Röhrchen und beschriftete sie entsprechend. Aliquots bis zur Gebrauchsfertigkeit bei -80°C lagern.
4. Herstellung von Master-Mixplatten
HINWEIS: Stellen Sie die Mastermischung in einer sterilen Umgebung vor, weg von synthetischer SARS-CoV-2-RNA oder Patientenproben. Alle Bestandteile müssen vor der Zugabe zum Gemisch vollständig aufgetaut sein; Ohne richtiges Auftauen können die Konzentrationen falsch sein. Unzureichendes Auftauen wird durch das Vorhandensein von Eis oder eine ungleichmäßige Farbe von Reagenzien angezeigt. Während der Zubereitung der Mischung auf einem Gefrierblock aufbewahren.
- Bereiten Sie eine Charge Multiplex-Master-Mix (Gesamtvolumen von 48 ml, Tabelle 2) in einem konischen 50-ml-Rohr vor.
- Homogenisieren Sie die Mischung, indem Sie das Rohr 3x drehen. Mischen Sie nicht, indem Sie auf und ab pipettieren oder wirbeln, da dies das Enzym schädigt.
- Füllen Sie die Säulen 1-4 eines sterilen 96-Well-Tiefbrunnenreservoirs, indem Sie 1,48 ml Master-Mix in jedes Bohrloch übertragen. Ein 50 ml konisch füllt vier Säulen, genug für 12 Platten.
- Decken Sie den Tiefbrunnenbehälter mit einer Folienversiegelung ab und legen Sie ihn in den speziellen Master-Mix-Liquid-Handling-Roboter. Platzieren Sie das gefüllte Tiefbrunnenreservoir auf Deck 10, platzieren Sie sechs leere 384-Well-Platten auf den Decks 1-6 und die P20-Spitzenbox auf Deck 11. Entdecken Sie die Tiefbrunnenplatte und die Spitzenboxen und schließen Sie den Roboter.
- Initialisieren Sie das benutzerdefinierte Python-Betriebsprotokoll, indem Sie in der Roboter-Desktopanwendung auf Start Run klicken.
- Nach 40 Minuten pausiert der Lauf. Decken Sie die gefüllten 384 Wellplatten mit Foliendichtungen ab, während sie im Roboter verbleiben, und drücken Sie sie mit der Walze nach unten, um die Haftung zu gewährleisten. Beschriften Sie den Rand jeder Platte mit einer Chargenkennung.
- Legen Sie sechs neue leere 384-Well-Platten auf die Decks 1-6 und setzen Sie das Betriebsprotokoll fort, indem Sie auf Resume Run klicken. Nachdem der Lauf abgeschlossen ist, bedecken Sie den letzten Satz von 384 Bohrlochplatten mit Foliendichtungen.
- Pipette 2 μL der verbleibenden Mastermischung in die Spalten 1-3 und 22-24 einer leeren 384-Well-Platte zur Chargenqualitätskontrolle. Mit einer optisch undurchsichtigen Abdichtung abdichten und auf dem Thermocycler laufen (Abschnitt 10.1-10.2). Wenn Bohrungen N1-Schwellenwerte (Ct) aufweisen oder wenn mehr als 10 Bohrlöcher P1-Ct-Werte aufweisen, ist die Charge kontaminiert und kann nicht verwendet werden.
- Lagern Sie die vorbereiteten Master-Mixplatten bei 4 °C und verwenden Sie sie innerhalb von 7 Tagen nach der Zubereitung.
5. Probenentnahme, -aufnahme und -wärmebehandlung
- Weisen Sie die Teilnehmer an, 30 Minuten vor der Speichelentnahme nicht zu essen, zu trinken, zu rauchen oder Zahnhygiene durchzuführen. Weisen Sie die Teilnehmer an, mindestens 1 ml Speichel zu sammeln, der sich auf natürliche Weise im Mund sammelt, und ihn in einem sterilen konischen 50-ml-Röhrchen ohne Konservierungsstoffe abzuscheiden und dann das Röhrchen zu verschließen (Supplemental File 3).
- Dekontaminieren Sie die Außenseite von Speichelsammelröhrchen mit 70% Ethanol oder Desinfektionstüchern und geben Sie sie zur Prüfung ins Labor.
- Zeichnen Sie die Probenankunft auf, indem Sie jeden Proben-Barcode in die tägliche Aufnahmetabelle (Supplemental File 4) scannen.
- Behandeln Sie die gescannten Proben 30 min lang in einem 95 °C heißen Ofen. Entfernen Sie Proben, während Sie hitzebeständige Handschuhe tragen.
HINWEIS: Unbehandelte Proben sind bei Raumtemperatur (23 °C) bis zu 72 h stabil. Nach der Wärmebehandlung müssen die Proben bei 4 °C gelagert werden, wenn sie nicht sofort verarbeitet werden.
6. Beispielzuordnung
- Öffnen Sie die täglichen Probenladetabellen für jeden Probenladeroboter (Supplemental File 5) auf dem Computer an der Probenzuweisungsstation.
- Weisen Sie jeder 384-Well-Platte 188 Proben wie folgt zu: Die Proben 1-48 gelten als Quartal 1, die Proben 49-96 als Quartal 2, die Proben 97-144 als Quartal 3 und die Proben 145-188 als Quartal 4. Die Proben werden doppelt analysiert.
- Beschriften Sie Tabletts mit Plattenname, Datum und Viertelnummer. Scannen Sie die Proben der Reihe nach in die Probenladetabelle.
HINWEIS: Proben von früheren Platten müssen möglicherweise manuell ausgeführt werden, wie in Abbildung 3 definiert. Manuelle Anweisungen zur Probenzuweisung und zum Laden finden Sie in den Abschnitten 8.1-8.3.
7. Bedienung von Probenladerobotern
- Stellen Sie an der Probenladestation zwei vollständige Sätze von acht 3D-gedruckten Racks auf, die der Deckplatzierung im Roboter entsprechen.
- Schließen Sie die Tuben von Viertel 1 auf und legen Sie sie in 3D-gedruckte Racks, beginnend mit der Position A1 in Rack 1. Füllen Sie jedes Rack von links nach rechts und von oben nach unten. Setzen Sie dieses Lademuster in Rack 2 fort, und fahren Sie dann mit den Racks 4 und 5 fort (siehe Abbildung 2C).
HINWEIS: Racks werden aufgrund der Roboterprogrammparameter nicht fortlaufend nummeriert. - Platzieren Sie beladene Quarter 1 Sample Racks auf den Decks 1, 2, 4, 5, 7, 8, 10, 11. Platzieren Sie P20-Tipps auf den Decks 3 und 9. Um den Rüstvorgang zu vereinfachen, laden Sie Materialien von hinten nach vorne in den Roboter.
- Nehmen Sie eine vorgefertigte Master-Mixplatte aus der 4 °C, beschriften Sie sie mit dem Plattennamen und schneiden Sie mit einer scharfen Klinge eine Linie in der Folie um die Steuerbrunnen (N23/24, O23/24 und P23/24).
- Legen Sie die Master-Mixplatte auf Deck 6 und ziehen Sie die Folienabdeckung ab, wobei das kleine Rechteck, das die Steuerschächte bedeckt, zurückbleibt. Entdecken Sie die Tip-Boxen und schließen Sie den Roboter.
- Initialisieren Sie das benutzerdefinierte Python-Betriebsprotokoll, indem Sie über die Roboterdesktopanwendung auf Ausführen starten klicken. Jedes Viertel benötigt 24,5 Minuten, um auf die Platte geladen zu werden; Legen Sie einen Timer als Erinnerung fest.
- Während der Roboter läuft, öffnen Sie die Kappe und laden Sie Viertel-2-Probenröhrchen in den zweiten Satz 3D-gedruckter Regale, wie in Abschnitt 7.2 beschrieben.
- Wenn der Roboter pausiert, entfernen Sie die Racks von Viertel 1 und ersetzen Sie sie durch die Racks von Viertel 2. Klicken Sie in der Desktopanwendung auf Ausführen fortsetzen .
- Fassen Sie die Probenröhrchen von Quartal 1 zusammen und lagern Sie sie in einem 4 ° C-Kühlschrank, während Sie auf die Ergebnisse warten.
Wiederholen Sie diesen Ladevorgang für die Quartale 3 und 4. - Überführen Sie die beladene Platte in eine Biosicherheitswerkbank. Um die Kontamination zu minimieren, halten Sie die Platte während des Transfers bedeckt.
8. Manuelles Laden der Probe
HINWEIS: Führen Sie bei wiederholten Proben (N1 Rerun oder Rerun, siehe Abbildung 3) bei unzureichender Roboterbelastung einen einzelnen manuellen Lauf durch.
- Sammeln Sie alle Wiederholungsproben und weisen Sie sie als letzte Proben in Quartal 4 zu (siehe Abschnitt 6.2). Nummerieren Sie Proben, scannen Sie die Barcodes, geben Sie den ursprünglichen Probenspeicherort und das Ergebnis in die Probenladetabelle ein.
- Erneute Proben an die Biosicherheitskabine übergeben. Laden Sie keine Wiederholungsprobenröhrchen in die Roboterladegestelle.
- Pipette 2 μL jeder Wiederholungsprobe zu den richtigen Vertiefungen gemäß dem Plattenlayoutdiagramm (Supplemental File 6). Verwenden Sie eine spezielle Pipette zum Hinzufügen von Patientenproben. Halten Sie die Kontrollbrunnen mit Folie bedeckt, während Sie Proben hinzufügen, um die Kontamination zu minimieren.
9. Hinzufügen von Kontrollen zu den Prüfplatten
- Ziehen Sie die Folienabdeckung über den Kontrollvertiefungen mit einer Pinzette ab.
- Pipette 2 μL nukleasefreies Wasser (keine Schablonenkontrolle) zu den Brunnen N23-N24 und 2 μL von 200 cpμ gemischter positiver Kontrolle (siehe Abschnitt 3) zu den Brunnen O23-O24. Pipette 2 μL einer bestätigten positiven Patientenprobenkontrolle in die Vertiefungen M23-M24 als zusätzliche Kontrolle. Lassen Sie die Bohrlöcher P23-P24 leer, um die Qualität der Master-Mix-Chargen zu überwachen.
- Decken Sie die Platte mit einer optisch klaren Abdichtung ab und verwenden Sie die Applikatorwalze, um die Dichtung an allen Vertiefungen festzuhalten. Wirbeln Sie die Platte bei 2500 U / min für 30 Sekunden, um gründlich zu mischen. Zentrifugieren Sie die Platte bei 500 x g für 1 min.
10. Durchführung der RT-qPCR
- Erstellen Sie in der Thermocycler-Software ein Protokollprogramm gemäß den beschriebenen Bedingungen (Tabelle 3). Speichern Sie das Protokoll für zukünftige Platten. Legen Sie die versiegelte Platte in den Thermocycler und führen Sie das Protokoll aus.
- Exportieren Sie Ct-Werte als XSLX-Datei, und kopieren Sie die Werte in die Beispieltabelle zum Laden von Beispielen (Ergänzende Datei 5).
HINWEIS: Diese Blätter wurden speziell für Ct-Ausgabedateien von der Herstellersoftware entworfen und müssen möglicherweise geändert werden, um andere Formate zu akzeptieren.
11. Bestimmung der Gültigkeit des Tellers
- Validieren Sie sowohl die Positivkontrolle und/oder bekannte positive Proben als auch die Negativkontrolle, um die Plattenergebnisse als gültig zu betrachten. Bewerten Sie die Kontrollbohrungen anhand der folgenden Kriterien.
- Überprüfen Sie bei der Positivkontrolle, ob mindestens eine Positivkontrollquelle (O23/O24) Ct-Werte zwischen 22 und 28 für P1- und N1-Sonden erzeugt. Alternativ erzeugen die bekannten positiven Probenvertiefungen (M23/M24) P1- und N1-Ct-Werte <33 auf den P1- und N1-Sonden.
- Überprüfen Sie bei der Negativkontrolle, ob in keinem der beiden Negativkontrollbohrungen (N23/N24) N1- oder P1-Ct-Werte vorhanden sind. Vergewissern Sie sich, dass Ct-Werte gültige Verstärkungskurven aufweisen, bevor Sie die Platte ungültig machen.
12. Interpretation von Stichprobenergebnissen
- Bestimmen Sie das Patientenergebnis anhand des Diagramms (Abbildung 3) und melden Sie aufgelöste Proben.
- Bewerten Sie das P1-Ergebnis als GÜLTIG oder UNGÜLTIG. Wenn P1 ein Ergebnis von Ct <33 ergibt, betrachten Sie den Well als VALID und fahren Sie fort, aus N1 zu resultieren. Wenn P1 ein Ergebnis von Ct >=33 oder keinem Ct-Wert ergibt, betrachten Sie die Vertiefung als INVALID.
- Bewerten Sie das N1-Ergebnis als JA, NEIN oder NEIN*. Wenn N1 ein Ergebnis von Ct <33 erzeugt, ist der Brunnen JA. Wenn N1 keinen Ct-Wert erzeugt, ist der Brunnen NO. Wenn N1 eine Ct->=33 erzeugt, ist die Vertiefung NO*. Vergewissern Sie sich, dass alle N1 Ct-Werte einer realen Verstärkungskurve zugeordnet sind. Wenn ein Ct-Wert für N1 keine Verstärkungskurve hat, ist der Brunnen NO.
- Identifizieren Sie Wiederholungsproben (N1 Rerun oder Rerun), kennzeichnen Sie sie mit einer internen Sample-Nummer und einem Sample-Typ und geben Sie sie an den Lade-Workflow zurück (Abschnitt 8.1-8.3).
- Bewerten Sie das P1-Ergebnis als GÜLTIG oder UNGÜLTIG. Wenn P1 ein Ergebnis von Ct <33 ergibt, betrachten Sie den Well als VALID und fahren Sie fort, aus N1 zu resultieren. Wenn P1 ein Ergebnis von Ct >=33 oder keinem Ct-Wert ergibt, betrachten Sie die Vertiefung als INVALID.
13. Laborreinigung
- Liquid-Handling-Roboter
- Reinigen Sie alle Seiten mit Desinfektionsmittel mittlerer Ebene. Verwenden Sie kein Ethanol, da es den Kunststoff abbaut.
- Pipettenspitzenende und Abfallbehälter vorsichtig mit einem Alkohol (70% Ethanol oder 100% Isopropanol) abwischen. Wischen Sie Tastatur und Maus nach unten.
- Biosicherheitswerkbank
- Reinigen Sie alle Oberflächen mit Desinfektionsmittel auf mittlerer Ebene. Schalten Sie das UV-Licht für 15 Minuten ein.
Ergebnisse
Wir haben den Nachweisbereich für RT-qPCR-Sonden und Primer für den synthetischen Nukleinsäuregehalt sowohl für SARS-CoV-2 (N1) als auch für Hs_RPP30 (P1) bestimmt. Es wurde eine 10-fache serielle Verdünnung der bekannten Konzentrationen von kombinierter synthetischer SARS-CoV-2-RNA und synthetischer Hs_RPP30-DNA in Wasser durchgeführt. Die folgende Formel wurde verwendet, um das Molekulargewicht in die Anzahl der Genkopien umzuwandeln
Genkopienzahl = (ng * 6,0221 x 1023)/((Länge in Basenpaaren*660 g/Mol) *1 x 109 ng/g)
und RT-qPCR wurde durchgeführt. Nach der Durchführung der RT-qPCR zeigten lineare Kurven für den N1-Nachweis (Abbildung 4A) und den P1-Nachweis (Abbildung 4B) gute Korrelationskoeffizienten über einen weiten Bereich von Genkopierkonzentrationen (R2= 0,9975 bzw. R2= 0,9884). Dieses Ergebnis deutet darauf hin, dass die Kombination von Primer- und Sondensätzen nicht inhibitorisch ist und SARS-CoV-2-RNA bei einer Genkopie / μL (Cq = 33) genau nachweisen kann. Eine Genkopie entspricht in etwa einer viralen Kopie; Aufgrund der semi-quantitativen Natur der RT-qPCR haben wir jedoch keine quantitativen viralen Kopienzahlen im Speichel bestimmt. Wir versuchten, positive Speichelproben zu simulieren, indem wir synthetische SARS-CoV-2-RNA bekannter Konzentrationen in virusfreien Speichel (sowohl wärmebehandelt als auch nicht wärmebehandelt) spizten, konnten jedoch keine N1-Amplifikation bei niedrigen RNA-Konzentrationen erzeugen (Daten nicht gezeigt). Dies kann auf den RNase-Abbau oder andere Störfaktoren zurückzuführen sein.
Die Inter- und Intra-Assay-Variabilität zwischen automatisierten und manuellen Probenlademethoden wurde ebenfalls bewertet. Zur Bewertung der Inter-Assay-Variabilität wurden 20 eindeutige positive Proben mit den manuellen (beschrieben in Abschnitt 8.1-8.3) und automatisierten (beschrieben in Abschnitt 7.1-7.11) Methoden geladen. N1-Ct-Werte wurden verglichen, um festzustellen, ob Liquid-Handling-Roboter und manuelle Probenbeladung gleichwertige Ergebnisse lieferten (Abbildung 5A). Die lineare Beziehung zwischen manuellen und automatisierten Methoden ergab einen hohen Korrelationskoeffizienten (R2= 0,9088), was darauf hindeutet, dass beide Methoden funktional äquivalent sind. Mit zunehmendem Anstieg der N1-Ct-Werte nahm auch die Variabilität der Ct-Werte zu. Dieser Trend ist wahrscheinlich auf die heterogene Verteilung der viralen Partikel im Speichel zurückzuführen, die ausgeprägter ist, wenn weniger Partikel vorhanden sind. Um die Variabilität des Intra-Assays zu bewerten, wurde ein Vergleich zwischen den N1-Ct-Werten aus Replikatvertiefungen einzigartiger Speichelproben unter Verwendung beider Methoden der Probenbeladung durchgeführt (Abbildung 5B). Die lineare Beziehung zwischen Replikaten der automatisierten Probenbeladung (R2= 0,9622) ergab einen etwas höheren Korrelationskoeffizienten als der der manuellen Beladung (R2= 0,9589), was auf eine hohe Reproduzierbarkeit der SARS-CoV-2-Detektion für beide Belastungsmethoden hinweist.
Schließlich wurde eine Bewertung der Speichelviskositätsreduktion in Bezug auf die Wärmebehandlungsmethoden durchgeführt (Abbildung 6). Speichel wurde aus einer einzigen Quelle gewonnen, um die Probenvariabilität zu eliminieren. Eine größere Variabilität der P1-Ct-Werte innerhalb einer Wärmebehandlungsmethode kann auf eine höhere Probenviskosität hinweisen, da viskoser Speichel nicht genau angesaugt und dosiert werden kann. Sowohl die 30-minütige als auch die 60-minütige Wärmebehandlungsmethode führten zu einer signifikant verringerten Probenvariabilität im Vergleich zu keiner Behandlungskontrolle (p = 0,0006 bzw. p = 0,0429). Es gab keinen signifikanten Unterschied zwischen 30-minütigen und 60-minütigen Behandlungen (p = 0,2245); Daher wurde die 30-minütige Wärmebehandlungsmethode implementiert, um die Verarbeitungszeit zu reduzieren.
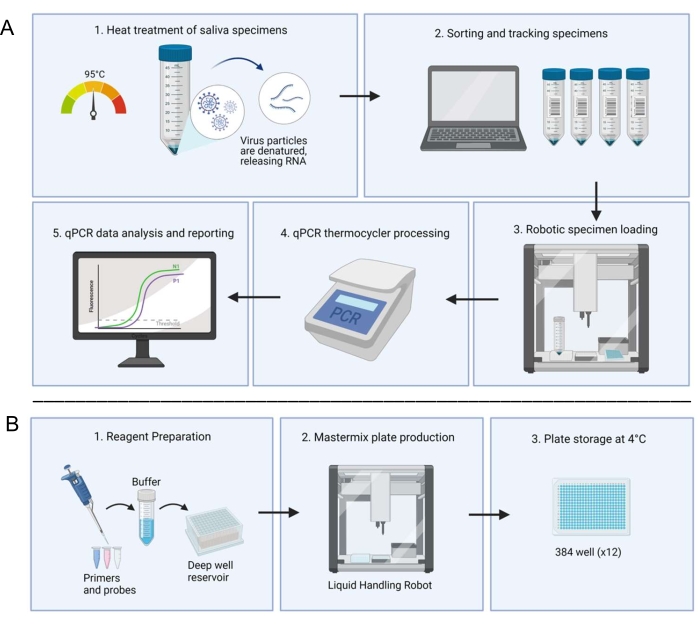
Abbildung 1: Labor-Workflow mit dem speichelbasierten RT-qPCR-Diagnosesystem . (A) Die Proben werden gesammelt und bei 95 °C für 30 min wärmebehandelt. Die behandelten Proben werden über ein hauseigenes Tabellenkalkulationssystem sortiert und mit Patienteninformationen verfolgt. Ein Liquid-Handling-Roboter lädt Proben in doppelte Vertiefungen von vorbereiteten Master-Mixplatten. Ein Techniker lädt die Bedienelemente manuell, dichtet die Platte ab und legt die Platte zur Verarbeitung in einen Thermocycler. Die Ergebnisse werden durch ein automatisiertes Computersystem analysiert und von einem Techniker verifiziert. (B) Ein Techniker bereitet Reagenzien für das Master-Mix vor, die einem Tiefbrunnenbehälter in einer sterilen Biosicherheitskabine zugesetzt werden. Gefüllte Tiefbrunnenreservoirs werden in einen speziellen Liquid-Handling-Roboter geladen. Fertige Platten werden mit Folie versiegelt, beschriftet und bei 4 °C gelagert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
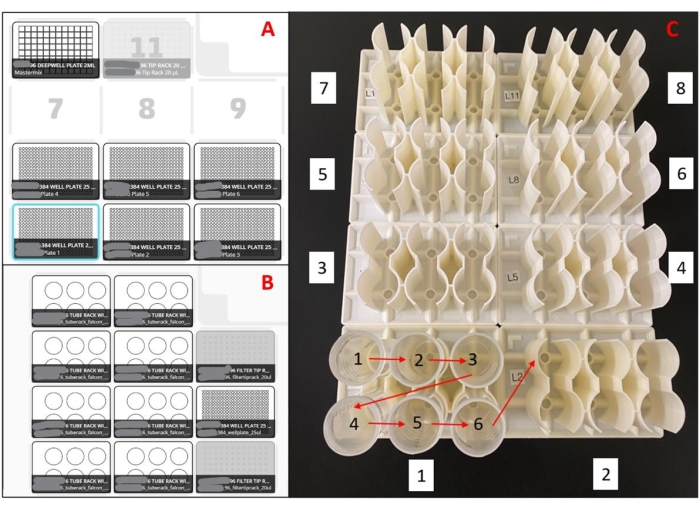
Abbildung 2: Für den Liquid-Handling-Roboter verwendete Layouts. (A) Decklayout für Master-Mixplattenvorbereitungsroboter. Mit einer achtkanaligen Pipette ist der Roboter so programmiert, dass er Pipettenspitzen aufnimmt, Master-Mix aus einem 96-Well-Tiefbrunnenreservoir aspiriert, Master-Mix in leere 384-Well-Platten dosiert und die Pipettenspitzen in einen Abfalleimer auswirft. Dies wird für sechs Platten pro Lauf wiederholt. (B) Deck-Setup für Probenladeroboter. Bei einer einkanaligen Pipette ist der Roboter so programmiert, dass er eine Pipettenspitze aufnimmt, eine Speichelprobe aspiriert, eine Speichelprobe in doppelte Vertiefungen einer 384-Well-Master-Mixplatte dosiert und die Pipettenspitze in einen Abfalleimer auswirft. Dies wird für 48 Stichproben pro Durchlauf wiederholt. (C) Probenröhrchen-Ladeauftrag für 3D-gedruckte Racks. Rote Pfeile zeigen die Ladereihenfolge innerhalb eines Racks an, und die weißen Kästchennummern geben die Ladereihenfolge des gesamten Racksatzes an. Das gesamte Setup lädt 188 Proben doppelt in eine 384-Well-Platte. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
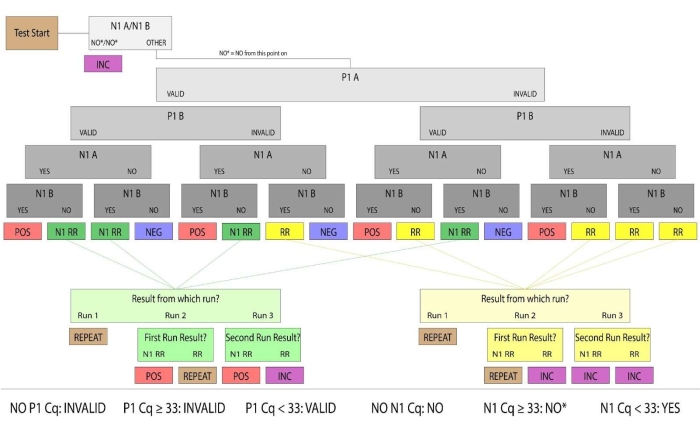
Abbildung 3: Beispiel für ein resultierendes Flussdiagramm. Proben mit gültigem P1 und positivem N1 wurden als humane Speichelproben identifiziert, die positiv auf SARS-CoV-2 waren. Valide und positive/negative Stichprobenergebnisse wurden als schlüssig angesehen. Stichproben, die im ersten Durchlauf keine schlüssigen Ergebnisse lieferten, wurden als Rerun (bezeichnet als RR) oder N1 Rerun (als N1 RR bezeichnet) kategorisiert. Rerun-Samples hatten keine gültige P1-Verstärkung, und N1 Rerun-Samples hatten eine positive N1-Verstärkung in einer einzigen Replikation. Wenn bei einem nachfolgenden manuellen Lauf keine gültige P1-Verstärkung erzeugt werden konnte oder beide Replikate N1-Ct-Werte über dem positiven Schwellenwert (Ct >33) aufwiesen, wurden die Stichprobenergebnisse als nicht schlüssig angesehen. Für klinische Zwecke wurden Patientenproben, die nicht im Labor ankamen, eine unzureichende Menge an Speichel zum Pipettieren enthielten oder beschädigt waren, als ungültig angesehen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
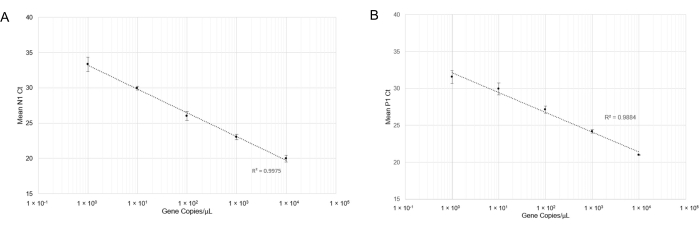
Abbildung 4: RT-qPCR-Nachweis von N1 (SARS-CoV-2) synthetischer RNA und P1 (Hs_RPP 30) synthetischer DNA. Standardkurven wurden mit Standardabweichungen gezeichnet, um den Bereich der genauen Detektion mit dieser Sonden-Primer-Kombination zu bestimmen. (A) Die in den jeweiligen Verdünnungen erhaltenen mittleren Ct-Werte (n =4) wurden gegen die geschätzte Menge synthetischer RNA (1x100 bis 1x104 RNA-Kopien in 10 μL RT-qPCR-Reaktion) aufgetragen. (B) Die mittleren Ct-Werte (n =3), die in den jeweiligen Verdünnungen erhalten wurden, wurden gegen die geschätzte Menge synthetischer DNA (1 x 100 bis 1 x 104 Genkopien in 10 μL RT-qPCR-Reaktion) aufgetragen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
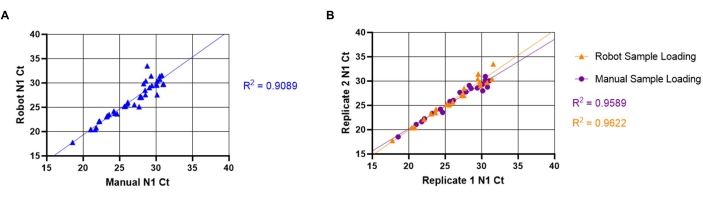
Abbildung 5: Vergleich zwischen manuellem und automatisiertem Speicheltransfer SARS-CoV-2 (N1) Ct-Werten. Die bekannten SARS-CoV-2-positiven Speichelproben (n =20) wurden von einem Liquid-Handling-Roboter doppelt in eine RT-qPCR-Master-Mixplatte geladen. Die Proben haben einen Ct-Wert zwischen 18 und 32 für N1. Die gleichen Proben wurden dann manuell in doppelte Vertiefungen an einer anderen Plattenposition geladen. (A) N1-Ct-Werte, die aus einzigartigen Proben sowohl unter Verwendung der Roboter- als auch der manuellen Probenbeladung erhalten wurden, wurden transponiert, um die Variabilität zwischen dem Assay zwischen manueller und Roboterbeladung zu bestimmen. (B) Die Intra-Assay-Variabilität wurde auch unter Verwendung einer transponierten Replikation von N1-Ct-Werten bestimmt, die sowohl aus dem Roboter als auch aus dem manuellen Laden von Proben gewonnen wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
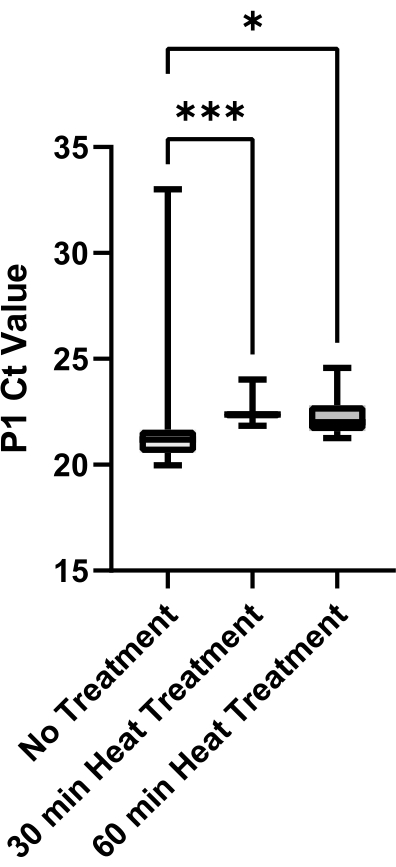
Abbildung 6: Bewertung von Wärmebehandlungsmethoden zur Viskositätsreduktion im Speichel. SARS-CoV-2 negativer Speichel wurde aus einer einzigen Quelle gesammelt und Aliquots wurden entweder für 0 min, 30 min oder 60 min bei 95 °C wärmebehandelt. P1 Ct-Werte aus technischen Replikaten (n = 12) jeder Bedingung wurden aufgetragen, um die Variabilität zwischen den Behandlungsmethoden zu bestimmen. Paarweise Vergleiche zwischen Gruppen wurden mit einem ungepaarten t-Test ausgewertet (*** zeigt p <0,001, * zeigt p <0,05 an). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzende Abbildung 1: Vergleich von N1 Ct in Speichelproben mit niedrigem P1 CT. Die positiven Proben mit niedrigem P1 Ct wurden ausgewählt und mit dem N1 Ct (n =106) verglichen. Die N1 Ct-Werte lagen zwischen 14 und 33, was darauf hindeutet, dass der Assay in Speichelproben einen dynamischen Bereich aufweist, der mit der Standardkurve vergleichbar ist. Bitte klicken Sie hier, um diese Datei herunterzuladen.
| Bestandteil | Sequenz (5'→3') | Lagerkonzentration | Volumen | ||
| 2019-nCoV-N1 Sonde | /5FAM/ACCCCGCAT/ZEN/TACGTTTGGTGGACC/3IABkFQ | 50 μM | 500 μL | ||
| 2019-nCoV-N1-Für | GACCCCAAAATCAGCGAAAT | 100 μM | 2000 μL | ||
| 2019-nCoV-N1-Rev | TCTGGTTACTGCCAGTTGAATCTG | 100 μM | 2000 μL | ||
| Hs RPP30 Cy5 Sonde | /5Cy5/TTCTGACCT/ZEN/GAAGGCTGCGG/3IABkFQ | 50 μM | 500 μL | ||
| Hs-RPP30-Für | AGATTTGGACCTGCGAGCG | 100 μM | 2000 μL | ||
| Hs-RPP30-Rev | GAGCGGCTCTCTCCACAAGT | 100 μM | 2000 μL | ||
| Wasser | - | - | 11000 μL | ||
Tabelle 1: Komponenten der Sonden-/Primermischung N1+P1.
| Bestandteil | Lagerkonzentration | Volumen pro Reaktion | Endkonzentration | Chargenvolumen | ||
| Luna WarmStart RT Enzymmischung | 20-fach | 0,5 μL | 1X | 3 ml | ||
| Luna Pufferreaktionsmischung | 2-fach | 5,0 μL | 1X | 30 ml | ||
| N1+P1 Primer/Sonde Mix | nCoV N1 F: 10 μM | 0,5 μL | 500 nM | 3 ml | ||
| nCoV N1 R: 10 μM | 500 nM | |||||
| Sonde nCoV N1: 2,5 μM | 125 nM | |||||
| RPP_30 P1 F: 10 μM | 500 nM | |||||
| RPP_30 P1 R: 10 μM | 500 nM | |||||
| Sonde RPP_30 P1: 2,5 μM | 125 nM | |||||
| Nuklatschfreies Wasser | --- | 2 μL | --- | 12 ml | ||
| Zwischensumme | --- | 8 μL | --- | 48 ml | ||
| Schablone | 2 μL | |||||
Tabelle 2: Komponenten des Multiplex-SARS-CoV-2-Mastermixes.
| Bühne | Temperatur (°C) | Dauer | Anzahl der Zyklen |
| Reverse Transkription | 55 | 10 Minuten | 1 |
| Anfängliche Denaturierung | 95 | 1 min | 1 |
| Touchdown | 95 | 10 Sek. | 3 |
| 72 | 30 Sek. | ||
| 95 | 10 Sek. | 3 | |
| 69 | 30 Sek. | ||
| 95 | 10 Sek. | 3 | |
| 66 | 30 Sek. | ||
| Hauptverstärkung | 95 | 10 Sek. | 40 |
| 65 | 30 Sek. |
Tabelle 3: Touchdown-RT-qPCR-Protokoll. Thermocycling-Bedingungen für einen einstufigen RT-qPCR SARS-CoV-2 Diagnoseassay.
| Touchdown-Schritt | Kein Touchdown-Schritt | |||
| Mittelwert N1 Ct | Mittelwert P1 kt | Mittelwert N1 Ct | Mittelwert P1 kt | |
| Beispiel 1 | 19.65 | 22.7 | 27.8 | 28.3 |
| Beispiel 2 | 22.24 | 24.9 | 28.77 | 30.5 |
| Beispiel 3 | 18.85 | 19.2 | 24.65 | 25.9 |
| Beispiel 4 | 25.56 | 22.8 | 31.93 | 29.2 |
| Beispiel 5 | 22.34 | 24.8 | 38.48 | 40.0 (Fehlgeschlagene Erkennung) |
Tabelle 4: Vergleich der Touchdown-Ct-Werte für fünf positive Proben mit den Ct-Werten ohne Touchdown.
| Probe | TigerSpeichel | Kommerziell erhältlicher Speichel-basierter SARS-CoV-2-Assay | ||
| N1 Ct | P1 kt | Covid-19 Wert | RNaseP-Wert | |
| D11 | 16.4 | 18.1 | 20.86 | 23.4 |
| E-11 | 18.9 | 19.1 | 25.6 | 21.2 |
| F11 | 19.5 | 18.4 | 22.8 | 22.2 |
| G-11 | 22.2 | 19.1 | 23.7 | 22.9 |
| H11 | 26.4 | 21.3 | 32.2 | 26.7 |
| A-12 | 14.8 | 16.5 | 29.15 | 19 |
| B12 | 24 | 19.6 | 31.05 | 21.35 |
| C-12 | 14.9 | 17.5 | 20.84 | 18.9 |
Tabelle 5: Vergleich der Ergebnisse des TigerSaliva Ct mit den kommerziell erhältlichen Speichel-basierten SARS-CoV-2-Assay-Ergebnissen. Beide Assays wurden an denselben Speichelproben (n =8) durchgeführt.
Ergänzende Datei 1: Benutzerdefiniertes Skript für die Erstellung von Roboter-Master-Mixplatten. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 2: Benutzerdefiniertes Skript für die Speichelverarbeitung auf Probenladerobotern. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Supplemental File 3: Anleitung zur Selbstentnahme hochwertiger Speichelproben von Teilnehmern. Weitere Details finden Sie in der kurzen Videobeschreibung des Testprozesses, die bei https://www.clemson.edu/centers-institutes/reddilab/index.html verfügbar ist. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 4: Beispielaufnahmetabelle. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 5: Beispiel für das Laden einer Tabelle. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 6: Beispiel für ein 384-Well-Plattenlayoutdiagramm. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Der im Protokoll beschriebene Assay wurde durch eine unabhängige Validierungsstudie bewertet. Es wurde festgestellt, dass der Assay eine Spezifität von 98,9% (1,1% falsch positiv) und eine Sensitivität von 90,0% (10,0% falsch negativ) aufwies, wenn er gegen paarweise Nasopharynxabstriche ausgewertet wurde, die gleichzeitig genommen wurden (n = 837; 817 negative, 20 positiv). Wichtig ist, dass drei Teilnehmer, die positiv mit TigerSaliva und negativ mit einem Nasopharynxabstrich getestet wurden, 48 h später erneut mit Tupfern getestet wurden und positive Ergebnisse lieferten, was darauf hindeutet, dass TigerSaliva in der Lage sein könnte, SARS-CoV-2-Infektionen früher im Krankheitsverlauf zu erkennen.
Wir simulierten positive Speichelproben, indem wir virusfreien Speichel (sowohl wärmebehandelte als auch nicht wärmebehandelte) mit bekannten Konzentrationen von synthetischer SARS-CoV-2-RNA spizierten und eine 10-fache Verdünnung durchführten, um die Ct-Grenze im Speichel zu bestimmen. Das N1-Gen war unter 10.000 Genkopien (ca. Ct = 28) in simulierten positiven Proben nicht nachweisbar. Wir vermuten, dass dies auf den RNase-Abbau oder andere Störfaktoren zurückzuführen ist. Die Wechselwirkung von Speichel-RNasen mit nackter synthetischer RNA unterscheidet sich jedoch wahrscheinlich von der Wechselwirkung mit viralen Partikeln, selbst nachdem sie durch Hitze denaturiert wurden. Positive Speichelproben wurden mit Ct >30 identifiziert und externe Labore erhielten aus diesen Proben genetische Sequenzdaten zu SARS-CoV-2. Wir spekulieren, dass die viralen Proteine in Speichelproben von Patienten vor dem RNA-Abbau schützen.
Der kritischste Schritt im Protokoll ist die Implementierung der Automatisierung für die Master-Mix-Vorbereitung und die Speichelprobenverarbeitung (Abschnitte 4 bzw. 7). Dies ermöglicht überlappende Aufgabenprozesse, was die Durchlaufzeit drastisch reduziert. Ein weiterer kritischer Schritt ist die klinische Ergebnisinterpretation (Abschnitte 11 und 12). Die Festlegung von Zwischenergebniskategorien (Wiederholung und N1-Wiederholung) minimierte auch das Auftreten von nicht schlüssigen Testergebnissen.
Wir zeigten, dass die Variation zwischen manuellen und automatisierten Speichelprobenlademethoden vernachlässigbar ist (Abbildung 5A) und dass die Automatisierung die Reproduzierbarkeit der SARS-CoV-2-Detektion verbessern kann (Abbildung 5B). Automatisierung sollte bevorzugt werden, um das Testen bei der Gestaltung und Erweiterung klinischer Labore zu erleichtern25. Der Labor-Workflow wird durch die Implementierung von roboterautomatisierten Aufgaben verbessert26. Open-Source-Funktionen der Liquid-Handling-Roboter ermöglichen die Implementierung von benutzerdefiniertem Scripting für das Protokolldesign. Dies macht Liquid-Handling-Roboter zu einem kostengünstigen und hochgradig modifizierbaren System im Vergleich zu herkömmlichen klinischen Automatisierungsmethoden. Es ist auch eine ideale Strategie für die Ausführung von sich wiederholenden Laboraufgaben. Die hohe Anpassbarkeit des Systems führt zu der Freiheit, Laborgeräte (z. B. Auffangrohre, Pipettenspitzen oder 384-Well-Platten) im Falle von Engpässen zu ändern. Daher ist die Automatisierung durch den Einsatz von Liquid-Handling-Robotern sowohl für die Überwachung und Forschung im großen als auch im kleinen Maßstab praktikabel.
Ein großer Vorteil dieser Teststrategie ist eine viel kürzere Durchlaufzeit im Vergleich zu anderen klinischen Labors. Der Einsatz von automatisierten Liquid-Handling-Robotern spielt eine Schlüsselrolle bei der Verkürzung der Durchlaufzeit, aber auch der gleichzeitige Einsatz von Robotern und Thermocyclern trägt zur Maximierung der Testeffizienz bei. Ein Roboter und ein Thermocycler sollten als Paar betrieben werden, wobei beide Maschinen zusammen für die ununterbrochene Probenbeladung und die Analyse der Probenergebnisse eingesetzt werden. Sobald ein stetiger Fluss der zugeordneten Proben hergestellt ist, können alle Maschinenpaare gleichzeitig betrieben werden. Der ständige gleichzeitige Einsatz von Robotern und Thermocyclern erhöht die Testkapazität und -effizienz drastisch, was für das hohe Testvolumen von entscheidender Bedeutung ist.
Im Gegensatz zu anderen etablierten SARS-CoV-2 RT-qPCR-Protokollen haben wir einen Touchdown-Schritt in das Thermocycler-Protokoll aufgenommen, um das Abkühlen der Sonde und der Primer-Sets zu den Zielgenen27 zu verbessern, wodurch das Risiko einer fehlgeschlagenen Verstärkung verringert wird. Die Ergebnisse zeigten, dass das Touchdown die Detektion positiver Proben verbesserte, ohne den Verlust einer spezifischen Primerbindung zu riskieren (Tabelle 4). Wir stellten fest, dass eine breite Palette von SARS-CoV-2-RNA-Kopien (Abbildung 4A) und Hs_RPP30 DNA-Kopien (Abbildung 4B) gleichzeitig mit dem RT-qPCR-Assay nachgewiesen werden kann.
Eine Einschränkung von Liquid-Handling-Robotern ist die Möglichkeit einer Kreuzkontamination von positiven Proben während des Speicheltransfers. Speichel ist eine viskoelastische Flüssigkeit28 und kann sich nach der Abgabe von der Pipettenspitze über benachbarte Vertiefungen aneinanderreihen. Darüber hinaus kann die Heterogenität von Speichel29 zu einer ungleichmäßigen Verteilung der Viruspartikel in der gesamten Probe führen. Dies erhöht die Wahrscheinlichkeit von False Positives und Negatives, was die Bezeichnung von N1 Rerun und Rerun Samples erforderlich macht. 14,1 % der Proben, die ursprünglich als N1 Rerun bezeichnet wurden, lösten sich jedoch als positiv für SARS-CoV-2 auf und waren mehr als 30-mal wahrscheinlicher als bei Rerun-Proben, dass sie nach erneuten Tests als positiv abklingen. Folglich ermöglichte die Unterscheidung zwischen Rerun und N1 Rerun (Abbildung 3) eine genauere Trennung potenziell positiver Proben, wodurch die Sensitivität und Spezifität unseres diagnostischen Assays erhöht wurde. Andere resultierende Parameter für diagnostische Speicheltests machten diese Unterscheidung nicht12,14,24,30,31.
Speichelproben können aufgrund von Heterogenität und Viskosität schwer zu pipettieren sein32. Die Wärmebehandlung denaturiert Proteine in der Speichel-Biomatrix angemessen, reduziert die Viskosität und eliminiert den Bedarf an RNA-Extraktionsreagenzien9, die in den frühen Stadien der Pandemie knapp waren10. Die erweiterte Wärmebehandlung inaktiviert auch vorhandene Viren33, was eine Laborverarbeitung bei niedrigeren Biosicherheitsniveaus ermöglicht. Folglich wurde eine hitzebasierte RNA-Extraktion (beschrieben in Abschnitt 5.4) implementiert, um die Viskosität durch Proteindenaturierung zu verringern (Abbildung 6). Basierend auf den Ergebnissen postulieren wir, dass die Wärmebehandlung neben der Denaturierung der Protein-Biomatrix auch Speichelproben homogenisieren kann. Andere Gruppen kombinierte Wärmebehandlung und Proteinase K Behandlung zur Erhöhung der Homogenität9,14,34. Wir haben uns entschieden, diesen Schritt nicht umzusetzen, da er Virionproteine mit einer Rate denaturieren kann, die virale RNA dem Wärmeabbau aussetzt35. Darüber hinaus kann die Probenverdünnung mit Proteinase K positive Proben mit weniger Viruspartikeln maskieren, wodurch die Empfindlichkeit verringert wird. Darüber hinaus wurden die Assay-Ergebnisse mit einem kommerziell erhältlichen Speichel-basierten SARS-CoV-2-Assay (Logix Smart COVID-19) verglichen, der eine magnetische Perlen-RNA-Extraktion verwendet (Tabelle 5). Es wurde festgestellt, dass der aktuelle Assay im Vergleich zum kommerziell erhältlichen Assay besser geeignet war, schwach positive Proben nachzuweisen.
Es ist schwierig, die Anzahl der Viruskopien im Speichel nur mit RT-qPCR zu quantifizieren, da die qPCR semi-quantitativ ist. Es gibt inhärente Unterschiede zwischen den Ct-Werten, die auf technische Einschränkungen zurückzuführen sind. Die Genkopienzahl kann aus Ct-Werten bestimmt werden (Abbildung 4) und entspricht in etwa der viralen Kopienzahl. Eine mögliche Lösung zur Bestimmung der viralen Kopienzahl in Speichelproben ist die ddPCR, die eine harte Quantifizierung von Genkopien in der Reaktion ermöglicht. Wir glauben jedoch, dass es angemessen ist, Klinikern qualitative Ergebnisse zu liefern, und der relative virale Gehalt kann über Proben hinweg verglichen werden, die mit unseren Methoden verarbeitet werden.
Trotz einiger Einschränkungen, die sich bei der Verwendung von Speichel ergeben, erweist sich der SARS-CoV-2-Assay durch speichelbasierte RT-qPCR als effektive Methode für den schnellen und zuverlässigen Nachweis viraler RNA in jeder Testskala. Dies gilt insbesondere in Verbindung mit dem Einsatz von Open-Source-Liquid-Handling-Systemen. Dieser Testansatz kann modifiziert werden, um andere für die Diagnostik relevante Nukleinsäuresequenzen wie Infektionserreger, Krankheitsmarker oder andere Viren nachzuweisen. Dies macht den Assay sowohl für klinische als auch für Forschungsdiagnosebemühungen anwendbar.
Offenlegungen
Die Autoren haben nichts offenzulegen. Der im Protokoll beschriebene Assay fällt unter die von der Yale School of Public Health eingereichte SalivaDirect EUA.
Danksagungen
Die Autoren danken Clemsons Verwaltung, dem medizinischen Personal und den Mitarbeitern des klinischen Labors im REDDI Lab, die bei der Implementierung und Verwaltung von SARS-CoV-2-Tests geholfen haben. Wir danken Dr. Phillip Buckhaults und Dr. Carolyn Bannister von der University of South Carolina für die erste Projektberatung und Branchenkontakte für die Beschaffung von Ausrüstungen. Wir danken vielen Studenten, Professoren und Mitarbeitern für ihre Unterstützung bei der Probensammlung. Vielen Dank an die Creative Inquiry-Studenten für die Standard-Kurvendatenerfassung. Die Finanzierung für diese Studie wurde aus dem National Institutes of Health-Zuschuss P20GM121342 (vergeben an DD und LGP), dem Clemson Athletic Department, dem Vice President for Research der Clemson University und dem South Carolina Governor & Joint Bond Review Committee erhalten.
Materialien
| Name | Company | Catalog Number | Comments |
| 100% EtOH | Fisher scientific | 22-032-601 | |
| 20 uL Filtered Pipette Tips | Opentrons | 20uL tips | |
| 2mL Microcentrifuge Tubes | Fisher Scientific | 14-666-313 | Alternate product may be used |
| Armadillo PCR Plate, 384-well, clear, white wells | Thermo Scientific | AB3384 | Alternate product may be used |
| Celltreat 2mL 96 Deep Well Plates | Fisher Scientific | 50-828-743 | For mastermix preparation |
| Clear PCR Sealing Sheets | Thermo Scientific | AB0558 | Alternate product may be used |
| DPEC Treated Water | Ambion (Thermo Scientific) | AM9916 | |
| Flip Cap 50 mL Conical Tubes | VWR | 75845-210 | For sample collection |
| Foil PCR Sealing Sheets | Thermo Scientific | AB0626 | For storage of mastermix plates, Alternate product may be used |
| HS_RPP30 Synthetic DNA | Integrated DNA Technologies | 299788131 | P1 positive control |
| Luna Buffer Probe One-Step Reaction | New England Biolabs | M3006B | |
| Luna WarmStart RT Enzyme Mix | New England Biolabs | M3002B | |
| nCOV_N1 Forward Primer, 100 nmol | Integrated DNA Technologies | 10006830 | |
| nCOV_N1 Probe Aliquot, 50 nmol | Integrated DNA Technologies | 10006832 | Probe can be synthesized by other vendors with SYBR or FAM fluophores |
| nCOV_N1 Reverse Primer, 100 nmol | Integrated DNA Technologies | 10006831 | |
| Opentron HEPA Filter Module | Opentrons | N/A | Not required, but useful to reduce contamination |
| Opentron Multichannel Attachment, P20 | Opentrons | 999-00005 | For mastermix preparation |
| Opentron OT-2 Liquid Handling Robot | Opentrons | OT-2 | |
| Opentron Pipette Attachment, P20 | Opentrons | 999-0000215 | For sample loading |
| Oven | Memmert | UF450 PLUS 208V-3PH | |
| PCR Tubes (rnase, dnase free) | Fisher Scientific | 14-230-225 | For aliquots of positive and neg controls |
| PolarSafe Aluminum Cooling Block, 15-Well (1.5/2.0 mL Tubes) | VWR | 10808-952 | |
| PolarSaf Aluminum Cooling Block, 24-Well (0.5mL tubes) | VWR | 10808-956 | |
| RNAse P (ATTO 647) Probe, 50 nmol | Integrated DNA Technologies | 10007062 | Probe can be synthesized by other vendors with Cy5 fluorophore |
| RNAse P Forward Primer, 100nmol | Integrated DNA Technologies | 10006836 | |
| RNAse P Reverse Primer, 100 nmol | Integrated DNA Technologies | 10006837 | |
| Sars-CoV-2 Synthetic RNA Control 2 | Twist Biosciences | 102024 / 103907 / 103909 | N1 Positive Control |
| Scanners | Code | CR1500 | Only required when scaling up |
| Small HEPA Filtered Hood | Erlab | Captair Bio 321 | For mastermix preparation |
| Thermocycler CFX384 Touch | Biorad | CFX384 Touch | Alternate models can be used, e.g. CFX384 Opus |
| X-acto Knife Set | Staples | N/A | To cut foil for keeping control wells covered |
Referenzen
- Zhu, N., et al. A novel coronavirus from patients with pneumonia in China, 2019. New England Journal Medicine. 382 (8), 727-733 (2020).
- Chen, J. Pathogenicity and transmissibility of 2019-nCoV-A quick overview and comparison with other emerging viruses. Microbes and Infection. 22 (2), 69-71 (2020).
- Petersen, E., et al. Comparing SARS-CoV-2 with SARS-CoV and influenza pandemics. The Lancet. Infectious Diseases. 20 (9), 238-244 (2020).
- Honein, M. A., et al. Summary of Guidance for Public Health Strategies to Address High Levels of Community Transmission of SARS-CoV-2 and Related Deaths, December 2020. MMWR. Morbidity and Mortality Weekly Report. 69 (49), 1860-1867 (2020).
- World Health Organization. Surveillance strategies for COVID-19 human infection: interim guidance. World Health Organization. , Available from: https://apps.who.int/iris/handle/10665/332051 (2020).
- Screening testing for early detection of SARS-CoV-2 infection. Division of viral diseases. Centers for Disease Control. , Available from: https://www.cdc.gov/coronavirus/2019-ncov/hcp/tsting-overview.html#PublicHealthSurveillance (2020).
- Larremore, D. B., et al. Test sensitivity is secondary to frequency and turnaround time for COVID-19 screening. Science Advances. 7 (1), 5393(2021).
- Sethuraman, N., Jeremiah, S. S., Ryo, A. Interpreting Diagnostic Tests for SARS-CoV-2. JAMA. 323 (22), 2249-2251 (2020).
- Chu, A. W., et al. Evaluation of simple nucleic acid extraction methods for the detection of SARS-CoV-2 in nasopharyngeal and saliva specimens during global shortage of extraction kits. Journal of clinical virology: the official publication of the Pan American Society for Clinical Virology. 129, 104519(2020).
- Guan, D., et al. Global supply-chain effects of COVID-19 control measures. Nature Human Behaviour. 4 (6), 577-587 (2020).
- Bastos, M. L., Perlman-Arrow, S., Menzies, D., Campbell, J. R. The Sensitivity and Costs of Testing for SARS-CoV-2 Infection With Saliva Versus Nasopharyngeal Swabs: A Systematic Review and Meta-analysis. Annals of Internal Medicine. 174 (4), 501-510 (2021).
- Pasomsub, E., et al. Saliva sample as a non-invasive specimen for the diagnosis of coronavirus disease 2019: a cross-sectional study. Clinical Microbiology and Infection: The Official Publication of The European Society of Clinical Microbiology and Infectious Diseases. 27 (2), (2021).
- To, K. K., et al. Consistent Detection of 2019 Novel Coronavirus in Saliva. Clinical Infectious Diseases: An Official Publication of The Infectious Diseases Society of America. 71 (15), 841-843 (2020).
- Vogels, C. B., et al. SalivaDirect: A simplified and flexible platform to enhance SARS-CoV-2 testing capacity. Med (New York, N.Y.). 2 (3), 263-280 (2021).
- Griesemer, S. B., et al. Evaluation of Specimen Types and Saliva Stabilization Solutions for SARS-CoV-2 Testing. Journal of Clinical Microbiology. 59 (5), 1418-1420 (2021).
- Wehrhahn, M. C., et al. Self-collection: An appropriate alternative during the SARS-CoV-2 pandemic. Journal of Clinical Virology: The Official Publication of The Pan American Society for Clinical Virology. 128, 104417(2020).
- Barza, R., Patel, P., Sabatini, L., Singh, K. Use of a simplified sample processing step without RNA extraction for direct SARS-CoV-2 RT-PCR detection. Journal of Clinical Virology: The Official Publication of the Pan American Society for Clinical Virology. 132, 104587(2020).
- Paltiel, A. D., Zheng, A., Walensky, R. P. Assessment of SARS-CoV-2 Screening Strategies to Permit the Safe Reopening of College Campuses in the United States. JAMA Network Open. 3 (7), 2016818(2020).
- Centers for Disease Control. 2019-Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Primers and Probes. U.S. Department of Health and Human Services. , Available from: https://www.cdc.gov/coronavirus/2019-ncov/lab/rt-pcr-panel-primer-probes.html (2020).
- Cresswell, K., Ramalingam, S., Sheikh, A. Can Robots Improve Testing Capacity for SARS-CoV-2. Journal of Medical Internet Research. 22 (8), 20169(2020).
- Villanueva-Cañas, J. L., et al. Implementation of an open-source robotic platform for SARS-CoV-2 testing by real-time RT-PCR. PLoS One. 16 (7), 0252509(2021).
- Robot Boosts COVID-19 Testing Efficiency. University of South Carolina College of Pharmacy. , Available from: https://sc.edu/study/colleges_schools/pharmacy/about/news/2020/robot-boosts-testing-effort.php (2020).
- Matic, N., et al. Practical challenges to the clinical implementation of saliva for SARS-CoV-2 detection. European Journal of Clinical Microbiology & Infectious Diseases: Official Publication of The European Society of Clinical Microbiology. 40 (2), 447-450 (2021).
- Sahajpal, N. S., et al. SalivaSTAT: Direct-PCR and Pooling of Saliva Samples Collected in Healthcare and Community Setting for SARS-CoV-2 Mass Surveillance. Diagnostics. 11 (5), Basel, Switzerland. 904(2021).
- Genzen, J. R., et al. Challenges and Opportunities in Implementing Total Laboratory Automation. Clinical Chemistry. 64 (2), 259-264 (2018).
- Archetti, C., Montanelli, A., Finazzi, D., Caimi, L., Garrafa, E. Clinical Laboratory Automation: A Case Study. Journal of Public Health Research. 6 (1), 881(2017).
- Hecker, K. H., Roux, K. H. High and low annealing temperatures increase both specificity and yield in touchdown and stepdown PCR. BioTechniques. 20 (3), 478-485 (1996).
- Bhat, P. P., et al. Formation of beads-on-a-string structures during break-up of viscoelastic filaments. Nature Physics. 6, 625-631 (2010).
- Miller, C. S., et al. Current developments in salivary diagnostics. Biomarkers in Medicine. 4 (1), 171-189 (2010).
- Moreno-Contreras, J., et al. Saliva Sampling and Its Direct Lysis, an Excellent Option To Increase the Number of SARS-CoV-2 Diagnostic Tests in Settings with Supply Shortages. Journal of Clinical Microbiology. 58 (10), 01659(2020).
- Wang, W., et al. Detection of SARS-CoV-2 in Different Types of Clinical Specimens. JAMA. 323 (18), 1843-1844 (2020).
- Landry, M. L., Criscuolo, J., Peaper, D. R. Challenges in use of saliva for detection of SARS CoV-2 RNA in symptomatic outpatients. Journal of Clinical Virology: The Official Publication of The Pan American Society for Clinical Virology. 130, 104567(2020).
- Lista, M. J., et al. Resilient SARS-CoV-2 diagnostics workflows including viral heat inactivation. PLoS One. 16 (9), 0256813(2021).
- Brotons, P., et al. Validation and implementation of a direct RT-qPCR method for rapid screening of SARS-CoV-2 infection by using non-invasive saliva samples. International Journal of Infectious Diseases: IJID: Official Publication of The International Society for Infectious Diseases. 110, 363-370 (2021).
- Batéjat, C., Grassin, Q., Manuguerra, J. C., Leclercr, I. Heat inactivation of the severe acute respiratory syndrome coronavirus 2. Journal of Biosafety and Biosecurity. 3 (1), 1-3 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten