需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
葡萄糖酸氯己定诱导腹膜损伤的小鼠模型
* 这些作者具有相同的贡献
摘要
本协议建立了葡萄糖酸氯己定(CG)诱导的腹膜纤维化的腹膜透析(PD)小鼠模型。与其他PD动物模型相比,目前的模型简单易用。
摘要
腹膜纤维化是腹膜透析(PD)的重要并发症。为了调查和解决这个问题,需要适当的PD动物模型。本协议建立了葡萄糖酸氯己定(CG)诱导的腹膜纤维化模型,该模型模拟PD患者的状况。 腹膜内注射0.1%的CG在15%乙醇中3周(每隔一天给药),在雄性C57BL / 6小鼠中总共9次诱导腹膜纤维化。然后在第22天进行腹膜功能测试。处死小鼠后,收获腹壁壁腹膜和肝脏内脏腹膜。在Masson的三色染色后进行显微镜分析时,它们更厚,纤维化更多。超滤速率降低,葡萄糖质量转运表明CG诱导的腹膜通透性增加。这样建立的PD模型在改善PD技术、透析疗效和延长患者生存期方面具有应用价值。
引言
腹膜透析(PD)是一种肾脏替代疗法。但是,PD存在无法解决的问题。例如,长期PD治疗可引起腹膜损伤,最终导致超滤失败和治疗停止1,2,3,4,5,6。腹膜纤维化是最严重的并发症之一7,8。腹膜纤维化的特征是间质内细胞外基质的沉积和积累,以及腹膜9,10的新血管生成和血管病变。
这些腹膜变化的主要原因是复发性腹膜炎和透析液的非生物相容性,它们是高渗、高葡萄糖、低pH和葡萄糖降解产物积累11,12。因此,合适的动物实验模型可以帮助研究人员更好地研究PD治疗过程中腹膜的生理和病理变化。因此,建立动物PD模型对于提高PD技术和透析疗效,延长患者生存期具有重要意义。本研究旨在通过腹膜内(ip)注射葡萄糖酸氯己定(CG)来生成PD小鼠模型,如前所述13,14。与其他PD动物模型相比,该PD小鼠模型简单,易于使用且可行。
Access restricted. Please log in or start a trial to view this content.
研究方案
所有小鼠实验均由E-DA医院/义寿大学实验动物中心批准,并根据"实验动物护理和使用指南"(NRC,美国2011)进行处理。雄性C57BL / 6小鼠,7-8周龄,用于本研究。
1. 化学制剂
- 通过在15%乙醇中稀释0.1%葡萄糖酸氯己定(CG,见 材料表)来制备化学刺激物。
2. 动物治疗
- 指定三只小鼠作为对照组。每隔一天进行 1 mL/kg 0.9% 生理盐水 (NS) 的腹膜内注射 (ip),持续 3 周,共 9 次。
- 将三只小鼠分配到腹膜纤维化组。使用葡萄糖酸氯己定(CG)以12.5μL / g体重的剂量腹膜注射0.1%的CG在15%乙醇中(步骤1.1)诱导腹膜纤维化。每隔一天执行一次,持续 3 周,总共 9 次。
3. 腹膜功能检查(改良腹膜平衡试验)
- 制备含有4.25%葡萄糖的透析溶液。用注射器抽取0.5mL透析液样品,然后检查透析液样品中的葡萄糖浓度。
注意:葡萄糖浓度根据己糖激酶/ G6PD方法测定。透析液样品进行L型Glu 2测定,并用生化分析仪进行研究(见 材料表)。这是初始透析液葡萄糖浓度。 - 通过肌肉注射唑莱地尔和赛拉嗪(以1:2体积的比例制备,参见 材料表)以20μL / 20gw的剂量麻醉小鼠。此外,在眼睛上使用兽医软膏以防止麻醉下干燥。
- 进行腹膜滴注透析溶液(2mL / 20g体重)。
- 30分钟后,评估并验证缺乏脚趾夹反射的麻醉深度。然后,在腹部中线(剑突下方)进行垂直切口,然后打开小鼠的腹部并用注射器收集腹膜内液(定义为"体积1")。然后,测量干净干燥的棉花的重量,并将棉花放入小鼠的腹腔中以吸收残留的腹腔内液。最后,再次测量棉花重量。
注意:棉花的体重增加等于残留腹腔内液的重量。然后,转换为获得的体积(比重:1 g/cm3;定义为"体积2")。最终透析液体积为第 1 卷加第 2 卷。 - 使用 0.5 mL 透析液样品(最终透析液)测量葡萄糖浓度。这是最终的透析液葡萄糖浓度。
- 使用公式15 计算净超滤:
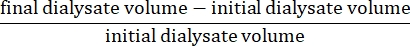
- 使用以下公式15计算腹膜通透性:
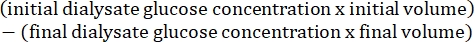
4.腹壁肌肉和肝脏的组织准备及组织学分析
- 通过心脏穿刺(静脉切开术) 处 死小鼠3,16。
- 切开腹壁(1 cm x 1 cm)和全肝切除术。将小鼠的腹壁和肝组织在10%中性缓冲福尔马林中固定过夜。
- 准备腹壁肌肉和肝脏的3μm厚的石蜡切片,并根据先前发表的报告17进行组织学分析。
- 使用形态测量法评估小鼠腹壁的顶腹膜和肝脏表面的内脏腹膜18。
- 使用统计和绘图软件进行统计分析(见 材料表)。将所有数据表示为平均值± SD,并使用t 检验 19 分析统计显著性。将 P < 0.05 的值定义为显著结果。
Access restricted. Please log in or start a trial to view this content.
结果
在图1A,B中,在Masson三色染色17下,腹壁壁壁腹膜明显增厚且纤维化更多,表明在CG暴露组中,腹膜纤维化比对照盐水组(NS)更严重。在图2A,B中,肝脏表面的内脏腹膜也明显增厚且纤维化,从而证明在CG暴露组中,腹膜纤维化比对照盐水组(NS)更严重。在图3A中,CG组的超滤速率降低?...
Access restricted. Please log in or start a trial to view this content.
讨论
本研究通过腹腔注射CG提出了小鼠PD模型,结果显示该模型存在腹膜纤维化和功能恶化,模拟PD患者的病情。
协议中有几个关键步骤。首先,为了进行CG或NS的腹腔注射,必须使用镊子拾取小鼠的腹壁皮肤,以防止穿刺引起的腹膜内器官损伤。其次,在收集腹壁腹膜进行组织学分析时,必须避免腹腔注射损伤的区域。
在腹膜纤维化的几种实验动物模型中,?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
我们衷心感谢Shin-Han Tseng对这项研究的批判性讨论和部分执行。本研究得到了台湾E-DA医院研究基金和国立成功大学的EDAHP110003和NCKUEDA110002的支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 0.9% Normal Saline | Y F CHEMICAL CORP., New Taipei City, Taiwan | - | |
| 10% neutral buffered formalin | Taiwan Burnett International Co., Ltd., Taipei City, Taiwan | 00002A | |
| Automatic biochemical analyzer | Hitachi Ltd., Tokyo, Japan | Labospect Series 008 | for determining glucose concentration |
| Chlorhexidine digluconate solution, 20% in H2O | Sigma-Aldrich, MO, USA | C9394 | diluted to 0.1% with 15% ethanol for injection |
| Ethanol | Avantor Performance Materials, LLC, PA, USA | BAKR8006-05 | diluted to 15% with normal saline for working concentration |
| Glucose (Dianeal) | Baxter International, Inc., IL, USA | FNB9896 | Commercial dialysis solution (4.25%) |
| GraphPad Prism 8.0 | GraphPad Software, Inc., CA, US | ||
| L-type Glu 2 assay | FUJIFILM Wako, Japan | 461-32403 | |
| Xylazine 20 | Juily Pharmaceutical Co., Ltd., New Taipei City, Taiwan | - | |
| Zoletil 50 | Virbac Laboratories, Carros, France | - |
参考文献
- Han, S. H., et al. Improving outcome of CAPD: twenty-five years' experience in a single Korean center. Peritoneal Dialysis International. 27 (4), 432-440 (2007).
- Kawaguchi, Y., Hasegawa, T., Nakayama, M., Kubo, H., Shigematu, T. Issues affecting the longevity of the continuous peritoneal dialysis therapy. Kidney International Supplements. 62, 105-107 (1997).
- Lee, Y. C., et al. Vitamin D can ameliorate chlorhexidine gluconate-induced peritoneal fibrosis and functional deterioration through the inhibition of epithelial-to-mesenchymal transition of mesothelial cells. BioMed Research International. 2015, 595030(2015).
- Nakamoto, H., Kawaguchi, Y., Suzuki, H. Is technique survival on peritoneal dialysis better in Japan. Peritoneal Dialysis International. 26 (2), 136-143 (2006).
- Schaefer, F., Klaus, G., Muller-Wiefel, D. E., Mehls, O. Current practice of peritoneal dialysis in children: results of a longitudinal survey. Mid European Pediatric Peritoneal Dialysis Study Group (MEPPS). Peritoneal Dialysis International. 19, Suppl 2 445-449 (1999).
- Woodrow, G., Turney, J. H., Brownjohn, A. M. Technique failure in peritoneal dialysis and its impact on patient survival. Peritoneal Dialysis International. 17 (4), 360-364 (1997).
- Schmidt, D. W., Flessner, M. F. Pathogenesis and treatment of encapsulating peritoneal sclerosis: basic and translational research. Peritoneal Dialysis International. 28, Suppl 5 10-15 (2008).
- Augustine, T., Brown, P. W., Davies, S. D., Summers, A. M., Wilkie, M. E. Encapsulating peritoneal sclerosis: clinical significance and implications. Nephron Clinical Practice. 111 (2), 149-154 (2009).
- Di Paolo, N., Nicolai, G. A., Garosi, G. The peritoneum: from histological studies to mesothelial transplant through animal experimentation. Peritoneal Dialysis International. 28, Suppl 5 5-9 (2008).
- Fusshoeller, A. Histomorphological and functional changes of the peritoneal membrane during long-term peritoneal dialysis. Pediatric Nephrology. 23 (1), 19-25 (2008).
- Goffin, E. Peritoneal membrane structural and functional changes during peritoneal dialysis. Seminars in Dialysis. 21 (3), 258-265 (2008).
- Ito, T., Yorioka, N. Peritoneal damage by peritoneal dialysis solutions. Clinical and Experimental Nephrology. 12 (4), 243-249 (2008).
- Io, K., et al. SAHA suppresses peritoneal fibrosis in mice. Peritoneal Dialysis International. 35 (3), 246-258 (2015).
- Yoh, K., Ojima, M., Takahashi, S. Th2-biased GATA-3 transgenic mice developed severe experimental peritoneal fibrosis compared with Th1-biased T-bet and Th17-biased RORgammat transgenic mice. Experimental Animals. 64 (4), 353-362 (2015).
- Karl, Z. J. T., et al. Peritoneal Equilibration Test. Peritoneal Dialysis International. 7 (3), 138-148 (1987).
- Lee, Y. C., et al. The clinical implication of vitamin D nanomedicine for peritoneal dialysis-related peritoneal damage. International Journal of Nanomedicine. 14, 9665-9675 (2019).
- Goldner, J. A. Modification of the masson trichrome technique for routine laboratory purposes. The American Journal of Pathology. 14 (2), 237-243 (1938).
- Cheng, F. Y., et al. Novel application of magnetite nanoparticle-mediated vitamin D3 delivery for peritoneal dialysis-related peritoneal damage. International Journal of Nanomedicine. 16, 2137-2146 (2021).
- Ross, A., Willson, V. L. Basic and Advanced Statistical Tests: Writing Results Sections and Creating Tables and Figures. , SensePublishers. 13-16 (2017).
- Suga, H., et al. Preventive effect of pirfenidone against experimental sclerosing peritonitis in rats. Experimental and Toxicologic Pathology. 47 (4), 287-291 (1995).
- Ishii, Y., et al. An experimental sclerosing encapsulating peritonitis model in mice. Nephrology Dialysis Transplantation. 16 (6), 1262-1266 (2001).
- Nishino, T., et al. Antisense oligonucleotides against collagen-binding stress protein HSP47 suppress peritoneal fibrosis in rats. Kidney International. 64 (3), 887-896 (2003).
- Mishima, Y., et al. Enhanced expression of heat shock protein 47 in rat model of peritoneal fibrosis. Peritoneal Dialysis International. 23 (1), 14-22 (2003).
- Kushiyama, T., et al. Effects of liposome-encapsulated clodronate on chlorhexidine gluconate-induced peritoneal fibrosis in rats. Nephrology Dialysis Transplantation. 26 (10), 3143-3154 (2011).
- Nishino, T., et al. Involvement of lymphocyte infiltration in the progression of mouse peritoneal fibrosis model. Renal Failure. 34 (6), 760-766 (2012).
- Lua, I., Li, Y., Pappoe, L. S., Asahina, K. Myofibroblastic conversion and regeneration of mesothelial cells in peritoneal and liver fibrosis. The American Journal of Pathology. 185 (12), 3258-3273 (2015).
- Kitamura, M., et al. Epigallocatechin gallate suppresses peritoneal fibrosis in mice. Chemico-Biological Interactions. 195 (1), 95-104 (2012).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。