Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein Mäusemodell der Chlorhexidingluconat-induzierten Peritonealschädigung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll etabliert ein Peritonealdialyse (PD)-Mausmodell der Chlorhexidingluconat (CG)-induzierten Peritonealfibrose. Das aktuelle Modell ist im Vergleich zu anderen PD-Tiermodellen einfach und leicht zu bedienen.
Zusammenfassung
Die Peritonealfibrose ist eine wichtige Komplikation der Peritonealdialyse (PD). Um dieses Problem zu untersuchen und anzugehen, ist ein geeignetes Tiermodell für Parkinson erforderlich. Das vorliegende Protokoll etabliert ein Chlorhexidingluconat (CG)-induziertes Peritonealfibrosemodell, das den Zustand eines Patienten mit Parkinson nachahmt. Die Peritonealfibrose wurde durch intraperitoneale Injektion von 0,1% CG in 15% Ethanol für 3 Wochen (jeden zweiten Tag verabreicht) induziert, insgesamt neunmal bei männlichen C57BL/6-Mäusen. Am 22. Tag wurden dann peritoneale Funktionstests durchgeführt. Nachdem die Mäuse getötet worden waren, wurden das parietale Peritoneum der Bauchdecke und das viszerale Peritoneum der Leber geerntet. Sie waren dicker und fibrotischer, wenn sie nach Massons Trichromfärbung mikroskopisch analysiert wurden. Die Ultrafiltrationsrate nahm ab und der Glukose-Stofftransport zeigte eine CG-induzierte Erhöhung der peritonealen Permeabilität an. Das so etablierte PD-Modell kann Anwendungen zur Verbesserung der PD-Technologie, der Wirksamkeit der Dialyse und der Verlängerung des Überlebens der Patienten haben.
Einleitung
Die Peritonealdialyse (PD) ist eine Form der Nierenersatztherapie. PD hat jedoch Probleme, die nicht gelöst werden können. Zum Beispiel kann eine langfristige Parkinson-Behandlung zu Peritonealschäden führen, die schließlich zum Versagen der Ultrafiltration und zum Absetzen der Behandlung führen 1,2,3,4,5,6. Die Peritonealfibrose ist eine der schwerwiegendsten Komplikationen 7,8. Die peritoneale Fibrose ist gekennzeichnet durch die Ablagerung und Akkumulation von extrazellulärer Matrix im Interstitium sowie durch Neo-Angiogenese und Vaskulopathie des Peritoneums 9,10.
Die Hauptursachen für diese peritonealen Veränderungen sind rezidivierende Peritonitis und Nicht-Biokompatibilität des Dialysats, die hyperosmotisch, hohe Glukose, niedriger pH-Wert und Akkumulation von Glukoseabbauprodukten sind11,12. Daher können geeignete Tierversuchsmodelle den Forschern helfen, die physiologischen und pathologischen Veränderungen des Peritoneums während der Parkinson-Therapie besser zu untersuchen. Daher ist die Etablierung eines tierischen Parkinson-Modells wichtig, um die Parkinson-Technologie und die Wirksamkeit der Dialyse zu verbessern und das Überleben der Patienten zu verlängern. Diese Studie zielte darauf ab, ein PD-Mausmodell durch intraperitoneale (i.p.) Injektion von Chlorhexidingluconat (CG) zu generieren, wie zuvor beschrieben13,14. Dieses PD-Mausmodell ist einfach, leicht zu bedienen und im Vergleich zu anderen PD-Tiermodellen machbar.
Protokoll
Alle Mausversuche wurden vom Laboratory Animal Center des E-DA Hospital/ I-Shou University genehmigt und nach dem "Guide for the Care and Use of Laboratory Animals" (NRC, USA 2011) durchgeführt. Männliche C57BL/6-Mäuse im Alter von 7-8 Wochen wurden für die vorliegende Studie verwendet.
1. Chemische Zubereitung
- Bereiten Sie den chemischen Reizstoff vor, indem Sie 0,1% Chlorhexidingluconat (CG, siehe Materialtabelle) in 15% Ethanol verdünnen.
2. Behandlung von Tieren
- Weisen Sie drei Mäuse als Kontrollgruppe zu. Führen Sie 3 Wochen lang jeden zweiten Tag eine intraperitoneale Injektion (i.p.) von 1 ml/kg 0,9% normaler Kochsalzlösung (NS) durch, insgesamt neunmal.
- Ordnen Sie drei Mäuse der Peritonealfibrose-Gruppe zu. Induzieren Sie eine Peritonealfibrose mit Chlorhexidingluconat (CG) durch Verabreichung von i.p. Injektionen von 0,1% CG in 15% Ethanol (Schritt 1.1) in einer Dosis von 12,5 μl/g Körpergewicht. Führen Sie dies 3 Wochen lang jeden zweiten Tag durch, insgesamt neunmal.
3. Peritoneale Funktionstests (modifizierter peritonealer Gleichgewichtstest)
- Bereiten Sie eine Dialyselösung mit 4,25% Glukose vor. Ziehen Sie 0,5 ml Dialysatprobe mit einer Spritze und überprüfen Sie dann die Glukosekonzentration in der Dialysatprobe.
HINWEIS: Die Glukosekonzentration wird nach der Hexokinase/G6PD-Methode bestimmt. Dialysatproben wurden mit dem L-Typ-Glu-2-Assay zugänglich gemacht und mit einem biochemischen Analysator untersucht (siehe Materialtabelle). Dies ist die anfängliche Dialysat-Glukosekonzentration. - Anästhesie der Mäuse durch intramuskuläre Injektion von Zoletil und Xylazin (hergestellt im Verhältnis 1:2 nach Volumen, siehe Materialtabelle) in einer Dosis von 20 μl/20 gw. Verwenden Sie zusätzlich Tierarztsalbe auf den Augen, um Trockenheit unter Narkose zu verhindern.
- Führen Sie eine i.p. Instillation der Dialyselösung durch (2 ml/20 g Körpergewicht).
- Beurteilen und überprüfen Sie nach 30 Minuten die Anästhesietiefe ohne Zehenklemmreflex. Führen Sie dann einen vertikalen Schnitt in der Mittellinie des Bauches (unterhalb des Xiphoid-Prozesses) durch, öffnen Sie dann den Bauch der Mäuse und sammeln Sie die intraperitoneale Flüssigkeit mit einer Spritze (definiert als "Volumen 1"). Messen Sie dann das Gewicht einer sauberen und trockenen Baumwolle und legen Sie die Baumwolle in die Bauchhöhle der Mäuse, um die restliche intraperitoneale Flüssigkeit aufzunehmen. Zum Schluss messen Sie noch einmal das Baumwollgewicht.
HINWEIS: Die Gewichtszunahme von Baumwolle entspricht dem Gewicht der verbleibenden intraperitonealen Flüssigkeit. Konvertieren Sie dann in das erhaltene Volumen (spezifisches Gewicht: 1 g/cm3; definiert als "Volumen 2"). Das endgültige Dialysatvolumen ist Band 1 plus Band 2. - Verwenden Sie 0,5 ml Dialysatprobe (Enddialysat), um die Glukosekonzentration zu messen. Dies ist die endgültige Dialysat-Glukosekonzentration.
- Berechnen Sie die Netto-Ultrafiltration mit der Formel15:
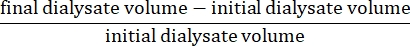
- Berechnen Sie die peritoneale Permeabilität mit der folgenden Formel15:
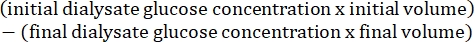
4. Gewebepräparation der Bauchdecke, des Muskels und der Leber und histologische Analyse
- Opfern Sie die Mäuse durch Herzpunktion (Phlebotomie)3,16.
- Schneiden Sie die Bauchdecke (1 cm x 1 cm) und die totale Hepatektomie. Fixieren Sie die Bauchdecke und das Lebergewebe der Mäuse über Nacht in 10% neutral gepuffertem Formalin.
- Bereiten Sie 3 μm dicke Paraffinschnitte des Bauchwandmuskels und der Leber vor und führen Sie eine histologische Analyse gemäß dem zuvor veröffentlichten Bericht17 durch.
- Beurteilen Sie das parietale Peritoneum der Bauchdecke und das viszerale Peritoneum der Leberoberflächen der Mäuse mit Hilfe der Morphometrie18.
- Führen Sie statistische Analysen mit Hilfe von Statistik- und Grafiksoftware durch (siehe Materialtabelle). Alle Daten werden als Mittelwert ± SD ausgedrückt und mit einem t-Test19 auf statistische Signifikanz analysiert. Definieren Sie Werte mit P < 0,05 als signifikante Ergebnisse.
Ergebnisse
In Abbildung 1A, B war das parietale Peritoneum der Bauchdecke unter der Masson-Trichromfärbung deutlich dicker und fibrotischer17, was darauf hindeutet, dass die Peritonealfibrose in der CG-exponierten Gruppe schwerer ist als in der Kontrollgruppe mit Kochsalzlösung (NS). In Abbildung 2A,B war das viszerale Peritoneum der Leberoberflächen ebenfalls deutlich dicker und fibrotischer, was beweist, dass die Peritonealfibr...
Diskussion
In dieser Studie wird ein Maus-PD-Modell durch i.p. Injektion von CG, und die Ergebnisse zeigten Peritonealfibrose und funktionelle Verschlechterung in diesem Modell, was den Zustand des Parkinson-Patienten nachahmte.
Es gibt mehrere kritische Schritte im Protokoll. Zunächst muss für die Durchführung einer IP-Injektion von CG oder NS die Bauchwandhaut der Maus mit einer Pinzette aufgenommen werden, um eine punktionsbedingte intraperitoneale Organschädigung zu verhindern. Zweitens muss bei ...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Wir danken Shin-Han Tseng herzlich für die kritische Diskussion und teilweise Durchführung der Studie. Diese Studie wurde von EDAHP110003 und NCKUEDA110002 von der Research Foundation of E-DA Hospital und der National Cheng Kung University, Taiwan, unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.9% Normal Saline | Y F CHEMICAL CORP., New Taipei City, Taiwan | - | |
| 10% neutral buffered formalin | Taiwan Burnett International Co., Ltd., Taipei City, Taiwan | 00002A | |
| Automatic biochemical analyzer | Hitachi Ltd., Tokyo, Japan | Labospect Series 008 | for determining glucose concentration |
| Chlorhexidine digluconate solution, 20% in H2O | Sigma-Aldrich, MO, USA | C9394 | diluted to 0.1% with 15% ethanol for injection |
| Ethanol | Avantor Performance Materials, LLC, PA, USA | BAKR8006-05 | diluted to 15% with normal saline for working concentration |
| Glucose (Dianeal) | Baxter International, Inc., IL, USA | FNB9896 | Commercial dialysis solution (4.25%) |
| GraphPad Prism 8.0 | GraphPad Software, Inc., CA, US | ||
| L-type Glu 2 assay | FUJIFILM Wako, Japan | 461-32403 | |
| Xylazine 20 | Juily Pharmaceutical Co., Ltd., New Taipei City, Taiwan | - | |
| Zoletil 50 | Virbac Laboratories, Carros, France | - |
Referenzen
- Han, S. H., et al. Improving outcome of CAPD: twenty-five years' experience in a single Korean center. Peritoneal Dialysis International. 27 (4), 432-440 (2007).
- Kawaguchi, Y., Hasegawa, T., Nakayama, M., Kubo, H., Shigematu, T. Issues affecting the longevity of the continuous peritoneal dialysis therapy. Kidney International Supplements. 62, 105-107 (1997).
- Lee, Y. C., et al. Vitamin D can ameliorate chlorhexidine gluconate-induced peritoneal fibrosis and functional deterioration through the inhibition of epithelial-to-mesenchymal transition of mesothelial cells. BioMed Research International. 2015, 595030 (2015).
- Nakamoto, H., Kawaguchi, Y., Suzuki, H. Is technique survival on peritoneal dialysis better in Japan. Peritoneal Dialysis International. 26 (2), 136-143 (2006).
- Schaefer, F., Klaus, G., Muller-Wiefel, D. E., Mehls, O. Current practice of peritoneal dialysis in children: results of a longitudinal survey. Mid European Pediatric Peritoneal Dialysis Study Group (MEPPS). Peritoneal Dialysis International. 19, 445-449 (1999).
- Woodrow, G., Turney, J. H., Brownjohn, A. M. Technique failure in peritoneal dialysis and its impact on patient survival. Peritoneal Dialysis International. 17 (4), 360-364 (1997).
- Schmidt, D. W., Flessner, M. F. Pathogenesis and treatment of encapsulating peritoneal sclerosis: basic and translational research. Peritoneal Dialysis International. 28, 10-15 (2008).
- Augustine, T., Brown, P. W., Davies, S. D., Summers, A. M., Wilkie, M. E. Encapsulating peritoneal sclerosis: clinical significance and implications. Nephron Clinical Practice. 111 (2), 149-154 (2009).
- Di Paolo, N., Nicolai, G. A., Garosi, G. The peritoneum: from histological studies to mesothelial transplant through animal experimentation. Peritoneal Dialysis International. 28, 5-9 (2008).
- Fusshoeller, A. Histomorphological and functional changes of the peritoneal membrane during long-term peritoneal dialysis. Pediatric Nephrology. 23 (1), 19-25 (2008).
- Goffin, E. Peritoneal membrane structural and functional changes during peritoneal dialysis. Seminars in Dialysis. 21 (3), 258-265 (2008).
- Ito, T., Yorioka, N. Peritoneal damage by peritoneal dialysis solutions. Clinical and Experimental Nephrology. 12 (4), 243-249 (2008).
- Io, K., et al. SAHA suppresses peritoneal fibrosis in mice. Peritoneal Dialysis International. 35 (3), 246-258 (2015).
- Yoh, K., Ojima, M., Takahashi, S. Th2-biased GATA-3 transgenic mice developed severe experimental peritoneal fibrosis compared with Th1-biased T-bet and Th17-biased RORgammat transgenic mice. Experimental Animals. 64 (4), 353-362 (2015).
- Karl, Z. J. T., et al. Peritoneal Equilibration Test. Peritoneal Dialysis International. 7 (3), 138-148 (1987).
- Lee, Y. C., et al. The clinical implication of vitamin D nanomedicine for peritoneal dialysis-related peritoneal damage. International Journal of Nanomedicine. 14, 9665-9675 (2019).
- Goldner, J. A. Modification of the masson trichrome technique for routine laboratory purposes. The American Journal of Pathology. 14 (2), 237-243 (1938).
- Cheng, F. Y., et al. Novel application of magnetite nanoparticle-mediated vitamin D3 delivery for peritoneal dialysis-related peritoneal damage. International Journal of Nanomedicine. 16, 2137-2146 (2021).
- Ross, A., Willson, V. L. . Basic and Advanced Statistical Tests: Writing Results Sections and Creating Tables and Figures. , 13-16 (2017).
- Suga, H., et al. Preventive effect of pirfenidone against experimental sclerosing peritonitis in rats. Experimental and Toxicologic Pathology. 47 (4), 287-291 (1995).
- Ishii, Y., et al. An experimental sclerosing encapsulating peritonitis model in mice. Nephrology Dialysis Transplantation. 16 (6), 1262-1266 (2001).
- Nishino, T., et al. Antisense oligonucleotides against collagen-binding stress protein HSP47 suppress peritoneal fibrosis in rats. Kidney International. 64 (3), 887-896 (2003).
- Mishima, Y., et al. Enhanced expression of heat shock protein 47 in rat model of peritoneal fibrosis. Peritoneal Dialysis International. 23 (1), 14-22 (2003).
- Kushiyama, T., et al. Effects of liposome-encapsulated clodronate on chlorhexidine gluconate-induced peritoneal fibrosis in rats. Nephrology Dialysis Transplantation. 26 (10), 3143-3154 (2011).
- Nishino, T., et al. Involvement of lymphocyte infiltration in the progression of mouse peritoneal fibrosis model. Renal Failure. 34 (6), 760-766 (2012).
- Lua, I., Li, Y., Pappoe, L. S., Asahina, K. Myofibroblastic conversion and regeneration of mesothelial cells in peritoneal and liver fibrosis. The American Journal of Pathology. 185 (12), 3258-3273 (2015).
- Kitamura, M., et al. Epigallocatechin gallate suppresses peritoneal fibrosis in mice. Chemico-Biological Interactions. 195 (1), 95-104 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten