A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מודל עכברים של נזק פריטוניאלי הנגרם על ידי כלורהקסידין גלוקונאט
* These authors contributed equally
In This Article
Summary
הפרוטוקול הנוכחי קובע מודל עכבר לדיאליזה פריטוניאלית (PD) של פיברוזיס פריטוניאלי המושרה על ידי כלורהקסידין גלוקונאט (CG). המודל הנוכחי פשוט וקל לשימוש בהשוואה למודלים אחרים של חיות פרקינסון.
Abstract
פיברוזיס פריטוניאלי הוא סיבוך חשוב של דיאליזה פריטוניאלית (PD). כדי לחקור בעיה זו ולטפל בה, נדרש מודל מתאים של פרקינסון בבעלי חיים. הפרוטוקול הנוכחי מבסס מודל פיברוזיס פריטוניאלי המושרה על ידי כלורהקסידין גלוקונאט (CG) המחקה את מצבו של חולה עם פרקינסון. פיברוזיס פריטוניאלי נגרם על ידי הזרקה תוך צפקית של 0.1% CG באתנול 15% במשך 3 שבועות (ניתן אחת ליומיים), בסך הכל תשע פעמים בעכברים זכרים C57BL/6. בדיקות תפקודיות פריטוניאליות בוצעו ביום ה-22. לאחר הקרבת העכברים, נקצרו הצפק הקודקודי של דופן הבטן והצפק הקרבי של הכבד. הם היו עבים יותר ופיברוטיים יותר כאשר נותחו מיקרוסקופית לאחר צביעת הטריכרום של מאסון. קצב האולטרה-סינון ירד, והעברת מסת גלוקוז הצביעה על עלייה הנגרמת על ידי CG בחדירות הצפק. למודל הפרקינסון שהוקם עשויים להיות יישומים בשיפור טכנולוגיית פרקינסון, יעילות הדיאליזה והארכת הישרדות המטופלים.
Introduction
דיאליזה פריטוניאלית (PD) היא סוג של טיפול בתחליפי כליות. עם זאת, לפרקינסון יש בעיות שלא ניתן לפתור. לדוגמה, טיפול ארוך טווח בפרקינסון עלול לגרום לנזק לצפק, מה שיוביל בסופו של דבר לכישלון אולטרה-סינון ולנסיגה מטיפול 1,2,3,4,5,6. פיברוזיס פריטוניאלי הוא אחד הסיבוכים החמורים ביותר 7,8. פיברוזיס פריטוניאלי מאופיין על ידי תצהיר והצטברות של מטריצה תאית בתוך interstitium, ו neo-אנגיוגנזה ו vasculopathy של הצפק 9,10.
הגורמים העיקריים לשינויים אלה בצפק הם דלקת צפק חוזרת ואי תאימות ביולוגית של הדיאליזה, שהם היפראוסמוטיים, גלוקוז גבוה, pH נמוך, והצטברות מוצר השפלת גלוקוז11,12. לכן, מודלים ניסיוניים מתאימים בבעלי חיים יכולים לסייע לחוקרים לחקור טוב יותר את השינויים הפיזיולוגיים והפתולוגיים של הצפק במהלך הטיפול בפרקינסון. לכן, ביסוס מודל פרקינסון של בעלי חיים חשוב לשיפור טכנולוגיית פרקינסון ויעילות הדיאליזה ולהארכת הישרדות החולים. מחקר זה נועד ליצור מודל עכבר PD על ידי הזרקה intraperitoneal (i.p.) של chlorhexidine gluconate (CG), כפי שתואר קודם13,14. דגם עכבר PD זה הוא פשוט, קל לשימוש וישים בהשוואה למודלים אחרים של חיות פרקינסון.
Access restricted. Please log in or start a trial to view this content.
Protocol
כל ניסויי העכבר אושרו על ידי מרכז חיות המעבדה של בית החולים E-DA / אוניברסיטת I-Shou וטופלו על פי "המדריך לטיפול ושימוש בחיות מעבדה" (NRC, ארה"ב 2011). עכברי C57BL/6 זכרים, בני 7-8 שבועות, שימשו במחקר הנוכחי.
1. הכנה כימית
- הכינו את החומר המגרה הכימי על ידי דילול 0.1% כלורהקסידין גלוקונאט (CG, ראו טבלת חומרים) באתנול 15%.
2. טיפול בבעלי חיים
- הקצו שלושה עכברים כקבוצת הביקורת. בצע הזרקה תוך צפקית (i.p.) של 1 מ"ל / ק"ג של 0.9% מלוחים נורמליים (NS) כל יומיים במשך 3 שבועות, בסך הכל תשע פעמים.
- הקצה שלושה עכברים לקבוצת פיברוזיס הצפק. לגרום לפיברוזיס פריטוניאלי באמצעות כלורהקסידין גלוקונאט (CG) על ידי מתן זריקות i.p. של 0.1% של CG באתנול 15% (שלב 1.1) במינון של 12.5 μL / g משקל גוף. בצעו זאת אחת ליומיים במשך 3 שבועות, ובסך הכל תשע פעמים.
3. בדיקות תפקוד פריטוניאלי (מבחן שיווי משקל פריטוניאלי שונה)
- הכינו תמיסת דיאליזה המכילה 4.25% גלוקוז. צייר 0.5 מ"ל של דגימת דיאליזה עם מזרק, ולאחר מכן לבדוק את ריכוז הגלוקוז במדגם דיאליזה.
הערה: ריכוז הגלוקוז נקבע על פי שיטת הקסוקינאז/G6PD. דגימות דיאליזה היו נגישות לבדיקת Glu 2 מסוג L ונחקרו באמצעות אנלייזר ביוכימי (ראה טבלת חומרים). זהו ריכוז הגלוקוז הראשוני בדיאליזה. - מרדימים את העכברים על ידי הזרקה תוך שרירית של זולטיל וקסילזין (מוכן ביחס של 1:2 לפי נפח, ראה טבלת חומרים) במינון של 20 μL/20 gw. בנוסף, יש להשתמש במשחה וטרינרית על העיניים למניעת יובש בהרדמה.
- ביצוע החדרת תמיסת הדיאליזה (2 מ"ל/20 גרם משקל גוף).
- לאחר 30 דקות, להעריך ולאמת את עומק ההרדמה עם חוסר רפלקס צביטת הבוהן. לאחר מכן, בצע חתך אנכי בקו האמצע של הבטן (מתחת לתהליך הקסיפואיד), ולאחר מכן פתח את בטן העכברים ואסף את הנוזל התוך צפקי באמצעות מזרק (מוגדר כ"נפח 1"). לאחר מכן, מדדו את משקלה של כותנה נקייה ויבשה והכניסו את הכותנה לחלל הבטן של העכברים כדי לספוג את שאריות הנוזל התוך-צפקי. לבסוף, מדדו שוב את משקל הכותנה.
הערה: העלייה במשקל של כותנה שווה למשקל של נוזל intraperitoneal שיורית. לאחר מכן, להמיר לנפח המתקבל (כוח משיכה סגולי: 1 גרם / ס"מ3; מוגדר כ "נפח 2"). נפח הדיאליזה הסופי הוא כרך 1 ועוד כרך 2. - השתמש 0.5 מ"ל של דגימת דיאליזה (דיאליזה סופית) כדי למדוד את ריכוז הגלוקוז. זהו ריכוז הגלוקוז הסופי בדיאליזה.
- חשב את ultrafiltration נטו באמצעות הנוסחה15:
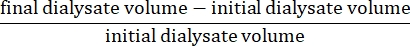
- חישוב חדירות הצפק באמצעות הנוסחה הבאה15:
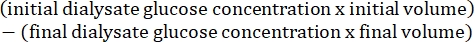
4. הכנת רקמות של שריר דופן הבטן והכבד וניתוח היסטולוגי
- להקריב את העכברים באמצעות ניקוב לב (phlebotomy)3,16.
- לחתוך את דופן הבטן (1 ס"מ x 1 ס"מ) ואת hepatectomy הכולל. תקנו את דופן הבטן ורקמות הכבד של העכברים למשך הלילה בפורמלין חוצץ ניטרלי 10%.
- הכינו קטעי פרפין בעובי 3 מיקרומטר של שריר דופן הבטן והכבד, ובצעו ניתוח היסטולוגי בעקבות דו"ח17 שפורסם בעבר.
- להעריך את הצפק הקודקוד של דופן הבטן ואת הצפק הקרבי של משטחי הכבד של העכברים באמצעות מורפומטריה18.
- ביצוע ניתוחים סטטיסטיים באמצעות סטטיסטיקה ותוכנות גרפים (ראה טבלת חומרים). בטא את כל הנתונים כממוצע ± SD ונתח מובהקות סטטיסטית באמצעות מבחן t19. הגדר ערכים עם P <- 0.05 כתוצאות משמעותיות.
Access restricted. Please log in or start a trial to view this content.
תוצאות
באיור 1A,B, הצפק הקודקודי של דופן הבטן היה עבה יותר באופן ניכר ופיברוטי יותר תחת צביעת הטריכרום17 של מאסון, מה שמצביע על כך שבקבוצת הביקורת שנחשפה ל-CG, פיברוזיס פריטוניאלי חמור יותר מאשר בקבוצת הביקורת במי מלח (NS). באיור 2A,B, הצפק הקרבי של מ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
במחקר זה, מודל PD של עכבר מוצג על ידי הזרקת i.p. של CG, והתוצאות הראו פיברוזיס פריטוניאלי והידרדרות תפקודית במודל זה, אשר חיקו את מצבו של חולה פרקינסון.
ישנם מספר שלבים קריטיים בפרוטוקול. ראשית, לצורך ביצוע הזרקת i.p. של CG או NS, יש להרים את עור דופן הבטן של העכבר באמצעות מלקחיים כדי ל...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים מקרב לב לשין-האן טסנג על הדיון הביקורתי והביצוע החלקי של המחקר. מחקר זה נתמך על ידי EDAHP110003 ו- NCKUEDA110002 מקרן המחקר של בית החולים E-DA ואוניברסיטת צ'נג קונג הלאומית, טייוואן.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0.9% Normal Saline | Y F CHEMICAL CORP., New Taipei City, Taiwan | - | |
| 10% neutral buffered formalin | Taiwan Burnett International Co., Ltd., Taipei City, Taiwan | 00002A | |
| Automatic biochemical analyzer | Hitachi Ltd., Tokyo, Japan | Labospect Series 008 | for determining glucose concentration |
| Chlorhexidine digluconate solution, 20% in H2O | Sigma-Aldrich, MO, USA | C9394 | diluted to 0.1% with 15% ethanol for injection |
| Ethanol | Avantor Performance Materials, LLC, PA, USA | BAKR8006-05 | diluted to 15% with normal saline for working concentration |
| Glucose (Dianeal) | Baxter International, Inc., IL, USA | FNB9896 | Commercial dialysis solution (4.25%) |
| GraphPad Prism 8.0 | GraphPad Software, Inc., CA, US | ||
| L-type Glu 2 assay | FUJIFILM Wako, Japan | 461-32403 | |
| Xylazine 20 | Juily Pharmaceutical Co., Ltd., New Taipei City, Taiwan | - | |
| Zoletil 50 | Virbac Laboratories, Carros, France | - |
References
- Han, S. H., et al. Improving outcome of CAPD: twenty-five years' experience in a single Korean center. Peritoneal Dialysis International. 27 (4), 432-440 (2007).
- Kawaguchi, Y., Hasegawa, T., Nakayama, M., Kubo, H., Shigematu, T. Issues affecting the longevity of the continuous peritoneal dialysis therapy. Kidney International Supplements. 62, 105-107 (1997).
- Lee, Y. C., et al. Vitamin D can ameliorate chlorhexidine gluconate-induced peritoneal fibrosis and functional deterioration through the inhibition of epithelial-to-mesenchymal transition of mesothelial cells. BioMed Research International. 2015, 595030(2015).
- Nakamoto, H., Kawaguchi, Y., Suzuki, H. Is technique survival on peritoneal dialysis better in Japan. Peritoneal Dialysis International. 26 (2), 136-143 (2006).
- Schaefer, F., Klaus, G., Muller-Wiefel, D. E., Mehls, O. Current practice of peritoneal dialysis in children: results of a longitudinal survey. Mid European Pediatric Peritoneal Dialysis Study Group (MEPPS). Peritoneal Dialysis International. 19, Suppl 2 445-449 (1999).
- Woodrow, G., Turney, J. H., Brownjohn, A. M. Technique failure in peritoneal dialysis and its impact on patient survival. Peritoneal Dialysis International. 17 (4), 360-364 (1997).
- Schmidt, D. W., Flessner, M. F. Pathogenesis and treatment of encapsulating peritoneal sclerosis: basic and translational research. Peritoneal Dialysis International. 28, Suppl 5 10-15 (2008).
- Augustine, T., Brown, P. W., Davies, S. D., Summers, A. M., Wilkie, M. E. Encapsulating peritoneal sclerosis: clinical significance and implications. Nephron Clinical Practice. 111 (2), 149-154 (2009).
- Di Paolo, N., Nicolai, G. A., Garosi, G. The peritoneum: from histological studies to mesothelial transplant through animal experimentation. Peritoneal Dialysis International. 28, Suppl 5 5-9 (2008).
- Fusshoeller, A. Histomorphological and functional changes of the peritoneal membrane during long-term peritoneal dialysis. Pediatric Nephrology. 23 (1), 19-25 (2008).
- Goffin, E. Peritoneal membrane structural and functional changes during peritoneal dialysis. Seminars in Dialysis. 21 (3), 258-265 (2008).
- Ito, T., Yorioka, N. Peritoneal damage by peritoneal dialysis solutions. Clinical and Experimental Nephrology. 12 (4), 243-249 (2008).
- Io, K., et al. SAHA suppresses peritoneal fibrosis in mice. Peritoneal Dialysis International. 35 (3), 246-258 (2015).
- Yoh, K., Ojima, M., Takahashi, S. Th2-biased GATA-3 transgenic mice developed severe experimental peritoneal fibrosis compared with Th1-biased T-bet and Th17-biased RORgammat transgenic mice. Experimental Animals. 64 (4), 353-362 (2015).
- Karl, Z. J. T., et al. Peritoneal Equilibration Test. Peritoneal Dialysis International. 7 (3), 138-148 (1987).
- Lee, Y. C., et al. The clinical implication of vitamin D nanomedicine for peritoneal dialysis-related peritoneal damage. International Journal of Nanomedicine. 14, 9665-9675 (2019).
- Goldner, J. A. Modification of the masson trichrome technique for routine laboratory purposes. The American Journal of Pathology. 14 (2), 237-243 (1938).
- Cheng, F. Y., et al. Novel application of magnetite nanoparticle-mediated vitamin D3 delivery for peritoneal dialysis-related peritoneal damage. International Journal of Nanomedicine. 16, 2137-2146 (2021).
- Ross, A., Willson, V. L. Basic and Advanced Statistical Tests: Writing Results Sections and Creating Tables and Figures. , SensePublishers. 13-16 (2017).
- Suga, H., et al. Preventive effect of pirfenidone against experimental sclerosing peritonitis in rats. Experimental and Toxicologic Pathology. 47 (4), 287-291 (1995).
- Ishii, Y., et al. An experimental sclerosing encapsulating peritonitis model in mice. Nephrology Dialysis Transplantation. 16 (6), 1262-1266 (2001).
- Nishino, T., et al. Antisense oligonucleotides against collagen-binding stress protein HSP47 suppress peritoneal fibrosis in rats. Kidney International. 64 (3), 887-896 (2003).
- Mishima, Y., et al. Enhanced expression of heat shock protein 47 in rat model of peritoneal fibrosis. Peritoneal Dialysis International. 23 (1), 14-22 (2003).
- Kushiyama, T., et al. Effects of liposome-encapsulated clodronate on chlorhexidine gluconate-induced peritoneal fibrosis in rats. Nephrology Dialysis Transplantation. 26 (10), 3143-3154 (2011).
- Nishino, T., et al. Involvement of lymphocyte infiltration in the progression of mouse peritoneal fibrosis model. Renal Failure. 34 (6), 760-766 (2012).
- Lua, I., Li, Y., Pappoe, L. S., Asahina, K. Myofibroblastic conversion and regeneration of mesothelial cells in peritoneal and liver fibrosis. The American Journal of Pathology. 185 (12), 3258-3273 (2015).
- Kitamura, M., et al. Epigallocatechin gallate suppresses peritoneal fibrosis in mice. Chemico-Biological Interactions. 195 (1), 95-104 (2012).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved