JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
클로르헥시딘 글루코네이트 유발 복막 손상의 마우스 모델
* 이 저자들은 동등하게 기여했습니다
요약
현재 프로토콜은 클로르헥시딘 글루코네이트(CG) 유발 복막 섬유증의 복막 투석(PD) 마우스 모델을 설정합니다. 현재 모델은 다른 PD 동물 모델에 비해 간단하고 사용하기 쉽습니다.
초록
복막 섬유증은 복막 투석(PD)의 중요한 합병증입니다. 이 문제를 조사하고 해결하기 위해서는 PD의 적절한 동물 모델이 필요합니다. 본 프로토콜은 PD 환자의 상태를 모방하는 클로르헥시딘 글루코네이트(CG) 유도 복막 섬유증 모델을 설정합니다. 복막 섬유증은 수컷 C57BL/6 마우스에서 총 9회 동안 3주 동안 15% 에탄올에 0.1% CG를 복강내 주사하여(격일로 투여) 유도했습니다. 그런 다음 22일째에 복막 기능 테스트를 수행했습니다. 생쥐를 희생시킨 후, 복벽의 정수리 복막과 간의 내장 복막을 적출 하였다. 그들은 Masson의 삼색 염색 후 현미경으로 분석했을 때 더 두껍고 섬유질적이었습니다. 한외여과율은 감소하였고, 포도당 질량수송은 CG에 의해 유도된 복막 투과성의 증가를 나타내었다. 이렇게 확립된 PD 모델은 PD 기술을 개선하고, 투석 효능을 개선하고, 환자 생존을 연장하는 데 응용할 수 있다.
서문
복막 투석(PD)은 일종의 신대체 요법입니다. 그러나 PD는 해결할 수 없는 문제가 있다. 예를 들어, 장기간의 PD 치료는 복막 손상을 야기할 수 있고, 결국 한외여과 실패 및 치료 중단을 초래할 수 있다(1,2,3,4,5,6). 복막 섬유증은 가장 심각한 합병증중 하나입니다 7,8. 복막 섬유증은 간질 내 세포외 기질의 침착 및 축적, 복막의 신혈관신생 및 혈관병증을 특징으로 한다 9,10.
이러한 복막 변화의 주요 원인은 재발성 복막염 및 투석액의 비생체적합성이며, 이는 고삼투압, 고포도당, 낮은 pH 및 포도당 분해 생성물 축적이다11,12. 따라서 적절한 동물 실험 모델은 연구자들이 PD 치료 중 복막의 생리학적 및 병리학적 변화를 더 잘 연구하는 데 도움이 될 수 있습니다. 따라서 PD 기술 및 투석 효능을 향상시키고 환자의 생존을 연장하기 위해서는 동물 PD 모델을 구축하는 것이 중요합니다. 이 연구는 앞서 설명한 바와 같이 클로르헥시딘 글루코네이트(CG)의 복강내(i.p.) 주사에 의해 PD 마우스 모델을 생성하는 것을 목표로 했습니다 13,14. 이 PD 마우스 모델은 다른 PD 동물 모델에 비해 간단하고 사용하기 쉬우며 실현 가능합니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
모든 마우스 실험은 E-DA Hospital/I-Shou University의 Laboratory Animal Center의 승인을 받았으며 "Guide for the Care and Use of Laboratory Animals"(NRC, USA 2011)에 따라 처리되었습니다. 7-8주령의 수컷 C57BL/6 마우스를 본 연구에 사용하였다.
1. 화학 약품 준비
- 0.1% 클로르헥시딘 글루코네이트(CG, 재료 표 참조)를 15% 에탄올에 희석하여 화학적 자극제를 준비합니다.
2. 동물 치료
- 세 마리의 마우스를 대조군으로 지정합니다. 0.9% 생리식염수(NS) 1mL/kg을 3주 동안 격일로 총 9회 복강주사(ip)한다.
- 복막 섬유증 그룹에 3 마리의 마우스를 할당하십시오. 12.5μL/g 체중의 용량으로 15% 에탄올(1.1단계)에 0.1% CG를 주사하여 클로르헥시딘 글루코네이트(CG)를 사용하여 복막 섬유증을 유도합니다. 이것을 3 주 동안 격일로 총 9 번 수행하십시오.
3. 복막 기능 검사 (복막 평형 시험 변형)
- 4.25% 포도당을 함유하는 투석액을 준비한다. 투석액 시료 0.5mL를 주사기로 채취한 후 투석액 시료의 포도당 농도를 확인합니다.
참고: 포도당 농도는 헥소키나제/G6PD 방법에 따라 결정됩니다. 투석액 샘플을 L-형 Glu2 분석에 접근하고 생화학적 분석기로 조사하였다( 재료 표 참조). 이것은 초기 투석액 포도당 농도입니다. - 20μL/20gw의 용량으로 Zoletil과 Xylazine(부피 1:2 비율로 준비, 재료 표 참조)을 근육내 주사하여 마우스를 마취합니다. 또한 마취 상태에서 건조를 방지하기 위해 눈에 수의사 연고를 사용하십시오.
- 투석 용액(2mL/20g 체중)의 점적 수행.
- 30분 후 발가락 꼬집음 반사가 없는 상태에서 마취 깊이를 평가하고 확인합니다. 그런 다음 복부 정중선 (xiphoid process) 아래에서 수직 절개를 수행 한 다음 마우스의 복부를 열고 주사기 ( "볼륨 1"로 정의 됨)로 복강 내 액을 수집합니다. 그런 다음 깨끗하고 마른 면의 무게를 측정하고 면봉을 생쥐의 복강에 넣어 잔류 복강 내액을 흡수합니다. 마지막으로 면 무게를 다시 측정합니다.
참고: 면화의 체중 증가는 잔류 복강내액의 무게와 같습니다. 그런 다음 얻은 부피(비중: 1g/cm3, "부피 2"로 정의됨)로 변환합니다. 최종 투석액의 양은 1권에 2권을 더한 것입니다. - 0.5mL의 투석액 샘플(최종 투석액)을 사용하여 포도당 농도를 측정합니다. 이것이 최종 투석액 포도당 농도입니다.
- 화학식15를 사용하여 순 한외여과를 계산합니다.
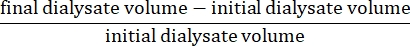
- 다음 식15를 사용하여 복막 투과도를 계산합니다.
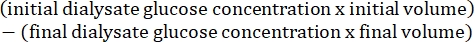
4. 복벽 근육과 간의 조직 준비 및 조직학적 분석
- 심장 천자 (정맥 절개술)를 통해 생쥐를 희생하십시오.3,16.
- 복벽 (1cm x 1cm)을 자르고 전체 간 절제술을 받으십시오. 생쥐의 복벽과 간 조직을 10% 중성 완충 포르말린에 하룻밤 동안 고정합니다.
- 복벽 근육과 간의 3μm 두께의 파라핀 절편을 준비하고 이전에 발표된 보고서17에 따라 조직학적 분석을 수행합니다.
- 복벽의 정수리 복막과 마우스의 간 표면의 내장 복막을 형태 측정법을 사용하여 평가한다18.
- 통계 및 그래프 소프트웨어를 사용하여 통계 분석을 수행합니다( 재료 표 참조). 모든 데이터를 평균± SD로 표현하고 t-검정19를 사용하여 통계적 유의성을 분석합니다. P < 0.05인 값을 유의한 결과로 정의합니다.
Access restricted. Please log in or start a trial to view this content.
결과
그림 1A,B에서 복벽의 정수리 복막은 Masson의 삼색 염색17에서 현저하게 두껍고 섬유화되었으며, 이는 CG 노출 그룹에서 복막 섬유증이 대조군 식염수 그룹(NS)보다 더 심각함을 나타냅니다. 그림 2A,B에서 간 표면의 내장 복막도 현저하게 두껍고 섬유화되어 CG 노출 그룹에서 복막 섬유증이 대조군 식염수군(NS)보다 더 심하다?...
Access restricted. Please log in or start a trial to view this content.
토론
본 연구에서는 마우스 PD 모델을 i.p. CG를 주사하고, 그 결과 이 모델에서 복막 섬유증과 기능 저하가 나타나 PD 환자의 상태를 모방하였다.
프로토콜에는 몇 가지 중요한 단계가 있습니다. 첫째, CG 또는 NS의 i.p. 주사를 수행하기 위해서는 천자로 인한 복강 내 장기 손상을 방지하기 위해 집게를 사용하여 마우스의 복벽 피부를 집어 올려야 합니다. 둘째, 조직학적 분석을 위해 ?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 것이 없습니다.
감사의 말
우리는 Shin-Han Tseng에게 비판적인 토론과 연구의 부분적인 실행에 진심으로 감사드립니다. 이 연구는 E-DA 병원 연구 재단과 대만 국립 청쿵 대학교의 EDAHP110003 및 NCKUEDA110002의 지원을 받았습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 0.9% Normal Saline | Y F CHEMICAL CORP., New Taipei City, Taiwan | - | |
| 10% neutral buffered formalin | Taiwan Burnett International Co., Ltd., Taipei City, Taiwan | 00002A | |
| Automatic biochemical analyzer | Hitachi Ltd., Tokyo, Japan | Labospect Series 008 | for determining glucose concentration |
| Chlorhexidine digluconate solution, 20% in H2O | Sigma-Aldrich, MO, USA | C9394 | diluted to 0.1% with 15% ethanol for injection |
| Ethanol | Avantor Performance Materials, LLC, PA, USA | BAKR8006-05 | diluted to 15% with normal saline for working concentration |
| Glucose (Dianeal) | Baxter International, Inc., IL, USA | FNB9896 | Commercial dialysis solution (4.25%) |
| GraphPad Prism 8.0 | GraphPad Software, Inc., CA, US | ||
| L-type Glu 2 assay | FUJIFILM Wako, Japan | 461-32403 | |
| Xylazine 20 | Juily Pharmaceutical Co., Ltd., New Taipei City, Taiwan | - | |
| Zoletil 50 | Virbac Laboratories, Carros, France | - |
참고문헌
- Han, S. H., et al. Improving outcome of CAPD: twenty-five years' experience in a single Korean center. Peritoneal Dialysis International. 27 (4), 432-440 (2007).
- Kawaguchi, Y., Hasegawa, T., Nakayama, M., Kubo, H., Shigematu, T. Issues affecting the longevity of the continuous peritoneal dialysis therapy. Kidney International Supplements. 62, 105-107 (1997).
- Lee, Y. C., et al. Vitamin D can ameliorate chlorhexidine gluconate-induced peritoneal fibrosis and functional deterioration through the inhibition of epithelial-to-mesenchymal transition of mesothelial cells. BioMed Research International. 2015, 595030(2015).
- Nakamoto, H., Kawaguchi, Y., Suzuki, H. Is technique survival on peritoneal dialysis better in Japan. Peritoneal Dialysis International. 26 (2), 136-143 (2006).
- Schaefer, F., Klaus, G., Muller-Wiefel, D. E., Mehls, O. Current practice of peritoneal dialysis in children: results of a longitudinal survey. Mid European Pediatric Peritoneal Dialysis Study Group (MEPPS). Peritoneal Dialysis International. 19, Suppl 2 445-449 (1999).
- Woodrow, G., Turney, J. H., Brownjohn, A. M. Technique failure in peritoneal dialysis and its impact on patient survival. Peritoneal Dialysis International. 17 (4), 360-364 (1997).
- Schmidt, D. W., Flessner, M. F. Pathogenesis and treatment of encapsulating peritoneal sclerosis: basic and translational research. Peritoneal Dialysis International. 28, Suppl 5 10-15 (2008).
- Augustine, T., Brown, P. W., Davies, S. D., Summers, A. M., Wilkie, M. E. Encapsulating peritoneal sclerosis: clinical significance and implications. Nephron Clinical Practice. 111 (2), 149-154 (2009).
- Di Paolo, N., Nicolai, G. A., Garosi, G. The peritoneum: from histological studies to mesothelial transplant through animal experimentation. Peritoneal Dialysis International. 28, Suppl 5 5-9 (2008).
- Fusshoeller, A. Histomorphological and functional changes of the peritoneal membrane during long-term peritoneal dialysis. Pediatric Nephrology. 23 (1), 19-25 (2008).
- Goffin, E. Peritoneal membrane structural and functional changes during peritoneal dialysis. Seminars in Dialysis. 21 (3), 258-265 (2008).
- Ito, T., Yorioka, N. Peritoneal damage by peritoneal dialysis solutions. Clinical and Experimental Nephrology. 12 (4), 243-249 (2008).
- Io, K., et al. SAHA suppresses peritoneal fibrosis in mice. Peritoneal Dialysis International. 35 (3), 246-258 (2015).
- Yoh, K., Ojima, M., Takahashi, S. Th2-biased GATA-3 transgenic mice developed severe experimental peritoneal fibrosis compared with Th1-biased T-bet and Th17-biased RORgammat transgenic mice. Experimental Animals. 64 (4), 353-362 (2015).
- Karl, Z. J. T., et al. Peritoneal Equilibration Test. Peritoneal Dialysis International. 7 (3), 138-148 (1987).
- Lee, Y. C., et al. The clinical implication of vitamin D nanomedicine for peritoneal dialysis-related peritoneal damage. International Journal of Nanomedicine. 14, 9665-9675 (2019).
- Goldner, J. A. Modification of the masson trichrome technique for routine laboratory purposes. The American Journal of Pathology. 14 (2), 237-243 (1938).
- Cheng, F. Y., et al. Novel application of magnetite nanoparticle-mediated vitamin D3 delivery for peritoneal dialysis-related peritoneal damage. International Journal of Nanomedicine. 16, 2137-2146 (2021).
- Ross, A., Willson, V. L. Basic and Advanced Statistical Tests: Writing Results Sections and Creating Tables and Figures. , SensePublishers. 13-16 (2017).
- Suga, H., et al. Preventive effect of pirfenidone against experimental sclerosing peritonitis in rats. Experimental and Toxicologic Pathology. 47 (4), 287-291 (1995).
- Ishii, Y., et al. An experimental sclerosing encapsulating peritonitis model in mice. Nephrology Dialysis Transplantation. 16 (6), 1262-1266 (2001).
- Nishino, T., et al. Antisense oligonucleotides against collagen-binding stress protein HSP47 suppress peritoneal fibrosis in rats. Kidney International. 64 (3), 887-896 (2003).
- Mishima, Y., et al. Enhanced expression of heat shock protein 47 in rat model of peritoneal fibrosis. Peritoneal Dialysis International. 23 (1), 14-22 (2003).
- Kushiyama, T., et al. Effects of liposome-encapsulated clodronate on chlorhexidine gluconate-induced peritoneal fibrosis in rats. Nephrology Dialysis Transplantation. 26 (10), 3143-3154 (2011).
- Nishino, T., et al. Involvement of lymphocyte infiltration in the progression of mouse peritoneal fibrosis model. Renal Failure. 34 (6), 760-766 (2012).
- Lua, I., Li, Y., Pappoe, L. S., Asahina, K. Myofibroblastic conversion and regeneration of mesothelial cells in peritoneal and liver fibrosis. The American Journal of Pathology. 185 (12), 3258-3273 (2015).
- Kitamura, M., et al. Epigallocatechin gallate suppresses peritoneal fibrosis in mice. Chemico-Biological Interactions. 195 (1), 95-104 (2012).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유