Method Article
秀丽隐杆线虫肠的手部解剖
摘要
本协议描述了一种手动从 秀丽隐杆线 虫成虫中分离肠道的程序,以输入基因组学、蛋白质组学、微生物组或其他测定。
摘要
秀丽隐杆线虫肠道仅由20个细胞组成,是许多生命支持功能的纽带,包括消化,新陈代谢,衰老,免疫和环境反应。秀丽隐杆线虫宿主与其环境之间的关键相互作用在肠道内汇聚,肠道微生物群集中在那里。因此,将肠道组织与蠕虫的其余部分隔离开来的能力对于评估肠道特异性过程是必要的。该协议描述了一种手工解剖成年秀丽隐杆线虫肠道的方法。该程序可以在荧光标记的菌株中进行,以便于或训练目的。一旦技术完善,就可以从任何基因型的未标记蠕虫中收集肠道。这种显微切割方法允许同时捕获宿主肠道组织和肠道微生物群,这对许多微生物组研究都有好处。因此,该方案产生的肠道制剂的下游应用可以包括但不限于从肠细胞中分离RNA和从捕获的微生物群中分离DNA。总体而言,秀丽隐杆线虫肠道的手解剖提供了一种简单而强大的方法来研究肠道生物学的关键方面。
引言
秀丽隐杆线虫线虫只有 959 个细胞和 4 天的卵到卵生命周期,是许多遗传学、基因组学和发育研究的理想模型系统1,2。正向和反向遗传筛选的便利性、工程荧光标记的流行、进行核苷酸特异性基因组编辑的能力以及众多社区范围内的资源都有助于秀丽隐杆线虫系统的重大发现和见解。然而,一个显着的缺点是难以获得纯粹的细胞,组织或器官群体,这些细胞,组织或器官很小,脆弱并且可以相互连接。由于纯细胞群对于基因组学测定(如RNA-seq,ChIP-seq和ATAC-seq)很重要,因此已经出现了几种方法来获得秀丽隐杆线虫细胞,组织和器官的纯制剂。这里描述了一种从秀丽隐杆线虫成虫中大切片手工解剖肠道的方法。所得制剂适用于下游基因组学测定(图1)。
这里描述的精细组织解剖方法(图2)只是一种方法。其他替代技术 - 例如分子标记,解聚蠕虫以及通过荧光激活细胞分选(FACS)和事后分析纯化感兴趣的细胞类型 - 也已成功用于研究秀丽隐杆线虫分子生物学的组织特异性特征。然而,与其他方法相比,手部解剖的一个优点是,它可以用来同时探索秀丽隐杆线虫肠道的特征及其细菌含量3,4,5。这使得16S rRNA基因测序成为可能,并促进秀丽隐杆线虫系统内的微生物组研究。然而,一个重要的限制是肠细胞不是单独分离的。
分子标记仅将细胞类型特异性标记赋予指定组织或目标细胞内的分子。然后可以将这些标签与整个蠕虫制剂分离。通过这种方式,驱动标记的polyA结合蛋白或剪接领导者的组织特异性启动子已经实现了组织特异性转录组分析6,7,8,9,10和3'UTR映射11,12。类似地,使用ChIP-seq和DamID进行了组织特异性转录因子谱,其中启动子特异性转录因子变体附加了标签或酶融合13,14。
FACS允许根据其固有的细胞特征和荧光特性从解离的蠕虫中分离感兴趣的细胞类型。这种方法已经从不同的器官8,15,16和单个神经元细胞类型8,9,15,16,17,18中产生了组织特异性转录组,并已用于创建整个秀丽隐杆线虫神经系统的表达图19,20.FACS及其表亲荧光激活细胞核分选(FANS)也已用于生成细胞特异性染色质谱21,22。
最后,可以在单细胞分辨率测定中进行事后分析。在该方法中,调查所有单个细胞,在分析阶段归因每个细胞的细胞类型,并选择性地过滤感兴趣的细胞类型以进行进一步研究。事后分析已成功用于获得秀丽隐杆线虫胚胎 23、24、25、26、27 和 L1 28 期蠕虫中具有高空间和时间分辨率的发育细胞的转录组。染色质可及性也使用ATAC-seq而不是RNA-seq使用类似的策略表征29。
每种方法都有其优点和局限性。对于秀丽隐杆线虫肠道,蠕虫分解和肠道细胞的FACS分离在胚胎和幼虫阶段30中是可以实现的,但在成虫中具有挑战性。这被认为是由于肠道的大细胞、内在重复和强贴壁细胞使它们难以解离而不受损伤。这里描述的手部解剖方法规避了这些挑战,允许分离成虫肠道的大部分。从同一阶段手工解剖性腺的做法是广泛而直接的。肠道清扫术与性腺清扫术相似,但较少进行32。这里介绍的协议改编自James McGhee博士和Barb Goszczynski开发的更长的,未发表的协议。这种简化的方案借用了从早期胚胎中分离卵裂球的技术23,33,34,35。虽然手部解剖对于分离秀丽隐杆线虫中的大多数细胞或组织类型是不可行的,但它是分离肠道和成虫的理想选择。因此,手解剖补充了获得肠道特异性细胞制剂的其他方法。
研究方案
CL2122蠕虫用于本研究。这些蠕虫是通过Caenorhabditis遗传学中心(CGC,见 材料表)获得的,该中心由NIH研究基础设施计划办公室(P40 OD010440)资助。
1. 用于解剖的蠕虫的生长
- 按照标准培养程序(即接种大 肠杆菌 OP50的NGM板)生长一大块混合阶段CL2122蠕虫以同步36,37。
注意:通常需要~96小时才能达到最大产卵能力。- 胚胎在72-96小时内准备蠕虫。胚胎制备后,让胚胎在M9(见 表1)中孵化48小时。这将产生 L1 期蠕虫的同步种群。
注意:CL2122蠕虫含有由肠道特异性 mtl-2 (MeTaLlothionein 2)启动子38驱动的集成转基因GFP(绿色荧光蛋白)。该启动子对肠细胞质具有特异性,并允许在荧光解剖显微镜上观察肠道。一旦经过训练,用户可能不需要荧光指导。
- 胚胎在72-96小时内准备蠕虫。胚胎制备后,让胚胎在M9(见 表1)中孵化48小时。这将产生 L1 期蠕虫的同步种群。
- 在至少两个小板上板同步L1蠕虫。在具有足够食物的NGM平板上生长蠕虫,直到它们达到成虫阶段(通过存在能够产卵的胚胎来识别)。这在20°C下需要38-46小时。
- 注意确保跨重复和比较菌株收获相同的发育阶段。
注意:蠕虫生长的时间长短取决于菌株、温度、食物来源和目标发育阶段39。也可以使用接近成人阶段的其他阶段,例如L4和老年阶段。为了规划微生物组实验,可以使用传统食物来源(大肠杆菌 OP50)以外的不同细菌食物来源来培养蠕虫,例如CeMbio菌株4 或感兴趣的病原体40。
- 注意确保跨重复和比较菌株收获相同的发育阶段。
2. 储备溶液和微量毛细管移液器的制备
注: 表1 提供了用于本研究的所有缓冲液和溶液的详细信息。
- 在无核酸酶锥形管中制备 50 mL 蛋盐(又名鸡蛋缓冲液)(参见 材料表)。制成后,在室温下储存。
- 在无核酸酶锥形管中制备 10 mL 100 mM 左旋咪唑储备溶液。制备完成后,制作 500 μL 等分试样并将其储存在 −20 °C。 等分试样可以解冻并在4°C下一次储存1周。
- 在无核酸酶微量离心管中制备 1 mL 20 mg/mL 乙酰化牛血清白蛋白 (BSA) 储备液。制备完成后,制作 50 μL 一次性等分试样并将其储存在 −20 °C。
注意:使用乙酰化版本的BSA很重要,因为这是唯一不含核酸酶的BSA形式。非乙酰化BSA可能是核酸酶的重要来源,因此会导致样品降解。 - 按照以下步骤分别准备至少五个 50 μm 和 100 μm 微毛细管移液器。
- 首先,使用拔针器将标准玻璃毛细管(4 英寸长,外径 1.2 毫米)拉成注射针形状(见材料表)和 Sutter Instruments 移液器食谱41 中的"贴壁细胞、秀丽隐杆线虫和果蝇"条件(条件:热量 = 斜坡 + 5;拉力 = 100;Vel. = 75;延迟 = 90;压力 = 500;2.5 毫米 x 2.5 毫米盒子)。
- 接下来,使用微锻将微毛细管移液器锻造至50μm(M5/0.1物镜下的微锻目标尺指示的三个刻度线)或100μm(相同条件下的五个刻度线)尺寸(参见 材料表)。这些尺寸代表微毛细管移液器的估计开口直径(图3)。
- 然后,将口吸管固定在微毛细管移液器上。
注意:抽吸器移液器传统上通过口吸移液来控制,但许多现代安全协议不允许使用这种方法。因此,用户可以通过在手指和拇指之间夹住管子来控制口吸气管的吸气。此外,注射器过滤器可以安装在口腔吸气器管系统内,以增加安全性。
3. 实验准备
- 在无核酸酶锥形管中制备 5 mL 解剖缓冲液。在室温下储存。
- 在无核酸酶微量离心管中制备 1 mL 工作乙酰化 BSA 溶液。继续在冰上。
- 在无核酸酶微量离心管中制备 350 μL 工作左旋咪唑溶液。一式三份准备(一管约20条蠕虫)。继续在冰上。
- 在无核酸酶的微量离心管中制备螯合缓冲液(表1)。复制(一管约10条解剖蠕虫)。继续在冰上。在手部解剖过程中使用螯合缓冲液可提高RNA的质量和数量(图4)。
- 每个实验组准备一个微量离心管,其中含有500μL核酸分离试剂或试剂盒指定的分离试剂(参见 材料表),在无核酸酶管中。继续在冰上。该管将用于收集最终的分离肠以供储存或以后使用。
- 准备一个M9浴和一个解剖缓冲浴。为此,获得两个直径为35毫米的无菌培养皿。然后,将 2 mL M9 加入一个培养皿中,将 2 mL 解剖缓冲液加入另一个培养皿中。最后,向每个浴中加入 100 μL 工作 BSA 溶液。旋转混合。将BSA添加到浴槽中可以防止蠕虫粘附在塑料上。
- 准备解剖阵列。获得2孔凹面载玻片(参见 材料表),并向第一个孔中加入150μL工作左旋咪唑溶液。然后,向第二个孔中加入 150 μL 解剖缓冲液。最后,向每个孔中加入 20 μL 工作 BSA 溶液。将BSA添加到每个孔中将防止蠕虫粘在载玻片上。
4.手部解剖 秀丽隐杆线虫 肠道
- 使用蠕虫镐将 20 条成虫从 NGM 板移动到 M9 浴中(步骤 3.6)。这将从蠕虫中清除外部细菌。
- 然后,将所有20条蠕虫从M9浴中移动到解剖缓冲浴中(步骤3.6)。这将进一步洗去外部细菌并平衡解剖缓冲液中的蠕虫。
- 接下来,将一批蠕虫(即每批10只)从解剖缓冲浴中移动到含有左旋咪唑溶液的孔中(步骤3.7)。
注意:左旋咪唑会暂时麻痹蠕虫。- 一旦蠕虫运动减慢,迅速将它们从左旋咪唑孔移动到包含解剖缓冲液的孔中(步骤3.7)。注意不要使蠕虫过度麻痹。
注意:批量移动到左旋咪唑溶液中的蠕虫数量可能因用户的舒适度而异。对于最初采入M9浴中然后移入解剖缓冲浴的蠕虫数量也是如此。最好有额外的蠕虫进行解剖,尤其是在训练期间,因为用户学习并熟悉了协议。
- 一旦蠕虫运动减慢,迅速将它们从左旋咪唑孔移动到包含解剖缓冲液的孔中(步骤3.7)。注意不要使蠕虫过度麻痹。
- 然后,在开始解剖之前,让蠕虫开始在解剖缓冲区中移动一点。
注意:肠道不能很好地从过度麻痹的蠕虫(即根本不移动的蠕虫)中挤出。 - 准备好后,使用皮下注射针(即27G x 1/2英寸)(参见 材料表)在荧光解剖镜下解剖蠕虫,方法是在咽部后面(图5Aa)或直肠前切开(图5Ab)。这将产生肠道的两大部分,前中半部分和中后半部分I。对其余蠕虫继续这种模式,保持从前中段和中后部获得的肠段数相等,直到获得所需的肠总数。
注意:将皮下注射针头固定在空的 1 mL 注射器桶上有助于在手部解剖期间对其进行操作。根据用户的舒适度和经验,进行不产生肠碎片的解剖切口并不少见。然而,随着实践,这种情况变得不那么常见了。 - 等待约1分钟,使肠道最大限度地从体内挤出。它们通常呈环形,可能粘在性腺的一部分上(图5A)。等待期间,向孔中加入 50 μL 螯合缓冲液,以帮助减少 RNA 降解(图 4)。
- 在等待并进一步帮助促进肠挤出时,使用连接到口腔吸引器的100μm微毛细管移液器,并将肠/蠕虫吸入和拉出移液器(图5B)。这也将有助于将肠道从性腺中解放出来。注意不要因意外将其完全吸入微毛细管移液管而失去肠道。
注意:用户可以在100μm和50μm微毛细管移液器之间交替,以将肠道从身体其他部位和性腺中解放出来。50μm微毛细管移液器的较小直径开口可能有利于从肠道中去除粘性碎片。抽吸器移液器传统上通过口吸移液来控制,但许多现代安全协议不允许这种方法。因此,用户可以通过在手指和拇指之间夹住管子来控制口吸气管的吸气。此外,注射器过滤器可以安装在口腔吸气器管系统内,以增加安全性。 - 一旦肠道充分挤出,使用 27 G 皮下注射针将其从身体其他部位和任何剩余的性腺中切开。分离的肠切片的大小可能会有很大差异,具体取决于收割机的经验、切割的质量以及蠕虫的麻痹程度。
注意:肠道和肠道碎片的完整性可以通过其GFP荧光 在整个 方案中轻松监测。 - 现在,使用微毛细管移液器吸出肠部分并将其移出孔并放入含有核酸分离试剂或试剂盒指定分离试剂的微量离心管中。将分离的肠保持在冰上的试剂中,并对剩余的肠重复。
注意:全天可以将多个肠添加到含有核酸分离试剂或其他试剂盒指定分离试剂的微量离心管中。继续在冰上。如果无法在 1 天内分离所有肠道,则已分离并储存在核酸分离试剂(保留核酸)中的肠可以保持在 -80°C,直到分离恢复和/或可以完成。在这里,样品是长期稳定的(即几个月到1年),并且可以保持直到准备好分离核酸。肠可以收获到水或任何试剂盒特异性裂解缓冲液中。然而,在进入下游应用之前,在确定肠道可以在给定的冰缓冲液(或其他所需温度)中停留多长时间时,必须考虑这一点。
5. 从解剖的肠道中分离RNA
- 通过执行三个冻融/涡旋循环,均质化储存在核酸分离试剂中的获取组织。为此,请使用37°C珠浴和液氮(或其他类似方法)。
- 然后,向样品中加入0.2体积的苯酚:氯仿:IAA试剂(见 材料表)并短暂涡旋。例如,对于 500 μL 的起始样品体积,0.2 体积的氯仿为 100 μL。
- 用手摇动试管20秒,然后在室温下孵育3分钟。
- 通过离心(10,000 x g ,18分钟,4°C)分离样品相。
- 除去水相并转移到新的无核酸酶微量离心管中。
注:注意不要吸气或干扰接口。 - 然后,向水相中加入等体积的100%乙醇,并用手摇动样品20秒。
- 将700 μL样品转移到离心柱中(参见 材料表)。然后,通过离心(≥8,000 x g ,30 s,室温 [室温])将RNA粘附到色谱柱上。丢弃流出物。对任何其他剩余样品重复此操作。
- 向色谱柱中加入350 μL RW1缓冲液(参见 材料表)以洗涤样品。然后,离心机(≥8,000 x g ,30 s,室温)并丢弃流通物。
- 进行柱上DNA消化。将 80 μL DNase I 加入 RDD 缓冲液(参见 材料表)中。然后,在室温下孵育15分钟。
- 然后,向色谱柱中加入350 μL RW1缓冲液以洗涤样品。离心机(≥8,000 x g ,30 s,室温)并将色谱柱转移到新的收集管中。丢弃流通管和旧收集管。这种洗涤去除了脱氧核糖核酸酶。
- 向样品柱中加入 500 μL RPE(参见 材料表)。然后,离心机(≥8,000 x g ,30 s,室温)并丢弃流出物。重复第二次洗涤。
- 然后,再离心1分钟以进一步干燥柱膜(≥8,000× g,1分钟,室温)。接下来,将样品柱转移到带盖的新鲜无核酸酶微量离心机收集管中。丢弃流通管和旧收集管。
- 将 14 μL 无核酸酶的水直接加入样品柱的膜中。然后,将样品在室温下孵育2分钟。接下来,离心(≥8,000 x g ,1分钟,室温)洗脱RNA。
- 将样品储存在冰上。接下来,使用市售的检测试剂盒评估样品的RNA质量和数量(参见 材料表)。完成后,将样品储存在-80°C冰箱中。
注意:RNA通常在-80°C下稳定长达1年而不会降解。
结果
本方案用于用手从成年 秀丽隐杆线虫 中分离大部分肠道(图2)。所示每个实验组的最终肠道样本由前中肠和中后肠部分的相等集合组成。然而,根据实验问题,它也可以仅包括前肠、中肠或后肠部分的集合。总的来说,该协议提出了三个具有代表性的结果。第一个描述了肠道的成功解剖和分离(图6)。第二个报告了从分离的肠中分离RNA的结果(图7)。第三个显示了来自分离肠道的微生物监测结果(图8)。
对于第一个结果,图6A显示了在成虫CL2122蠕虫内在图5A中的位点"a"处做一个初级切口后挤出的肠子的样子。由于CL2122蠕虫含有与GFP融合的肠道特异性mtl-2启动子(mtl-2 p::GFP),因此分离的肠道在荧光解剖镜下会发出绿色光。然后如图6B所示成功解剖肠段。该肠道切片没有可见的污染物,例如性腺或胴体的碎屑。相比之下,图6C显示了未成功解剖的肠道,因为性腺和胴体仍然明显附着在肠段上。
对于第二个结果,将肠收获到核酸分离试剂中,并在第二天使用低输入总RNA提取方案进行处理(参见 材料表)。来自前中段和中后段的 60 个总肠切片的最终肠道样品产生大约 15 ng 的高质量总 RNA(图 7A)。这种总量可以在一天内轻松获得,但如果需要,也可以在几天内分解。手部解剖的RNA产量比蠕虫分解和肠道细胞的FACS分离更有效,因为需要数十万个肠道细胞才能获得相应数量的总RNA(图7B)。重要的是,手工解剖产生的RNA产量足以作为商业RNA-seq文库试剂盒(即NEBNext Ultra II和NEBNext单细胞/低输入)的输入,这些试剂盒只需2 pg的RNA。
对于第三个结果,将肠收获到无菌ddH20中,并在同一天使用商业微生物DNA分离试剂盒进行处理(见 材料表)。使用泛细菌检测测定法,来自前中段和中后段的40个总肠切片的最终肠道样品产生约0.009pg的总微生物DNA(见 材料表)(图8)。这些数量对于传统的定量方法来说太低,必须从qPCR标准曲线外推。理想情况下,用户应以最终肠总量>40为目标,因为这会增加检测限和信噪比对试剂污染水平的边界。
在考虑实验设计时,收集适当的对照样品始终是必要的。对于转录组学实验,合适的实验对照可以包括以与肠道相同的方式收集的整个蠕虫的制剂。然而,在从 秀丽隐杆线虫解剖和分离肠道的过程中,通常会看到一些尸体和性腺附着在肠道部分。虽然理想情况下,这些污染组织将在储存以供下游使用之前从肠道中去除,但其他实验控制可以包括在肠道解剖后收集剩余的蠕虫尸体和/或收集解剖的性腺。对于微生物组实验,除了常规的阳性(细菌培养)和阴性(水)对照外,对照还可以包括以与肠道相同的方式收集的整个蠕虫的制备。
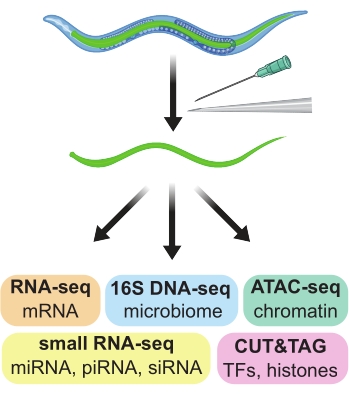
图 1:手工解剖来自成年秀丽隐杆线虫的肠道,用于生成用于各种下游组学测定的组织特异性制剂。 请点击此处查看此图的大图。
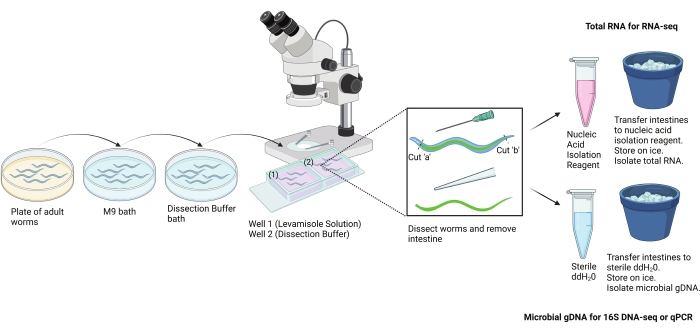
图 2:手部解剖协议的方案。 该方案用于用手从成年 秀丽隐杆线虫 中分离大部分肠道。可以分离肠道以进行不同的下游测定。这里显示的是使用肠道进行RNA分离和微生物DNA分离。使用 BioRender.com 创建的图像。 请点击此处查看此图的大图。
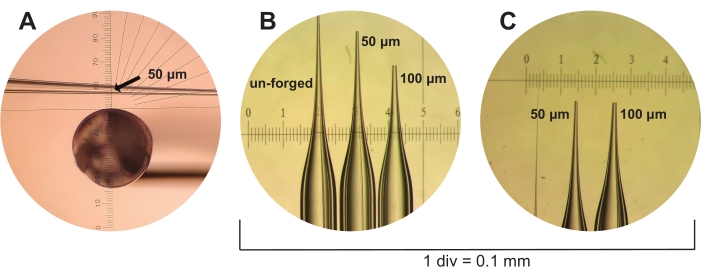
图 3:微毛细管移液器制造。(A)新拉动但未锻造的微毛细管移液器通过微锻件的眼部显示。目尺用于测量50μm大小的微毛细管移液器,估计内径为三个刻度线(由箭头表示)。(B) 未锻造的 50 μm 和 100 μm 微毛细管移液器与校准尺一起显示在解剖镜下,旁边是 1 div = 0.1 mm 的校准尺。 (C) 再次显示来自 (B) 的 50 μm 和 100 μm 微毛细管移液器,但从不同的有利位置显示。 请点击此处查看此图的大图。
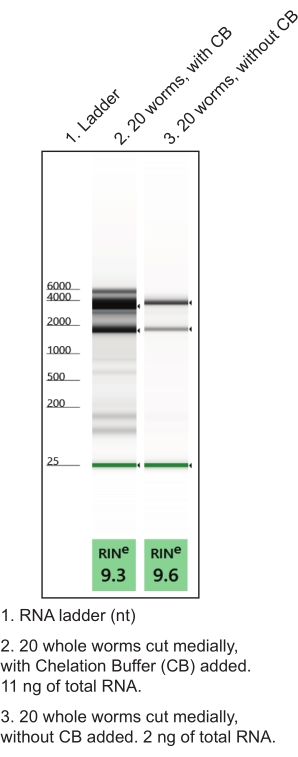
图 4:在手部解剖过程中使用螯合缓冲液 (CB) 来提高 RNA 产量。 低输入总RNA提取方案从命名组织中生成RNA制剂。图中显示了表征分离总RNA质量(RIN,RNA完整性数)和数量的代表性凝胶电泳运行。 请点击此处查看此图的大图。
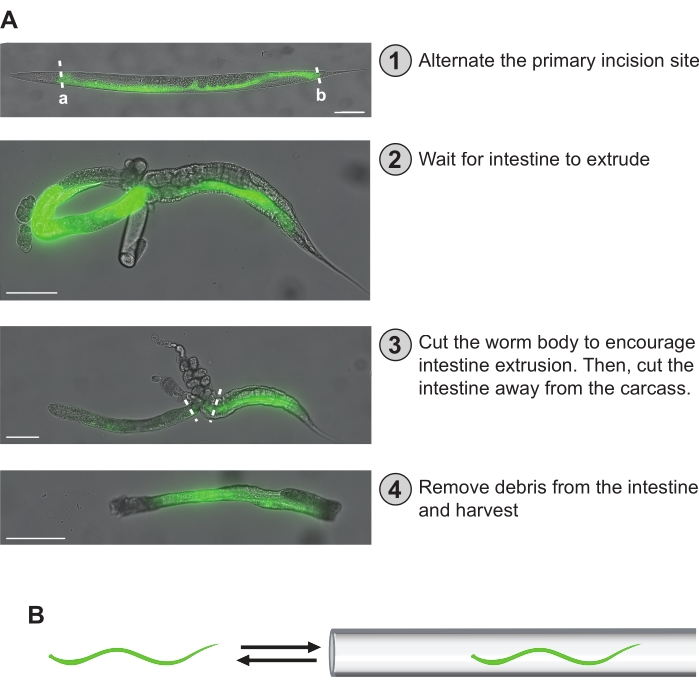
图 5:手部 解剖步骤。 (A) 此处概述了协议中描述的解剖步骤。在(1)中,蠕虫的肠道通过GFP荧光可视化。初级切口部位可以均匀分布在蠕虫之间,以确保均匀覆盖整个肠道长度。或者,可以选择"a"或"b"原切口部位以获得前中或中后肠碎片特异性制剂。在(2)中,肠已经挤压,呈环形。在(3)中,首先将肠道从蠕虫体中切开,同时试图将其从胴体和性腺中解放出来。然后将肠道从任何无法去除的剩余胴体或性腺中取出。在(4)中,将清洁的肠部分分离并准备储存。(B)一个关键步骤是通过将其进出口吸器末端形成的微毛细管移液管,将其从肠道中移出。比例尺 = 100 μm。 请点击此处查看此图的大图。
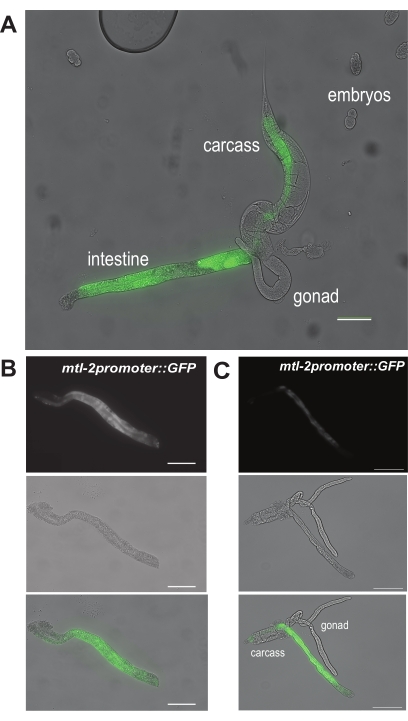
图6:手部解剖步骤的代表性结果。 显示(A)肠道从蠕虫中挤出的代表性图像。这些是CL2122基因型的蠕虫,在肠细胞特异性 mtl-2 启动子下表达GFP。两张代表性图像显示(B)清洁且完全隔离的肠道部分和(C)具有污染性腺和胴体组织的分离肠道。比例尺 = 100 μm。 请点击此处查看此图的大图。
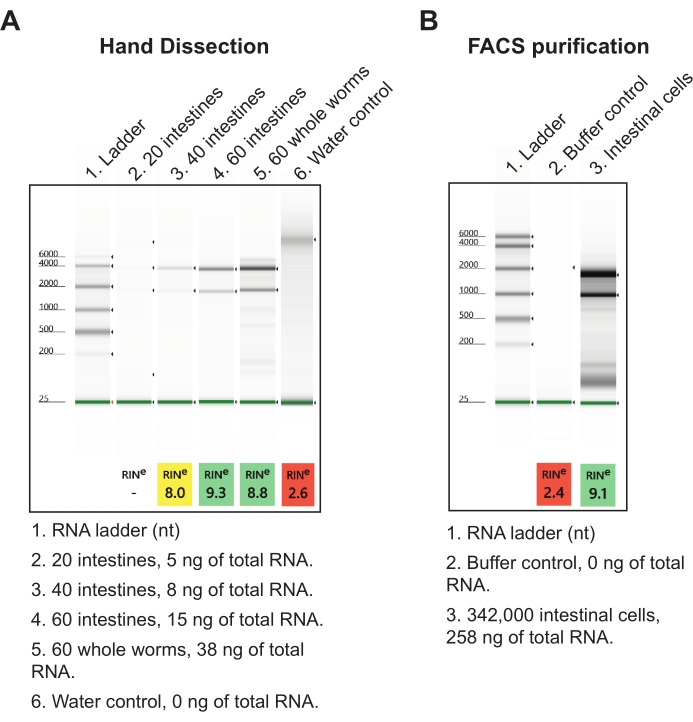
图7:从分离的肠中提取总RNA的代表性结果 。 (A)显示了通过琼脂糖凝胶电泳分离的RNA制剂的代表性图像,表征了分离的总RNA的质量(RINs,RNA完整性数)和数量。(B)显示了通过荧光激活细胞分选(FACS) 从 L1期蠕虫收获的肠细胞中分离的总RNA的代表性凝胶进行比较。在每肠20个细胞时,可以推断手解剖法每肠产生的总RNA比FACS纯化的肠细胞更多。 请点击此处查看此图的大图。
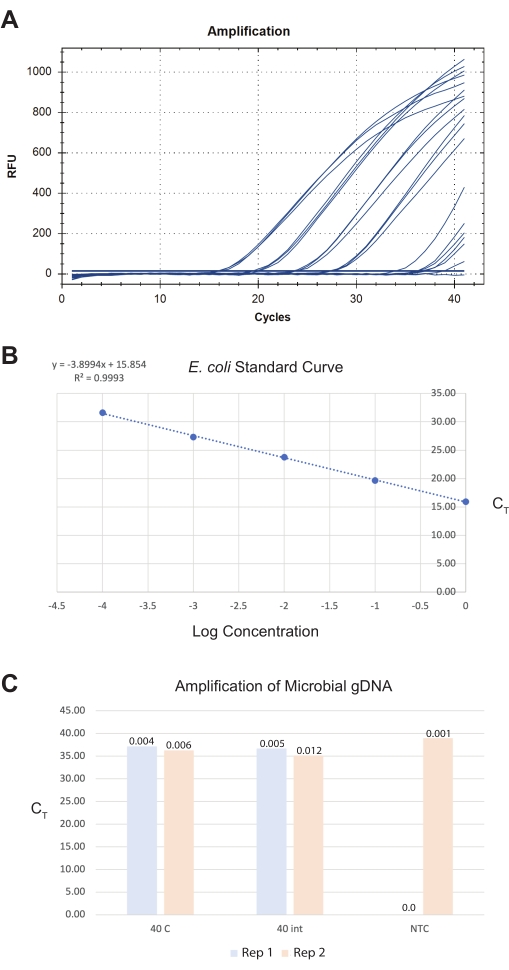
图 8:从分离的肠道中提取总微生物 DNA 的代表性结果。 一种商业微生物DNA分离试剂盒从肠道、全虫和对照中生成DNA制剂。泛细菌基因测定用于量化样品中的细菌数量。显示了(A)生成的qPCR扩增曲线,(B)用于定量样品的大 肠杆菌 OP50标准曲线以及(C)样品的代表性图像。在(B)中, 大肠杆菌 标准品的对数起始浓度与其CT 值作图。在(C)中,对40条全虫进行两次重复(重复),并处理40个分离的肠道切片以进行微生物gDNA分离。还显示了来自qPCR运行的无模板对照(NTC)。Y 轴表示样本 CT 值。从PCR定量的DNA量显示为样品条上方的总皮克(pg)值。 请点击此处查看此图的大图。
表1:本研究中使用的缓冲液和溶液的组成。请按此下载此表格。
讨论
本文介绍了从 秀丽隐杆线虫成年中手工解剖肠道的分步方案,为下游测定生成纯制剂。该方案中的关键步骤包括(1)确保不会过度麻痹蠕虫,(2)进行准确的解剖切割,(3)锻造适当尺寸的微量移液器进行解剖,以及(4)确保在最终收获期间快速恢复健康肠道。由于这些原因,将蠕虫暴露于左旋咪唑溶液时必须小心,并且需要经常刷新皮下注射针头以确保最大清晰度。使用微毛细管移液器和口腔吸引器处理肠道是另一个需要练习的步骤。适当尺寸的锻造微量移液器除了降低微量移液器内肠道丢失的风险外,还可以在解剖过程中分离大部分肠道方面产生重大影响。新方案使用者通常会在微毛细管移液管内边缘丢失肠道,然后才能将其喷射到分离试剂中。这个问题可以通过实践和正确锻造的微毛细管移液器来修正。
本文描述的方案设计用于成虫。初步试验支持该方案对L4蠕虫和老年蠕虫也有效。然而,该方案的有效性尚未在早期幼虫阶段蠕虫中进行评估。这种方法的局限性是它产生的材料量小。虽然这些数量对于RNA-seq和PCR是足够的,但它们可能不足以用于其他测定。因此,用户需要确定是否可以使用此协议切实收集测定所需的最小输入。
我们的实验室常规使用FACS纯化分离后的肠细胞30,肠细胞鉴定的事后分析方法,以及这种手解剖方法30,42。手部解剖的优点是,当蠕虫分解和细胞分离不太成功时,适合用于成虫。此外,从手部解剖制剂中提取的总RNA的效率和质量很高,这可能是因为组织从蠕虫中快速取出,然后快速沉积在核酸分离试剂中,从而减少了RNA降解。手撕法的另一个好处是成本低,易于学习,并且不需要专门的设备。最后,这种方法允许从蠕虫肠道中收获和分离肠道细菌,从而实现下游微生物组研究。
这里描述的用于从 成年秀丽隐杆 线虫中分离肠道的手解剖方案代表了研究 秀丽隐杆线虫 生物学各个方面的有力工具。例如,通过纯肠道制剂,研究人员可以研究免疫、衰老、新陈代谢和微生物组之间的交集。
披露声明
作者声明不存在利益冲突。
致谢
我们感谢James McGhee和Barb Goszczynski的开创性工作,他们最初开发了肠道解剖方法,该方法适用于此协议。我们的工作得到了由美国国家普通医学科学研究所(美国国立卫生研究院,R35GM124877至EON)监督的MIRA(R35)奖和由NSF MCB Div of Molecular and Cellular Bioscience监督的NSF-CAREER奖(EON奖#2143849)的支持。
材料
| Name | Company | Catalog Number | Comments |
| Acetylated Bovine Serum Albumin (BSA) | VWR | 97061-420 | Nuclease free BSA |
| CL2122 worm strain | CGC (Caenorhabditis Genetics Center) | CL2122 | dvIs15 [(pPD30.38) unc-54(vector) + (pCL26) mtl-2::GFP]. Control strain for CL2120. Phenotype apparently WT. |
| Calcium Chloride Dihydrate | Fisher | C79 | needed for making Egg Salts |
| 50 mL Centrifuge Tubes, Bulk | Olympus Plastics | 28-108 | Nuclease free conical tube needed for solution making. |
| 15 mL Centrifuge Tubes, Bulk | Olympus Plastics | 28-103 | Nuclease free conical tube needed for solution making. |
| Concavity slide (2-well) | Electron Microscopy Sciences | 71878-08 | 12-pk of 2-well concavity slides |
| Ethylene glycol-bis(2-amino-ethylether)-N,N,N',N'-tetraacetic acid (EGTA) | Millipore Sigma | E3889 | needed for making chelation buffer |
| Fluorescent Dissection Microscope | Leica | M205 FCA | This is an optional piece of equipment that can be used with fluorescent C. elegans strains to help guid users during hand dissections |
| N-(2-Hydroxyethyl)piperazine-N′-(2-ethanesulfonic acid), 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid (HEPES) | Millipore Sigma | H4034 | needed for making dissection buffer |
| High Sensitivity RNA ScreenTape | Agilent | 5067-5579 | for assesment of total RNA quality and quantity |
| High Sensitivity RNA ScreenTape Ladder | Agilent | 5067-5581 | for assesment of total RNA quality and quantity |
| High Sensitivity RNA ScreenTape Sample Buffer | Agilent | 5067-5580 | for assesment of total RNA quality and quantity |
| HostZERO Microbial DNA Kit | Zymo Research | D4310 | Isolation of microbial DNA from worm intestines/worms |
| Hypodermic Needle (27G x 1/2") | BD Scientific | 305109 | needed for hand dissection of intestines |
| Levamisole (a.k.a. (-)-Tetramisole hydrochloride) | Millipore Sigma | L9756 | used to temporarily paralyze worms prior to hand dissection of intestines. |
| Luer-Lok General Use Disposable Syringe (1 mL) | BD Scientific | 309628 | Optional. Can be used to affix the hypodermic needle to, allowing easier manipulation of the needle during dissection. Remove the plunger. |
| Magnesium Chloride Hexahydrate | Fisher | M33 | needed for making Egg Salts |
| Magnesium Sulfate Hpetahydrate | Sigma-Aldrich | 230391-500G | needed for making M9 buffer |
| MF-900 Microforge | Narishige | MF-900 | Used to forge the microcapillary pipettes. Available through Tritech Research. |
| 1.7 mL Microtubes, Clear | Olympus Plastics | 22-282 | Nuclease free microfuge tube needed for solution making and sample storage. |
| Mouth Aspirator Tube | Millipore Sigma | A5177 | Mouth aspirator tube is needed in combination with the microcapillary pipette to allow aspiration of dissected intestines. |
| 16S Pan-Bacterial Control TaqMan Assay | Thermo Fisher | A50137 | Assay ID: Ba04930791_s1. Assay used for gut microbial detection via qPCR. |
| P-1000 Micropipette Puller | Sutter Instruments | Model P-1000 | Used to pull the microcapillary pippettes prior to forging. |
| Petri Dish (35 x 10 mm) | Genesee Scientific - Olympus Plastics | 32-103 | Used to make M9 bath and Disseciton Buffer bath for washing worms prior to dissection. |
| Phenol:Chloroform:IAA | Ambion | AM9730 | Used in the isolation of total RNA |
| Potassium Chloride | Millipore Sigma | 529552 | needed for making Egg Salts |
| Potassium Phosphate Monobasic | Sigma-Aldrich | P0662-500G | needed for making M9 buffer |
| Qubit 3 Fluorometer | Invitrogen | Q33216 | Accompanies the Qubit RNA HS Assay Kit. Can be used to quantify RNA prior to running sample on the Agilent ScreenTape. |
| Qubit RNA HS Assay Kit | Invitrogen | Q32852 | Can be used to quantify RNA prior to running sample on the Agilent ScreenTape. |
| RNasin Ribonuclease Inhibitor | Promega | N2111 | Broad spectrum inhibition of common eukaryotic Rnases |
| RNase-Free DNase Set | Qiagen | 79254 | used for on-column DNA digestion during RNA isolation protocol. |
| RNeasy Micro Kit | Qiagen | 74004 | Used for isolation of total RNA from worm intestines/worms |
| Standard Glass Capillaries | World Precision Instruments | 1B100F-4 | 4 in OD 1.2 mm standard borosilicate glass capillaries used to make microcapillary pipettes for dissection |
| Sodium Chloride | Fisher | S271 | needed for making Egg Salts |
| Sodium phosphate dibasic heptahydrate | Fisher Scientific | S373-500 | needed for making M9 buffer |
| Syringe filter (0.2 micrometer SCFA) | Thermo Fisher | 72302520 | Optional for use with the mouth aspirator tube when mouth pipetting. |
| 4150 TapeStation System | Agilent | G2992AA | Accompanies the RNA ScreenTape reagents for assessing RNA quality and quantity |
| TaqPath BactoPure Microbial Detection Master Mix | Applied Biosystems | A52699 | master mix used for qPCR |
| TRIzol Reagent | Thermo Fisher Scientific | 15596026 | Nucleic acid isolation and preservation. QIAzol (Qiagen; 79306) can be substituted if preferred. |
| Worm Pick | NA | NA | Made in house from a pasteur pipette and a platinum wire. See wormbook for details. |
参考文献
- Riddel, D. L., Blumenthal, T., Meyer, B. J., Priess, J. . C. elegans II. , (1997).
- Corsi, A. K., Wightman, B., Chalfie, M. A transparent window into biology: A primer on Caenorhabditis elegans. Genetics. 200 (2), 387-407 (2015).
- Zhang, F., et al. Natural genetic variation drives microbiome selection in the Caenorhabditis elegans gut. Current Biology. 31 (12), 2603-2618 (2021).
- Dirksen, P., et al. CeMbio - The Caenorhabditis elegans microbiome resource. G3: Genes, Genomes, Genetics. 10 (9), 3025-3039 (2020).
- Zhang, F., et al. Caenorhabditis elegans as a model for microbiome research. Frontiers in Microbiology. 8, 485 (2017).
- Roy, P. J., Stuart, J. M., Lund, J., Kim, S. K. Chromosomal clustering of muscle-expressed genes in Caenorhabditis elegans. Nature. 418 (6901), 975-979 (2002).
- Pauli, F., Liu, Y., Kim, Y. A., Chen, P. -. J., Kim, S. K. Chromosomal clustering and GATA transcriptional regulation of intestine-expressed genes in C. elegans. Development. 133 (2), 287-295 (2005).
- Spencer, W. C., et al. A spatial and temporal map of C. elegans gene expression. Genome Research. 21 (2), 325-341 (2011).
- Spencer, W. C., et al. Isolation of specific neurons from C. elegans larvae for gene expression profiling. PLoS One. 9 (11), 112102 (2014).
- Ma, X., et al. Analysis of C. elegans muscle transcriptome using trans-splicing-based RNA tagging (SRT). Nucleic Acids Research. 44 (21), 156 (2016).
- Blazie, S. M., et al. Comparative RNA-Seq analysis reveals pervasive tissue-specific alternative polyadenylation in Caenorhabditis elegans intestine and muscles. BMC Biology. 13 (1), 4 (2015).
- Blazie, S. M., et al. Alternative polyadenylation directs tissue-specific miRNA targeting in Caenorhabditis elegans somatic tissues. Genetics. 206 (2), 757-774 (2017).
- Gómez-Saldivar, G., et al. et al.Tissue-specific transcription footprinting using RNA PoI DamID (RAPID) in Caenorhabditis elegans. Genetics. 216 (4), 931-945 (2020).
- Katsanos, D., Barkoulas, M. Targeted DamID in C. elegans reveals a direct role for LIN-22 and NHR-25 in antagonizing the epidermal stem cell fate. Science Advances. 8 (5), 3141 (2022).
- Kaletsky, R., et al. The C. elegans adult neuronal IIS/FOXO transcriptome reveals adult phenotype regulators. Nature. 529 (7584), 92-96 (2015).
- Kaletsky, R., et al. Transcriptome analysis of adult Caenorhabditis elegans cells reveals tissue-specific gene and isoform expression. PLoS Genetics. 14 (8), 1007559 (2018).
- Mathies, L. D., et al. mRNA profiling reveals significant transcriptional differences between a multipotent progenitor and its differentiated sister. BMC Genomics. 20 (1), 427 (2019).
- Liang, X., Calovich-Benne, C., Norris, A. Sensory neuron transcriptomes reveal complex neuron-specific function and regulation of mec-2/ Stomatin splicing. Nucleic Acids Research. 50 (5), 2401-2416 (2021).
- Glenwinkel, L., et al. In silico analysis of the transcriptional regulatory logic of neuronal identity specification throughout the C. elegans nervous system. eLife. 10, 64906 (2021).
- Taylor, S. R., et al. Molecular topography of an entire nervous system. Cell. 184 (16), 4329-4347 (2021).
- Charest, J., et al. Combinatorial action of temporally segregated transcription factors. Developmental Cell. 55 (4), 483-499 (2020).
- Steiner, F. A., Talbert, P. B., Kasinathan, S., Deal, R. B., Henikoff, S. Cell-type-specific nuclei purification from whole animals for genome-wide expression and chromatin profiling. Genome Research. 22 (4), 766-777 (2012).
- Tintori, S. C., Nishimura, E. O., Golden, P., Lieb, J. D., Goldstein, B. A transcriptional lineage of the early C. embryo. Developmental Cell. 38 (4), 430-444 (2016).
- Hashimshony, T., Wagner, F., Sher, N., Yanai, I. CEL-Seq: Single-cell RNA-Seq by multiplexed linear amplification. Cell Reports. 2 (3), 666-673 (2012).
- Hashimshony, T., Feder, M., Levin, M., Hall, B. K., Yanai, I. Spatiotemporal transcriptomics reveals the evolutionary history of the endoderm germ layer. Nature. 519 (7542), 219-222 (2015).
- Packer, J. S., et al. A lineage-resolved molecular atlas of C. elegans embryogenesis at single-cell resolution. Science. 365 (6459), 1971 (2019).
- Warner, A. D., Gevirtzman, L., Hillier, L. W., Ewing, B., Waterston, R. H. The C. elegans embryonic transcriptome with tissue, time, and alternative splicing resolution. Genome Research. 29 (6), 1036-1045 (2019).
- Cao, J., et al. Comprehensive single-cell transcriptional profiling of a multicellular organism. Science. 357 (6352), 661-667 (2017).
- Durham, T. J., et al. Comprehensive characterization of tissue-specific chromatin accessibility in L2 Caenorhabditis elegans nematodes. Genome Research. 31 (10), 1952-1969 (2021).
- King, D. C., et al. The transcription factor ELT-2 positively and negatively impacts direct target genes to modulate the Caenorhabditis elegans intestinal transcriptome. bioRxiv. , (2021).
- Kocsisova, Z., Mohammad, A., Kornfeld, K., Schedl, T. Cell cycle analysis in the C. elegans germline with the thymidine analog EdU. Journal of Visualized Experiments. (140), e58339 (2018).
- Han, S., et al. Mono-unsaturated fatty acids link H3K4me3 modifiers to C. elegans lifespan. Nature. 544 (7649), 185-190 (2017).
- Edgar, L. G., Wolf, N., Wood, W. B. Early transcription in Caenorhabditis elegans embryos. Development. 120 (2), 443-451 (1994).
- Edgar, L. G., Goldstein, B. Culture and manipulation of embryonic cells. Methods in Cell Biology. 107, 151-175 (2012).
- Nishimura, E. O., Zhang, J. C., Werts, A. D., Goldstein, B., Lieb, J. D. Asymmetric transcript discovery by RNA-seq in C. elegans blastomeres identifies neg-1, a gene important for anterior morphogenesis. PLoS Genetics. 11 (4), 1005117 (2015).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Cerón, J. Basic Caenorhabditis elegans methods: Synchronization and observation. Journal of Visualized Experiments. (64), e4019 (2012).
- Fay, D. S., Fluet, A., Johnson, C. J., Link, C. D. In vivo aggregation of β-amyloid peptide variants. Journal of Neurochemistry. 71 (4), 1616-1625 (1998).
- Altun, Z. F., Hall, D. H. WormAtas Hermaphrodite Handbook – Introduction to C. elegans Anatomy. WormAtlas. , (2006).
- Tan, M. -. W., Mahajan-Miklos, S., Ausubel, F. M. Killing of Caenorhabditis elegans by Pseudomonas aeruginosa used to model mammalian bacterial pathogenesis. Proceedings of the National Academy of Sciences of the United States of America. 96 (2), 715-720 (1999).
- Oesterle, A. Pipette Cookbook 2018: P-97 & P-1000 Micropipette Pullers. Sutter Instrument Company. , (2018).
- Dineen, A., Nishimura, E. O., Goszczynski, B., Rothman, J. H., McGhee, J. D. Quantitating transcription factor redundancy: The relative roles of the ELT-2 and ELT-7 GATA factors in the C. elegans endoderm. Developmental Biology. 435 (2), 150-161 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。