Method Article
Caenorhabditis elegans Bağırsaklarının El Diseksiyonu
Bu Makalede
Özet
Mevcut protokol, genomik, proteomik, mikrobiyom veya diğer tahlillere giriş için bağırsakları yetişkin Caenorhabditis elegans nematod solucanlarından elle izole etmek için bir prosedürü açıklamaktadır.
Özet
Sadece 20 hücreden oluşan Caenorhabditis elegans bağırsağı , sindirim, metabolizma, yaşlanma, bağışıklık ve çevresel tepki dahil olmak üzere yaşamı destekleyen birçok fonksiyonun bağlantı noktasıdır. C. elegans konağı ve çevresi arasındaki kritik etkileşimler, bağırsak mikrobiyotasının yoğunlaştığı bağırsakta birleşir. Bu nedenle, bağırsak dokusunu solucanın geri kalanından uzaklaştırma yeteneği, bağırsağa özgü süreçleri değerlendirmek için gereklidir. Bu protokol, yetişkin C. elegans bağırsaklarını elle diseke etmek için bir yöntemi açıklar. Prosedür, kolaylık veya eğitim amacıyla floresan etiketli suşlarda gerçekleştirilebilir. Teknik mükemmelleştirildikten sonra, bağırsaklar herhangi bir genotipteki etiketsiz solucanlardan toplanabilir. Bu mikrodiseksiyon yaklaşımı, konakçı bağırsak dokusunun ve bağırsak mikrobiyotasının eşzamanlı olarak yakalanmasını sağlar, bu da birçok mikrobiyom çalışmasına fayda sağlar. Bu nedenle, bu protokol tarafından üretilen bağırsak preparatları için aşağı akış uygulamaları, bağırsak hücrelerinden RNA izolasyonunu ve yakalanan mikrobiyotadan DNA izolasyonunu içerebilir, ancak bunlarla sınırlı değildir. Genel olarak, C. elegans bağırsaklarının el diseksiyonu, bağırsak biyolojisinin kritik yönlerini araştırmak için basit ve sağlam bir yöntem sağlar.
Giriş
Sadece 959 hücreye ve 4 günlük yumurtadan yumurtaya yaşam döngüsüne sahip Caenorhabditis elegans nematod solucanı, birçok genetik, genomik ve gelişimsel çalışma için ideal bir model sistemidir 1,2. İleri ve geri genetik taramanın kolaylığı, mühendislik floresan belirteçlerinin yaygınlığı, nükleotidi spesifik genom düzenlemesi yapma kapasitesi ve topluluk çapında sayısız kaynak, C. elegans sistemindeki büyük keşiflere ve içgörülere katkıda bulunmuştur. Bununla birlikte, önemli bir dezavantaj, küçük, kırılgan ve birbirine bağlanabilen saf hücre, doku veya organ popülasyonları elde etmenin zorluğudur. RNA-seq, ChIP-seq ve ATAC-seq gibi genomik testler için saf hücre popülasyonları önemli olduğundan, C. elegans hücrelerinin, dokularının ve organlarının saf preparatlarını elde etmek için çeşitli yaklaşımlar ortaya çıkmıştır. Burada, bağırsakları, büyük bölümlerde, yetişkin C. elegans solucanlarından elle diseke etmek için bir yöntem açıklanmaktadır. Elde edilen preparatlar aşağı akış genomik testleri için uygundur (Şekil 1).
Burada açıklanan ince ölçekli doku diseksiyonu yöntemi (Şekil 2) sadece bir yaklaşımdır. Moleküler etiketleme, solucanları ayrıştırma ve floresan ile aktive edilmiş hücre sıralama (FACS) ve post hoc analiz ile ilgilenen hücre tiplerini saflaştırma gibi diğer alternatif teknikler de C. elegans moleküler biyolojisinin dokuya özgü özelliklerini araştırmak için başarıyla kullanılmıştır. Bununla birlikte, el diseksiyonunun bu diğer yaklaşımlara göre bir avantajı, C. elegans bağırsağının özelliklerini ve bakteri içeriğini aynı anda araştırmak için kullanılabilmesidir 3,4,5. Bu, 16S rRNA gen dizilimini mümkün kılar ve C. elegans sistemi içinde mikrobiyom çalışmalarını kolaylaştırır. Bununla birlikte, önemli bir sınırlama, bağırsak hücrelerinin ayrı ayrı izole edilmemesidir.
Moleküler etiketleme, yalnızca belirtilen doku veya ilgili hücreler içindeki moleküllere hücre tipine özgü bir etiket verir. Bu etiketler daha sonra toplam solucan preparatlarından izole edilebilir. Bu şekilde, etiketli bir poliA bağlayıcı protein veya eklenmiş lider kullanan dokuya özgü promotörler, dokuya özgü transkriptom profillemesini 6,7,8,9,10 ve 3'UTR haritalama 11,12'yi etkinleştirmiştir. Benzer şekilde, dokuya özgü transkripsiyon faktörü profilleri, promotöre özgü transkripsiyon faktörü varyantlarının etiketler veya enzim füzyonları13,14 ile eklendiği ChIP-seq ve DamID kullanılarak gerçekleştirilmiştir.
FACS, ilgilenilen hücre tiplerini, içsel hücresel özelliklerine ve floresan özelliklerine dayanarak ayrışmış solucanlardan izole etmeyi sağlar. Bu yaklaşım, 8,15,16 ve bireysel nöronal hücre tipleri8,9,15,16,17,18 olmak üzere çeşitli organlardan dokuya özgü transkriptomlar üretmiş ve tüm C. elegans sinir sisteminin ekspresyon haritasını oluşturmak için kullanılmıştır 19,20 . FACS ve kuzeni floresan ile aktive edilen çekirdek sıralama (FANS), hücreye özgü kromatin profilleri21,22 oluşturmak için de kullanılmıştır.
Son olarak, post-hoc analiz, tek hücreli çözünürlük tahlillerinde gerçekleştirilebilir. Bu yöntemde, tüm bireysel hücreler incelenir, analiz aşamasında her birinin hücre tipi atfedilir ve ilgilenilen hücre tipleri daha fazla çalışma için seçici olarak filtrelenir. Post-hoc analiz, C. elegans embriyoları 23,24,25,26,27 ve L1 28 evre solucanlarında hem yüksek uzamsal hem de zamansal çözünürlüğe sahip gelişmekte olan hücrelerin transkriptomlarını elde etmek için başarıyla kullanılmıştır. Kromatin erişilebilirliği, benzer bir strateji29 kullanılarak RNA-seq yerine ATAC-seq kullanılarak da karakterize edilmiştir.
Her yaklaşımın avantajları ve sınırlamaları vardır. C. elegans bağırsağı için, bağırsak hücrelerinin solucan ayrışması ve FACS izolasyonu, embriyo ve larva evreleri30'da elde edilebilir, ancak yetişkinlerde zordur. Bunun, bağırsağın büyük, endo-reporte edilmiş ve güçlü bir şekilde yapışan hücrelerinden kaynaklandığı düşünülmektedir ve bu da onları hasarsız olarak ayrıştırmayı zorlaştırmaktadır. Burada açıklanan el diseksiyonu yöntemi, yetişkin solucanın bağırsağının büyük bölümlerinin izole edilmesine izin vererek bu zorlukları aşar. Aynı aşamadan gonadların elle diseksiyonu uygulaması yaygın ve basittir. Bağırsak diseksiyonu gonad diseksiyonuna benzer, ancak daha az sıklıkla yapılır32. Burada sunulan protokol, Dr. James McGhee ve Barb Goszczynski tarafından geliştirilen daha uzun, yayınlanmamış bir protokolden uyarlanmıştır. Bu kolaylaştırılmış protokol, blastomerleri erken evre embriyolardan izole etmek için teknikler ödünç alır 23,33,34,35. C. elegans'ta çoğu hücre veya doku tipini izole etmek için el diseksiyonu mümkün olmasa da, bağırsakları yetişkin solucanlardan izole etmek için idealdir. Bu nedenle, el diseksiyonu, bağırsağa özgü hücre preparatları elde etmek için diğer araçları tamamlar.
Protokol
Bu çalışmada CL2122 solucanları kullanılmıştır. Solucanlar, NIH Araştırma Altyapı Programları Ofisi (P40 OD010440) tarafından finanse edilen Caenorhabditis Genetik Merkezi (CGC, bakınız Malzeme Tablosu) aracılığıyla elde edildi.
1. Diseksiyon için solucanların büyümesi
- Standart kültürleme prosedürlerini (yani, E. coli OP50 ile tohumlanmış NGM plakaları) 36,37'yi izleyerek senkronizasyon için karışık aşama CL2122 solucanlarından oluşan büyük bir plaka yetiştirin.
NOT: Maksimum yumurtlama kapasitesine ulaşmak genellikle ~ 96 saat sürer.- Embriyo solucanları 72-96 saatlik periyotta hazırlar. Embriyo hazırlandıktan sonra, embriyoların M9'da (bakınız Tablo 1) 48 saat boyunca yumurtadan çıkmasına izin verin. Bu, senkronize bir L1 evre solucanı popülasyonu verecektir.
NOT: CL2122 solucanları, bağırsağa özgü mtl-2 (MeTaLlothionein 2) promotörü38'den tahrik edilen entegre bir transgen-GFP (yeşil floresan proteini) barındırır. Bu promotör, bağırsak hücresi sitoplazmasına özgüdür ve bağırsağın floresan diseksiyon mikroskobunda görselleştirilmesini sağlar. Eğitildikten sonra, kullanıcılar floresan rehberliğini gerekli bulamayabilir.
- Embriyo solucanları 72-96 saatlik periyotta hazırlar. Embriyo hazırlandıktan sonra, embriyoların M9'da (bakınız Tablo 1) 48 saat boyunca yumurtadan çıkmasına izin verin. Bu, senkronize bir L1 evre solucanı popülasyonu verecektir.
- Plaka senkronize L1 solucanları en az iki küçük plaka üzerinde. NGM plakalarında yetişkin aşamasına ulaşana kadar yeterli yiyecekle solucanlar yetiştirin (yumurtlama yeteneğine sahip embriyoların varlığı ile tanımlanır). Bu, 20 °C'de 38-46 saat arasında sürer.
- Aynı gelişim aşamasının replikalar ve karşılaştırmalı suşlar arasında toplandığından emin olun.
NOT: Solucanların yetiştirilme süresinin uzunluğu, suşa, sıcaklığa, besin kaynağına ve hedeflenen gelişim aşamasına bağlıdır39. L4 ve yaşlı yetişkin aşamaları gibi yetişkin aşamasına yakın diğer aşamalar da kullanılabilir. Mikrobiyom deneylerini planlamak için, geleneksel gıda kaynağının (E. coli OP50) ötesindeki farklı bakteriyel gıda kaynakları, CeMbio suşları 4 veya ilgilenilen bir patojen40 gibi solucanlar yetiştirmek için kullanılabilir.
- Aynı gelişim aşamasının replikalar ve karşılaştırmalı suşlar arasında toplandığından emin olun.
2. Stok çözeltilerinin ve mikrokapiler pipetlerin hazırlanması
NOT: Tablo 1 , bu çalışma için kullanılan tüm tamponların ve çözeltilerin ayrıntılarını vermektedir.
- Nükleaz içermeyen konik bir tüpte 50 mL Yumurta tuzu (diğer adıyla Yumurta tamponu) hazırlayın (bkz. Yapıldıktan sonra, oda sıcaklığında saklayın.
- Nükleaz içermeyen konik bir tüp içinde 10 mL'lik 100 mM levamisol stok çözeltisi hazırlayın. Hazırlandıktan sonra, 500 μL alikot yapın ve bunları -20 ° C'de saklayın. Alikotlar çözülebilir ve bir seferde 1 hafta boyunca 4 ° C'de saklanabilir.
- Nükleaz içermeyen bir mikrosantrifüj tüpünde 1 mL stok asetillenmiş sığır serum albümini (BSA) çözeltisi hazırlayın. Hazırlandıktan sonra, 50 μL tek kullanımlık alikotlar yapın ve bunları -20 ° C'de saklayın.
NOT: BSA'nın asetillenmiş versiyonunu kullanmak önemlidir, çünkü bu nükleaz içermeyen tek BSA şeklidir. Asetilasyonsuz BSA önemli bir nükleaz kaynağı olabilir ve bu nedenle numunelerin bozulmasına neden olabilir. - Aşağıdaki adımları izleyerek her biri en az beş adet 50 μm ve 100 μm mikrokapiler pipet hazırlayın.
- İlk olarak, standart cam kılcal damarları (4 inç uzunluğunda ve 1,2 mm dış çapında) bir iğne çektirme makinesi kullanarak bir enjeksiyon iğnesi şekline çekin (Malzeme Tablosuna bakınız) ve Sutter Instruments Pipet Yemek Kitabı41'den "Yapışkan Hücre, C. elegans, & Drosophila" için koşullar (Koşullar: Isı = Rampa + 5; Çekme = 100; Vel. = 75; Gecikme = 90; Basınç = 500; 2,5 mm x 2,5 mm Kutu).
- Daha sonra, mikrokapiler pipetleri bir mikroforge kullanarak 50 μm (M5/0.1 hedefi altındaki microforge oküler cetvel tarafından belirtilen üç onay işareti) veya 100 μm (aynı koşullar altında beş onay işareti) boyutuna kadar dövün (bkz. Bu boyutlar mikrokapiler pipetin tahmini açılma çapını temsil eder (Şekil 3).
- Ardından, mikrokapiller pipetlere bir ağız aspiratör tüpü yapıştırın.
NOT: Aspiratör pipetleri geleneksel olarak ağızdan pipetleme ile kontrol edilir, ancak birçok modern güvenlik protokolü bu yönteme izin vermez. Bu nedenle, kullanıcılar boruyu parmak ve başparmak arasına sıkıştırarak ağız aspiratör borusu ile aspirasyonu kontrol edebilirler. Ek olarak, daha fazla güvenlik için ağız aspiratör boru sistemine bir şırınga filtresi monte edilebilir.
3. Deneysel hazırlık
- Nükleaz içermeyen konik bir tüpte 5 mL diseksiyon tamponu hazırlayın. Oda sıcaklığında saklayın.
- Nükleaz içermeyen bir mikrosantrifüj tüpünde 1 mL çalışma asetillenmiş BSA çözeltisi hazırlayın. Buz üzerinde tutun.
- Nükleaz içermeyen bir mikrosantrifüj tüpünde 350 μL çalışma levamisol çözeltisi yapın. Üçlü olarak hazırlayın (yaklaşık 20 solucan için bir tüp). Buz üzerinde tutun.
- Şelasyon tamponunu nükleaz içermeyen bir mikrosantrifüj tüpünde hazırlayın (Tablo 1). Çoğaltın (yaklaşık 10 disseke solucan için bir tüp). Buz üzerinde tutun. El diseksiyonları sırasında şelasyon tamponunun kullanılması RNA kalitesini ve miktarını artırır (Şekil 4).
- Nükleaz içermeyen bir tüpte 500 μL nükleik asit izolasyon reaktifi veya kit tarafından belirtilen izolasyon reaktifi içeren deney grubu başına bir mikrosantrifüj tüpü hazırlayın (bkz. Buz üzerinde tutun. Bu tüp, depolama veya daha sonra kullanım için nihai, izole bağırsakları toplamak için kullanılacaktır.
- Bir M9 banyosu ve bir diseksiyon tampon banyosu hazırlayın. Bunu yapmak için, iki adet 35 mm çapında steril Petri kabı elde edin. Ardından, bir kaba 2 mL M9 ve diğerine 2 mL diseksiyon tamponu ekleyin. Son olarak, her banyoya 100 μL çalışan BSA çözeltisi ekleyin. Karıştırmak için girdap. Banyolara BSA eklenmesi, solucanların plastiğe yapışmasını önleyecektir.
- Diseksiyon dizisini hazırlayın. 2 delikli bir konkavite sürgüsü elde edin ( Malzeme Tablosuna bakınız) ve ilk kuyucuğa 150 μL çalışma levamisol çözeltisi ekleyin. Ardından, ikinci kuyucuğa 150 μL diseksiyon tamponu ekleyin. Son olarak, her bir kuyucuğa 20 μL çalışan BSA çözeltisi ekleyin. Her bir kuyucuğa BSA eklenmesi, solucanların slayta yapışmasını önleyecektir.
4. C. elegans bağırsağının el diseksiyonu
- Bir solucan toplama yöntemi kullanarak 20 yetişkin solucanı NGM plakasından M9 banyosuna taşıyın (adım 3.6). Bu, solucanlardan dış bakterileri yıkayacaktır.
- Ardından, 20 solucanın tümünü M9 banyosundan diseksiyon tampon banyosuna taşıyın (adım 3.6). Bu, dış bakterileri daha da yıkayacak ve diseksiyon tamponundaki solucanları dengeleyecektir.
- Daha sonra, solucan gruplarını (yani, 10'lu setler halinde) diseksiyon tampon banyosundan levamisol çözeltisi içeren kuyuya (adım 3.7) taşıyın.
NOT: Levamisol solucanları geçici olarak felç edecektir.- Solucan hareketleri yavaşladığında, onları levamisol kuyucuğundan diseksiyon tamponunu içeren kuyuya hızla taşıyın (adım 3.7). Solucanları aşırı felç etmemeye dikkat edin.
NOT: Gruplar halinde levamisol çözeltisine taşınan solucanların sayısı, kullanıcının rahatlığına bağlı olarak değişebilir. Bu, başlangıçta M9 banyosuna toplanan ve daha sonra diseksiyon tampon banyosuna taşınan solucanların sayısı için de geçerlidir. Özellikle eğitim sırasında, kullanıcı protokolü öğrendiği ve rahat ettiği için diseksiyon için ek solucanlara sahip olmak iyi bir uygulamadır.
- Solucan hareketleri yavaşladığında, onları levamisol kuyucuğundan diseksiyon tamponunu içeren kuyuya hızla taşıyın (adım 3.7). Solucanları aşırı felç etmemeye dikkat edin.
- Ardından, diseksiyonlara başlamadan önce solucanların diseksiyon tamponunda biraz hareket etmeye başlamasına izin verin.
NOT: Bağırsaklar aşırı felçli solucanlardan (yani, hiç hareket etmeyen solucanlardan) iyi ekstrüzyon yapmazlar. - Hazır olduğunda, solucanları hipodermik bir iğne (yani, 27 G x 1/2 inç) kullanarak (bkz. Malzeme Tablosu) bir floresan diseksiyon kapsamı altında, farenksin hemen arkasında (Şekil 5Aa) veya rektumun hemen önünde (Şekil 5Ab) bir kesim yaparak diseke edin. Bu, bağırsağın iki büyük bölümünü, bir ön-orta yarısı ve bir orta-arka yarısıI üretecektir. İstenilen toplam bağırsak sayısı elde edilene kadar ön-orta ve orta-arka bölümlerden elde edilen bağırsak bölümlerinin sayısını eşdeğer tutarak solucanların geri kalanı için bu kalıba devam edin.
NOT: Hipodermik iğneyi boş bir 1 mL şırınga namlusuna yapıştırmak, el diseksiyonları sırasında manipülasyonuna yardımcı olabilir. Kullanıcının rahatlığına ve deneyimine bağlı olarak, bağırsak parçası vermeyen bir diseksiyon kesimi yapmak nadir değildir. Bununla birlikte, pratikle, bu çok daha az yaygın hale gelir. - Bağırsakların vücuttan maksimum ekstrüzyon yapması için yaklaşık 1 dakika bekleyin. Genellikle bir döngü şekli alırlar ve gonadların bir kısmına yapışabilirler (Şekil 5A). Beklerken, RNA bozulmasını azaltmaya yardımcı olmak için kuyucuğa 50 μL şelat tamponu ekleyin (Şekil 4).
- Beklerken ve bağırsak ekstrüzyonunu kolaylaştırmaya yardımcı olmak için, bir ağız aspiratörüne bağlı 100 μm mikrokapiller pipeti kullanın ve bağırsak / solucanı pipetin içine ve dışına çekin (Şekil 5B). Bu aynı zamanda bağırsağın gonaddan kurtarılmasına yardımcı olacaktır. Bağırsakları yanlışlıkla mikrokapiler pipete tamamen emerek kaybetmemeye dikkat edin.
NOT: Kullanıcı, bağırsağı vücudun geri kalanından ve gonaddan kurtarmak için 100 μm ve 50 μm mikrokapiler pipetler arasında geçiş yapabilir. 50 μm mikrokapiler pipetin daha küçük çaplı açıklığı, yapışkan parçaların bağırsaktan çıkarılması için bir fayda sağlayabilir. Aspiratör pipetleri geleneksel olarak ağızlı pipetleme ile kontrol edilir, ancak birçok modern güvenlik protokolü bu yönteme izin vermez. Bu nedenle, kullanıcılar boruyu parmak ve başparmak arasına sıkıştırarak ağız aspiratör borusu ile aspirasyonu kontrol edebilirler. Ek olarak, daha fazla güvenlik için ağız aspiratör boru sistemine bir şırınga filtresi monte edilebilir. - Bir bağırsak yeterince ekstrüde edildikten sonra, vücudun geri kalanından ve kalan gonaddan kesmek için 27 G hipodermik iğneyi kullanın. İzole edilen bağırsak bölümünün boyutu, biçerdöverin deneyimine, kesimin kalitesine ve solucandaki felç seviyesine bağlı olarak büyük ölçüde değişebilir.
NOT: Bağırsak ve bağırsak parçalarının bütünlüğü, GFP floresanları aracılığıyla protokol boyunca kolayca izlenebilir. - Şimdi, bağırsak bölümünü aspire etmek için mikrokapiler pipeti kullanın ve kuyudan dışarı ve nükleik asit izolasyon reaktifi veya kit tarafından belirtilen izolasyon reaktifi içeren mikrosantrifüj tüpüne taşıyın. İzole bağırsakları buz üzerindeki reaktifte tutun ve kalan bağırsaklar için tekrarlayın.
NOT: Gün boyunca nükleik asit izolasyon reaktifi veya kit tarafından belirtilen başka bir izolasyon reaktifi içeren mikrosantrifüj tüpüne çoklu bağırsaklar eklenebilir. Buz üzerinde tutun. Tüm bağırsaklar 1 günde izole edilemezse, zaten izole edilmiş ve bir nükleik asit izolasyon reaktifinde (nükleik asitleri koruyan) depolanmış olanlar, izolasyonlar devam edene ve / veya tamamlanana kadar -80 ° C'de tutulabilir. Burada, numuneler uzun vadede stabildir (yani, birkaç aydan 1 yıla kadar) ve nükleik asitleri izole etmeye hazır olana kadar kalabilir. Bağırsaklar suya veya herhangi bir kit-spesifik lizis tamponuna toplanabilir. Bununla birlikte, aşağı akış uygulamalarına geçmeden önce bağırsakların buz üzerindeki belirli bir tamponda (veya istenen diğer sıcaklıkta) ne kadar süre kalabileceğini belirlerken dikkate alınmalıdır.
5. Disseke bağırsaklardan RNA izolasyonu
- Nükleik asit izolasyon reaktifinde depolanan edinilmiş dokuları üç donma/çözülme/vorteks döngüsü gerçekleştirerek homojenize edin. Bunu yapmak için, 37 ° C'lik bir boncuk banyosu ve sıvı azot (veya diğer benzer araçlar) kullanın.
- Daha sonra, numuneye 0.2 hacim fenol:kloroform:IAA reaktifi ekleyin (bkz. Malzeme Tablosu) ve vortekse kısaca. Örneğin, 500 μL'lik bir başlangıç numunesi hacmi için, 0.2 hacim kloroform 100 μL olacaktır.
- Tüpü 20 saniye boyunca elle sallayın ve ardından oda sıcaklığında 3 dakika inkübe edin.
- Numune fazlarını santrifüjleme ile ayırın (10.000 x g, 18 dakika, 4 °C).
- Sulu fazı çıkarın ve nükleaz içermeyen yeni bir mikrosantrifüj tüpüne aktarın.
NOT: Arabirimi aspire etmemeye veya rahatsız etmemeye dikkat edin. - Daha sonra, sulu faza eşit hacimde% 100 etanol ekleyin ve numuneyi 20 saniye boyunca elle sallayın.
- Numunenin 700 μL'sini spin kolonuna aktarın (bkz. Ardından, RNA'yı santrifüjleme ile sütuna yapıştırın (≥8.000 x g, 30 s, RT [oda sıcaklığı]). Akış akışını atın. Kalan ilave numuneler için bu işlemi tekrarlayın.
- Numuneyi yıkamak için sütuna 350 μL RW1 tamponu ekleyin (bkz. Ardından, santrifüj yapın (≥8.000 x g, 30 s, RT) ve akışı atın.
- Kolon üzerinde DNA sindirimi gerçekleştirin. Örnek sütuna RDD tamponuna 80 μL DNaz I ekleyin (bkz. Malzeme Tablosu). Ardından, RT'de 15 dakika kuluçkaya yatırın.
- Ardından, numuneyi yıkamak için sütuna 350 μL RW1 tamponu ekleyin. Santrifüj (≥8.000 x g, 30 s, RT) ve sütunu yeni bir toplama tüpüne aktarın. Akış ve eski toplama tüpünü atın. Bu yıkama DNase'i temizler.
- Örnek sütuna 500 μL RPE ekleyin (bkz. Malzeme Tablosu). Ardından, santrifüj (≥8.000 x g, 30 s, RT) ve akışı atın. İkinci bir yıkama için tekrarlayın.
- Daha sonra, kolon membranını daha da kurutmak için 1 dakika daha santrifüj yapın (≥8.000 x g, 1 dakika, RT). Ardından, numune kolonunu kapaklı taze nükleaz içermeyen bir mikrosantrifüj toplama tüpüne aktarın. Akış ve eski toplama tüpünü atın.
- 14 μL nükleaz içermeyen suyu doğrudan numune kolonunun zarına ekleyin. Ardından, numuneyi RT'de 2 dakika inkübe edin. Daha sonra, RNA'yı etkisiz hale getirmek için santrifüj (≥8.000 x g, 1 dakika, RT).
- Numuneyi buz üzerinde saklayın. Daha sonra, ticari olarak temin edilebilen tahlil kitlerini kullanarak numunenin RNA kalitesini ve miktarını değerlendirin (bkz. İşiniz bittiğinde, numuneyi -80 ° C'lik bir dondurucuda saklayın.
NOT: RNA genellikle -80 ° C'de bozulmadan 1 yıla kadar kararlıdır.
Sonuçlar
Bu protokol, bağırsağın büyük bölümlerini erişkin C. elegans'tan elle izole etmek için kullanıldı (Şekil 2). Gösterilen her deney grubu için son bağırsak örneği, anterior-orta ve orta-posterior bağırsak kesitlerinin eşit bir koleksiyonundan oluşur. Bununla birlikte, deneysel soruya bağlı olarak, sadece ön, orta veya arka bağırsak bölümlerinin bir koleksiyonunu da içerebilir. Toplu olarak, bu protokol için üç temsili sonuç sunulmaktadır. Birincisi, bağırsakların başarılı diseksiyonunu ve izolasyonunu göstermektedir (Şekil 6). İkincisi, izole bağırsaklardan RNA izolasyonunun sonuçlarını bildirmektedir (Şekil 7). Üçüncüsü, izole bağırsaklardan mikrobiyal sürveyansın sonuçlarını göstermektedir (Şekil 8).
İlk sonuç için, Şekil 6A, yetişkin CL2122 solucanları içindeki Şekil 5A'daki "a" bölgesinde birincil bir kesi yaptıktan sonra ekstrüde bir bağırsağın nasıl göründüğünü göstermektedir. CL2122 solucanları, GFP'ye (mtl-2 p::GFP) kaynaşmış bağırsağa özgü mtl-2 promotörünü barındırdığından, izole bağırsaklar floresan diseksiyon kapsamı altında yeşil renkte parlar. Bir bağırsak segmentinin başarılı diseksiyonu daha sonra Şekil 6B'de gösterilmiştir. Bu bağırsak bölümü, gonad veya karkastan gelen döküntüler gibi görünür kirleticilerden arındırılmıştır. Buna karşılık, Şekil 6C, gonad ve karkas hala bağırsak segmentine gözle görülür şekilde bağlı olduğu için başarılı bir şekilde diseke edilmemiş bağırsakları göstermektedir.
İkinci sonuç için, bağırsaklar bir nükleik asit izolasyon reaktifine toplandı ve ertesi gün düşük girişli toplam RNA ekstraksiyon protokolü kullanılarak işlendi (bkz. Anterior-orta ve orta-posterior kesitlerden 60 toplam bağırsak kesitinin son bir bağırsak örneği, kabaca 15 ng yüksek kaliteli toplam RNA verir (Şekil 7A). Bu miktarda toplam bağırsak tek bir günde kolayca elde edilebilir, ancak gerekirse birkaç gün içinde parçalanabilir. El diseksiyonundan elde edilen RNA verimleri, solucan ayrışmasından ve bağırsak hücrelerinin FACS izolasyonundan daha verimlidir, çünkü toplam RNA'nın orantılı miktarlarını elde etmek için yüz binlerce bağırsak hücresi gereklidir (Şekil 7B). Önemli olarak, el diseksiyonu ile üretilen RNA verimleri, 2 pg RNA kadar az alabilen ticari RNA-seq kütüphane kitleri (yani, NEBNext Ultra II ve NEBNext Tek Hücre / Düşük Giriş) için girdi olarak fazlasıyla yeterlidir.
Üçüncü sonuç için, bağırsaklar steril ddH20'a toplandı ve aynı gün ticari bir mikrobiyal DNA izolasyon kiti kullanılarak işlendi (bkz. Anterior-orta ve orta-posterior kesitlerden 40 toplam bağırsak kesitinin son bir bağırsak örneği, bir pan-bakteriyel tespit testi kullanılarak yaklaşık 0.009 pg toplam mikrobiyal DNA verir (bkz. Bu miktarlar geleneksel niceleme yöntemleri için çok düşüktür ve qPCR standart eğrilerinden tahmin edilmelidir. İdeal olarak, kullanıcılar nihai bir toplam bağırsak miktarını >40 hedeflemelidir, çünkü bu, reaktif kontaminasyon seviyeleri ile ilgili sinyal-gürültü algılama sınırını ve sınırını arttırır.
Deneysel tasarım göz önüne alındığında, uygun kontrol numunelerinin toplanması her zaman gereklidir. Transkriptomik deneyler için, uygun bir deneysel kontrol, bağırsaklarla aynı şekilde toplanan tüm solucanın preparatlarını içerebilir. Bununla birlikte, bağırsakların C. elegans'tan diseksiyonu ve izolasyonu sırasında, bağırsak bölümlerine yapışan karkas ve gonad parçalarını görmek yaygındır. İdeal olarak bu kirletici dokular, aşağı akış kullanımı için depolanmadan önce bağırsaklardan çıkarılacak olsa da, ek deneysel kontroller, bağırsak diseksiyonu sonrası kalan solucan karkaslarının toplanmasını ve / veya disseke edilmiş gonadların toplanmasını içerebilir. Mikrobiyom deneyleri için kontroller, geleneksel pozitif (bakteri kültürü) ve negatif (su) kontrollere ek olarak, bağırsaklarla aynı şekilde toplanan tüm solucanın preparatlarını da içerebilir.
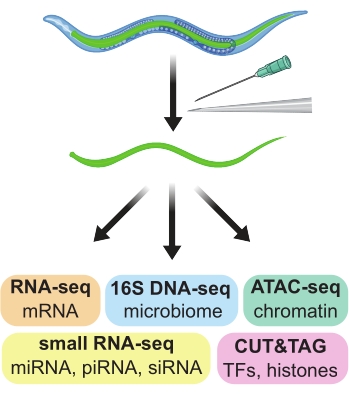
Şekil 1: Çok çeşitli aşağı akış omik testlerinde kullanılmak üzere dokuya özgü preparatlar üretmek için kullanılan yetişkin C. elegans'tan bağırsakların elle diseksiyonu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
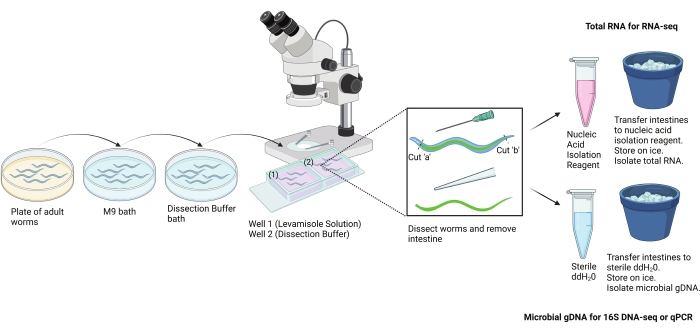
Şekil 2: El diseksiyon protokolü şeması. Bu protokol, bağırsağın büyük bölümlerini yetişkin C. elegans'tan elle izole etmek için kullanıldı. Bağırsaklar farklı aşağı akış tahlilleri için izole edilebilir. Burada RNA izolasyonu ve mikrobiyal DNA izolasyonu için bağırsakların kullanımı gösterilmektedir. BioRender.com ile oluşturulan görüntü. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
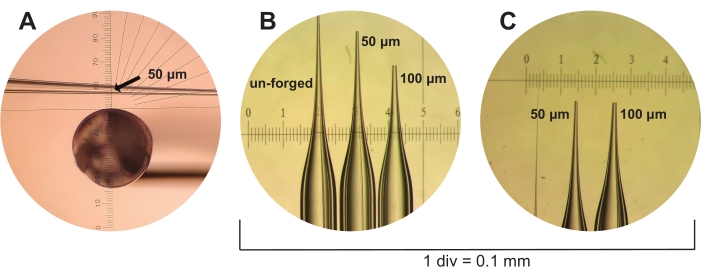
Şekil 3: Mikrokapiler pipet üretimi. (A) Yeni çekilmiş ancak dövülmemiş bir mikrokapiler pipet, bir mikrodemirin oküler parçasından gösterilir. Oküler cetvel, 50 μm boyutundaki mikrokapiler pipetleri tahmini üç kene işaretinin iç çapına (gösterilmiştir, okla gösterilir) ölçmek için kullanılır. (B) Dövülmemiş, 50 μm ve 100 μm mikrokapiler pipetler, diseksiyon kapsamı altında, 1 div = 0,1 mm'lik bir kalibrasyon cetvelinin yanında gösterilir. (C) (B)'den gelen 50 μm ve 100 μm mikrokapiler pipetler tekrar ancak farklı bir bakış açısından gösterilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
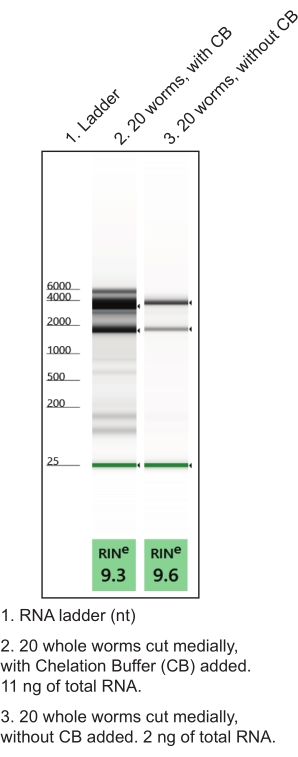
Şekil 4: RNA verimini artırmak için el diseksiyonu sırasında şelasyon tamponunun (CB) kullanımı. Düşük girişli toplam RNA ekstraksiyon protokolü, adlandırılmış dokulardan RNA preparatları üretti. İzole edilmiş toplam RNA kalitesini (RIN, RNA bütünlük numarası) ve miktarını karakterize eden temsili jel elektroforez çalışmaları gösterilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
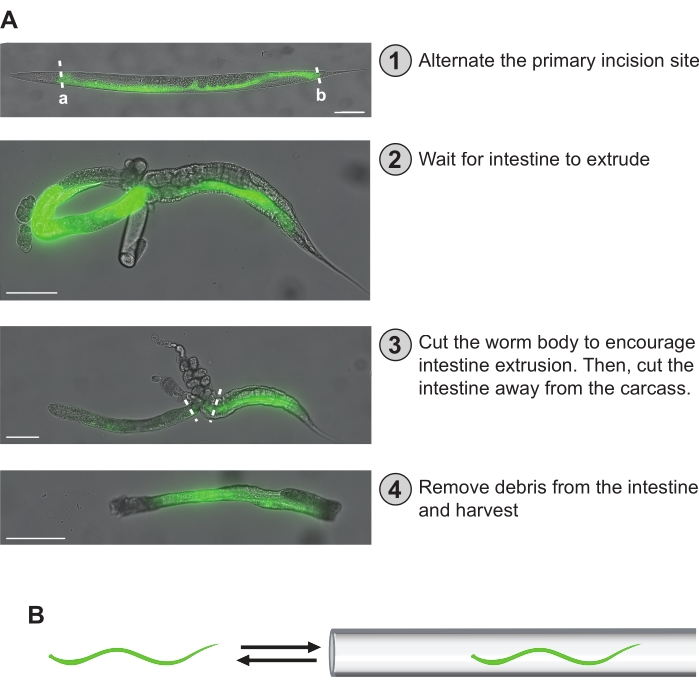
Şekil 5: El diseksiyon adımları. (A) Protokolde açıklanan diseksiyon adımları burada özetlenmiştir. (1)'de, solucanın bağırsağı GFP floresansı ile görselleştirilir. Birincil kesi bölgesi, bağırsağın tüm uzunluğu boyunca eşit kapsama alanı sağlamak için solucanlar arasında eşit olarak dağıtılabilir. Alternatif olarak, anterior-orta veya orta-posterior intestinal fragmana özgü bir preparat elde etmek için "a" veya "b" primer insizyon bölgeleri seçilebilir. (2)'de, bağırsak ekstrüde olmuş ve bir döngü şekli almıştır. (3)'te, bağırsak ilk önce karkas ve gonaddan kurtulmaya çalışırken solucan gövdesinden kesilir. Bağırsak daha sonra çıkarılamayan kalan karkas veya gonaddan çıkarılır. (4)'te, bağırsağın temizlenmiş bir bölümü izole edilir ve depolamaya hazırdır. (B) Kritik bir adım, yapışan kalıntıları (yani gonad, karkas) ağız aspiratörünün sonunda bulunan mikrokapiller pipetin içine ve dışına geçirerek bağırsaktan çıkarmaktır. Ölçek çubukları = 100 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
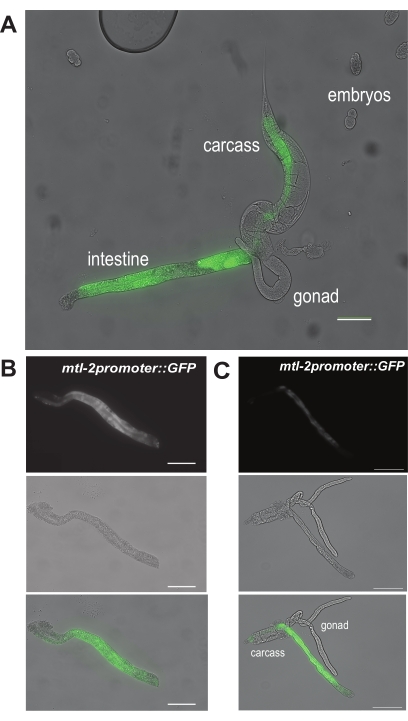
Şekil 6: El diseksiyonu adımlarının temsili sonuçları. (A) bağırsağın solucandan ekstrüzyonunu gösteren temsili bir görüntü. Bunlar, bağırsak hücresine özgü mtl-2 promotörü altında GFP'yi eksprese eden CL2122 genotipinin solucanlarıdır. İki temsili görüntü, (B) bağırsağın temizlenmiş ve tamamen izole edilmiş bir bölümünü ve (C) kirletici gonad ve karkas dokuları olan izole bir bağırsağı göstermektedir. Ölçek çubukları = 100 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
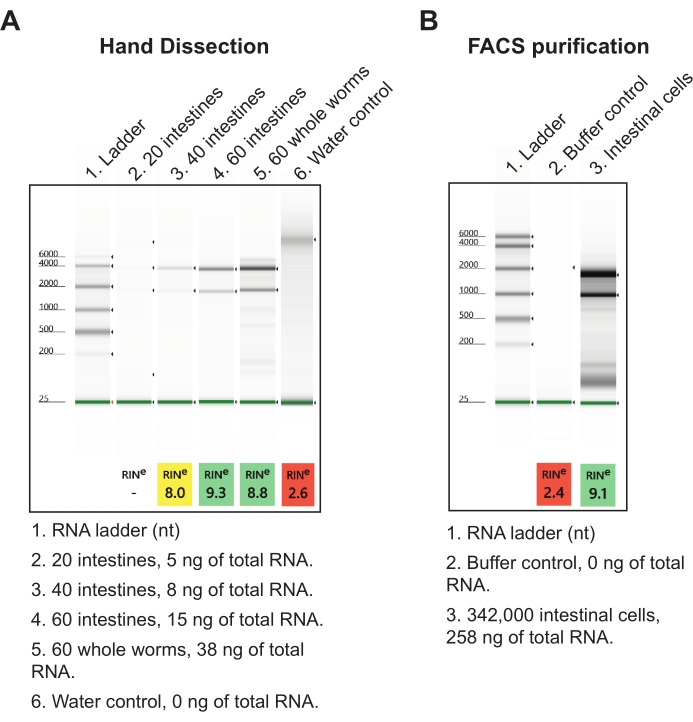
Şekil 7: İzole bağırsaklardan toplam RNA ekstraksiyonunun temsili sonuçları. (A) İzole edilmiş toplam RNA'ların kalitesini (RIN'ler, RNA bütünlük numarası) ve miktarını karakterize eden agaroz jel elektroforezi ile çözülen RNA preparatlarının temsili bir görüntüsü gösterilmiştir. (B) Karşılaştırma için, L1 evre solucanlarından floresan aktive edilmiş hücre sıralama (FACS) yoluyla toplanan bağırsak hücrelerinden izole edilen toplam RNA'nın temsili bir jeli gösterilmiştir. Bağırsak başına 20 hücrede, el diseksiyon yönteminin bağırsak başına FACS-saflaştırılmış bağırsak hücrelerinden daha fazla toplam RNA verdiği sonucuna varılabilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
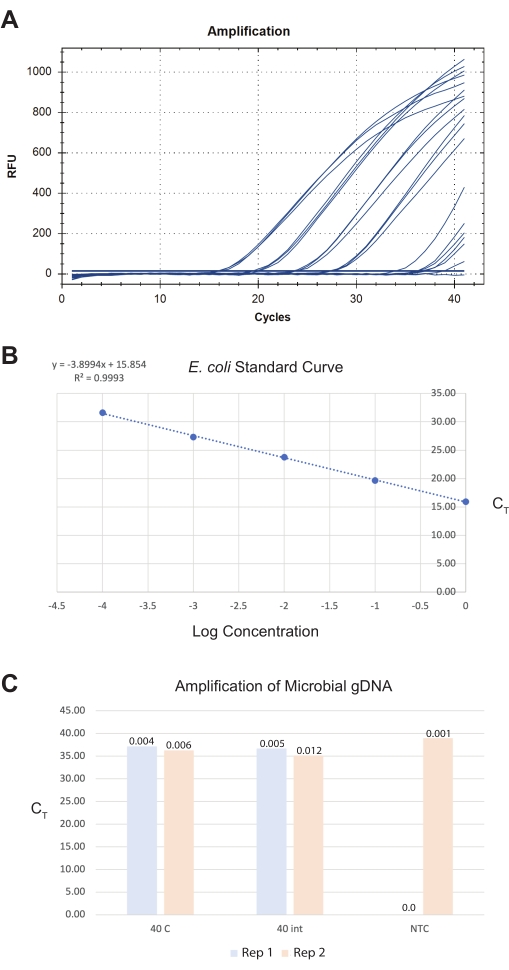
Şekil 8: İzole bağırsaklardan toplam mikrobiyal DNA ekstraksiyonu için temsili sonuçlar. Ticari bir mikrobiyal DNA izolasyon kiti, bağırsaklardan, bütün solucanlardan ve kontrollerden DNA preparatları üretti. Örneklerdeki bakteri sayısını ölçmek için bir pan-bakteriyel gen testi kullanıldı. (A) üretilen qPCR amplifikasyon eğrilerinin, (B) numuneleri ölçmek için kullanılan E. coli OP50 standart eğrisinin ve (C) numunelerin temsili bir görüntüsü. (B)'de, E. coli standartlarının log başlangıç konsantrasyonları CT değerlerine göre grafiklendirilir. (C)'de, 40 bütün solucanın iki replikası (tekrarı) medial olarak kesildi ve mikrobiyal gDNA izolasyonu için 40 izole bağırsak bölümü işlendi. qPCR çalıştırmasındaki No-Template-Control (NTC) de gösterilir. Y ekseni, örnek CT değerlerini temsil eder. PCR'lerden ölçülen DNA miktarı, örnek çubukların üzerindeki toplam pikogram (pg) değerleri olarak gösterilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tablo 1: Bu çalışmada kullanılan tampon ve çözeltilerin bileşimleri. Bu tabloyu indirmek için lütfen tıklayınız.
Tartışmalar
Bu makalede, bağırsakların yetişkin C. elegans'tan elle diseke edilmesi için adım adım protokol açıklanmakta ve aşağı akış tahlilleri için saf preparatlar üretilmektedir. Bu protokoldeki kritik adımlar arasında (1) solucanların aşırı felç edilmemesini sağlamak, (2) doğru diseksiyon kesimleri yapmak, (3) diseksiyon için uygun boyutta mikro pipetler dövmek ve (4) son hasat sırasında sağlıklı bağırsakların hızlı bir şekilde iyileşmesini sağlamak yer almaktadır. Bu nedenlerden dolayı, solucanları levamisol çözeltisine maruz bırakırken dikkatli olunmalı ve maksimum keskinliği sağlamak için hipodermik iğnelerin sık sık yenilenmesi gerekir. Mikrokapiler pipet ve ağız aspiratörü kullanılarak bağırsağın elleçlenmesi de pratik yapacak bir diğer adımdır. Uygun boyutta düzgün bir şekilde dövülmüş mikro pipetler, mikro pipet içindeki bağırsakları kaybetme riskini azaltmanın yanı sıra, diseksiyonlar sırasında bağırsağın büyük bölümlerinin izole edilmesinde de önemli bir fark yaratır. Yeni protokol kullanıcıları, izolasyon reaktifine atılmadan önce mikrokapiler pipetin iç kenarındaki bağırsakları genellikle kaybederler. Bu sorun uygulama ve uygun şekilde dövülmüş mikrokapiler pipetlerle değiştirilebilir.
Burada açıklanan protokol yetişkin solucanlarda kullanılmak üzere tasarlanmıştır. Ön denemeler, bu protokolün L4 solucanlarında ve yaşlı yetişkin solucanlarda kullanım için de etkili olduğunu desteklemektedir. Bununla birlikte, bu protokolün etkinliği henüz erken larva evre solucanlarda değerlendirilmemiştir. Bu yaklaşımın bir sınırlaması, ürettiği az miktarda malzemedir. Miktarlar RNA-seq ve PCR için yeterli olsa da, diğer tahliller için yeterli olmayabilir. Bu nedenle, kullanıcıların bir tahlil için gereken minimum girdinin bu protokolle fizibil olarak toplanıp toplanamayacağını belirlemeleri gerekir.
Laboratuvarımız rutin olarak izolasyon sonrası bağırsak hücrelerini arındırmak için FACS'ı kullanmaktadır 30, bağırsak hücresi tanımlaması için post-hoc analiz yöntemleri ve bu el diseksiyonu yöntemi30,42. El diseksiyonu, solucan ayrışması ve hücre izolasyonu daha az başarılı olduğunda yetişkin solucanlarda kullanım için uygun olma avantajına sahiptir. Ayrıca, el diseksiyonu preparatlarından ekstrakte edilen toplam RNA'nın etkinliği ve kalitesi yüksektir, çünkü muhtemelen dokular solucanlardan hızla koparılır ve daha sonra RNA bozulmasını azaltarak bir nükleik asit izolasyon reaktifinde hızlı bir şekilde biriktirilir. El diseksiyonu yönteminin bir diğer faydası da düşük maliyetli, kolay öğrenilebilir olması ve özel ekipman gerektirmemesidir. Son olarak, bu yaklaşım bağırsak bakterilerinin solucan bağırsaklarından toplanmasına ve izole edilmesine izin vererek aşağı akış mikrobiyom çalışmalarına olanak tanır.
Bağırsakları yetişkin C. elegans'tan izole etmek için burada açıklanan el diseksiyonu protokolü, C. elegans biyolojisinin çeşitli yönlerini incelemek için güçlü bir araçtır. Örneğin, bağırsakların saf bir şekilde hazırlanmasıyla, araştırmacılar bağışıklık, yaşlanma, metabolizma ve mikrobiyom arasındaki kesişimi araştırabilirler.
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Başlangıçta bu protokolün uyarlandığı bağırsak diseksiyon yöntemini geliştiren James McGhee ve Barb Goszczynski'nin öncü çalışmalarına borçluyuz. Çalışmalarımız, Ulusal Genel Tıp Bilimleri Enstitüsü (Ulusal Sağlık Enstitüleri, R35GM124877'den EON'a) tarafından denetlenen bir MIRA (R35) Ödülü ve NSF MCB Moleküler ve Hücresel Biyobilim Div'i (EON'a Ödül #2143849) tarafından denetlenen bir NSF-KARİYER Ödülü ile desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acetylated Bovine Serum Albumin (BSA) | VWR | 97061-420 | Nuclease free BSA |
| CL2122 worm strain | CGC (Caenorhabditis Genetics Center) | CL2122 | dvIs15 [(pPD30.38) unc-54(vector) + (pCL26) mtl-2::GFP]. Control strain for CL2120. Phenotype apparently WT. |
| Calcium Chloride Dihydrate | Fisher | C79 | needed for making Egg Salts |
| 50 mL Centrifuge Tubes, Bulk | Olympus Plastics | 28-108 | Nuclease free conical tube needed for solution making. |
| 15 mL Centrifuge Tubes, Bulk | Olympus Plastics | 28-103 | Nuclease free conical tube needed for solution making. |
| Concavity slide (2-well) | Electron Microscopy Sciences | 71878-08 | 12-pk of 2-well concavity slides |
| Ethylene glycol-bis(2-amino-ethylether)-N,N,N',N'-tetraacetic acid (EGTA) | Millipore Sigma | E3889 | needed for making chelation buffer |
| Fluorescent Dissection Microscope | Leica | M205 FCA | This is an optional piece of equipment that can be used with fluorescent C. elegans strains to help guid users during hand dissections |
| N-(2-Hydroxyethyl)piperazine-N′-(2-ethanesulfonic acid), 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid (HEPES) | Millipore Sigma | H4034 | needed for making dissection buffer |
| High Sensitivity RNA ScreenTape | Agilent | 5067-5579 | for assesment of total RNA quality and quantity |
| High Sensitivity RNA ScreenTape Ladder | Agilent | 5067-5581 | for assesment of total RNA quality and quantity |
| High Sensitivity RNA ScreenTape Sample Buffer | Agilent | 5067-5580 | for assesment of total RNA quality and quantity |
| HostZERO Microbial DNA Kit | Zymo Research | D4310 | Isolation of microbial DNA from worm intestines/worms |
| Hypodermic Needle (27G x 1/2") | BD Scientific | 305109 | needed for hand dissection of intestines |
| Levamisole (a.k.a. (-)-Tetramisole hydrochloride) | Millipore Sigma | L9756 | used to temporarily paralyze worms prior to hand dissection of intestines. |
| Luer-Lok General Use Disposable Syringe (1 mL) | BD Scientific | 309628 | Optional. Can be used to affix the hypodermic needle to, allowing easier manipulation of the needle during dissection. Remove the plunger. |
| Magnesium Chloride Hexahydrate | Fisher | M33 | needed for making Egg Salts |
| Magnesium Sulfate Hpetahydrate | Sigma-Aldrich | 230391-500G | needed for making M9 buffer |
| MF-900 Microforge | Narishige | MF-900 | Used to forge the microcapillary pipettes. Available through Tritech Research. |
| 1.7 mL Microtubes, Clear | Olympus Plastics | 22-282 | Nuclease free microfuge tube needed for solution making and sample storage. |
| Mouth Aspirator Tube | Millipore Sigma | A5177 | Mouth aspirator tube is needed in combination with the microcapillary pipette to allow aspiration of dissected intestines. |
| 16S Pan-Bacterial Control TaqMan Assay | Thermo Fisher | A50137 | Assay ID: Ba04930791_s1. Assay used for gut microbial detection via qPCR. |
| P-1000 Micropipette Puller | Sutter Instruments | Model P-1000 | Used to pull the microcapillary pippettes prior to forging. |
| Petri Dish (35 x 10 mm) | Genesee Scientific - Olympus Plastics | 32-103 | Used to make M9 bath and Disseciton Buffer bath for washing worms prior to dissection. |
| Phenol:Chloroform:IAA | Ambion | AM9730 | Used in the isolation of total RNA |
| Potassium Chloride | Millipore Sigma | 529552 | needed for making Egg Salts |
| Potassium Phosphate Monobasic | Sigma-Aldrich | P0662-500G | needed for making M9 buffer |
| Qubit 3 Fluorometer | Invitrogen | Q33216 | Accompanies the Qubit RNA HS Assay Kit. Can be used to quantify RNA prior to running sample on the Agilent ScreenTape. |
| Qubit RNA HS Assay Kit | Invitrogen | Q32852 | Can be used to quantify RNA prior to running sample on the Agilent ScreenTape. |
| RNasin Ribonuclease Inhibitor | Promega | N2111 | Broad spectrum inhibition of common eukaryotic Rnases |
| RNase-Free DNase Set | Qiagen | 79254 | used for on-column DNA digestion during RNA isolation protocol. |
| RNeasy Micro Kit | Qiagen | 74004 | Used for isolation of total RNA from worm intestines/worms |
| Standard Glass Capillaries | World Precision Instruments | 1B100F-4 | 4 in OD 1.2 mm standard borosilicate glass capillaries used to make microcapillary pipettes for dissection |
| Sodium Chloride | Fisher | S271 | needed for making Egg Salts |
| Sodium phosphate dibasic heptahydrate | Fisher Scientific | S373-500 | needed for making M9 buffer |
| Syringe filter (0.2 micrometer SCFA) | Thermo Fisher | 72302520 | Optional for use with the mouth aspirator tube when mouth pipetting. |
| 4150 TapeStation System | Agilent | G2992AA | Accompanies the RNA ScreenTape reagents for assessing RNA quality and quantity |
| TaqPath BactoPure Microbial Detection Master Mix | Applied Biosystems | A52699 | master mix used for qPCR |
| TRIzol Reagent | Thermo Fisher Scientific | 15596026 | Nucleic acid isolation and preservation. QIAzol (Qiagen; 79306) can be substituted if preferred. |
| Worm Pick | NA | NA | Made in house from a pasteur pipette and a platinum wire. See wormbook for details. |
Referanslar
- Riddel, D. L., Blumenthal, T., Meyer, B. J., Priess, J. . C. elegans II. , (1997).
- Corsi, A. K., Wightman, B., Chalfie, M. A transparent window into biology: A primer on Caenorhabditis elegans. Genetics. 200 (2), 387-407 (2015).
- Zhang, F., et al. Natural genetic variation drives microbiome selection in the Caenorhabditis elegans gut. Current Biology. 31 (12), 2603-2618 (2021).
- Dirksen, P., et al. CeMbio - The Caenorhabditis elegans microbiome resource. G3: Genes, Genomes, Genetics. 10 (9), 3025-3039 (2020).
- Zhang, F., et al. Caenorhabditis elegans as a model for microbiome research. Frontiers in Microbiology. 8, 485 (2017).
- Roy, P. J., Stuart, J. M., Lund, J., Kim, S. K. Chromosomal clustering of muscle-expressed genes in Caenorhabditis elegans. Nature. 418 (6901), 975-979 (2002).
- Pauli, F., Liu, Y., Kim, Y. A., Chen, P. -. J., Kim, S. K. Chromosomal clustering and GATA transcriptional regulation of intestine-expressed genes in C. elegans. Development. 133 (2), 287-295 (2005).
- Spencer, W. C., et al. A spatial and temporal map of C. elegans gene expression. Genome Research. 21 (2), 325-341 (2011).
- Spencer, W. C., et al. Isolation of specific neurons from C. elegans larvae for gene expression profiling. PLoS One. 9 (11), 112102 (2014).
- Ma, X., et al. Analysis of C. elegans muscle transcriptome using trans-splicing-based RNA tagging (SRT). Nucleic Acids Research. 44 (21), 156 (2016).
- Blazie, S. M., et al. Comparative RNA-Seq analysis reveals pervasive tissue-specific alternative polyadenylation in Caenorhabditis elegans intestine and muscles. BMC Biology. 13 (1), 4 (2015).
- Blazie, S. M., et al. Alternative polyadenylation directs tissue-specific miRNA targeting in Caenorhabditis elegans somatic tissues. Genetics. 206 (2), 757-774 (2017).
- Gómez-Saldivar, G., et al. et al.Tissue-specific transcription footprinting using RNA PoI DamID (RAPID) in Caenorhabditis elegans. Genetics. 216 (4), 931-945 (2020).
- Katsanos, D., Barkoulas, M. Targeted DamID in C. elegans reveals a direct role for LIN-22 and NHR-25 in antagonizing the epidermal stem cell fate. Science Advances. 8 (5), 3141 (2022).
- Kaletsky, R., et al. The C. elegans adult neuronal IIS/FOXO transcriptome reveals adult phenotype regulators. Nature. 529 (7584), 92-96 (2015).
- Kaletsky, R., et al. Transcriptome analysis of adult Caenorhabditis elegans cells reveals tissue-specific gene and isoform expression. PLoS Genetics. 14 (8), 1007559 (2018).
- Mathies, L. D., et al. mRNA profiling reveals significant transcriptional differences between a multipotent progenitor and its differentiated sister. BMC Genomics. 20 (1), 427 (2019).
- Liang, X., Calovich-Benne, C., Norris, A. Sensory neuron transcriptomes reveal complex neuron-specific function and regulation of mec-2/ Stomatin splicing. Nucleic Acids Research. 50 (5), 2401-2416 (2021).
- Glenwinkel, L., et al. In silico analysis of the transcriptional regulatory logic of neuronal identity specification throughout the C. elegans nervous system. eLife. 10, 64906 (2021).
- Taylor, S. R., et al. Molecular topography of an entire nervous system. Cell. 184 (16), 4329-4347 (2021).
- Charest, J., et al. Combinatorial action of temporally segregated transcription factors. Developmental Cell. 55 (4), 483-499 (2020).
- Steiner, F. A., Talbert, P. B., Kasinathan, S., Deal, R. B., Henikoff, S. Cell-type-specific nuclei purification from whole animals for genome-wide expression and chromatin profiling. Genome Research. 22 (4), 766-777 (2012).
- Tintori, S. C., Nishimura, E. O., Golden, P., Lieb, J. D., Goldstein, B. A transcriptional lineage of the early C. embryo. Developmental Cell. 38 (4), 430-444 (2016).
- Hashimshony, T., Wagner, F., Sher, N., Yanai, I. CEL-Seq: Single-cell RNA-Seq by multiplexed linear amplification. Cell Reports. 2 (3), 666-673 (2012).
- Hashimshony, T., Feder, M., Levin, M., Hall, B. K., Yanai, I. Spatiotemporal transcriptomics reveals the evolutionary history of the endoderm germ layer. Nature. 519 (7542), 219-222 (2015).
- Packer, J. S., et al. A lineage-resolved molecular atlas of C. elegans embryogenesis at single-cell resolution. Science. 365 (6459), 1971 (2019).
- Warner, A. D., Gevirtzman, L., Hillier, L. W., Ewing, B., Waterston, R. H. The C. elegans embryonic transcriptome with tissue, time, and alternative splicing resolution. Genome Research. 29 (6), 1036-1045 (2019).
- Cao, J., et al. Comprehensive single-cell transcriptional profiling of a multicellular organism. Science. 357 (6352), 661-667 (2017).
- Durham, T. J., et al. Comprehensive characterization of tissue-specific chromatin accessibility in L2 Caenorhabditis elegans nematodes. Genome Research. 31 (10), 1952-1969 (2021).
- King, D. C., et al. The transcription factor ELT-2 positively and negatively impacts direct target genes to modulate the Caenorhabditis elegans intestinal transcriptome. bioRxiv. , (2021).
- Kocsisova, Z., Mohammad, A., Kornfeld, K., Schedl, T. Cell cycle analysis in the C. elegans germline with the thymidine analog EdU. Journal of Visualized Experiments. (140), e58339 (2018).
- Han, S., et al. Mono-unsaturated fatty acids link H3K4me3 modifiers to C. elegans lifespan. Nature. 544 (7649), 185-190 (2017).
- Edgar, L. G., Wolf, N., Wood, W. B. Early transcription in Caenorhabditis elegans embryos. Development. 120 (2), 443-451 (1994).
- Edgar, L. G., Goldstein, B. Culture and manipulation of embryonic cells. Methods in Cell Biology. 107, 151-175 (2012).
- Nishimura, E. O., Zhang, J. C., Werts, A. D., Goldstein, B., Lieb, J. D. Asymmetric transcript discovery by RNA-seq in C. elegans blastomeres identifies neg-1, a gene important for anterior morphogenesis. PLoS Genetics. 11 (4), 1005117 (2015).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Cerón, J. Basic Caenorhabditis elegans methods: Synchronization and observation. Journal of Visualized Experiments. (64), e4019 (2012).
- Fay, D. S., Fluet, A., Johnson, C. J., Link, C. D. In vivo aggregation of β-amyloid peptide variants. Journal of Neurochemistry. 71 (4), 1616-1625 (1998).
- Altun, Z. F., Hall, D. H. WormAtas Hermaphrodite Handbook – Introduction to C. elegans Anatomy. WormAtlas. , (2006).
- Tan, M. -. W., Mahajan-Miklos, S., Ausubel, F. M. Killing of Caenorhabditis elegans by Pseudomonas aeruginosa used to model mammalian bacterial pathogenesis. Proceedings of the National Academy of Sciences of the United States of America. 96 (2), 715-720 (1999).
- Oesterle, A. Pipette Cookbook 2018: P-97 & P-1000 Micropipette Pullers. Sutter Instrument Company. , (2018).
- Dineen, A., Nishimura, E. O., Goszczynski, B., Rothman, J. H., McGhee, J. D. Quantitating transcription factor redundancy: The relative roles of the ELT-2 and ELT-7 GATA factors in the C. elegans endoderm. Developmental Biology. 435 (2), 150-161 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır