Method Article
Dissection manuelle des intestins de Caenorhabditis elegans
Dans cet article
Résumé
Le présent protocole décrit une procédure pour isoler manuellement les intestins des vers nématodes Caenorhabditis elegans adultes en vue de leur entrée en génomique, en protéomique, en microbiome ou dans d’autres essais.
Résumé
Composé de seulement 20 cellules, l’intestin Caenorhabditis elegans est le lien de nombreuses fonctions vitales, y compris la digestion, le métabolisme, le vieillissement, l’immunité et la réponse environnementale. Les interactions critiques entre l’hôte C. elegans et son environnement convergent dans l’intestin, où se concentre le microbiote intestinal. Par conséquent, la capacité d’isoler le tissu intestinal du reste du ver est nécessaire pour évaluer les processus spécifiques à l’intestin. Ce protocole décrit une méthode pour disséquer à la main les intestins adultes de C. elegans. La procédure peut être effectuée dans des souches marquées par fluorescence à des fins de facilité ou d’entraînement. Une fois la technique perfectionnée, les intestins peuvent être prélevés à partir de vers non marqués de n’importe quel génotype. Cette approche de microdissection permet la capture simultanée du tissu intestinal de l’hôte et du microbiote intestinal, un avantage pour de nombreuses études sur le microbiome. En tant que tels, les applications en aval des préparations intestinales générées par ce protocole peuvent inclure, sans toutefois s’y limiter, l’isolement de l’ARN des cellules intestinales et l’isolement de l’ADN du microbiote capturé. Dans l’ensemble, la dissection manuelle des intestins de C. elegans offre une méthode simple et robuste pour étudier les aspects critiques de la biologie intestinale.
Introduction
Le ver nématode Caenorhabditis elegans, avec seulement 959 cellules et un cycle de vie d’œuf à œuf de 4 jours, est un système modèle idéal pour de nombreuses études génétiques, génomiques et développementales 1,2. La facilité du dépistage génétique direct et inverse, la prévalence des marqueurs fluorescents modifiés, la capacité d’effectuer l’édition du génome spécifique aux nucléotides et les nombreuses ressources à l’échelle de la communauté ont tous contribué à des découvertes et à des connaissances majeures dans le système de C. elegans. Cependant, un inconvénient important est la difficulté d’obtenir des populations pures de cellules, de tissus ou d’organes, qui sont petites, fragiles et peuvent être interconnectées. Comme les populations pures de cellules sont importantes pour les tests génomiques tels que RNA-seq, ChIP-seq et ATAC-seq, plusieurs approches ont émergé pour obtenir des préparations pures de cellules, tissus et organes de C. elegans. Ici, une méthode pour disséquer les intestins à la main, en grandes sections, à partir de vers adultes C. elegans est décrite. Les préparations résultantes conviennent aux essais génomiques en aval (Figure 1).
La méthode de dissection tissulaire à échelle fine décrite ici (figure 2) n’est qu’une approche. D’autres techniques alternatives, telles que le marquage moléculaire, la désagrégation des vers et la purification des types de cellules d’intérêt avec le tri cellulaire activé par fluorescence (FACS) et l’analyse post hoc, ont également été utilisées avec succès pour étudier les caractéristiques tissulaires spécifiques de la biologie moléculaire de C. elegans. Un avantage de la dissection manuelle par rapport à ces autres approches, cependant, est qu’elle peut être utilisée pour explorer simultanément les caractéristiques de l’intestin de C. elegans et son contenu bactérien 3,4,5. Cela permet le séquençage du gène de l’ARNr 16S et facilite les études du microbiome au sein du système C. elegans. Une limitation importante, cependant, est que les cellules intestinales ne sont pas isolées individuellement.
Le marquage moléculaire confère une étiquette spécifique au type de cellule aux molécules uniquement dans le tissu ou les cellules d’intérêt spécifiés. Ces étiquettes peuvent ensuite être isolées des préparations totales de vers. De cette façon, les promoteurs spécifiques aux tissus conduisant une protéine de liaison polyA marquée ou un leader épissé ont permis le profilage du transcriptome spécifique au tissu 6,7,8,9,10 et la cartographie 3'UTR 11,12. De même, des profils de facteurs de transcription spécifiques aux tissus ont été réalisés à l’aide de ChIP-seq et de DamID, dans lesquels des variantes de facteur de transcription spécifiques au promoteur ont été ajoutées avec des étiquettes ou des fusions enzymatiques13,14.
FACS permet d’isoler les types cellulaires d’intérêt des vers dissociés en fonction de leurs caractéristiques cellulaires intrinsèques et de leurs propriétés fluorescentes. Cette approche a généré des transcriptomes spécifiques aux tissus de divers organes 8,15,16 et des types de cellules neuronales individuelles 8,9,15,16,17,18 et a été utilisée pour créer une carte d’expression de l’ensemble du système nerveux de C. elegans 19,20 . FACS, et son cousin le tri des noyaux activés par fluorescence (FANS), ont également été utilisés pour générer des profils de chromatine spécifiques aux cellules21,22.
Enfin, l’analyse post-hoc peut être effectuée dans des tests de résolution monocellulaire. Dans cette méthode, toutes les cellules individuelles sont étudiées, le type de cellule de chacune est attribué à l’étape de l’analyse et les types de cellules d’intérêt sont filtrés sélectivement pour une étude plus approfondie. L’analyse post-hoc a été utilisée avec succès pour obtenir des transcriptomes de cellules en développement avec une résolution spatiale et temporelle élevée chez les embryons de C. elegans 23,24,25,26,27 et L1 28 stades. L’accessibilité de la chromatine a également été caractérisée en utilisant ATAC-seq au lieu de RNA-seq en utilisant une stratégie similaire29.
Chaque approche a ses avantages et ses limites. Pour l’intestin de C. elegans, la désagrégation des vers et l’isolement FACS des cellules intestinales sont réalisables aux stades embryonnaire et larvaire30, mais sont difficiles chez les adultes. On pense que cela est dû aux grandes cellules de l’intestin, endo-redupliquées et fortement adhérentes, ce qui les rend difficiles à dissocier intactes. La méthode de dissection manuelle décrite ici contourne ces défis, permettant d’isoler de grandes sections de l’intestin du ver adulte. La pratique de disséquer à la main les gonades à partir de ce même stade est répandue et simple. Le curage intestinal est semblable au curage gonadique, mais moins courammenteffectué 32. Le protocole présenté ici est adapté d’un protocole plus long et non publié élaboré par le Dr James McGhee et Barb Goszczynski. Ce protocole simplifié emprunte des techniques d’isolement des blastomères à partir d’embryons à un stade précoce 23,33,34,35. Bien que la dissection manuelle ne soit pas réalisable pour isoler la plupart des types de cellules ou de tissus chez C. elegans, elle est idéale pour isoler les intestins des vers adultes. Par conséquent, la dissection manuelle complète d’autres moyens d’obtenir des préparations cellulaires spécifiques à l’intestin.
Protocole
Des vers CL2122 ont été utilisés pour la présente étude. Les vers ont été obtenus par l’intermédiaire du Caenorhabditis Genetics Center (CGC, voir Tableau des matériaux), financé par le NIH Office of Research Infrastructure Programs (P40 OD010440).
1. Culture de vers pour la dissection
- Cultiver une grande plaque de vers CL2122 à stade mixte pour la synchronisation en suivant les procédures de culture standard (c.-à-d. des plaques NGM ensemencées avec E. coli OP50)36,37.
REMARQUE: Il faut généralement ~96 h pour atteindre la capacité maximale de ponte.- Embryon préparer les vers dans la période de 72-96 heures. Après la préparation des embryons, laisser les embryons éclore dans M9 (voir tableau 1) pendant 48 h. Cela donnera une population synchrone de vers au stade L1.
REMARQUE: Les vers CL2122 hébergent un transgène-GFP (protéine fluorescente verte) intégré chassé par le promoteur mtl-2 (MeTaLlothionein 2) spécifique de l’intestin38. Ce promoteur est spécifique au cytoplasme cellulaire intestinal et permet de visualiser l’intestin au microscope à dissection fluorescente. Une fois formés, les utilisateurs peuvent ne pas trouver les conseils de fluorescence nécessaires.
- Embryon préparer les vers dans la période de 72-96 heures. Après la préparation des embryons, laisser les embryons éclore dans M9 (voir tableau 1) pendant 48 h. Cela donnera une population synchrone de vers au stade L1.
- Vers L1 synchronisés sur plaque sur un minimum de deux petites plaques. Cultivez des vers sur des plaques NGM avec suffisamment de nourriture jusqu’à ce qu’ils atteignent le stade adulte (identifié par la présence d’embryons capables de pondre des œufs). Cela prend entre 38-46 h à 20 °C.
- Assurez-vous que le même stade de développement est récolté dans les répétitions et entre les souches comparatives.
REMARQUE : La durée de croissance des vers dépend de la souche, de la température, de la source de nourriture et du stade de développement ciblé39. D’autres stades proches du stade adulte peuvent également être utilisés, tels que les stades L4 et plus âgés. Pour planifier des expériences sur le microbiome, différentes sources alimentaires bactériennes au-delà de la source alimentaire traditionnelle (E. coli OP50) peuvent être utilisées pour faire pousser des vers, tels que les souches CeMbio4 ou un agent pathogène d’intérêt40.
- Assurez-vous que le même stade de développement est récolté dans les répétitions et entre les souches comparatives.
2. Préparation des solutions mères et des pipettes microcapillaires
NOTE : Le tableau 1 fournit les détails de tous les tampons et solutions utilisés pour la présente étude.
- Préparer 50 ml de sels d’œufs (tampon d’œuf) dans un tube conique exempt de nucléases (voir le tableau des matières). Une fois préparé, conserver à température ambiante.
- Préparer 10 mL de solution mère de lévamisole à 100 mM dans un tube conique exempt de nucléase. Une fois préparés, préparer des aliquotes de 500 μL et les conserver à −20 °C. Les aliquotes peuvent être décongelées et conservées à 4 °C pendant 1 semaine à la fois.
- Préparer 1 mL de solution mère d’albumine sérique bovine acétylée (BSA) à 20 mg/mL dans un tube microcentrifuge sans nucléase. Une fois préparées, fabriquer des aliquotes à usage unique de 50 μL et les conserver à −20 °C.
NOTE: Il est important d’utiliser la version acétylée de BSA car c’est la seule forme de BSA qui est sans nucléase. Le BSA non acétylé peut être une source importante de nucléases et, par conséquent, conduire à la dégradation des échantillons. - Préparez au moins cinq pipettes microcapillaires de 50 μm et 100 μm en suivant chacune les étapes ci-dessous.
- Tout d’abord, tirez les capillaires de verre standard (4 po de long et 1,2 mm de diamètre extérieur) en forme d’aiguille d’injection à l’aide d’un extracteur d’aiguille (voir le tableau des matériaux) et les conditions pour « Adherent Cell, C. elegans, & Drosophila » du Sutter Instruments Pipette Cookbook41 (Conditions: Heat = Ramp + 5; Tirer = 100; Vel. = 75; Retard = 90; Pression = 500; Boîte de 2,5 mm x 2,5 mm).
- Ensuite, forgez les pipettes microcapillaires à une taille de 50 μm (trois graduations comme indiqué par la règle oculaire de la microforge sous l’objectif M5/0,1) ou de 100 μm (cinq graduations dans les mêmes conditions) à l’aide d’une microforge (voir le tableau des matériaux). Ces dimensions représentent le diamètre d’ouverture estimé de la pipette microcapillaire (Figure 3).
- Ensuite, fixez un tube d’aspiration buccale aux pipettes microcapillaires.
REMARQUE: Les pipettes d’aspiration sont traditionnellement contrôlées par pipetage à bouche, mais de nombreux protocoles de sécurité modernes interdisent cette méthode. En tant que tel, les utilisateurs peuvent contrôler l’aspiration avec le tube d’aspiration buccale en pinçant le tube entre le doigt et le pouce. De plus, un filtre à seringue peut être installé dans le système de tubulure d’aspiration buccale pour plus de sécurité.
3. Préparation expérimentale
- Préparer 5 mL de tampon de dissection dans un tube conique sans nucléase. Conserver à température ambiante.
- Préparer 1 mL de solution de BSA acétylée fonctionnelle dans un tube microcentrifuge sans nucléase. Restez sur la glace.
- Préparer 350 μL de solution de lévamisole fonctionnelle dans un tube microcentrifuge sans nucléase. Préparer en trois exemplaires (un tube pour environ 20 vers). Restez sur la glace.
- Préparer le tampon de chélation dans un tube microcentrifuge sans nucléase (tableau 1). Faire en réplique (un tube pour environ 10 vers disséqués). Restez sur la glace. L’utilisation d’un tampon de chélation pendant les dissections manuelles améliore la qualité et la quantité d’ARN (Figure 4).
- Préparer un tube de microcentrifugation par groupe expérimental qui contient 500 μL de réactif d’isolement d’acide nucléique ou de réactif d’isolement spécifié dans une trousse (voir le tableau des matières) dans un tube sans nucléase. Restez sur la glace. Ce tube sera utilisé pour recueillir les intestins ultimes et isolés pour le stockage ou une utilisation ultérieure.
- Préparez un bain M9 et un bain tampon de dissection. Pour ce faire, procurez-vous deux boîtes de Petri stériles de 35 mm de diamètre. Ensuite, ajoutez 2 mL de M9 à une capsule et 2 mL de tampon de dissection à l’autre. Enfin, ajoutez 100 μL de solution de BSA de travail à chaque bain. Tourbillonner pour mélanger. L’ajout de BSA aux bains empêchera les vers de coller au plastique.
- Préparez le tableau de dissection. Obtenir une lame de concavité à 2 puits (voir le tableau des matériaux) et ajouter 150 μL de solution de levamisole de travail au premier puits. Ensuite, ajoutez 150 μL de tampon de dissection au deuxième puits. Enfin, ajoutez 20 μL de solution BSA fonctionnelle à chaque puits. L’ajout de BSA à chaque puits empêchera les vers de coller à la lame.
4. Dissection manuelle de l’intestin de C. elegans
- À l’aide d’un pic de vers, déplacer 20 vers adultes de la plaque NGM dans le bain M9 (étape 3.6). Cela lavera les bactéries externes des vers.
- Ensuite, déplacez les 20 vers du bain M9 vers le bain tampon de dissection (étape 3.6). Cela éliminera davantage les bactéries externes et équilibrera les vers dans le tampon de dissection.
- Ensuite, déplacer les lots de vers (c.-à-d. par groupes de 10) du bain tampon de dissection dans le puits contenant la solution de lévamisole (étape 3.7).
REMARQUE: Le lévamisole paralysera temporairement les vers.- Une fois que les mouvements du ver ralentissent, déplacez-les rapidement du puits de lévamisole vers le puits contenant le tampon de dissection (étape 3.7). Veillez à ne pas trop paralyser les vers.
REMARQUE: Le nombre de vers déplacés par lots dans la solution de lévamisole peut varier en fonction du confort de l’utilisateur. Cela est également vrai pour le nombre de vers initialement prélevés dans le bain M9, puis déplacés dans le bain tampon de dissection. Il est recommandé d’avoir des vers supplémentaires disponibles pour la dissection, en particulier pendant la formation, à mesure que l’utilisateur apprend et se familiarise avec le protocole.
- Une fois que les mouvements du ver ralentissent, déplacez-les rapidement du puits de lévamisole vers le puits contenant le tampon de dissection (étape 3.7). Veillez à ne pas trop paralyser les vers.
- Ensuite, laissez les vers commencer à se déplacer un peu dans la mémoire tampon de dissection avant de commencer les dissections.
REMARQUE: Les intestins n’extrudent pas bien des vers trop paralysés (c’est-à-dire des vers qui ne bougent pas du tout). - Lorsque vous êtes prêt, disséquez les vers sous une lunette de dissection fluorescente à l’aide d’une aiguille hypodermique (c.-à-d. 27 G x 1/2 po) (voir le tableau des matières) en effectuant une coupe juste derrière le pharynx (figure 5Aa) ou juste devant le rectum (figure 5Ab). Cela produira deux grandes sections de l’intestin, une moitié mi-antérieure et une moitié mi-postérieure. Continuez ce schéma pour le reste des vers, en gardant équivalent le nombre de sections intestinales obtenues à partir des sections antérieures-moyennes et mi-postérieures jusqu’à ce que le nombre total d’intestins souhaité soit acquis.
REMARQUE : L’apposition de l’aiguille hypodermique sur un corps de seringue vide de 1 mL peut faciliter sa manipulation pendant les dissections manuelles. Selon le confort et l’expérience de l’utilisateur, il n’est pas rare de faire une coupe de dissection qui ne donne aucun fragment intestinal. Cependant, avec la pratique, cela devient beaucoup moins courant. - Attendez environ 1 min pour que les intestins extrudent au maximum du corps. Ils prennent généralement une forme de boucle et peuvent être collés à une partie des gonades (Figure 5A). En attendant, ajouter 50 μL de tampon de chélation au puits pour aider à réduire la dégradation de l’ARN (Figure 4).
- En attendant et pour faciliter davantage l’extrusion intestinale, utilisez la pipette microcapillaire de 100 μm fixée à un aspirateur buccal et aspirez l’intestin ou le ver dans et hors de la pipette (Figure 5B). Cela aidera également à libérer l’intestin de la gonade. Veillez à ne pas perdre l’intestin en l’aspirant accidentellement complètement dans la pipette microcapillaire.
REMARQUE: L’utilisateur peut alterner entre les pipettes microcapillaires de 100 μm et 50 μm pour libérer l’intestin du reste du corps et de la gonade. L’ouverture de plus petit diamètre de la pipette microcapillaire de 50 μm peut offrir un avantage pour éliminer les morceaux collants de l’intestin. Les pipettes d’aspiration sont traditionnellement contrôlées par pipetage à bouche, mais de nombreux protocoles de sécurité modernes interdisent cette méthode. En tant que tel, les utilisateurs peuvent contrôler l’aspiration avec le tube d’aspiration buccale en pinçant le tube entre le doigt et le pouce. De plus, un filtre à seringue peut être installé dans le système de tubulure d’aspiration buccale pour plus de sécurité. - Une fois qu’un intestin est suffisamment extrudé, utilisez l’aiguille hypodermique de 27 G pour le couper du reste du corps et de toute gonade restante. La taille de la section intestinale isolée peut varier considérablement en fonction de l’expérience de la moissonneuse, de la qualité de la coupe et du niveau de paralysie du ver.
REMARQUE: L’intégrité de l’intestin et des fragments intestinaux peut être facilement surveillée tout au long du protocole via leur fluorescence GFP. - Maintenant, utilisez la pipette microcapillaire pour aspirer la section intestinale et la déplacer hors du puits et dans le tube de microcentrifugeuse contenant le réactif d’isolement des acides nucléiques ou le réactif d’isolement spécifié dans le kit. Gardez les intestins isolés dans le réactif sur la glace et répétez pour les intestins restants.
REMARQUE: Plusieurs intestins peuvent être ajoutés au tube de microcentrifugation contenant un réactif d’isolation d’acide nucléique ou un autre réactif d’isolement spécifié par le kit tout au long de la journée. Restez sur la glace. Si tous les intestins ne peuvent pas être isolés en 1 jour, ceux qui sont déjà isolés et stockés dans un réactif d’isolement des acides nucléiques (qui préserve les acides nucléiques) peuvent être maintenus à -80°C jusqu’à ce que les isolements reprennent et/ou puissent être terminés. Ici, les échantillons sont stables à long terme (c.-à-d. plusieurs mois à 1 an) et peuvent rester jusqu’à ce qu’ils soient prêts à isoler les acides nucléiques. Les intestins peuvent être récoltés dans de l’eau ou dans n’importe quel tampon de lyse spécifique au kit. Cependant, il faut tenir compte de la durée pendant laquelle les intestins peuvent rester dans un tampon donné sur la glace (ou une autre température souhaitée) avant de passer aux applications en aval.
5. Isolement de l’ARN des intestins disséqués
- Homogénéiser les tissus acquis stockés dans le réactif d’isolement des acides nucléiques en effectuant trois cycles de congélation/décongélation/vortex. Pour ce faire, utilisez un bain de billes à 37 °C et de l’azote liquide (ou d’autres moyens comparables).
- Ensuite, ajoutez 0,2 volume de réactif phénol:chloroforme:IAA (voir le tableau des matériaux) à l’échantillon et vortex brièvement. Par exemple, pour un volume d’échantillon de départ de 500 μL, 0,2 volume de chloroforme serait de 100 μL.
- Secouer le tube à la main pendant 20 s, puis incuber à température ambiante pendant 3 min.
- Séparer les phases de l’échantillon par centrifugation (10 000 x g, 18 min, 4 °C).
- Retirer la phase aqueuse et la transférer dans un nouveau tube microcentrifuge sans nucléase.
REMARQUE: Veillez à ne pas aspirer ou perturber l’interface. - Ensuite, ajoutez un volume égal d’éthanol à 100% à la phase aqueuse et agitez l’échantillon à la main pendant 20 s.
- Transférer 700 μL de l’échantillon dans la colonne de spin (voir le tableau des matériaux). Ensuite, adhérer l’ARN à la colonne par centrifugation (≥8 000 x g, 30 s, RT [température ambiante]). Jetez le flux continu. Répétez l’opération pour tout échantillon restant supplémentaire.
- Ajouter 350 μL de tampon RW1 (voir le tableau des matières) à la colonne pour laver l’échantillon. Ensuite, centrifuger (≥8 000 x g, 30 s, RT) et jeter l’écoulement.
- Effectuer la digestion de l’ADN sur colonne. Ajouter 80 μL de DNase I dans le tampon RDD (voir le tableau des matières) à la colonne d’échantillon. Ensuite, incuber pendant 15 min à RT.
- Ensuite, ajoutez 350 μL de tampon RW1 à la colonne pour laver l’échantillon. Centrifuger (≥8 000 x g, 30 s, RT) et transférer la colonne dans un nouveau tube de collecte. Jetez le tube de collecte et l’ancien tube de collecte. Ce lavage élimine la DNase.
- Ajouter 500 μL d’EPR (voir le tableau des matières) à la colonne de l’échantillon. Ensuite, centrifuger (≥8 000 x g, 30 s, RT) et jeter l’écoulement. Répétez pour un deuxième lavage.
- Ensuite, centrifuger pendant 1 min supplémentaire pour sécher davantage la membrane de la colonne (≥8 000 x g, 1 min, RT). Ensuite, transférez la colonne d’échantillon dans un tube de collecte de microcentrifugeuses sans nucléase fraîche muni d’un couvercle. Jetez le tube de collecte et l’ancien tube de collecte.
- Ajouter 14 μL d’eau exempte de nucléases directement à la membrane de la colonne d’échantillonnage. Ensuite, incuber l’échantillon pendant 2 min à TA. Ensuite, centrifuger (≥8 000 x g, 1 min, RT) pour éluer l’ARN.
- Conservez l’échantillon sur de la glace. Ensuite, évaluez la qualité et la quantité d’ARN de l’échantillon à l’aide de trousses d’analyse disponibles dans le commerce (voir le tableau des matériaux). Une fois cela fait, conservez l’échantillon dans un congélateur à −80 °C.
NOTE: L’ARN est généralement stable à -80 ° C jusqu’à 1 an sans dégradation.
Résultats
Le présent protocole a été utilisé pour isoler manuellement de grandes sections de l’intestin de C. elegans adulte (Figure 2). L’échantillon final d’intestin pour chaque groupe expérimental présenté est composé d’une collection égale de sections de l’intestin antérieur-moyen et mi-postérieur. Cependant, selon la question expérimentale, il pourrait également comprendre une collection de sections de l’intestin antérieur, moyen ou postérieur seulement. Collectivement, trois résultats représentatifs sont présentés pour ce protocole. La première illustre la dissection et l’isolement réussis des intestins (Figure 6). Le second rapporte les résultats de l’isolement de l’ARN à partir d’intestins isolés (Figure 7). La troisième montre les résultats de la surveillance microbienne des intestins isolés (Figure 8).
Pour le premier résultat, la figure 6A montre à quoi ressemble un intestin extrudé après avoir pratiqué une incision primaire au site « a » de la figure 5A chez des vers CL2122 adultes. Comme les vers CL2122 hébergent le promoteur mtl-2 spécifique de l’intestin fusionné à la GFP (mtl-2p::GFP), les intestins isolés brilleront en vert sous la lunette de dissection fluorescente. La dissection réussie d’un segment intestinal est ensuite illustrée à la figure 6B. Cette section de l’intestin est exempte de contaminants visibles tels que les débris de la gonade ou de la carcasse. En revanche, la figure 6C montre des intestins qui ne sont pas disséqués avec succès, car la gonade et la carcasse sont encore visiblement attachées au segment intestinal.
Pour le deuxième résultat, les intestins ont été récoltés dans un réactif d’isolement d’acide nucléique et traités le lendemain à l’aide d’un protocole d’extraction d’ARN total à faible apport (voir le tableau des matériaux). Un échantillon final de 60 coupes intestinales totales des sections antérieures-moyennes et mi-postérieures donne environ 15 ng d’ARN total de haute qualité (Figure 7A). Cette quantité totale d’intestins peut facilement être obtenue en une seule journée, mais peut également être brisée sur plusieurs jours si nécessaire. Les rendements en ARN provenant de la dissection manuelle sont plus efficaces que la désagrégation par des vers et l’isolement FACS des cellules intestinales en ce sens que des centaines de milliers de cellules intestinales sont nécessaires pour obtenir des quantités proportionnelles d’ARN total (Figure 7B). Il est important de noter que les rendements d’ARN générés par la dissection manuelle sont plus que suffisants comme entrée pour les kits commerciaux de bibliothèque de séquençage d’ARN (c.-à-d. NEBNext Ultra II et NEBNext Single Cell / Low Input), qui peuvent prendre aussi peu que 2 pg d’ARN.
Pour le troisième résultat, les intestins ont été récoltés dans le ddH20 stérile et traités le même jour à l’aide d’une trousse commerciale d’isolement de l’ADN microbien (voir le tableau des matériaux). Un échantillon final d’intestin de 40 sections intestinales totales des sections antérieure-moyenne et mi-postérieure donne environ 0,009 pg d’ADN microbien total à l’aide d’un test de détection panbactérien (voir le tableau des matériaux) (Figure 8). Ces quantités sont trop faibles pour les méthodes de quantification traditionnelles et doivent être extrapolées à partir de courbes standard qPCR. Idéalement, les utilisateurs devraient cibler une quantité totale finale d’intestins >40, car cela augmente la limite de détection et la limite du rapport signal/bruit concernant les niveaux de contamination des réactifs.
Lors de l’examen de la conception expérimentale, il est toujours nécessaire de prélever des échantillons témoins appropriés. Pour les expériences transcriptomiques, un contrôle expérimental approprié peut inclure des préparations du ver entier collectées de la même manière que les intestins. Cependant, lors de la dissection et de l’isolement des intestins de C. elegans, il est courant de voir des morceaux de carcasse et de gonade accrochés aux sections intestinales. Bien qu’idéalement, ces tissus contaminants soient retirés des intestins avant d’être entreposés pour une utilisation en aval, d’autres contrôles expérimentaux peuvent inclure la collecte des carcasses de vers restantes après la dissection intestinale et/ou la collecte de gonades disséquées. Pour les expériences sur le microbiome, les contrôles peuvent également inclure des préparations du ver entier collectées de la même manière que les intestins, en plus des contrôles conventionnels positifs (culture bactérienne) et négatifs (eau).
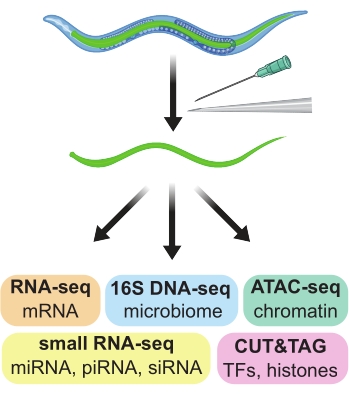
Figure 1 : Dissection manuelle des intestins de C. elegans adulte utilisée pour générer des préparations spécifiques aux tissus à utiliser dans une grande variété de tests omiques en aval. Veuillez cliquer ici pour voir une version agrandie de cette figure.
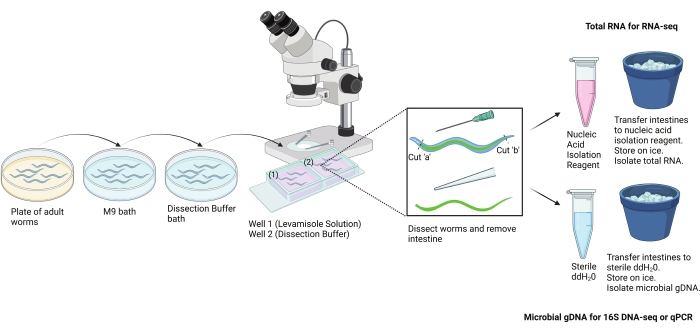
Figure 2 : Schéma du protocole de dissection manuelle. Ce protocole a été utilisé pour isoler manuellement de grandes sections de l’intestin de C. elegans adulte. Les intestins peuvent être isolés pour différents tests en aval. L’utilisation des intestins pour l’isolement de l’ARN et l’isolement de l’ADN microbien est illustrée ici. Image créée avec BioRender.com. Veuillez cliquer ici pour voir une version agrandie de cette figure.
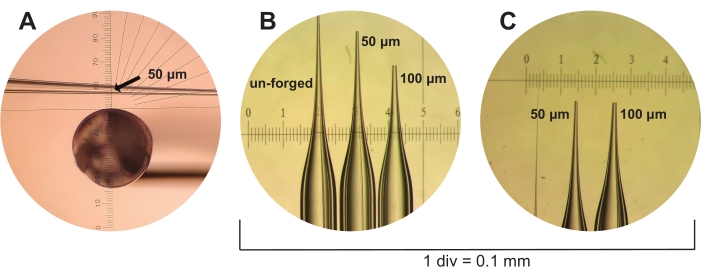
Figure 3 : Fabrication de pipettes microcapillaires. (A) Une pipette microcapillaire fraîchement tirée mais non forgée est représentée à travers la pièce oculaire d’une microforge. Une règle oculaire est utilisée pour mesurer des pipettes microcapillaires de taille de 50 μm à un diamètre intérieur estimé de trois graduations (illustré, indiqué par une flèche). (B) Les pipettes microcapillaires non forgées, de 50 μm et de 100 μm sont représentées sous le champ de dissection à côté d’une règle d’étalonnage de 1 div = 0,1 mm. (C) Les pipettes microcapillaires de 50 μm et 100 μm de (B) sont représentées, mais d’un point de vue différent. Veuillez cliquer ici pour voir une version agrandie de cette figure.
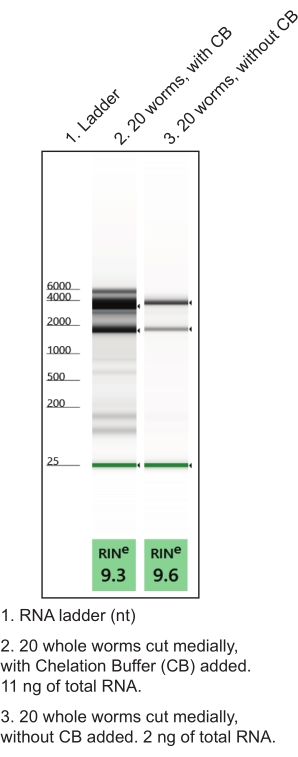
Figure 4 : Utilisation du tampon de chélation (CB) pendant la dissection de la main pour améliorer le rendement en ARN. Un protocole d’extraction d’ARN total à faible entrée a généré des préparations d’ARN à partir de tissus nommés. Des essais représentatifs d’électrophorèse sur gel caractérisant la qualité et la quantité de l’ARN total isolé (RIN, nombre d’intégrité de l’ARN) sont indiqués. Veuillez cliquer ici pour voir une version agrandie de cette figure.
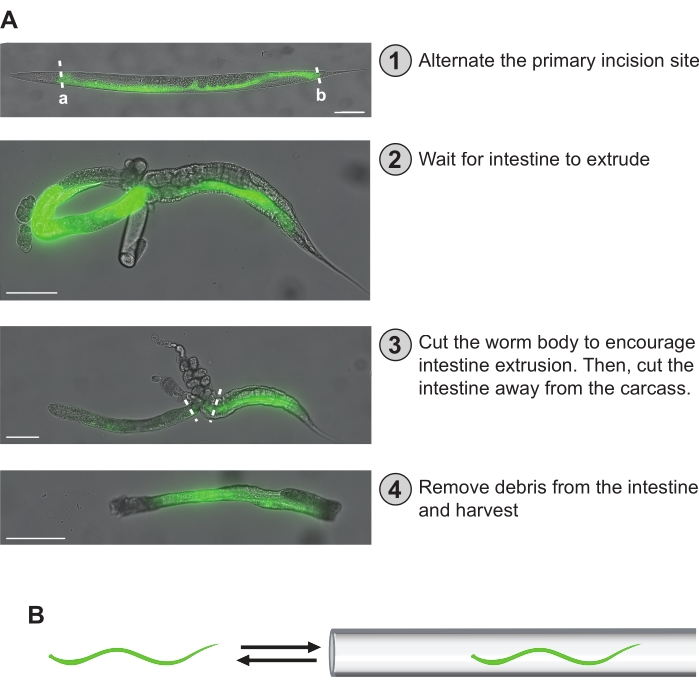
Figure 5 : Étapes de dissection manuelle. (A) Les étapes de dissection décrites dans le protocole sont décrites ici. En (1), l’intestin du ver est visualisé par fluorescence GFP. Le site d’incision primaire peut être réparti uniformément entre les vers pour assurer une couverture uniforme sur toute la longueur de l’intestin. Alternativement, les sites d’incision primaire « a » ou « b » peuvent être choisis pour obtenir une préparation spécifique aux fragments intestinaux antérieurs-moyens ou mi-postérieurs. En (2), l’intestin s’est extrudé, prenant une forme de boucle. En (3), l’intestin est d’abord coupé du corps du ver tout en essayant de le libérer de la carcasse et de la gonade. L’intestin est ensuite retiré de toute carcasse ou gonade restante qui ne peut pas être enlevée. En (4), une section nettoyée de l’intestin est isolée et prête à être stockée. (B) Une étape critique consiste à déloger tous les débris collés (c.-à-d. gonade, carcasse) de l’intestin en les faisant entrer et sortir de la pipette microcapillaire fabriquée à l’extrémité de l’aspirateur buccal. Barres d’échelle = 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
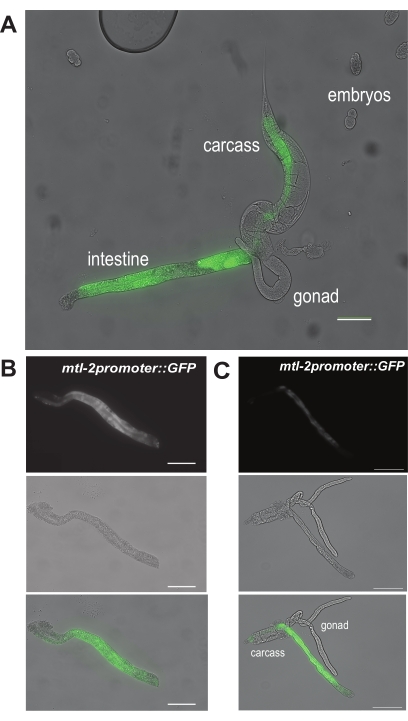
Figure 6 : Résultats représentatifs des étapes de dissection manuelle. Une image représentative montrant (A) l’extrusion de l’intestin du ver. Ce sont des vers du génotype CL2122, exprimant la GFP sous le promoteur mtl-2 spécifique de la cellule intestinale. Deux images représentatives montrent (B) une section nettoyée et complètement isolée de l’intestin et (C) un intestin isolé avec des tissus de gonades et de carcasses contaminants. Barres d’échelle = 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
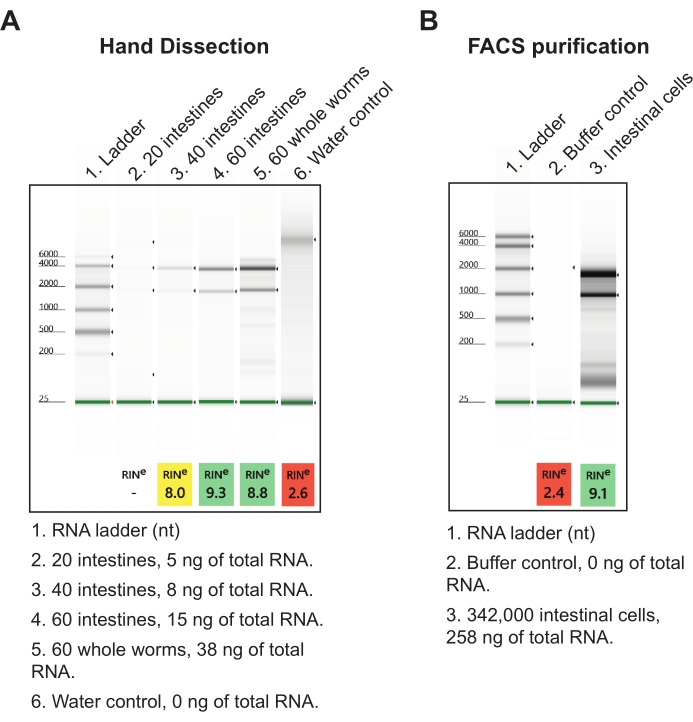
Figure 7 : Résultats représentatifs de l’extraction totale d’ARN à partir d’intestins isolés. (A) Une image représentative des préparations d’ARN résolues par électrophorèse sur gel d’agarose est montrée, caractérisant la qualité (RIN, nombre d’intégrité de l’ARN) et la quantité d’ARN totaux isolés. (B) Un gel représentatif d’ARN total isolé à partir de cellules intestinales prélevées sur des vers de stade L1 par tri cellulaire activé par fluorescence (FACS) est présenté à des fins de comparaison. À 20 cellules par intestin, on peut en déduire que la méthode de dissection manuelle produit plus d’ARN total par intestin que les cellules intestinales purifiées par FACS. Veuillez cliquer ici pour voir une version agrandie de cette figure.
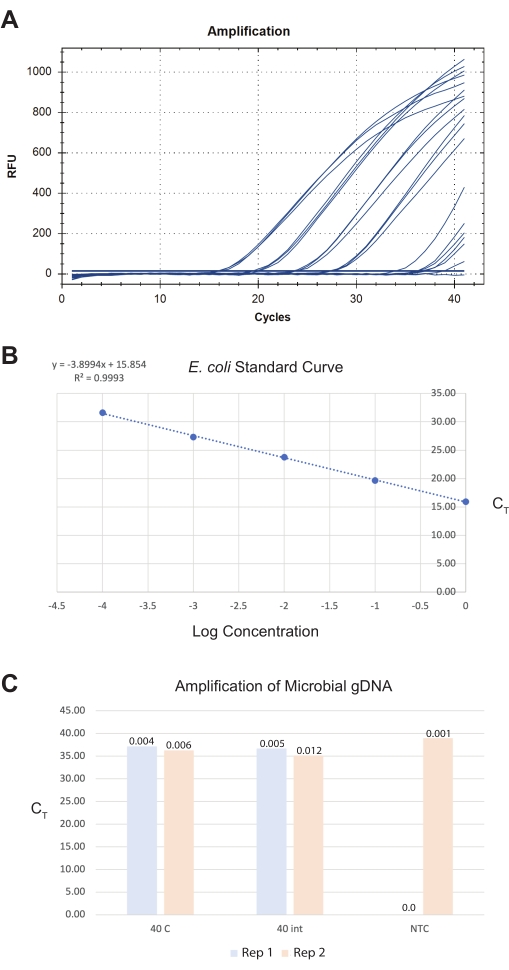
Figure 8 : Résultats représentatifs pour l’extraction totale d’ADN microbien à partir d’intestins isolés. Un kit commercial d’isolement d’ADN microbien a généré des préparations d’ADN à partir d’intestins, de vers entiers et de témoins. Un test génétique panbactérien a été utilisé pour quantifier le nombre de bactéries dans les échantillons. Une image représentative de (A) les courbes d’amplification qPCR générées, (B) la courbe standard E. coli OP50 utilisée pour quantifier les échantillons, et (C) les échantillons sont montrés. En (B), les concentrations logarithmiques de départ des étalons E. coli sont représentées graphiquement par rapport à leurs valeurs CT. En (C), deux répétitions (répétitions) de 40 vers entiers ont été coupées médialement, et 40 coupes intestinales isolées ont été traitées pour l’isolement microbien de l’ADNg. Le contrôle sans modèle (NTC) de l’exécution qPCR est également affiché. L’axe des Y représente les valeurs CT de l’échantillon. La quantité d’ADN quantifiée à partir des PCR est représentée par des valeurs de picogrammes totaux (pg) au-dessus des barres d’échantillonnage. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Composition des tampons et des solutions utilisés dans cette étude. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Cet article décrit le protocole étape par étape pour la dissection manuelle des intestins de C. elegans adulte, générant des préparations pures pour les tests en aval. Les étapes critiques de ce protocole comprennent (1) la garantie de ne pas trop paralyser les vers, (2) la réalisation de coupes de dissection précises, (3) la forge de micro-pipettes de taille appropriée pour la dissection et (4) la récupération rapide des intestins sains lors de la récolte finale. Pour ces raisons, des précautions doivent être prises lors de l’exposition des vers à la solution de lévamisole et les aiguilles hypodermiques doivent être rafraîchies fréquemment pour assurer une netteté maximale. La manipulation de l’intestin à l’aide de la pipette microcapillaire et de l’aspirateur buccal est une autre étape qui prendra de la pratique. Des micro-pipettes correctement forgées de la taille appropriée font également une différence substantielle dans l’isolement de grandes sections de l’intestin pendant les dissections, en plus de réduire le risque de perdre des intestins dans la micro-pipette. Les utilisateurs de nouveaux protocoles perdent généralement des intestins sur le bord interne de la pipette microcapillaire avant de pouvoir être éjectés dans le réactif d’isolement. Ce problème peut être résolu avec la pratique et des pipettes microcapillaires correctement forgées.
Le protocole décrit ici a été conçu pour être utilisé chez les vers adultes. Des essais préliminaires soutiennent que ce protocole est également efficace pour une utilisation chez les vers L4 et les vers adultes plus âgés. Cependant, l’efficacité de ce protocole n’a pas encore été évaluée chez les vers au stade larvaire précoce. Une limite de cette approche est la petite quantité de matériel qu’elle produit. Bien que les quantités soient suffisantes pour le séquençage de l’ARN et la PCR, elles peuvent ne pas être adéquates pour d’autres tests. En tant que tel, les utilisateurs doivent déterminer si l’entrée minimale requise pour un test peut être collectée avec ce protocole.
Notre laboratoire utilise régulièrement FACS pour purifier les cellules intestinales après l’isolement 30, des méthodes d’analyse post-hoc pour l’identification des cellules intestinales et cette méthode de dissection manuelle30,42. La dissection manuelle a l’avantage de pouvoir être utilisée chez les vers adultes lorsque la désagrégation des vers et l’isolement cellulaire sont moins efficaces. De plus, l’efficacité et la qualité de l’ARN total extrait des préparations de dissection manuelle sont élevées, probablement parce que les tissus sont rapidement arrachés des vers, puis rapidement déposés dans un réactif d’isolement des acides nucléiques, ce qui réduit la dégradation de l’ARN. Un autre avantage de la méthode de dissection manuelle est qu’elle est peu coûteuse, facile à apprendre et ne nécessite pas d’équipement spécialisé. Enfin, cette approche permet la récolte et l’isolement des bactéries intestinales des intestins des vers, ce qui permet des études du microbiome en aval.
Le protocole de dissection manuelle décrit ici pour isoler les intestins de C. elegans adultes représente un outil puissant pour étudier divers aspects de la biologie de C. elegans. Par exemple, avec une préparation pure des intestins, les chercheurs peuvent étudier l’intersection entre l’immunité, le vieillissement, le métabolisme et le microbiome.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Nous sommes redevables au travail pionnier de James McGhee et Barb Goszczynski, qui ont initialement développé la méthode de dissection intestinale à partir de laquelle ce protocole est adapté. Notre travail est soutenu par un prix MIRA (R35) supervisé par le National Institute of General Medical Sciences (National Institutes of Health, R35GM124877 à EON) et un NSF-CAREER Award supervisé par la NSF MCB Div Of Molecular and Cellular Bioscience (Award #2143849 à EON).
matériels
| Name | Company | Catalog Number | Comments |
| Acetylated Bovine Serum Albumin (BSA) | VWR | 97061-420 | Nuclease free BSA |
| CL2122 worm strain | CGC (Caenorhabditis Genetics Center) | CL2122 | dvIs15 [(pPD30.38) unc-54(vector) + (pCL26) mtl-2::GFP]. Control strain for CL2120. Phenotype apparently WT. |
| Calcium Chloride Dihydrate | Fisher | C79 | needed for making Egg Salts |
| 50 mL Centrifuge Tubes, Bulk | Olympus Plastics | 28-108 | Nuclease free conical tube needed for solution making. |
| 15 mL Centrifuge Tubes, Bulk | Olympus Plastics | 28-103 | Nuclease free conical tube needed for solution making. |
| Concavity slide (2-well) | Electron Microscopy Sciences | 71878-08 | 12-pk of 2-well concavity slides |
| Ethylene glycol-bis(2-amino-ethylether)-N,N,N',N'-tetraacetic acid (EGTA) | Millipore Sigma | E3889 | needed for making chelation buffer |
| Fluorescent Dissection Microscope | Leica | M205 FCA | This is an optional piece of equipment that can be used with fluorescent C. elegans strains to help guid users during hand dissections |
| N-(2-Hydroxyethyl)piperazine-N′-(2-ethanesulfonic acid), 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid (HEPES) | Millipore Sigma | H4034 | needed for making dissection buffer |
| High Sensitivity RNA ScreenTape | Agilent | 5067-5579 | for assesment of total RNA quality and quantity |
| High Sensitivity RNA ScreenTape Ladder | Agilent | 5067-5581 | for assesment of total RNA quality and quantity |
| High Sensitivity RNA ScreenTape Sample Buffer | Agilent | 5067-5580 | for assesment of total RNA quality and quantity |
| HostZERO Microbial DNA Kit | Zymo Research | D4310 | Isolation of microbial DNA from worm intestines/worms |
| Hypodermic Needle (27G x 1/2") | BD Scientific | 305109 | needed for hand dissection of intestines |
| Levamisole (a.k.a. (-)-Tetramisole hydrochloride) | Millipore Sigma | L9756 | used to temporarily paralyze worms prior to hand dissection of intestines. |
| Luer-Lok General Use Disposable Syringe (1 mL) | BD Scientific | 309628 | Optional. Can be used to affix the hypodermic needle to, allowing easier manipulation of the needle during dissection. Remove the plunger. |
| Magnesium Chloride Hexahydrate | Fisher | M33 | needed for making Egg Salts |
| Magnesium Sulfate Hpetahydrate | Sigma-Aldrich | 230391-500G | needed for making M9 buffer |
| MF-900 Microforge | Narishige | MF-900 | Used to forge the microcapillary pipettes. Available through Tritech Research. |
| 1.7 mL Microtubes, Clear | Olympus Plastics | 22-282 | Nuclease free microfuge tube needed for solution making and sample storage. |
| Mouth Aspirator Tube | Millipore Sigma | A5177 | Mouth aspirator tube is needed in combination with the microcapillary pipette to allow aspiration of dissected intestines. |
| 16S Pan-Bacterial Control TaqMan Assay | Thermo Fisher | A50137 | Assay ID: Ba04930791_s1. Assay used for gut microbial detection via qPCR. |
| P-1000 Micropipette Puller | Sutter Instruments | Model P-1000 | Used to pull the microcapillary pippettes prior to forging. |
| Petri Dish (35 x 10 mm) | Genesee Scientific - Olympus Plastics | 32-103 | Used to make M9 bath and Disseciton Buffer bath for washing worms prior to dissection. |
| Phenol:Chloroform:IAA | Ambion | AM9730 | Used in the isolation of total RNA |
| Potassium Chloride | Millipore Sigma | 529552 | needed for making Egg Salts |
| Potassium Phosphate Monobasic | Sigma-Aldrich | P0662-500G | needed for making M9 buffer |
| Qubit 3 Fluorometer | Invitrogen | Q33216 | Accompanies the Qubit RNA HS Assay Kit. Can be used to quantify RNA prior to running sample on the Agilent ScreenTape. |
| Qubit RNA HS Assay Kit | Invitrogen | Q32852 | Can be used to quantify RNA prior to running sample on the Agilent ScreenTape. |
| RNasin Ribonuclease Inhibitor | Promega | N2111 | Broad spectrum inhibition of common eukaryotic Rnases |
| RNase-Free DNase Set | Qiagen | 79254 | used for on-column DNA digestion during RNA isolation protocol. |
| RNeasy Micro Kit | Qiagen | 74004 | Used for isolation of total RNA from worm intestines/worms |
| Standard Glass Capillaries | World Precision Instruments | 1B100F-4 | 4 in OD 1.2 mm standard borosilicate glass capillaries used to make microcapillary pipettes for dissection |
| Sodium Chloride | Fisher | S271 | needed for making Egg Salts |
| Sodium phosphate dibasic heptahydrate | Fisher Scientific | S373-500 | needed for making M9 buffer |
| Syringe filter (0.2 micrometer SCFA) | Thermo Fisher | 72302520 | Optional for use with the mouth aspirator tube when mouth pipetting. |
| 4150 TapeStation System | Agilent | G2992AA | Accompanies the RNA ScreenTape reagents for assessing RNA quality and quantity |
| TaqPath BactoPure Microbial Detection Master Mix | Applied Biosystems | A52699 | master mix used for qPCR |
| TRIzol Reagent | Thermo Fisher Scientific | 15596026 | Nucleic acid isolation and preservation. QIAzol (Qiagen; 79306) can be substituted if preferred. |
| Worm Pick | NA | NA | Made in house from a pasteur pipette and a platinum wire. See wormbook for details. |
Références
- Riddel, D. L., Blumenthal, T., Meyer, B. J., Priess, J. . C. elegans II. , (1997).
- Corsi, A. K., Wightman, B., Chalfie, M. A transparent window into biology: A primer on Caenorhabditis elegans. Genetics. 200 (2), 387-407 (2015).
- Zhang, F., et al. Natural genetic variation drives microbiome selection in the Caenorhabditis elegans gut. Current Biology. 31 (12), 2603-2618 (2021).
- Dirksen, P., et al. CeMbio - The Caenorhabditis elegans microbiome resource. G3: Genes, Genomes, Genetics. 10 (9), 3025-3039 (2020).
- Zhang, F., et al. Caenorhabditis elegans as a model for microbiome research. Frontiers in Microbiology. 8, 485 (2017).
- Roy, P. J., Stuart, J. M., Lund, J., Kim, S. K. Chromosomal clustering of muscle-expressed genes in Caenorhabditis elegans. Nature. 418 (6901), 975-979 (2002).
- Pauli, F., Liu, Y., Kim, Y. A., Chen, P. -. J., Kim, S. K. Chromosomal clustering and GATA transcriptional regulation of intestine-expressed genes in C. elegans. Development. 133 (2), 287-295 (2005).
- Spencer, W. C., et al. A spatial and temporal map of C. elegans gene expression. Genome Research. 21 (2), 325-341 (2011).
- Spencer, W. C., et al. Isolation of specific neurons from C. elegans larvae for gene expression profiling. PLoS One. 9 (11), 112102 (2014).
- Ma, X., et al. Analysis of C. elegans muscle transcriptome using trans-splicing-based RNA tagging (SRT). Nucleic Acids Research. 44 (21), 156 (2016).
- Blazie, S. M., et al. Comparative RNA-Seq analysis reveals pervasive tissue-specific alternative polyadenylation in Caenorhabditis elegans intestine and muscles. BMC Biology. 13 (1), 4 (2015).
- Blazie, S. M., et al. Alternative polyadenylation directs tissue-specific miRNA targeting in Caenorhabditis elegans somatic tissues. Genetics. 206 (2), 757-774 (2017).
- Gómez-Saldivar, G., et al. et al.Tissue-specific transcription footprinting using RNA PoI DamID (RAPID) in Caenorhabditis elegans. Genetics. 216 (4), 931-945 (2020).
- Katsanos, D., Barkoulas, M. Targeted DamID in C. elegans reveals a direct role for LIN-22 and NHR-25 in antagonizing the epidermal stem cell fate. Science Advances. 8 (5), 3141 (2022).
- Kaletsky, R., et al. The C. elegans adult neuronal IIS/FOXO transcriptome reveals adult phenotype regulators. Nature. 529 (7584), 92-96 (2015).
- Kaletsky, R., et al. Transcriptome analysis of adult Caenorhabditis elegans cells reveals tissue-specific gene and isoform expression. PLoS Genetics. 14 (8), 1007559 (2018).
- Mathies, L. D., et al. mRNA profiling reveals significant transcriptional differences between a multipotent progenitor and its differentiated sister. BMC Genomics. 20 (1), 427 (2019).
- Liang, X., Calovich-Benne, C., Norris, A. Sensory neuron transcriptomes reveal complex neuron-specific function and regulation of mec-2/ Stomatin splicing. Nucleic Acids Research. 50 (5), 2401-2416 (2021).
- Glenwinkel, L., et al. In silico analysis of the transcriptional regulatory logic of neuronal identity specification throughout the C. elegans nervous system. eLife. 10, 64906 (2021).
- Taylor, S. R., et al. Molecular topography of an entire nervous system. Cell. 184 (16), 4329-4347 (2021).
- Charest, J., et al. Combinatorial action of temporally segregated transcription factors. Developmental Cell. 55 (4), 483-499 (2020).
- Steiner, F. A., Talbert, P. B., Kasinathan, S., Deal, R. B., Henikoff, S. Cell-type-specific nuclei purification from whole animals for genome-wide expression and chromatin profiling. Genome Research. 22 (4), 766-777 (2012).
- Tintori, S. C., Nishimura, E. O., Golden, P., Lieb, J. D., Goldstein, B. A transcriptional lineage of the early C. embryo. Developmental Cell. 38 (4), 430-444 (2016).
- Hashimshony, T., Wagner, F., Sher, N., Yanai, I. CEL-Seq: Single-cell RNA-Seq by multiplexed linear amplification. Cell Reports. 2 (3), 666-673 (2012).
- Hashimshony, T., Feder, M., Levin, M., Hall, B. K., Yanai, I. Spatiotemporal transcriptomics reveals the evolutionary history of the endoderm germ layer. Nature. 519 (7542), 219-222 (2015).
- Packer, J. S., et al. A lineage-resolved molecular atlas of C. elegans embryogenesis at single-cell resolution. Science. 365 (6459), 1971 (2019).
- Warner, A. D., Gevirtzman, L., Hillier, L. W., Ewing, B., Waterston, R. H. The C. elegans embryonic transcriptome with tissue, time, and alternative splicing resolution. Genome Research. 29 (6), 1036-1045 (2019).
- Cao, J., et al. Comprehensive single-cell transcriptional profiling of a multicellular organism. Science. 357 (6352), 661-667 (2017).
- Durham, T. J., et al. Comprehensive characterization of tissue-specific chromatin accessibility in L2 Caenorhabditis elegans nematodes. Genome Research. 31 (10), 1952-1969 (2021).
- King, D. C., et al. The transcription factor ELT-2 positively and negatively impacts direct target genes to modulate the Caenorhabditis elegans intestinal transcriptome. bioRxiv. , (2021).
- Kocsisova, Z., Mohammad, A., Kornfeld, K., Schedl, T. Cell cycle analysis in the C. elegans germline with the thymidine analog EdU. Journal of Visualized Experiments. (140), e58339 (2018).
- Han, S., et al. Mono-unsaturated fatty acids link H3K4me3 modifiers to C. elegans lifespan. Nature. 544 (7649), 185-190 (2017).
- Edgar, L. G., Wolf, N., Wood, W. B. Early transcription in Caenorhabditis elegans embryos. Development. 120 (2), 443-451 (1994).
- Edgar, L. G., Goldstein, B. Culture and manipulation of embryonic cells. Methods in Cell Biology. 107, 151-175 (2012).
- Nishimura, E. O., Zhang, J. C., Werts, A. D., Goldstein, B., Lieb, J. D. Asymmetric transcript discovery by RNA-seq in C. elegans blastomeres identifies neg-1, a gene important for anterior morphogenesis. PLoS Genetics. 11 (4), 1005117 (2015).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Cerón, J. Basic Caenorhabditis elegans methods: Synchronization and observation. Journal of Visualized Experiments. (64), e4019 (2012).
- Fay, D. S., Fluet, A., Johnson, C. J., Link, C. D. In vivo aggregation of β-amyloid peptide variants. Journal of Neurochemistry. 71 (4), 1616-1625 (1998).
- Altun, Z. F., Hall, D. H. WormAtas Hermaphrodite Handbook – Introduction to C. elegans Anatomy. WormAtlas. , (2006).
- Tan, M. -. W., Mahajan-Miklos, S., Ausubel, F. M. Killing of Caenorhabditis elegans by Pseudomonas aeruginosa used to model mammalian bacterial pathogenesis. Proceedings of the National Academy of Sciences of the United States of America. 96 (2), 715-720 (1999).
- Oesterle, A. Pipette Cookbook 2018: P-97 & P-1000 Micropipette Pullers. Sutter Instrument Company. , (2018).
- Dineen, A., Nishimura, E. O., Goszczynski, B., Rothman, J. H., McGhee, J. D. Quantitating transcription factor redundancy: The relative roles of the ELT-2 and ELT-7 GATA factors in the C. elegans endoderm. Developmental Biology. 435 (2), 150-161 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon