Method Article
Рассечение рук кишечника Caenorhabditis elegans
В этой статье
Резюме
Настоящий протокол описывает процедуру выделения кишечника от взрослых caenorhabditis elegans nematode червей вручную для ввода в геномику, протеомику, микробиом или другие анализы.
Аннотация
Кишечник Caenorhabditis elegans , состоящий всего из 20 клеток, является связующим звеном многих жизнеобеспечивающих функций, включая пищеварение, метаболизм, старение, иммунитет и реакцию окружающей среды. Критические взаимодействия между хозяином C. elegans и его окружающей средой сходятся в кишечнике, где концентрируется кишечная микробиота. Поэтому способность изолировать ткани кишечника вдали от остальной части червя необходима для оценки специфических для кишечника процессов. Этот протокол описывает метод ручного рассечения кишечника взрослых C. elegans . Процедура может быть выполнена в флуоресцентно меченных штаммах для удобства или обучения. Как только техника будет усовершенствована, кишечник можно будет собирать у немаркированных червей любого генотипа. Этот подход к микродиссекции позволяет одновременно захватывать кишечную ткань хозяина и микробиоту кишечника, что является преимуществом для многих исследований микробиома. Таким образом, последующие приложения для кишечных препаратов, генерируемых этим протоколом, могут включать, но не ограничиваются выделением РНК из клеток кишечника и выделением ДНК из захваченной микробиоты. В целом, ручное рассечение кишечника C. elegans обеспечивает простой и надежный метод для исследования критических аспектов биологии кишечника.
Введение
Червь Caenorhabditis elegans nematode, имеющий всего 959 клеток и 4-дневный жизненный цикл от яйца до яйца, является идеальной модельной системой для многих исследований генетики, геномики и развития 1,2. Простота прямого и обратного генетического скрининга, распространенность инженерных флуоресцентных маркеров, способность выполнять нуклеотид-специфическое редактирование генома и многочисленные ресурсы сообщества - все это способствовало крупным открытиям и пониманию системы C. elegans. Однако существенным недостатком является сложность получения чистых популяций клеток, тканей или органов, которые являются небольшими, хрупкими и могут быть взаимосвязаны. Поскольку чистые популяции клеток важны для геномных анализов, таких как RNA-seq, ChIP-seq и ATAC-seq, появилось несколько подходов к получению чистых препаратов клеток, тканей и органов C. elegans. Здесь описан способ ручного рассечения кишечника, на больших участках, из взрослых червей C. elegans. Полученные препараты пригодны для последующих геномных анализов (рисунок 1).
Метод мелкомасштабной рассечения тканей, описанный здесь (рисунок 2), является лишь одним из подходов. Другие альтернативные методы, такие как молекулярная маркировка, дезагрегирование червей и очистка типов клеток, представляющих интерес, с помощью флуоресцентно-активированной сортировки клеток (FACS) и пост-специального анализа, также были успешно использованы для изучения тканеспецифических особенностей молекулярной биологии C. elegans. Однако преимущество рассечения рук перед этими другими подходами заключается в том, что его можно использовать для одновременного изучения особенностей кишечника C. elegans и его бактериального содержимого 3,4,5. Это позволяет секвенировать ген 16S рРНК и облегчает исследования микробиома в системе C. elegans. Важным ограничением, однако, является то, что клетки кишечника не выделяются индивидуально.
Молекулярная маркировка придает специфический для типа клетки метку молекулам только в пределах указанной ткани или клеток, представляющих интерес. Эти метки затем могут быть выделены из общего количества препаратов червей. Таким образом, тканеспецифические промоторы, управляющие меченым полиА-связывающим белком или сращенным лидером, позволили тканеспецифическому профилированию транскриптома 6,7,8,9,10 и 3'UTR картированию11,12. Аналогичным образом, профили тканеспецифических факторов транскрипции были проведены с использованием ChIP-seq и DamID, в которых варианты фактора транскрипции, специфичные для промотора, были добавлены с метками или слияниями ферментов13,14.
FACS позволяет изолировать типы клеток, представляющие интерес, от диссоциированных червей на основе их внутренних клеточных характеристик и флуоресцентных свойств. Этот подход породил тканеспецифические транскриптомы из различных органов 8,15,16 и отдельных типов нейронных клеток 8,9,15,16,17,18 и был использован для создания карты экспрессии всей нервной системы C. elegans 19,20 . FACS и его двоюродный брат флуоресцентно-активированной сортировки ядер (FANS) также использовались для генерации клеточно-специфических профилей хроматина21,22.
Наконец, пост-специальный анализ может быть выполнен в анализах разрешения одной ячейки. В этом методе обследуются все отдельные клетки, тип клеток каждой из них присваивается на стадии анализа, а интересующие типы клеток выборочно фильтруются для дальнейшего изучения. Пост-специальный анализ был успешно использован для получения транскриптомов развивающихся клеток с высоким пространственным и временным разрешением у эмбрионов C. elegans 23,24,25,26,27 и L128 стадии червей. Доступность хроматина также была охарактеризована с использованием ATAC-seq вместо RNA-seq с использованием аналогичной стратегии29.
Каждый подход имеет свои преимущества и ограничения. Для кишечника C. elegans дезагрегация червей и выделение FACS клеток кишечника достижимы на30 стадии эмбриона и личинки, но являются сложными у взрослых. Считается, что это связано с большими, эндо-редуплицированными и сильно адгезивными клетками кишечника, что затрудняет их диссоциацию неповрежденными. Метод рассечения руки, описанный здесь, обходит эти проблемы, позволяя изолировать большие участки кишечника взрослого червя. Практика ручного препарирования половых желез с этой же стадии широко распространена и проста. Рассечение кишечника похоже на рассечение гонады, но реже выполняется32. Протокол, представленный здесь, адаптирован из более длинного, неопубликованного протокола, разработанного доктором Джеймсом Макги и Барбом Гощинским. Этот упрощенный протокол заимствует методы выделения бластомеров из эмбрионов ранней стадии 23,33,34,35. Хотя рассечение рук неосуществимо для выделения большинства типов клеток или тканей у C. elegans, оно идеально подходит для выделения кишечника от взрослых червей. Поэтому рассечение рук дополняет другие средства для получения специфических для кишечника клеточных препаратов.
протокол
Для настоящего исследования использовались черви CL2122. Черви были получены через Центр генетики Caenorhabditis (CGC, см. Таблицу материалов), финансируемый Управлением исследовательских инфраструктурных программ NIH (P40 OD010440).
1. Выращивание червей для рассечения
- Вырастите одну большую пластину червей смешанной стадии CL2122 для синхронизации в соответствии со стандартными процедурами культивирования (т.е. пластины NGM, засеянные E. coli OP50)36,37.
ПРИМЕЧАНИЕ: Обычно требуется ~ 96 часов, чтобы достичь максимальной яйцекладущей способности.- Эмбрион готовят глистов в течение 72-96 ч периода. После подготовки эмбриона дайте эмбрионам вылупиться в M9 (см. таблицу 1) в течение 48 ч. Это даст синхронную популяцию червей стадии L1.
ПРИМЕЧАНИЕ: Черви CL2122 содержат интегрированный трансген-GFP (зеленый флуоресцентный белок), вытесненный специфическим для кишечника промотором mtl-2 (MeTaLlothionein 2)38. Этот промотор специфичен для цитоплазмы кишечной клетки и позволяет визуализировать кишечник на флуоресцентном диссекционном микроскопе. После обучения пользователи могут не найти необходимым руководство по флуоресценции.
- Эмбрион готовят глистов в течение 72-96 ч периода. После подготовки эмбриона дайте эмбрионам вылупиться в M9 (см. таблицу 1) в течение 48 ч. Это даст синхронную популяцию червей стадии L1.
- Пластина синхронизировала червей L1 как минимум на двух небольших пластинах. Выращивайте червей на тарелках NGM с достаточным количеством пищи до тех пор, пока они не достигнут взрослой стадии (определяемой по наличию эмбрионов, способных к яйцекладке). Это занимает от 38 до 46 ч при 20 °C.
- Позаботьтесь о том, чтобы одна и та же стадия развития была собрана между репликами и сравнительными штаммами.
ПРИМЕЧАНИЕ: Продолжительность роста червей зависит от штамма, температуры, источника пищи и стадии развития, на которую нацелена39. Другие стадии вблизи взрослой стадии также могут быть использованы, такие как L4 и более взрослые стадии. Для планирования экспериментов с микробиомом различные бактериальные источники пищи, помимо традиционного источника пищи (E. coli OP50), могут быть использованы для выращивания червей, таких как штаммы CeMbio4 или патоген, представляющий интерес40.
- Позаботьтесь о том, чтобы одна и та же стадия развития была собрана между репликами и сравнительными штаммами.
2. Приготовление стоковых растворов и микрокапиллярных пипеток
ПРИМЕЧАНИЕ: В таблице 1 приводится подробная информация обо всех буферах и растворах, использованных для настоящего исследования.
- Приготовьте 50 мл яичных солей (также известных как Яичный буфер) в беснуклеазной конической трубке (см. Таблицу материалов). После изготовления храните при комнатной температуре.
- Приготовьте 10 мл 100 мМ раствора левамизола в беснуклеазной конической трубке. После приготовления сделайте 500 мкл аликвот и храните их при −20 °C. Аликвоты можно размораживать и хранить при 4 °C в течение 1 недели за один раз.
- Приготовьте 1 мл 20 мг/мл раствора ацетилированного сывороточного альбумина крупного рогатого скота (BSA) в безнуклеазной микроцентрифужной трубке. После приготовления сделайте 50 мкл одноразовых аликвот и храните их при −20 °C.
ПРИМЕЧАНИЕ: Важно использовать ацетилированную версию BSA, потому что это единственная форма BSA, которая не содержит нуклеазы. Неацетилированный BSA может быть значительным источником нуклеаз и, таким образом, приводить к деградации образцов. - Подготовьте не менее пяти микрокапиллярных пипеток по 50 мкм и 100 мкм каждая, следуя приведенным ниже шагам.
- Во-первых, потяните стандартные стеклянные капилляры (4 в длину и наружный диаметр 1,2 мм) в форму инъекционной иглы с помощью съемника иглы (см. Таблицу материалов) и условий для «Adherent Cell, C. elegans, & Drosophila» из поваренной книги Sutter Instruments PipetteCookbook 41 (Условия: Тепло = Рампа + 5; Тяга = 100; Вел. = 75; Задержка = 90; Давление = 500; Коробка 2,5 мм x 2,5 мм).
- Затем подделайте микрокапиллярные пипетки до размера 50 мкм (три галочки, как указано глазной линейкой микроковки под объективом M5/0.1) или 100 мкм (пять меток при тех же условиях) с помощью микрокрапши (см. Таблицу материалов). Эти размеры представляют собой предполагаемый диаметр отверстия микрокапиллярной пипетки (рисунок 3).
- Затем прикрепите трубку аспиратора рта к микрокапиллярным пипеткам.
ПРИМЕЧАНИЕ: Аспираторные пипетки традиционно контролируются пипеткой, но многие современные протоколы безопасности запрещают этот метод. Таким образом, пользователи могут управлять аспирацией с помощью трубки аспиратора рта, защемляя трубку между пальцем и большим пальцем. Кроме того, шприцевой фильтр может быть установлен в системе трубчатого аспиратора для дополнительной безопасности.
3. Экспериментальная подготовка
- Приготовьте 5 мл рассеченного буфера в беснуклеазной конической трубке. Хранить при комнатной температуре.
- Приготовьте 1 мл рабочего ацетилированного раствора BSA в безнуклеазной микроцентрифужной трубке. Держитесь на льду.
- Сделайте 350 мкл рабочего раствора левамизола в безнуклеазной микроцентрифужной трубке. Готовят в трех экземплярах (одна пробирка примерно на 20 червей). Держитесь на льду.
- Готовят хелатный буфер в безнуклеазной микроцентрифужной трубке (таблица 1). Сделать в реплике (одна трубка примерно на 10 рассеченных червей). Держитесь на льду. Использование хелатного буфера во время рассечения рук улучшает качество и количество РНК (рисунок 4).
- Приготовьте одну микроцентрифужную трубку на экспериментальную группу, содержащую 500 мкл реагента выделения нуклеиновых кислот или конфигурируемого изоляционного реагента (см. Таблицу материалов) в трубке без нуклеазы. Держитесь на льду. Эта трубка будет использоваться для сбора конечных, изолированных кишечников для хранения или последующего использования.
- Приготовьте одну ванну M9 и одну буферную ванну для рассечения. Для этого получают две стерильные чашки Петри диаметром 35 мм. Затем добавьте 2 мл M9 в одну чашку и 2 мл буфера рассечения в другую. Наконец, добавьте 100 мкл рабочего раствора BSA в каждую ванну. Закрутите для смешивания. Добавление BSA в ванны предотвратит прилипание червей к пластику.
- Подготовьте массив рассечения. Получают 2-луночный вогнутый слайд (см. Таблицу материалов) и добавляют 150 мкл рабочего раствора левамизола в первую лунку. Затем добавьте 150 мкл буфера рассечения во вторую лунку. Наконец, добавьте 20 мкл рабочего раствора BSA в каждую скважину. Добавление BSA в каждую лунку предотвратит прилипание червей к слайду.
4. Рассечение руки кишечника C. elegans
- Используя червячную кирку, переместите 20 взрослых червей из пластины NGM в ванну M9 (шаг 3.6). Это будет смывать внешние бактерии от червей.
- Затем переместите всех 20 червей из ванны M9 в буферную ванну для рассечения (шаг 3.6). Это еще больше смоет внешние бактерии и уравновесит червей в буфере рассечения.
- Далее перемещаем партии червей (т.е. наборами по 10) из рассеченной буферной ванны в скважину, содержащую раствор левамизола (этап 3.7).
ПРИМЕЧАНИЕ: Левамизол временно парализует червей.- Как только движения червей замедлятся, быстро переместите их из колодца левамизола в колодец, содержащий буфер рассечения (шаг 3.7). Позаботьтесь о том, чтобы не парализовать червей.
ПРИМЕЧАНИЕ: Количество червей, перемещаемых партиями в раствор левамизола, может варьироваться в зависимости от комфорта пользователя. Это также верно для количества червей, собранных первоначально в ванну M9, а затем перемещенных в буферную ванну для рассечения. Хорошей практикой является наличие дополнительных червей, доступных для рассечения, особенно во время обучения, поскольку пользователь учится и осваивается с протоколом.
- Как только движения червей замедлятся, быстро переместите их из колодца левамизола в колодец, содержащий буфер рассечения (шаг 3.7). Позаботьтесь о том, чтобы не парализовать червей.
- Затем позвольте червям начать немного двигаться в буфере рассечения перед началом рассечения.
ПРИМЕЧАНИЕ: Кишечник плохо выдавливается из чрезмерно парализованных червей (т.е. червей, которые вообще не двигаются). - Когда все будет готово, рассекните червей под флуоресцентным рассекающим прицелом с помощью подкожной иглы (т. Е. 27 G x 1/2 дюйма) (см. Таблицу материалов), сделав один разрез либо сразу за глоткой (рисунок 5Aa), либо непосредственно перед прямой кишкой (рисунок 5Ab). Это приведет к образованию двух больших участков кишечника, передне-средней половины и средне-задней половины I. Продолжайте эту схему для остальных червей, сохраняя количество отделов кишечника, полученных из передне-среднего и среднего-заднего отделов эквивалентным до тех пор, пока не будет приобретено желаемое общее количество кишок.
ПРИМЕЧАНИЕ: Прикрепление иглы для подкожных инъекций к пустому стволу шприца объемом 1 мл может помочь в его манипуляциях во время рассечения рук. В зависимости от комфорта и опыта пользователя, нередко делается рассечение, которое не дает кишечного фрагмента. Однако с практикой это становится гораздо менее распространенным явлением. - Подождите около 1 мин, чтобы кишечник максимально выдавился из организма. Они обычно принимают форму петли и могут прилипать к части гонад (рисунок 5А). Во время ожидания добавьте 50 мкл хелатного буфера в скважину, чтобы уменьшить деградацию РНК (рисунок 4).
- Во время ожидания и для дальнейшего облегчения экструзии кишечника используйте микрокапиллярную пипетку 100 мкм, прикрепленную к аспиратору рта, и втягивайте кишечник / червя в пипетку и из нее (рисунок 5B). Это также поможет освободить кишечник от гонады. Позаботьтесь о том, чтобы не потерять кишечник, случайно всасывая его полностью в микрокапиллярную пипетку.
ПРИМЕЧАНИЕ: Пользователь может чередовать 100 мкм и 50 мкм микрокапиллярные пипетки для освобождения кишечника от остальной части тела и гонады. Меньший диаметр отверстия микрокапиллярной пипетки 50 мкм может принести пользу для удаления липких кусочков из кишечника. Аспираторные пипетки традиционно контролируются пипеткой, но многие современные протоколы безопасности запрещают этот метод. Таким образом, пользователи могут управлять аспирацией с помощью трубки аспиратора рта, защемляя трубку между пальцем и большим пальцем. Кроме того, шприцевой фильтр может быть установлен в системе трубчатого аспиратора для дополнительной безопасности. - Как только кишечник будет достаточно экструдирован, используйте подкожную иглу 27 Г, чтобы отрезать ее от остальной части тела и любой оставшейся гонады. Размер изолированного участка кишечника может сильно варьироваться в зависимости от опыта комбайна, качества среза и уровня паралича у червя.
ПРИМЕЧАНИЕ: Целостность кишечника и кишечных фрагментов можно легко контролировать на протяжении всего протокола с помощью флуоресценции GFP. - Теперь используйте микрокапиллярную пипетку, чтобы аспирировать участок кишечника и переместить его из колодца в микроцентрифужную трубку, содержащую реагент для выделения нуклеиновых кислот или реагент для выделения. Держите изолированные кишки в реагенте на льду и повторите для остальных кишок.
ПРИМЕЧАНИЕ: Несколько кишечников могут быть добавлены в микроцентрифужную трубку, содержащую реагент для выделения нуклеиновых кислот или другой реагент для выделения, указанный в наборе, в течение дня. Держитесь на льду. Если все кишечники не могут быть выделены за 1 день, те, которые уже выделены и хранятся в реагенте выделения нуклеиновых кислот (который сохраняет нуклеиновые кислоты), могут храниться при -80 ° C до тех пор, пока выделения не возобновятся и / или не могут быть завершены. Здесь образцы стабильны в течение длительного времени (т.е. от нескольких месяцев до 1 года) и могут оставаться до тех пор, пока не будут готовы к выделению нуклеиновых кислот. Кишечник может быть собран в воду или любой специальный буфер лизиса. Тем не менее, необходимо учитывать при определении того, как долго кишечник может оставаться в данном буфере на льду (или другой желаемой температуре), прежде чем переходить к последующим применениям.
5. Выделение РНК из рассеченного кишечника
- Гомогенизировать приобретенные ткани, хранящиеся в реагенте выделения нуклеиновых кислот, выполняя три цикла замораживания/оттаивания/вихря. Для этого используйте шариковую ванну с температурой 37 °C и жидкий азот (или другие сопоставимые средства).
- Затем добавьте 0,2 объема реагента фенол:хлороформ:ИАА (см. Таблицу материалов) к образцу и кратковременно вихрь. Например, для исходного объема образца в 500 мкл 0,2 объема хлороформа будет составлять 100 мкл.
- Встряхните трубку вручную в течение 20 с, а затем высиживают при комнатной температуре в течение 3 мин.
- Разделите фазы образца путем центрифугирования (10 000 х г, 18 мин, 4 °C).
- Удалите водную фазу и переведите в новую безнуклеазную микроцентрифужную трубку.
ПРИМЕЧАНИЕ: Следите за тем, чтобы не аспирировать и не нарушать интерфейс. - Затем добавьте равный объем 100% этанола в водную фазу и встряхните образец вручную в течение 20 с.
- Перенесите 700 мкл образца в спиновую колонну (см. Таблицу материалов). Затем приклеивают РНК к колонке с центрифугированием (≥8000 х г, 30 с, RT [комнатная температура]). Отбросьте сквозной поток. Повторите для любого дополнительного оставшегося образца.
- Добавьте 350 мкл буфера RW1 (см. Таблицу материалов) в колонку для промывки образца. Затем центрифугу (≥8000 х г, 30 с, RT) и отбросьте сквозной поток.
- Выполняйте переваривание ДНК на колонке. Добавьте 80 мкл ДНКазы I в буфер RDD (см. Таблицу материалов) в столбец образца. Затем инкубировать в течение 15 мин на РТ.
- Затем добавьте 350 мкл буфера RW1 в колонку для промывки образца. Центрифуга (≥8 000 х г, 30 с, RT) и перенести колонну на новую коллекторную трубку. Выбросьте проточную и старую коллекторную трубку. Эта стирка удаляет ДНКазу.
- Добавить 500 мкл RPE (см. Таблицу материалов) в колонку образца. Затем центрифугу (≥8000 х г, 30 с, RT) и отбросьте сквозной поток. Повторите вторую стирку.
- Затем центрифугу еще на 1 мин дополнительно высушить мембрану колонны (≥8000 х г, 1 мин, RT). Затем перенесите колонку образца в свежую безнуклеазную трубку для сбора микроцентрифуги с крышкой. Выбросьте проточную и старую коллекторную трубку.
- Добавьте 14 мкл воды без нуклеазы непосредственно к мембране колонки образца. Затем инкубируют образец в течение 2 мин на RT. Далее центрифуга (≥8000 х г, 1 мин, RT) для элюирования РНК.
- Храните образец на льду. Затем оцените качество и количество РНК образца, используя коммерчески доступные наборы для анализа (см. Таблицу материалов). После этого храните образец в морозильной камере при температуре −80 °C.
ПРИМЕЧАНИЕ: РНК, как правило, стабильна при -80 °C в течение 1 года без деградации.
Результаты
Настоящий протокол использовался для выделения больших участков кишечника у взрослых C. elegans вручную (рисунок 2). Окончательный образец кишечника для каждой показанной экспериментальной группы состоит из равной коллекции передне-среднего и среднего заднего отделов кишечника. Однако, в зависимости от экспериментального вопроса, он также может включать в себя набор только переднего, среднего или заднего отделов кишечника. В совокупности для этого протокола представлены три репрезентативных результата. На первом изображено успешное рассечение и выделение кишечника (рисунок 6). Во втором сообщается о результатах выделения РНК из изолированных кишечников (рисунок 7). На третьем показаны результаты микробного наблюдения из изолированных кишечников (рисунок 8).
Для первого результата на рисунке 6А показано, как выглядит экструдированная кишка после проведения первичного разреза на участке «а» на рисунке 5А у взрослых червей CL2122. Поскольку черви CL2122 содержат специфический для кишечника промотор mtl-2 , слитый с GFP (mtl-2p::GFP), изолированные кишки будут светиться зеленым цветом под флуоресцентной рассекающей областью. Успешное рассечение сегмента кишечника затем показано на рисунке 6B. Этот участок кишечника свободен от видимых загрязнений, таких как мусор из гонады или туши. Напротив, на рисунке 6C показаны кишечники, которые не были успешно рассечены, так как гонады и тушка все еще заметно прикреплены к кишечному сегменту.
Для второго результата кишечник был собран в реагент выделения нуклеиновых кислот и обработан на следующий день с использованием протокола полной экстракции РНК с низким входом (см. Таблицу материалов). Окончательный образец кишечника из 60 общих участков кишечника из передне-среднего и среднего-заднего отделов дает примерно 15 нг высококачественной общей РНК (рисунок 7A). Это количество общего кишечника может быть легко получено за один день, но также может быть разрушено в течение нескольких дней, если это необходимо. Выход РНК от рассечения руки более эффективен, чем дезагрегация червей и выделение FACS клеток кишечника в том смысле, что для получения соразмерных количеств общей РНК требуются сотни тысяч кишечных клеток (рисунок 7B). Важно отметить, что выход РНК, генерируемый ручной рассечением, более чем достаточен в качестве входных данных для коммерческих наборов библиотеки РНК-seq (т. Е. NEBNext Ultra II и NEBNext Single Cell / Low Input), которые могут принимать всего 2 пг РНК.
Для третьего результата кишечник собирали в стерильный ddH20 и обрабатывали в тот же день с использованием коммерческого набора для выделения микробной ДНК (см. Таблицу материалов). Окончательный образец кишечника из 40 общих участков кишечника из передне-среднего и среднего-заднего отделов дает около 0,009 пг общей микробной ДНК с использованием панбактериального анализа обнаружения (см. Таблицу материалов) (рисунок 8). Эти величины слишком малы для традиционных методов количественной оценки и должны быть экстраполированы из стандартных кривых qPCR. В идеале пользователи должны ориентироваться на окончательное общее количество кишечника >40, поскольку это увеличивает предел обнаружения и границу сигнал-шум в отношении уровней загрязнения реагентами.
При рассмотрении экспериментального проекта всегда необходим сбор соответствующих контрольных образцов. Для экспериментов по транскриптомике подходящий экспериментальный контроль может включать препараты всего червя, собранные таким же образом, как и кишечник. Однако во время рассечения и выделения кишечника из C. elegans часто можно увидеть кусочки туши и гонады, цепляющиеся за участки кишечника. Хотя в идеале эти загрязняющие ткани должны быть удалены из кишечника перед хранением для последующего использования, дополнительные экспериментальные средства контроля могут включать сбор оставшихся туш червей после рассечения кишечника и/или сбор рассеченных половых желез. Для экспериментов с микробиомом контроль может также включать препараты всего червя, собранные таким же образом, как и кишечник, в дополнение к обычным положительным (бактериальная культура) и отрицательным (вода) контролю.
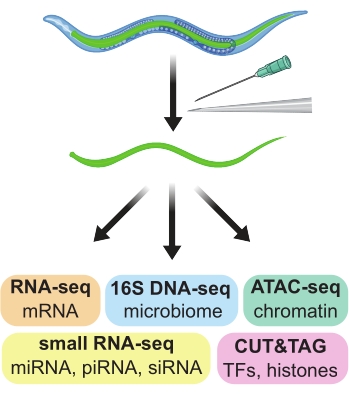
Рисунок 1: Ручное рассечение кишечника у взрослых C. elegans, используемых для получения тканеспецифических препаратов для использования в широком спектре последующих анализов омики. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
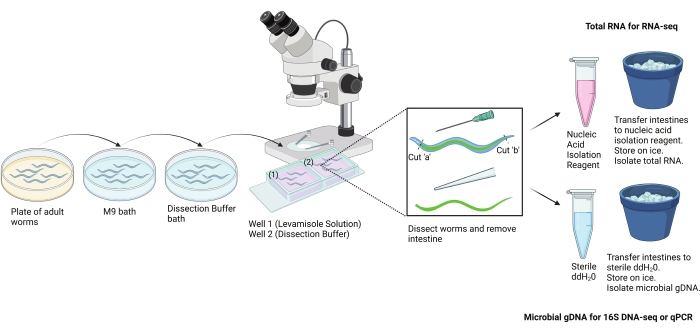
Рисунок 2: Схема протокола рассечения руки. Этот протокол использовался для выделения больших участков кишечника от взрослых C. elegans вручную. Кишечник может быть выделен для различных последующих анализов. Здесь показано использование кишечника для выделения РНК и выделения микробной ДНК. Изображение создано с помощью BioRender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
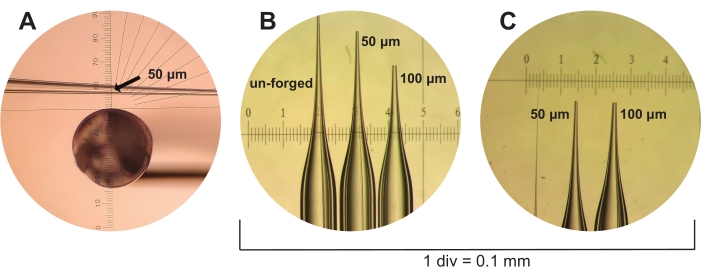
Рисунок 3: Изготовление микрокапиллярных пипеток. (A) Свежевытянутая, но неподделанная микрокапиллярная пипетка показана через глазной кусок микрокрапса. Глазная линейка используется для измерения микрокапиллярных пипеток размером 50 мкм до предполагаемого внутреннего диаметра из трех меток (показано, обозначено стрелкой). (B) Недвиженные, 50 мкм и 100 мкм микрокапиллярные пипетки показаны под рассекающим прицелом вместе с калибровочной линейкой с 1 div = 0,1 мм. (C) Микрокапиллярные пипетки 50 мкм и 100 мкм из (B) показаны снова, но с другой точки зрения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
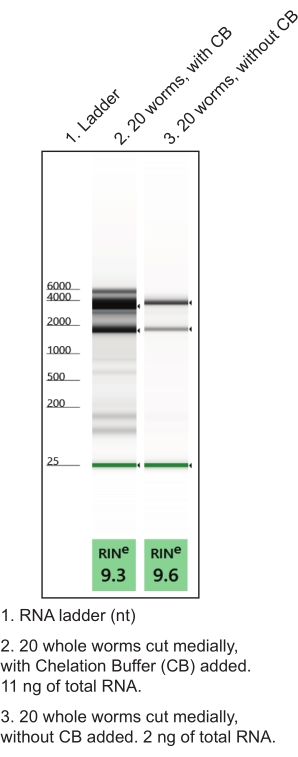
Рисунок 4: Использование хелатного буфера (CB) во время рассечения руки для улучшения выхода РНК. Протокол экстракции РНК с низким входом генерировал препараты РНК из названных тканей. Показаны репрезентативные гелевые электрофорезы, характеризующие изолированное общее качество РНК (RIN, число целостности РНК) и количество. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
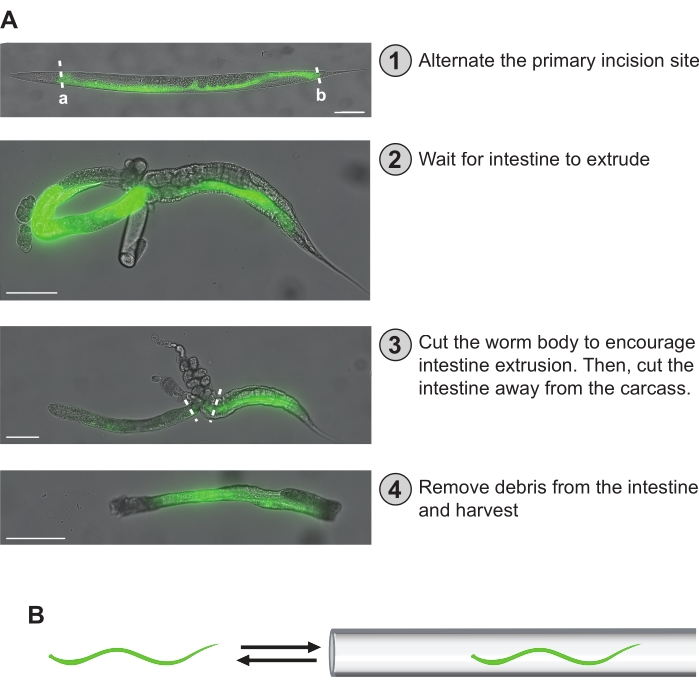
Рисунок 5: Этапы рассечения рук. (A) Этапы рассечения, описанные в протоколе, описаны здесь. В (1) кишечник червя визуализируется флуоресценцией GFP. Место первичного разреза может быть равномерно распределено между червями, чтобы обеспечить равномерное покрытие по всей длине кишечника. Альтернативно, участки первичного разреза "a" или "b" могут быть выбраны для получения препарата, специфичного для передне-среднего или среднего заднего фрагмента кишечника. В (2) кишечник экструдируется, принимая форму петли. В (3) кишечник сначала отрезают от тела червя, пытаясь освободить его от туши и гонады. Затем кишечник удаляется из любой оставшейся туши или гонады, которые не могут быть удалены. В (4) очищенный участок кишечника изолирован и готов к хранению. (B) Критическим шагом является вытеснение любого цепляющегося мусора (т.е. гонады, туши) из кишечника путем передачи его внутрь и из микрокапиллярной пипетки, вылепленной на конце аспиратора рта. Шкала = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
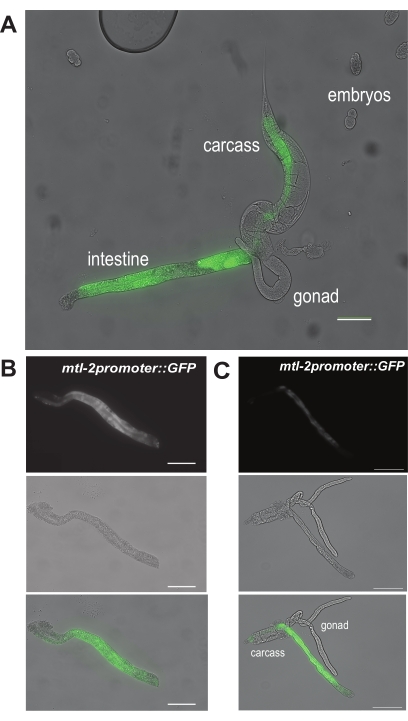
Рисунок 6: Репрезентативные результаты этапов рассечения рук. Репрезентативное изображение, показывающее (А) экструзию кишечника из червя. Это черви генотипа CL2122, экспрессирующие GFP под специфическим для клеток кишечника промотором mtl-2 . Два репрезентативных изображения показывают (B) очищенный и полностью изолированный участок кишечника и (C) изолированный кишечник с загрязняющими тканями гонад и туши. Шкала = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
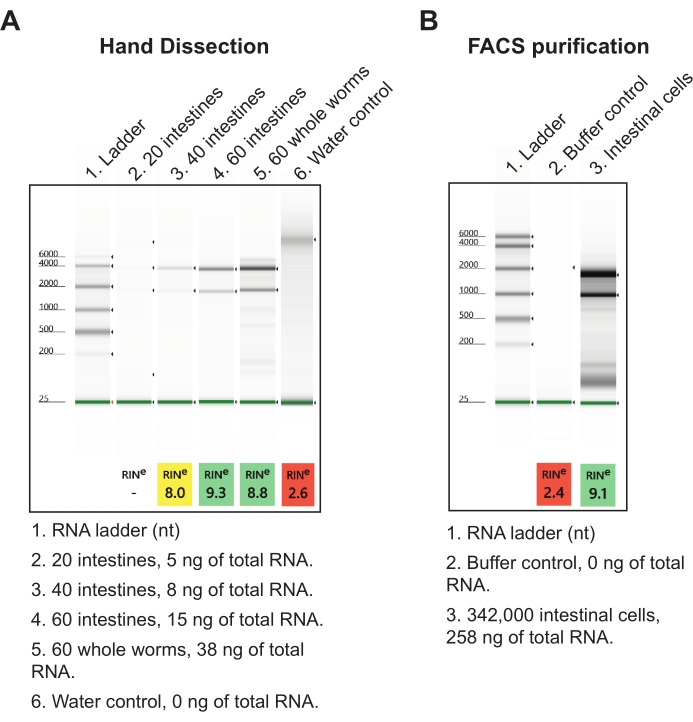
Рисунок 7: Репрезентативные результаты полной экстракции РНК из изолированных кишечников. (A) Показано репрезентативное изображение препаратов РНК, разрешенных электрофорезом агарозного геля, характеризующее качество (RINs, число целостности РНК) и количество изолированных общих РНК. (B) Для сравнения показан репрезентативный гель общей РНК, выделенной из клеток кишечника, собранных у червей стадии L1 с помощью флуоресцентно-активированной клеточной сортировки (FACS). При 20 клетках на кишечник можно сделать вывод, что метод рассечения руки дает больше общей РНК на кишечник, чем очищенные FACS кишечные клетки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
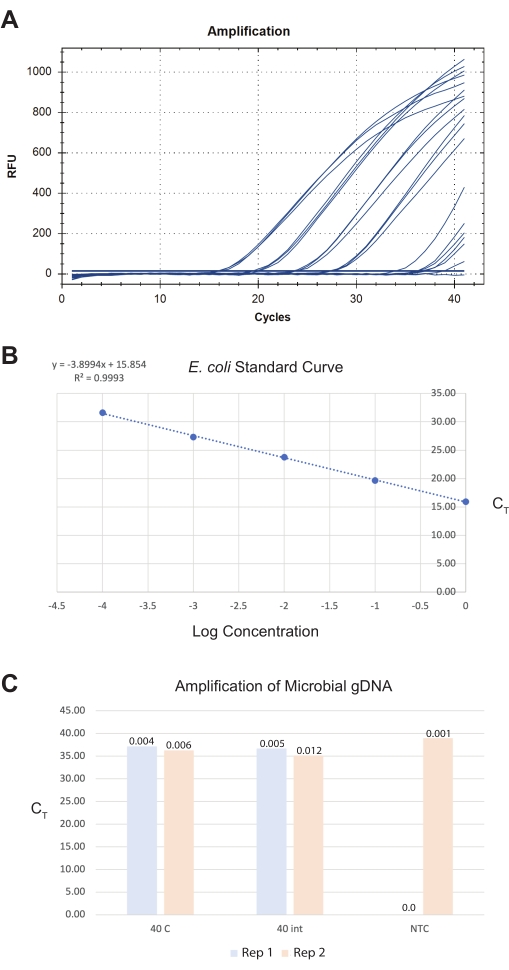
Рисунок 8: Репрезентативные результаты для полной экстракции микробной ДНК из изолированного кишечника. Коммерческий набор для выделения микробной ДНК генерировал препараты ДНК из кишечника, целых червей и контроля. Панбактериальный анализ генов был использован для количественной оценки количества бактерий в образцах. Репрезентативное изображение (A) сгенерированных кривых усиления qPCR, (B) стандартной кривой E. coli OP50, используемой для количественной оценки образцов, и (C) образцов. В пункте (B) исходные концентрации логарифмических эталонов E. coli отображаются на основе их значений CT . В (C) две реплики (повторения) 40 целых червей были разрезаны медиально, а 40 изолированных участков кишечника были обработаны для выделения микробной гДНК. Также отображается no-Template-Control (NTC) из запуска qPCR. Ось Y представляет выборочные значения CT . Количество ДНК, количественно измеренное с помощью ПЦР, показано в виде общих значений пикограмм (pg) над полосами образца. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Составы буферов и растворов, используемых в данном исследовании. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
В этой статье описывается пошаговый протокол для ручного рассечения кишечника у взрослых C. elegans, генерирующих чистые препараты для последующих анализов. Критические шаги в этом протоколе включают (1) обеспечение того, чтобы черви не парализовали чрезмерно, (2) выполнение точных рассечений для рассечения, (3) ковку микропипеток соответствующего размера для рассечения и (4) обеспечение быстрого восстановления здорового кишечника во время окончательного сбора урожая. По этим причинам необходимо соблюдать осторожность при воздействии на глистов раствор левамизола, а подкожные иглы нужно часто обновлять, чтобы обеспечить максимальную резкость. Работа с кишечником с помощью микрокапиллярной пипетки и аспиратора для рта является еще одним шагом, который потребует практики. Правильно подделанные микропипетки соответствующего размера также имеют существенное значение в изоляции больших участков кишечника во время рассечений, в дополнение к снижению риска потери кишечника внутри микропипетки. Пользователи нового протокола обычно теряют кишечник на внутреннем краю микрокапиллярной пипетки, прежде чем их можно будет выбросить в изоляционный реагент. Эта проблема может быть исправлена практикой и правильно подделанными микрокапиллярными пипетками.
Протокол, описанный в настоящем описании, был разработан для использования у взрослых червей. Предварительные испытания подтверждают, что этот протокол также эффективен для использования у червей L4 и пожилых взрослых червей. Однако эффективность этого протокола еще не была оценена у червей ранней личиночной стадии. Ограничением этого подхода является небольшое количество материала, которое он дает. Хотя эти количества достаточны для РНК-сек и ПЦР, они могут быть недостаточными для других анализов. Таким образом, пользователи должны определить, могут ли минимальные необходимые входные данные для анализа быть реально собраны с помощью этого протокола.
Наша лаборатория регулярно использует FACS для очистки клеток кишечника после изоляции30, методы пост-специального анализа для идентификации клеток кишечника и этот метод рассечения рук30,42. Вскрытие рук имеет то преимущество, что оно поддается использованию у взрослых червей, когда дезагрегация червей и изоляция клеток менее успешны. Кроме того, эффективность и качество общей РНК, извлеченной из препаратов для рассечения рук, высоки, вероятно, потому, что ткани быстро выщипываются у червей, а затем быстро депонируются в реагенте выделения нуклеиновых кислот, уменьшая деградацию РНК. Еще одним преимуществом метода вскрытия рук является то, что он недорогой, прост в освоении и не требует специализированного оборудования. Наконец, этот подход позволяет собирать и выделять кишечные бактерии из кишечника червей, что позволяет проводить последующие исследования микробиома.
Описанный здесь протокол вскрытия рук для выделения кишечника у взрослых C. elegans представляет собой мощный инструмент для изучения различных аспектов биологии C. elegans . Например, при чистой подготовке кишечника исследователи могут исследовать пересечение между иммунитетом, старением, метаболизмом и микробиомом.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Мы обязаны новаторской работе Джеймса Макги и Барба Гощинского, которые изначально разработали метод рассечения кишечника, из которого адаптирован этот протокол. Наша работа поддерживается премией MIRA (R35), контролируемой Национальным институтом общих медицинских наук (Национальные институты здравоохранения, R35GM124877 to EON) и премией NSF-CAREER, контролируемой NSF MCB Div Of Molecular and Cellular Bioscience (Award #2143849 to EON).
Материалы
| Name | Company | Catalog Number | Comments |
| Acetylated Bovine Serum Albumin (BSA) | VWR | 97061-420 | Nuclease free BSA |
| CL2122 worm strain | CGC (Caenorhabditis Genetics Center) | CL2122 | dvIs15 [(pPD30.38) unc-54(vector) + (pCL26) mtl-2::GFP]. Control strain for CL2120. Phenotype apparently WT. |
| Calcium Chloride Dihydrate | Fisher | C79 | needed for making Egg Salts |
| 50 mL Centrifuge Tubes, Bulk | Olympus Plastics | 28-108 | Nuclease free conical tube needed for solution making. |
| 15 mL Centrifuge Tubes, Bulk | Olympus Plastics | 28-103 | Nuclease free conical tube needed for solution making. |
| Concavity slide (2-well) | Electron Microscopy Sciences | 71878-08 | 12-pk of 2-well concavity slides |
| Ethylene glycol-bis(2-amino-ethylether)-N,N,N',N'-tetraacetic acid (EGTA) | Millipore Sigma | E3889 | needed for making chelation buffer |
| Fluorescent Dissection Microscope | Leica | M205 FCA | This is an optional piece of equipment that can be used with fluorescent C. elegans strains to help guid users during hand dissections |
| N-(2-Hydroxyethyl)piperazine-N′-(2-ethanesulfonic acid), 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid (HEPES) | Millipore Sigma | H4034 | needed for making dissection buffer |
| High Sensitivity RNA ScreenTape | Agilent | 5067-5579 | for assesment of total RNA quality and quantity |
| High Sensitivity RNA ScreenTape Ladder | Agilent | 5067-5581 | for assesment of total RNA quality and quantity |
| High Sensitivity RNA ScreenTape Sample Buffer | Agilent | 5067-5580 | for assesment of total RNA quality and quantity |
| HostZERO Microbial DNA Kit | Zymo Research | D4310 | Isolation of microbial DNA from worm intestines/worms |
| Hypodermic Needle (27G x 1/2") | BD Scientific | 305109 | needed for hand dissection of intestines |
| Levamisole (a.k.a. (-)-Tetramisole hydrochloride) | Millipore Sigma | L9756 | used to temporarily paralyze worms prior to hand dissection of intestines. |
| Luer-Lok General Use Disposable Syringe (1 mL) | BD Scientific | 309628 | Optional. Can be used to affix the hypodermic needle to, allowing easier manipulation of the needle during dissection. Remove the plunger. |
| Magnesium Chloride Hexahydrate | Fisher | M33 | needed for making Egg Salts |
| Magnesium Sulfate Hpetahydrate | Sigma-Aldrich | 230391-500G | needed for making M9 buffer |
| MF-900 Microforge | Narishige | MF-900 | Used to forge the microcapillary pipettes. Available through Tritech Research. |
| 1.7 mL Microtubes, Clear | Olympus Plastics | 22-282 | Nuclease free microfuge tube needed for solution making and sample storage. |
| Mouth Aspirator Tube | Millipore Sigma | A5177 | Mouth aspirator tube is needed in combination with the microcapillary pipette to allow aspiration of dissected intestines. |
| 16S Pan-Bacterial Control TaqMan Assay | Thermo Fisher | A50137 | Assay ID: Ba04930791_s1. Assay used for gut microbial detection via qPCR. |
| P-1000 Micropipette Puller | Sutter Instruments | Model P-1000 | Used to pull the microcapillary pippettes prior to forging. |
| Petri Dish (35 x 10 mm) | Genesee Scientific - Olympus Plastics | 32-103 | Used to make M9 bath and Disseciton Buffer bath for washing worms prior to dissection. |
| Phenol:Chloroform:IAA | Ambion | AM9730 | Used in the isolation of total RNA |
| Potassium Chloride | Millipore Sigma | 529552 | needed for making Egg Salts |
| Potassium Phosphate Monobasic | Sigma-Aldrich | P0662-500G | needed for making M9 buffer |
| Qubit 3 Fluorometer | Invitrogen | Q33216 | Accompanies the Qubit RNA HS Assay Kit. Can be used to quantify RNA prior to running sample on the Agilent ScreenTape. |
| Qubit RNA HS Assay Kit | Invitrogen | Q32852 | Can be used to quantify RNA prior to running sample on the Agilent ScreenTape. |
| RNasin Ribonuclease Inhibitor | Promega | N2111 | Broad spectrum inhibition of common eukaryotic Rnases |
| RNase-Free DNase Set | Qiagen | 79254 | used for on-column DNA digestion during RNA isolation protocol. |
| RNeasy Micro Kit | Qiagen | 74004 | Used for isolation of total RNA from worm intestines/worms |
| Standard Glass Capillaries | World Precision Instruments | 1B100F-4 | 4 in OD 1.2 mm standard borosilicate glass capillaries used to make microcapillary pipettes for dissection |
| Sodium Chloride | Fisher | S271 | needed for making Egg Salts |
| Sodium phosphate dibasic heptahydrate | Fisher Scientific | S373-500 | needed for making M9 buffer |
| Syringe filter (0.2 micrometer SCFA) | Thermo Fisher | 72302520 | Optional for use with the mouth aspirator tube when mouth pipetting. |
| 4150 TapeStation System | Agilent | G2992AA | Accompanies the RNA ScreenTape reagents for assessing RNA quality and quantity |
| TaqPath BactoPure Microbial Detection Master Mix | Applied Biosystems | A52699 | master mix used for qPCR |
| TRIzol Reagent | Thermo Fisher Scientific | 15596026 | Nucleic acid isolation and preservation. QIAzol (Qiagen; 79306) can be substituted if preferred. |
| Worm Pick | NA | NA | Made in house from a pasteur pipette and a platinum wire. See wormbook for details. |
Ссылки
- Riddel, D. L., Blumenthal, T., Meyer, B. J., Priess, J. . C. elegans II. , (1997).
- Corsi, A. K., Wightman, B., Chalfie, M. A transparent window into biology: A primer on Caenorhabditis elegans. Genetics. 200 (2), 387-407 (2015).
- Zhang, F., et al. Natural genetic variation drives microbiome selection in the Caenorhabditis elegans gut. Current Biology. 31 (12), 2603-2618 (2021).
- Dirksen, P., et al. CeMbio - The Caenorhabditis elegans microbiome resource. G3: Genes, Genomes, Genetics. 10 (9), 3025-3039 (2020).
- Zhang, F., et al. Caenorhabditis elegans as a model for microbiome research. Frontiers in Microbiology. 8, 485 (2017).
- Roy, P. J., Stuart, J. M., Lund, J., Kim, S. K. Chromosomal clustering of muscle-expressed genes in Caenorhabditis elegans. Nature. 418 (6901), 975-979 (2002).
- Pauli, F., Liu, Y., Kim, Y. A., Chen, P. -. J., Kim, S. K. Chromosomal clustering and GATA transcriptional regulation of intestine-expressed genes in C. elegans. Development. 133 (2), 287-295 (2005).
- Spencer, W. C., et al. A spatial and temporal map of C. elegans gene expression. Genome Research. 21 (2), 325-341 (2011).
- Spencer, W. C., et al. Isolation of specific neurons from C. elegans larvae for gene expression profiling. PLoS One. 9 (11), 112102 (2014).
- Ma, X., et al. Analysis of C. elegans muscle transcriptome using trans-splicing-based RNA tagging (SRT). Nucleic Acids Research. 44 (21), 156 (2016).
- Blazie, S. M., et al. Comparative RNA-Seq analysis reveals pervasive tissue-specific alternative polyadenylation in Caenorhabditis elegans intestine and muscles. BMC Biology. 13 (1), 4 (2015).
- Blazie, S. M., et al. Alternative polyadenylation directs tissue-specific miRNA targeting in Caenorhabditis elegans somatic tissues. Genetics. 206 (2), 757-774 (2017).
- Gómez-Saldivar, G., et al. et al.Tissue-specific transcription footprinting using RNA PoI DamID (RAPID) in Caenorhabditis elegans. Genetics. 216 (4), 931-945 (2020).
- Katsanos, D., Barkoulas, M. Targeted DamID in C. elegans reveals a direct role for LIN-22 and NHR-25 in antagonizing the epidermal stem cell fate. Science Advances. 8 (5), 3141 (2022).
- Kaletsky, R., et al. The C. elegans adult neuronal IIS/FOXO transcriptome reveals adult phenotype regulators. Nature. 529 (7584), 92-96 (2015).
- Kaletsky, R., et al. Transcriptome analysis of adult Caenorhabditis elegans cells reveals tissue-specific gene and isoform expression. PLoS Genetics. 14 (8), 1007559 (2018).
- Mathies, L. D., et al. mRNA profiling reveals significant transcriptional differences between a multipotent progenitor and its differentiated sister. BMC Genomics. 20 (1), 427 (2019).
- Liang, X., Calovich-Benne, C., Norris, A. Sensory neuron transcriptomes reveal complex neuron-specific function and regulation of mec-2/ Stomatin splicing. Nucleic Acids Research. 50 (5), 2401-2416 (2021).
- Glenwinkel, L., et al. In silico analysis of the transcriptional regulatory logic of neuronal identity specification throughout the C. elegans nervous system. eLife. 10, 64906 (2021).
- Taylor, S. R., et al. Molecular topography of an entire nervous system. Cell. 184 (16), 4329-4347 (2021).
- Charest, J., et al. Combinatorial action of temporally segregated transcription factors. Developmental Cell. 55 (4), 483-499 (2020).
- Steiner, F. A., Talbert, P. B., Kasinathan, S., Deal, R. B., Henikoff, S. Cell-type-specific nuclei purification from whole animals for genome-wide expression and chromatin profiling. Genome Research. 22 (4), 766-777 (2012).
- Tintori, S. C., Nishimura, E. O., Golden, P., Lieb, J. D., Goldstein, B. A transcriptional lineage of the early C. embryo. Developmental Cell. 38 (4), 430-444 (2016).
- Hashimshony, T., Wagner, F., Sher, N., Yanai, I. CEL-Seq: Single-cell RNA-Seq by multiplexed linear amplification. Cell Reports. 2 (3), 666-673 (2012).
- Hashimshony, T., Feder, M., Levin, M., Hall, B. K., Yanai, I. Spatiotemporal transcriptomics reveals the evolutionary history of the endoderm germ layer. Nature. 519 (7542), 219-222 (2015).
- Packer, J. S., et al. A lineage-resolved molecular atlas of C. elegans embryogenesis at single-cell resolution. Science. 365 (6459), 1971 (2019).
- Warner, A. D., Gevirtzman, L., Hillier, L. W., Ewing, B., Waterston, R. H. The C. elegans embryonic transcriptome with tissue, time, and alternative splicing resolution. Genome Research. 29 (6), 1036-1045 (2019).
- Cao, J., et al. Comprehensive single-cell transcriptional profiling of a multicellular organism. Science. 357 (6352), 661-667 (2017).
- Durham, T. J., et al. Comprehensive characterization of tissue-specific chromatin accessibility in L2 Caenorhabditis elegans nematodes. Genome Research. 31 (10), 1952-1969 (2021).
- King, D. C., et al. The transcription factor ELT-2 positively and negatively impacts direct target genes to modulate the Caenorhabditis elegans intestinal transcriptome. bioRxiv. , (2021).
- Kocsisova, Z., Mohammad, A., Kornfeld, K., Schedl, T. Cell cycle analysis in the C. elegans germline with the thymidine analog EdU. Journal of Visualized Experiments. (140), e58339 (2018).
- Han, S., et al. Mono-unsaturated fatty acids link H3K4me3 modifiers to C. elegans lifespan. Nature. 544 (7649), 185-190 (2017).
- Edgar, L. G., Wolf, N., Wood, W. B. Early transcription in Caenorhabditis elegans embryos. Development. 120 (2), 443-451 (1994).
- Edgar, L. G., Goldstein, B. Culture and manipulation of embryonic cells. Methods in Cell Biology. 107, 151-175 (2012).
- Nishimura, E. O., Zhang, J. C., Werts, A. D., Goldstein, B., Lieb, J. D. Asymmetric transcript discovery by RNA-seq in C. elegans blastomeres identifies neg-1, a gene important for anterior morphogenesis. PLoS Genetics. 11 (4), 1005117 (2015).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Cerón, J. Basic Caenorhabditis elegans methods: Synchronization and observation. Journal of Visualized Experiments. (64), e4019 (2012).
- Fay, D. S., Fluet, A., Johnson, C. J., Link, C. D. In vivo aggregation of β-amyloid peptide variants. Journal of Neurochemistry. 71 (4), 1616-1625 (1998).
- Altun, Z. F., Hall, D. H. WormAtas Hermaphrodite Handbook – Introduction to C. elegans Anatomy. WormAtlas. , (2006).
- Tan, M. -. W., Mahajan-Miklos, S., Ausubel, F. M. Killing of Caenorhabditis elegans by Pseudomonas aeruginosa used to model mammalian bacterial pathogenesis. Proceedings of the National Academy of Sciences of the United States of America. 96 (2), 715-720 (1999).
- Oesterle, A. Pipette Cookbook 2018: P-97 & P-1000 Micropipette Pullers. Sutter Instrument Company. , (2018).
- Dineen, A., Nishimura, E. O., Goszczynski, B., Rothman, J. H., McGhee, J. D. Quantitating transcription factor redundancy: The relative roles of the ELT-2 and ELT-7 GATA factors in the C. elegans endoderm. Developmental Biology. 435 (2), 150-161 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены