需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
一种基于流式细胞术的细胞表面蛋白结合测定,用于评估抗癌适配体的选择性和特异性
摘要
抗癌适配体开发的必要步骤是测试其与靶标的结合。我们展示了一种基于流式细胞术的测定来研究这种结合,强调了包括阴性对照适配体和对该特定蛋白质呈阳性或阴性的癌细胞的重要性。
摘要
开发抗癌适配体的一个关键挑战是有效地确定开发的适配体对目标蛋白的选择性和特异性。由于其与单克隆抗体相比的几个优点,适配体的开发在癌症研究人员中获得了极大的欢迎。通过指数富集(SELEX)对配体进行系统进化是开发目标蛋白质特异性适配体的最常见方法。在SELEX之后,快速有效的结合测定加快了鉴定过程,确认了适配体的选择性和特异性。
本文解释了一种基于流式细胞术的上皮细胞粘附分子特异性适配体(EpCAM)的分步流式细胞术结合测定。跨膜糖蛋白EpCAM在大多数癌中过表达,并在癌症的发生、进展和转移中发挥作用。因此,它是靶向药物递送到肿瘤的有价值的候选者。为了评估适配体对膜结合EpCAM的选择性和特异性,需要EpCAM阳性和阴性细胞。此外,还需要具有与EpCAM结合适配体相似的长度和二维(2D)结构的非结合性EpCAM适配体。结合测定包括不同的缓冲液(封闭缓冲液、洗涤缓冲液、孵育缓冲液和FACS缓冲液)和孵育步骤。
核酸适配体与细胞系一起孵育。在孵育和洗涤步骤之后,将使用灵敏的流式细胞术测定法评估细胞。结果分析显示EpCAM特异性适配体与EpCAM阳性细胞结合,而不是EpCAM阴性细胞。在EpCAM阳性细胞中,与非结合适配体对照相比,这被描述为EpCAM适配体向右结合的带移。在EpCAM阴性细胞中,EpCAM结合和非结合适配体的相应条带重叠。这证明了EpCAM适配体的选择性和特异性。虽然该协议侧重于EpCAM适配体,但该协议适用于其他已发布的适配体。
引言
癌症仍然是全球死亡的主要原因之一1。尽管近几十年来癌症治疗有了显着改善,但抗癌药物的开发仍然是一个备受争议的话题。这是因为化疗作为癌症治疗的支柱,伴随着严重的副作用,限制了患者对治疗的依从性。此外,化疗引起的癌症对治疗的耐药性限制了其作为医疗干预的唯一选择的应用。单克隆抗体(mAb)的应用增强了对癌症治疗的反应2。使用mAb的基本原理是提高化疗药物的疗效并尽量减少其不良反应。然而,单克隆抗体的管理也成为一项挑战。这不仅是因为mAb诱导的免疫反应,还因为动物依赖性和昂贵的生产成本以及困难的储存条件3。1990年代4 中核酸适配体的引入为癌症治疗带来了新的希望,因为核酸适配体的应用可以解决与mAb相关的挑战。
核酸适配体是专门为特定靶标产生的短核酸序列。通过指数富集(SELEX)系统进化配体是适配体生产的常用方法。在SELEX中,目标蛋白与随机核苷酸序列文库一起孵育,并通过一系列迭代循环,纯化该蛋白特异性适配体。核酸适配子与mAb具有相似的靶标选择性和特异性,因此该领域的药物开发显示出广阔的未来应用前景。癌症生物标志物特异性适配体可用作单一药物和癌症诊断工具5,6,7。由于其纳米尺寸的结构,这些适配体还可以作为药物载体,将细胞毒性剂特异性地输送到肿瘤8。这将提高靶向药物递送的疗效,并减少化疗相关的脱靶不良反应。此外,这些纳米药物具有高组织渗透率,这使它们成为深部肿瘤药物递送和治疗的理想候选者。核酸适配体还可以设计成靶向在血脑屏障(BBB)上表达的转运蛋白,以改善药物向脑肿瘤的输送9。这种适配体的一个很好的例子是双功能适配体,靶向转铁蛋白受体(TfR)10以增强跨BBB的药物递送,并将细胞毒性药物有效载荷递送到肿瘤细胞11。
尽管核酸适配体具有所有优点,但该领域的药物开发尚未产生上市的、成功的抗癌药物。其中一个原因可能是缺乏该领域研究人员可以在全球范围内遵循的标准和可重复的方法。在本文中,展示了适配体与细胞表面表达的天然蛋白质结合的分步方案。该方案是抗癌适配体临床前评估的先决条件步骤。进行该测定以显示从SELEX或已发布的适配体序列中收集的纯化适配体的选择性和特异性,以确认选择性和特异性。这种基于流式细胞术的测定是一种快速、可靠、灵敏的测定,可准确显示适配体的选择性和特异性,其中核酸适配体正在针对细胞表面的蛋白质进行测试12,13,14。该方法使用本文15所示的EpCAM特异性适配体的结合进行了演示。EpCAM作为一种跨膜糖蛋白,在肿瘤细胞信号传导、进展、迁移和转移中发挥作用16,17。为了显示该适配体的选择性和特异性,使用了EpCAM阳性和阴性癌细胞。先前开发的EpCAM特异性适配体TEPP(5′-GC GCG GTAC CGC GC TA ACG GA GGTTGCG TCC GT-3′)和阴性对照适体TENN(5′-GC GCG TGCA CGC GC TA ACG GA TTCCTTT TCC GT-3)分别用作EpCAM结合和非结合适配体10。TEPP和TENN的3'端都用TYE665荧光团标记。
TEPP是一种双功能适配体,一端靶向EpCAM,另一端靶向TfR。这使得TEPP成为EpCAM+ 脑肿瘤药物递送的合适候选者。使用其TfR特异性末端,TEPP穿过血脑屏障,并使用EpCAM特异性末端找到肿瘤并将其货物(例如,细胞毒性药物)输送到肿瘤。TENN具有与TEPP相似的长度和2D结构,但它对EpCAM或TfR没有亲和力,因此是一种合适的阴性对照适配体。本文使用TEPP和TENN,使用流式细胞术测试适配体与靶蛋白的结合。该协议适用于细胞特异性适配体的开发。它也适用于文献中可用的适配体序列的进一步补充和确认分析。该协议也可以由那些刚进入适配体领域的人使用,他们正在考虑将以前发表的适配体用于他们的研发(R&D)目的。本文研究了文献中可用的两种适配体序列。
研究方案
注意:在开始实验之前,请穿戴个人防护设备,包括实验室外套,手套和护目镜。有关本协议中使用的材料、试剂、设备和软件的详细信息,请参阅 材料表 。
1. 测定所需的缓冲液
- 在实验当天新鲜制备本实验所需的缓冲液 - 适配体折叠所需的SELEX缓冲液,封闭缓冲液(BB),洗涤缓冲液(WB)和结合缓冲液(BiB)(表1),并将它们保存在冰上或4°C。
注意:每个适配体都需要独特的折叠条件。这包括 SELEX 缓冲器和折叠温度条件。应注意完全复制描述适配体10的原始论文中的方法。在该实验中,所有缓冲液均在Dulbecco的磷酸盐缓冲盐水(DPBS)中制备。每个实验所需的缓冲液体积取决于所测试的细胞系数量、重复次数和适配体浓度的数量。
| 成分 | 所需卷 | ||
| 项目 | 浓度 | ||
| SELEX 缓冲液 | 氯化镁2 | 5 毫米米 | 每个样品 50 μL + 10% 移液误差 |
| 阻塞缓冲区 | 氯化镁2 | 5 毫米米 | 每细胞系 500 μL |
| BSA a | 1毫克/毫升 | ||
| tRNA b | 0.1毫克/毫升 | ||
| FBS c | 10% (V/V) | ||
| 洗涤缓冲液 | 氯化镁2 | 5 毫米米 | 第一次洗涤 1 mL + 每个测试样品 100 μL + 10% 移液误差 |
| 结合缓冲液 | 氯化镁2 | 5 毫米米 | 每个样品 50 μL + 10% 移液误差 |
| 软件联盟 | 2毫克/毫升 | ||
| 嘟�� | 0.2毫克/毫升 | ||
| FBS | 20% (垂直/垂直) | ||
表1:结合测定所需的缓冲液。 一个牛血清白蛋白, b转移核糖核酸, c胎牛血清。
2. 核酸适配体的制备
注意:测定中使用的核酸适配体用荧光报告分子标记,因此应注意保护它们免受光照。
- 在实验之前,使用不含热原和RNase的超纯水制备100μM的测试和控制适配体(储备A)(图1)。
注意:为了长期保存,库存A应保存在-20°C的冰箱中。 - 通过使用SELEX缓冲液稀释储备液A来制备储备B作为适配体的工作浓度(表1)。要遵循此协议,请将储备液A稀释至1,000 nM储备液以制备储备液B(图1)。
- 为了使适配体准备好形成三维(3D)结构,在250 μL管中,用SELEX缓冲液稀释储备液B,以制备折叠所需的适配体体积和浓度。
注意:折叠的核酸适配体将暴露在等体积的细胞中。因此,设置为折叠的适配体浓度应比所需的最终浓度高2倍。使用公式(1)计算所需的体积和浓度。请记住,对于移液错误,要考虑额外的10%体积。
集中库存 A × 批量库存A = 集中库存 B × 批量库存 B (1)
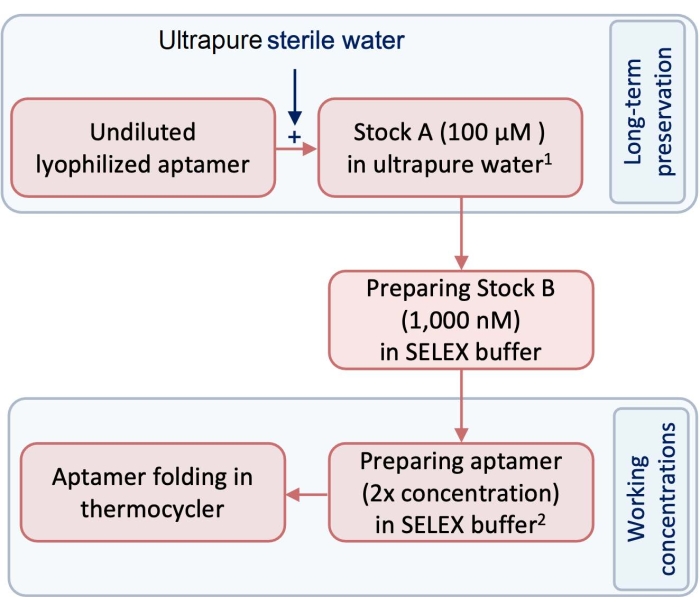
图 1:显示制备适配体步骤的图表。 1 储备液 1储存在 -20 °C 下以便长期保存。阿拉伯数字工作浓度在SELEX缓冲液中制备,不储存。请点击此处查看此图的大图。
3. 癌细胞的维持
注意:在开始研究之前,请确保细胞处于其早期传代数,显示其典型的形态特征,并且不含支原体。为了测试适配体的选择性和特异性,理想情况下需要目标蛋白的高、中和低/阴性表达细胞系。
- 使用适当的培养条件将细胞接种在T75培养瓶中。在37°C的5%CO2 加湿培养箱中培养它们。
注意:在这项研究中,使用了补充有10%胎牛血清(完全培养基)的Dulbecco改良鹰培养基(DMEM)。 - 当细胞达到~80%汇合度时,将它们传代到含有新鲜完全培养基的新烧瓶中。
注意:根据感兴趣的蛋白质和细胞系,80%的汇合度可以为结合测定提供合适的细胞群。对于本实验中的细胞系MDA-MB-231和HEK 293T,80%的汇合度是合适的。在此阶段,进行第4节,结合测定。始终使用针对该蛋白质的特异性mAb检查目标蛋白的表达。
4. 结合试验
注意: 图2 总结了贴壁细胞结合测定中所需的步骤。
- 在II类生物安全柜中,将每个烧瓶的细胞收集在管中,如下所示:
- 收集并丢弃烧瓶中的培养基,加入2mL PBS,将其散布在细胞上,然后收集并丢弃PBS。再重复此步骤两次,以去除所有可能使胰蛋白酶失活的培养基痕迹。向每个烧瓶中加入1mL的0.25%胰蛋白酶/ EDTA,并在 37oC下孵育5-10分钟。
- 向细胞中加入 1 mL 完全培养基,上下移液细胞以制成单细胞悬液。将细胞移液到适当的管中,并以200 × g 离心5分钟。
注意:对于非贴壁细胞,将细胞收集在管中,离心(200× g,5分钟),然后继续步骤4.1.3。 - 弃去上清液并将细胞重悬于1mL新鲜培养基中。使用台盼蓝染色,通过用台盼蓝稀释一定体积的细胞悬液来计数细胞。在血细胞计数器和盖玻片之间分配~15μL的混合物。使用等式(2)按前面描述的18计数细胞:
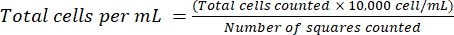 (二)
(二)
注意:使用尽可能小的细胞悬液体积并记下稀释因子。例如,将等体积的细胞悬液和 0.04% 台盼蓝混合,稀释因子为 2。在继续之前,确保大多数贴壁细胞系的高活力(活细胞/总细胞×100)~90%。死细胞非特异性地吸收适配体并改变结果19。可以使用其他细胞计数技术,例如使用细胞计数器。 - 收集所需数量的细胞,确保每个测试样品有 10 × 104 个细胞。考虑额外增加10%的体积以产生移液误差。
注意:在实验和重复之间始终保持相同的细胞计数非常重要。 - 将细胞在37°C孵育2小时,以便在酶分离后稳定细胞膜上感兴趣的蛋白质。
注意:此潜伏期可能因感兴趣的蛋白质而异。
- 在这2小时孵育期间:
- 将离心机的温度设置为4°C。 将tRNA和适配体储备在室温下或冰上解冻。为了保护荧光报告分子,请保护适配体管免受光照。
注意:tRNA的作用是阻断核酸结合位点。 - 准备SELEX缓冲液,BB,WB和BiB(见第1节),将它们全部放在冰上或4°C下。 将热循环仪设置为空循环。将 96 孔黑板和流式细胞术管放在冰上。
注意:将热循环仪设置为空循环可准备冷却和加热系统,并有助于产生更可重复的结果。
- 将离心机的温度设置为4°C。 将tRNA和适配体储备在室温下或冰上解冻。为了保护荧光报告分子,请保护适配体管免受光照。
- 孵育2小时后,将细胞以500× g 离心5分钟。弃去上清液并将细胞重悬于500μLBB中。将细胞在4°C下孵育30分钟,间歇混合。
- 在这30分钟的孵育期间,按如下方式进行适配体折叠:
- 补足2x浓度的核酸适配体(见第2节),然后根据所需的折叠条件在热循环仪中混合并孵育核酸适配体。对于该EpCAM适配体,使用以下折叠条件95°C,5分钟,然后22°C,10分钟和37°C,15分钟。
注意:始终包括阴性对照(即不含适体的SELEX缓冲液)。
- 补足2x浓度的核酸适配体(见第2节),然后根据所需的折叠条件在热循环仪中混合并孵育核酸适配体。对于该EpCAM适配体,使用以下折叠条件95°C,5分钟,然后22°C,10分钟和37°C,15分钟。
- 孵育30分钟后,离心细胞(500× g,5分钟,4°C),除去上清液,加入1mLWB,然后再次离心细胞(500× g,5分钟,4°C)。除去上清液并将细胞重悬于适当体积的BiB中。
- 将 50 μL 重悬细胞移液到冰冷的 96 孔黑板的每个孔中。将细胞保持在冰上以抑制目标蛋白质的内化。
- 将 50 μL 适配体移液到 50 μL 体积的细胞上,混合并在 4 °C 的黑暗中孵育 30 分钟。将板在500× g,5分钟,4°C下离心,并小心地除去上清液。
- 小心地将沉淀重悬于WB中,并以500× g 离心5分钟。重复洗涤步骤(4.7)2次,重悬于100μLWB中进行流式细胞术分析。
注意:有关核酸适配体和细胞之间相互作用的示意图,请参见 图3 。

图 2:描述执行适体蛋白结合测定的步骤的图表。 缩写:SELEX = 通过外源富集对配体进行系统进化;BB = 阻塞缓冲液;WB = 洗涤缓冲液;BiB = 结合缓冲区。 请点击此处查看此图的大图。

图 3:显示执行适配体结合测定所需的不同类型的细胞和适配体的图表。 缩写:EpCAM = 上皮细胞粘附分子。这个数字是用 Biorender.com 创建的。请点击此处查看此图的大图。
5. 流式细胞术和数据分析
注意:在打开流式细胞仪之前,请确保关闭溶液,清洁溶液和鞘液(0.9%NaCl)的膜过滤单元中没有"气泡"。如果胶囊中有气泡,则"排出"气泡。确保废物容器是空的,并且鞘液,水和超纯水中的1%漂白剂的容器已满。
- 打开流式细胞仪,然后打开计算机。
注意:此处介绍的流式细胞仪运行细节特定于视频中演示的机器和软件(参见 材料表)。其他软件需要适当的培训才能使用。 - 打开流式细胞术分析软件,登录程序,在" 细胞仪 "选项卡下,运行 "流体启动"。
- 若要创建新实验,请在"实验"选项卡下,单击"新建文件夹",然后相应地命名文件夹/实验。
- 单击要突出显示的新文件夹,然后再次在实验选项卡下,单击"新建实验"并相应地命名实验。
- 要添加第一个样品/标本,请在 实验 选项卡下单击新标本并适当命名此 标 本(细胞系/对照样品/实验样品的名称)。
- 要添加试管样品,请突出显示该试样(组),然后在 实验 选项卡下单击 新建试管。添加适当数量的管子和名称。
- 若要准备所需的图形,请在工作表选项卡下打开一个新 工作表 。弹出新工作表窗口后,使用工作表屏幕打开以下内容(将鼠标悬停在徽标/图片上以查找名称):
- 准备前向散射 (FSC) 与侧向散射 (SCC) 的 点印 迹图,以选择感兴趣的群体。通过在前向和侧向散点密度图中识别和选择感兴趣的总体 (P1) 来定义第一个门。排除碎片,碎片构成前向散射信号最低的群体。
注意: FSC 参数根据单元格或事件的大小检测它们,SCC 根据其粒度20 区分它们。 - 准备FSC面积(FSC-A)与FSC高度(FSC-H)的 点印图 ,以选择单细胞群。通过排除双峰细胞群来定义第二个门,因为双峰细胞会显着影响结果和结论。通过使用 FSC-H 与 FSC-A 密度图排除双峰,其中相同大小的单元格显示相似的面积和高度。因此,单峰对角线聚集并与双峰分开。
注意:FSC 大致与电池大小成正比。电压脉冲定义为FSC-H,信号强度,反映单元大小和信号持续时间的FSC宽度,以及FSC-A,即H×W。因此,单峰态的门控基于检测由双峰引起的 H、W 和 A 之间的不比例。 - 准备针对目标荧光团的事件数的 直方图 。
- 准备前向散射 (FSC) 与侧向散射 (SCC) 的 点印 迹图,以选择感兴趣的群体。通过在前向和侧向散点密度图中识别和选择感兴趣的总体 (P1) 来定义第一个门。排除碎片,碎片构成前向散射信号最低的群体。
- 在开始流式细胞术之前,请确保用于控制样品采集的采集仪表板、检测器和用于调整电压参数的细胞仪以及包含所有图表的工作表已打开。
注意:流式细胞术管中至少需要 100 μL 的 10 ×10 4 细胞悬液才能进行分析。特别是在活力较低的情况下,可以进行碘化丙啶染色以选择活细胞群21,22。 - 要运行第一个样品,请在屏幕左侧确保指向试管的箭头为绿色。如果此箭头不是绿色的,请单击箭头使其变为绿色。
- 使用移液器将每个样品从 96 孔黑板转移到流式细胞术管中。以低速运行未经处理、未染色的对照样品。
- 在采集仪表板上,选择要记录的适当数量的事件 (30,000),将 流速 更改为 低,然后单击 采集数据。
- 调整 FSC 和 SCC 参数的电压。确保细胞群集中在点图中,并且没有细胞接触图形的任一轴,以避免丢失感兴趣的像元。
- 将采集速度提高到中或高,以更快地分析样品,但不超过200个事件/秒。然后,单击 "记录数据"。
- 对P1(图4A)和单细胞群(图4B)进行门控。针对使用的荧光染料构建事件的直方图,并根据数据(本例中为别藻蓝蛋白(APC))选择P1(图4C)。
- 调整电压,门控并记录数据后,取出样品并单击 Next Tube。
- 插入下一个样品,并重复所有对照和测试样品的记录数据(图3)。
- 收集完所有数据后,通过运行三管50%漂白剂,FACS冲洗和超纯水来洗涤流式细胞仪,每管以高流速洗涤5分钟。
- 然后,从 细胞仪 下拉菜单中,单击 流体关闭。
- 在关闭软件并关闭计算机和计算机之前,将结果作为 .fcs 文件导出到 USB 驱动器以进行传输和分析,如下所示:
- 在分析软件中,按 "新建 "按钮创建新文档和窗口以处理分析。将示例文件拖到新窗口中。
- 双击以打开未染色的样品。选择 P1 群体,双击 P1 群体以创建 FSC-H 与 FSC-A 图,然后门禁单细胞群体。
- 双击门控单细胞以针对使用的荧光染料创建事件的直方图。
- 在原始窗口中,选择 P1 和 单个单元格 ,然后将它们拖到"所有样本",以便 所有样本 现在都包含相同的门控。
- 单击布局 编辑器 按钮以打开 布局 窗口。将两个样本(对照和测试)相互拖动以创建叠加直方图。
结果
新药发现和开发的一个重要方面是确保候选药物的选择性和特异性。这意味着候选药物应该能够区分不同的细胞,并且只影响感兴趣的细胞群(选择性)。使用在目标蛋白表达方面不同的细胞系研究选择性。在这项研究中,MDA-MB-231和HEK 293T细胞系被选为EpCAM阳性和阴性细胞。特异性是另一个决定因素,表明感兴趣的蛋白质仅对单个候选药物有反应。在这里,通过使用EpCAM非结合适体TENN,表明只有TE...
讨论
开发新适配体的主要挑战是缺乏适用于该过程不同步骤的标准指南。McKeague等人最近证明了一些相关的挑战,这些挑战导致出版物中数据的呈现不明确,并且无法复制该研究。他们提出了表征适配体所必需的基本准则19。核酸适配体结合测定是筛选和/或表征核酸适配体23的关键步骤,该试剂被该领域的研究人员广泛使用。由于没有单一的指南来显示分步方案,因...
披露声明
作者没有利益冲突需要披露。
致谢
作者感谢心理和身体健康与临床翻译研究所 (IMPACT) SEED 资金、迪肯大学的"阿尔弗雷德·迪肯博士后研究奖学金"计划和"澳大利亚政府研究培训计划奖学金"。
材料
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tubes with attached lid | Sigma-Aldrich | T6649 | |
| 15 mL CellStar blue screw cap, conical bottom tube | Greiner Bio One | 188271 | |
| 5 mL serological pipettes | Greiner Bio One | 606180 | |
| BD FACSCanto II Flow Becton Dickinson Cytometer | Becton Dickinson | N/A | |
| BD FACSDiva V9.0 | BD Biosciences | N/A | |
| Bovine Serum Albumin (BSA), Lyophilized powder | Sigma-AldrichTM | A7906-50G | |
| Bright-line Hemocytometer | Sigma-Aldrich | Z359629 | |
| Dulbecco’s Modified Eagle Medium (DMEM) High Glucose Media Powder | Life Technologies | 12100046 | |
| Dulbecco’s Phosphate- Buffered Saline (DPBS) | Life Technologies | 21300025 | |
| FlowJo, LLC 10.8.1 | BD Biosciences | N/A | |
| Foetal Bovine Serum (FBS) | Bovogen | SFBS-F | |
| HEK293T | American Type Culture Collection | ACS-4500 | |
| Heracell 150i CO2 Incubator | Thermo Fisher Scientific | N/A | |
| Heraeus Megafuge 16R Centrifuge | Thermo Fisher Scientific | N/A | |
| Magnesium Chloride (MgCl2) | Sigma-Aldrich | M8266 | |
| MDA-MB-231 | American Type Culture Collection | CRM-HTB-26 | |
| Microplate, PS, 96 well, F-bottom (Chimney well), Black | Greiner Bio One | 655076 | |
| MiniAmp Thermal Cycler | Thermo Fisher Scientific | A37834 | |
| Phosphate-Buffered Saline (PBS) tablets | Life Technologies | 18912014 | |
| Pyrogen- and RNase-free ultrapure water | Milli-Q | ||
| T75 Cell Culture flask | Cellstar | 658170 | |
| TENN | Integrated DNA Technologies | N/A | 5′-GC GCG TGCA CGC GC TA ACG GA TTCCTTT TCC GT-3 |
| TEPP | Integrated DNA Technologies | N/A | 5′-GC GCG GTAC CGC GC TA ACG GA GGTTGCG TCC GT-3′ |
| Transfer RNA (tRNA) | Sigma-Aldrich | R8508-5X1ML | |
| Trypan Blue Solution | Life Technologies | 15250061 | |
| Trypsin-EDTA | Gibco | 15400054 |
参考文献
- Cancer. World Health Organization Available from: https://www.who.int/news-room/fact-sheets/detail/cancer#:~:text=Cancer%20is%20a%20leading%20cause.and%20rectum%20and%20prostate%20cancers (2022)
- Liu, J. K. H. The history of monoclonal antibody development - Progress, remaining challenges and future innovations. Annals of Medicine and Surgery. 3 (4), 113-116 (2014).
- Nakhjavani, M., Shigdar, S. Future of PD-1/PD-L1 axis modulation for the treatment of triple-negative breast cancer. Pharmacological Research. 175, 106019 (2022).
- Bukari, B., Samarasinghe, R. M., Noibanchong, J., Shigdar, S. L. Non-invasive delivery of therapeutics into the brain: the potential of aptamers for targeted delivery. Biomedicines. 8 (5), 120 (2020).
- Wu, X., Chen, J., Wu, M., Zhao, J. X. Aptamers: active targeting ligands for cancer diagnosis and therapy. Theranostics. 5 (4), 322 (2015).
- Feng, X., et al. The aptamer functionalized nanocomposite used for prostate cancer diagnosis and therapy. Journal of Nanomaterials. 2022, (2022).
- Huang, J., et al. Advances in aptamer-based biomarker discovery. Frontiers in Cell and Developmental Biology. 9, 571 (2021).
- Ashrafuzzaman, M. Aptamers as both drugs and drug-carriers. BioMed Research International. 2014, (2014).
- Nakhjavani, M., Samarasinghe, R. M., Shigdar, S. Triple-negative breast cancer brain metastasis: an update on druggable targets, current clinical trials, and future treatment options. Drug Discovery Today. , (2022).
- Macdonald, J., et al. Development of a bifunctional aptamer targeting the transferrin receptor and epithelial cell adhesion molecule (EpCAM) for the treatment of brain cancer metastases. ACS Chemical Neuroscience. 8 (4), 777-784 (2017).
- Macdonald, J., et al. Bifunctional aptamer-doxorubicin conjugate crosses the blood-brain barrier and selectively delivers its payload to EpCAM-positive tumor cells. Nucleic Acid Therapeutics. 30 (2), 117-128 (2020).
- Shigdar, S., Agnello, L., Fedele, M., Camorani, S., Cerchia, L. Profiling cancer cells by cell-SELEX: use of aptamers for discovery of actionable biomarkers and therapeutic applications thereof. Pharmaceutics. 14 (1), 28 (2021).
- Rahimizadeh, K., et al. Development of cell-specific aptamers: recent advances and insight into the selection procedures. Molecules. 22 (12), 2070 (2017).
- Chen, M., et al. Development of cell-SELEX technology and its application in cancer diagnosis and therapy. International Journal of Molecular Sciences. 17 (12), 2079 (2016).
- Shigdar, S., et al. The use of sensitive chemical antibodies for diagnosis: detection of low levels of EpCAM in breast cancer. PLoS One. 8 (2), 57613 (2013).
- Ni, J., et al. Role of the EpCAM (CD326) in prostate cancer metastasis and progression. Cancer and Metastasis Reviews. 31 (3), 779-791 (2012).
- Ni, J., et al. Epithelial cell adhesion molecule (EpCAM) is associated with prostate cancer metastasis and chemo/radioresistance via the PI3K/Akt/mTOR signaling pathway. The International Journal of Biochemistry & Cell Biology. 45 (12), 2736-2748 (2013).
- McKeague, M., Kruse, P. F., Patterson, M. K., et al. . Tissue Culture. , 395-397 (1973).
- McKeague, M., et al. The minimum aptamer publication standards (MAPS guidelines) for de novo aptamer selection. Aptamers. 6, 10-18 (2022).
- Schoofs, G., Van Hout, A., D'huys, T., Schols, D., Van Loy, T. A flow cytometry-based assay to identify compounds that disrupt binding of fluorescently-labeled CXC Chemokine ligand 12 to CXC Chemokine receptor 4. Journal of Visualized Experiments. (133), e57271 (2018).
- McKinnon, K. M. Flow cytometry: an overview. Current Protocols in Immunology. 120 (1), 1-11 (2018).
- Kamiloglu, S., Sari, G., Ozdal, T., Capanoglu, E. Guidelines for cell viability assays. Food Frontiers. 1 (3), 332-349 (2020).
- Ruscito, A., DeRosa, M. C. Small-molecule binding aptamers: Selection strategies, characterization, and applications. Frontiers in Chemistry. 4, 14 (2016).
- McKeague, M., et al. Comprehensive analytical comparison of strategies used for small molecule aptamer evaluation. Analytical Chemistry. 87 (17), 8608-8612 (2015).
- Henri, J., Bayat, N., Macdonald, J., Shigdar, S. A guide to using nucleic acid aptamers in cell based assays. Aptamers. 23, (2019).
- Mao, H., et al. The mechanism and regularity of quenching the effect of bases on fluorophores: the base-quenched probe method. Analyst. 143 (14), 3292-3301 (2018).
- McKeague, M., et al. Analysis of in vitro aptamer selection parameters. Journal of Molecular Evolution. 81 (5), 150-161 (2015).
- Chen, B., et al. Targeting negative surface charges of cancer cells by multifunctional nanoprobes. Theranostics. 6 (11), 1887 (2016).
- Shigdar, S., et al. RNA aptamers targeting cancer stem cell marker CD133. Cancer Letters. 330 (1), 84-95 (2013).
- Amraee, M., Oloomi, M., Yavari, A., Bouzari, S. DNA aptamer identification and characterization for E. coli O157 detection using cell based SELEX method. Analytical Biochemistry. 536, 36-44 (2017).
- Yu, X. -. X., et al. Selection and characterization of a novel DNA aptamer, Apt-07S specific to hepatocellular carcinoma cells. Drug Design, Development and Therapy. 14, 1535 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。