Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un ensayo de unión a proteínas de superficie celular basado en citometría de flujo para evaluar la selectividad y la especificidad de un aptámero anticanceroso
En este artículo
Resumen
Un paso necesario en el desarrollo de aptámeros anticancerosos es probar su unión al objetivo. Demostramos un ensayo basado en citometría de flujo para estudiar esta unión, enfatizando la importancia de incluir un aptámero de control negativo y células cancerosas que sean positivas o negativas para esa proteína en particular.
Resumen
Un desafío clave en el desarrollo de un aptámero anticanceroso es determinar eficientemente la selectividad y especificidad del aptámero desarrollado para la proteína diana. Debido a sus varias ventajas sobre los anticuerpos monoclonales, el desarrollo de aptámeros ha ganado una enorme popularidad entre los investigadores del cáncer. La evolución sistemática de ligandos por enriquecimiento exponencial (SELEX) es el método más común para desarrollar aptámeros específicos para proteínas de interés. Después de SELEX, un ensayo de unión rápido y eficiente acelera el proceso de identificación, confirmando la selectividad y especificidad del aptámero.
Este documento explica un ensayo de unión citométrico de flujo paso a paso de un aptámero específico para la molécula de adhesión celular epitelial (EpCAM). La glicoproteína transmembrana EpCAM se sobreexpresa en la mayoría de los carcinomas y desempeña un papel en el inicio, la progresión y la metástasis del cáncer. Por lo tanto, es un candidato valioso para la administración de fármacos dirigidos a los tumores. Para evaluar la selectividad y especificidad del aptámero a la EpCAM unida a la membrana, se requieren células positivas y negativas para EpCAM. Además, se requiere un aptámero EpCAM no vinculante con una longitud y estructura bidimensional (2D) similares al aptámero de unión a EpCAM. El ensayo de unión incluye diferentes tampones (tampón de bloqueo, tampón de lavado, tampón de incubación y tampón FACS) y pasos de incubación.
El aptámero se incuba con las líneas celulares. Después de los pasos de incubación y lavado, las células se evaluarán mediante un ensayo de citometría de flujo sensible. El análisis de los resultados muestra la unión del aptámero específico de EpCAM a las células positivas para EpCAM y no a las células negativas para EpCAM. En las células positivas para EpCAM, esto se representa como un cambio de banda en la unión del aptámero EpCAM a la derecha en comparación con el control del aptámero no vinculante. En las células negativas para EpCAM, las bandas correspondientes de aptámeros de unión y no unión a EpCAM se superponen. Esto demuestra la selectividad y especificidad del aptámero EpCAM. Si bien este protocolo se centra en el aptámero EpCAM, el protocolo es aplicable a otros aptámeros publicados.
Introducción
El cáncer sigue siendo una de las principales causas de mortalidad en todo el mundo1. A pesar de la mejora significativa en el tratamiento del cáncer en las últimas décadas, el desarrollo de medicamentos contra el cáncer sigue siendo un tema muy debatido. Esto se debe a que la quimioterapia, como pilar del tratamiento del cáncer, se acompaña de efectos secundarios graves que limitan el cumplimiento del tratamiento por parte del paciente. Además, la resistencia al tratamiento del cáncer inducida por la quimioterapia ha restringido su aplicación como la única opción de intervención médica. La aplicación de anticuerpos monoclonales (mAbs) introdujo una respuesta mejorada a los tratamientos contra el cáncer2. La razón del uso de mAbs fue mejorar la eficacia de los quimioterapéuticos y minimizar sus reacciones adversas. Sin embargo, la administración de mAbs también se convirtió en un desafío. Esto no solo se debió a las reacciones inmunológicas inducidas por mAb, sino también a los costosos costos de producción dependientes de los animales y a las difíciles condiciones de almacenamiento3. La introducción de aptámeros en la década de 19904 generó nuevas esperanzas en el tratamiento del cáncer, ya que la aplicación de aptámeros podría abordar los desafíos asociados con los mAbs.
Los aptámeros son secuencias cortas de ácidos nucleicos que se producen específicamente para un determinado objetivo. La evolución sistemática de ligandos por enriquecimiento exponencial (SELEX) es un método común en la producción de aptámeros. En SELEX, la proteína de interés se incuba con una biblioteca de secuencias aleatorias de nucleótidos, y a través de una serie de ciclos iterativos, se purifica el aptámero específico para esa proteína. Los aptámeros tienen una selectividad y especificidad objetivo similares a los mAbs, y por lo tanto el desarrollo de fármacos en este campo muestra aplicaciones futuras prometedoras. Los aptámeros específicos para biomarcadores de cáncer podrían aplicarse como fármacos individuales y herramientas de diagnóstico del cáncer 5,6,7. Debido a su estructura de tamaño nanométrico, estos aptámeros también podrían actuar como portadores de fármacos para administrar agentes citotóxicos específicamente al tumor8. Esto aumentaría la eficacia de la administración dirigida de fármacos y disminuiría las reacciones adversas asociadas a la quimioterapia y fuera del objetivo. Además, estos nanomedicamentos tienen una alta penetración tisular, lo que los convierte en un candidato deseable para la administración y el tratamiento de fármacos para tumores profundos. Los aptámeros también pueden diseñarse para dirigirse a los transportadores expresados en la barrera hematoencefálica (BBB) para mejorar la administración de fármacos a los tumores cerebrales9. Un buen ejemplo de tal aptámero son los aptámeros bifuncionales, dirigidos al receptor de transferrina (TfR)10 para mejorar la administración del fármaco a través de la barrera hematoencefálica, y la entrega de una carga útil de fármaco citotóxico a las células tumorales11.
A pesar de todas las ventajas de los aptámeros, el desarrollo de fármacos en este campo aún no ha producido un medicamento contra el cáncer comercializado y exitoso. Una razón para esto podría ser la falta de métodos estándar y reproducibles que puedan ser seguidos globalmente por los investigadores en el campo. En este artículo, se demuestra un protocolo paso a paso de un aptámero que se une a una proteína nativa expresada en la superficie celular. Este protocolo es un paso previo en la evaluación preclínica de los aptámeros anticancerosos. El ensayo se realiza para mostrar la selectividad y especificidad del aptámero purificado recogido de SELEX o una secuencia de aptámeros publicada para confirmar la selectividad y la especificidad. Este ensayo basado en citometría de flujo es un ensayo rápido, confiable y sensible que muestra con precisión la selectividad y especificidad del aptámero, donde el aptámero se está probando contra proteínas en la superficie celular12,13,14. Este método se demuestra utilizando la unión de un aptámero específico para EpCAM que se muestra en este documento15. La EpCAM, como glicoproteína transmembrana, desempeña un papel en la señalización, progresión, migración y metástasis de las células tumorales16,17. Para mostrar la selectividad y especificidad de este aptámero, se utilizaron células cancerosas EpCAM positivas y negativas. El aptámero específico de EpCAM previamente desarrollado, TEPP (5'-GC GCG GTAC CGC GC TA ACG GA GGTTGCG TCC GT-3′), y un aptámero de control negativo, TENN (5'-GC GCG TGCA CGC GC TA ACG GA TTCCTTT TCC GT-3), se utilizaron como aptámeros de unión a EpCAM y no vinculantes, respectivamente10. El extremo 3' de TEPP y TENN se etiquetó con un fluoróforo TYE665.
TEPP es un aptámero bifuncional que se dirige a EpCAM por un extremo y TfR por el otro. Esto ha hecho de TEPP un candidato adecuado para la administración de fármacos a los tumores cerebrales EpCAM+ . Usando su extremo específico de TfR, TEPP atraviesa la barrera hematoencefálica y, utilizando el extremo específico de EpCAM, encuentra el tumor y entrega su carga (por ejemplo, medicamentos citotóxicos) al tumor. TENN tiene una longitud y estructura 2D similares a TEPP, pero no tiene afinidad con la EpCAM o TfR, y por lo tanto es un aptámero de control negativo adecuado. Usando TEPP y TENN, la prueba de la unión de un aptámero a la proteína diana mediante citometría de flujo se muestra en este documento. Este protocolo se aplica al desarrollo de aptámeros específicos de células. También es aplicable a otros análisis complementarios y de confirmación de las secuencias de aptámeros disponibles en la literatura. El protocolo también puede ser utilizado por aquellos nuevos en el campo de los aptámeros que están buscando usar un aptámero previamente publicado para sus fines de investigación y desarrollo (R&D). En este trabajo, se estudian dos secuencias de aptámeros disponibles en la literatura.
Protocolo
NOTA: Antes de comenzar el experimento, use equipo de protección personal, incluyendo una bata de laboratorio, guantes y gafas. Consulte la Tabla de materiales para obtener detalles sobre materiales, reactivos, equipos y software utilizados en este protocolo.
1. Tampones necesarios para el ensayo
- Prepare los tampones necesarios para este experimento: el tampón SELEX requerido para el plegado del aptámero, el tampón de bloqueo (BB), el tampón de lavado (WB) y el tampón de unión (BiB) (Tabla 1), recién el día del experimento y manténgalos en hielo o a 4 °C.
NOTA: Cada aptámero requiere una condición de plegado única. Esto incluye el amortiguador SELEX y las condiciones de temperatura de plegado. Se debe tener cuidado de replicar completamente los métodos del artículo original que describe el aptámero10. En este experimento, todos los tampones se preparan en solución salina tamponada con fosfato (DPBS) de Dulbecco. El volumen de tampón requerido en cada experimento depende del número de líneas celulares, el número de réplicas y el número de concentraciones de aptámeros que se prueban.
| Ingredientes | Volumen requerido | ||
| Artículo | Concentración | ||
| Búfer SELEX | MgCl2 | 5 mM | 50 μL por muestra + 10% de error de pipeteo |
| Búfer de bloqueo | MgCl2 | 5 mM | 500 μL por línea celular |
| BSA a | 1 mg/ml | ||
| ARNt b | 0.1 mg/ml | ||
| FBS c | 10% (v/v) | ||
| Tampón de lavado | MgCl2 | 5 mM | 1 ml para el primer lavado + 100 μL por muestra problema + 10% de error de pipeteo |
| Búfer de enlace | MgCl2 | 5 mM | 50 μL por muestra + 10% de error de pipeteo |
| BSA | 2 mg/ml | ||
| ARNt | 0.2 mg/ml | ||
| FBS (en inglés) | 20% (v/v) | ||
Tabla 1: Buffers necesarios para el ensayo de enlace. un Albúmina sérica bovina, bÁcido ribonucleico de transferencia, cSuero bovino fetal.
2. Preparación de aptámeros
NOTA: Los aptámeros utilizados en el ensayo están marcados con una molécula reportera de fluorescencia y, por lo tanto, se debe tener cuidado para protegerlos de la luz.
- Antes del experimento, prepare un stock de 100 μM (stock A) de aptámeros de prueba y control utilizando agua ultrapura libre de pirógenos y RNasa (Figura 1).
NOTA: Para la conservación a largo plazo, las existencias A deben conservarse en un congelador a -20 °C. - Preparar la población B como concentración de trabajo de los aptámeros diluyendo la existencias A utilizando el amortiguador SELEX (Tabla 1). Para seguir este protocolo, diluya la población A a una población de 1.000 nM para preparar la población B (Figura 1).
- Para preparar el aptámero para la formación de la estructura tridimensional (3D), en un tubo de 250 μL, diluya la culata B con tampón SELEX para preparar el volumen y la concentración requeridos del aptámero para el plegado.
NOTA: Los aptámeros plegados estarán expuestos a un volumen igual de células. Por lo tanto, la concentración del aptámero que se establece para el plegado debe ser 2 veces más concentrada que la concentración final deseada. Utilice la ecuación (1) para calcular los volúmenes y concentraciones requeridos. Recuerde considerar un volumen adicional del 10% para el error de pipeteo.
Existencias de concentración A × Existencias de volumen A = Existencias de concentración B × Existencias de volumenB (1)
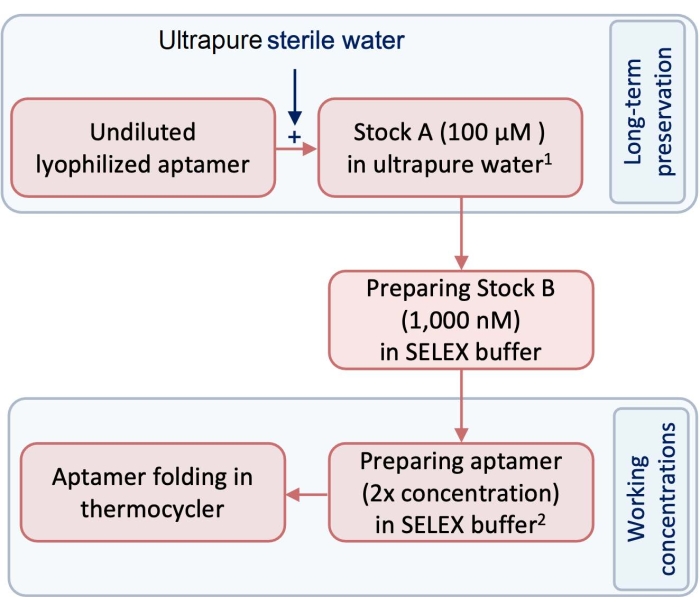
Figura 1: Un diagrama que muestra los pasos en la preparación de aptámeros. 1 El stock 1se almacena a -20 °C para su conservación a largo plazo. número arábigo Las concentraciones de trabajo se preparan en tampón SELEX y no se almacenan. Haga clic aquí para ver una versión más grande de esta figura.
3. Mantenimiento de las células cancerosas
NOTA: Antes de comenzar el estudio, asegúrese de que las células estén en sus números de paso temprano, muestren sus características morfológicas típicas y estén libres de micoplasma. Para probar la selectividad y especificidad del aptámero, idealmente se requieren líneas celulares que sean expresores altos, moderados y bajos/negativos de la proteína de interés.
- Sembrar las células en un matraz de cultivo T75, utilizando las condiciones de cultivo adecuadas. Cultivarlos en una incubadora humidificada al 5% deCO2 , a 37 °C.
NOTA: En este estudio, se utilizó el Medio de Águila Modificada (DMEM) de Dulbecco suplementado con 10% de suero bovino fetal (medio completo). - Cuando las células alcancen ~80% de confluencia, pasarlas a un nuevo matraz que contenga medio fresco completo.
NOTA: Dependiendo de la proteína de interés y la línea celular, la confluencia del 80% podría proporcionar una población celular adecuada para el ensayo de unión. Para las líneas celulares en este experimento, MDA-MB-231 y HEK 293T, la confluencia del 80% es adecuada. En esta etapa, continúe con la sección 4, el ensayo vinculante. Compruebe siempre la expresión de la proteína de interés, utilizando mAbs específicos para esa proteína.
4. Ensayo de unión
NOTA: La Figura 2 resume los pasos requeridos en el ensayo de unión en células adherentes.
- En un armario de bioseguridad de clase II, recoger las células de cada matraz en tubos de la siguiente manera:
- Recoja y deseche el medio en el matraz, agregue 2 ml de PBS, extiéndalo sobre las células y luego recoja y deseche el PBS. Repita este paso dos veces más para eliminar todos los restos de medios que puedan desactivar la tripsina. Añadir 1 ml de tripsina/EDTA al 0,25% a cada matraz e incubar durante 5-10 min a 37 oC. Visualizar el desprendimiento de células bajo un microscopio.
- Agregue 1 ml de medio completo a las células y pipetear las células hacia arriba y hacia abajo para hacer una suspensión de una sola célula. Pipetear las células en un tubo apropiado y centrifugar a 200 × g durante 5 min.
NOTA: Para las células no adherentes, recoger las células en un tubo, centrifugar (200 × g, 5 min) y continuar con el paso 4.1.3. - Deseche el sobrenadante y resuspenda las células en 1 ml de medio fresco. Contar las células usando tinción de azul de tripano, diluyendo un cierto volumen de suspensión celular con azul de tripano. Distribuya ~15 μL de la mezcla entre un hemocitómetro y un vaso de cobertura. Cuente las celdas como se describió anteriormente18, usando la ecuación (2):
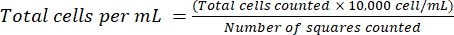 (2)
(2)
NOTA: Utilice el volumen mínimo posible de suspensión celular y tome nota del factor de dilución. Por ejemplo, mezclando volúmenes iguales de suspensión celular y azul de tripano al 0,04% da un factor de dilución de 2. Asegurar una alta viabilidad (células vivas/células totales × 100) de ~90% para la mayoría de las líneas celulares adherentes antes de proceder. Las células muertas absorben aptámeros de forma no específica y alteran los resultados19. Es posible utilizar otras técnicas de conteo de células, como el uso de un contador de celdas. - Recoja el número requerido de células, asegurándose de tener 10 × 104 células por muestra de prueba. Considere un volumen adicional del 10% para el error de pipeteo.
NOTA: Es importante mantener siempre el mismo recuento de células entre experimentos y réplicas. - Incubar las células a 37 °C durante 2 h para permitir la estabilización de la proteína de interés en la membrana celular después del desprendimiento enzimático.
NOTA: Este período de incubación puede diferir según la proteína de interés.
- Durante esta incubación de 2 h:
- Ajuste la temperatura de la centrífuga a 4 °C. Deje que el ARNt y las existencias de aptámero a temperatura ambiente o en hielo se descongelen. Para proteger la molécula reportera de fluorescencia, proteja los tubos aptámeros de la luz.
NOTA: El papel del ARNt es bloquear los sitios de unión de ácidos nucleicos. - Preparar el tampón SELEX, BB, WB y BiB (ver sección 1), manteniéndolos todos en hielo o a 4 °C. Ponga la máquina termocicladora en un ciclo vacío. Coloque una placa negra de 96 pocillos y tubos de citometría de flujo sobre hielo.
NOTA: Configurar el termociclador en un ciclo vacío prepara el sistema de refrigeración y calefacción y ayuda a generar resultados más reproducibles.
- Ajuste la temperatura de la centrífuga a 4 °C. Deje que el ARNt y las existencias de aptámero a temperatura ambiente o en hielo se descongelen. Para proteger la molécula reportera de fluorescencia, proteja los tubos aptámeros de la luz.
- Después de la incubación de 2 h, centrifugar las células a 500 × g durante 5 min. Desechar el sobrenadante y resuspender las células en 500 μL de BB. Incubar las células a 4 °C durante 30 min con mezcla intermitente.
- Durante esta incubación de 30 minutos, realice el plegado del aptámero de la siguiente manera:
- Enrasar las concentraciones 2x de aptámeros (ver sección 2) y, a continuación, mezclar e incubar los aptámeros en la máquina termocicladora, de acuerdo con las condiciones de plegado requeridas. Para este aptámero EpCAM, utilice las siguientes condiciones de plegado de 95 °C, 5 min, seguido de 22 °C, 10 min, y 37 °C, 15 min.
NOTA: Incluya siempre un control negativo (es decir, búfer SELEX sin aptámeros).
- Enrasar las concentraciones 2x de aptámeros (ver sección 2) y, a continuación, mezclar e incubar los aptámeros en la máquina termocicladora, de acuerdo con las condiciones de plegado requeridas. Para este aptámero EpCAM, utilice las siguientes condiciones de plegado de 95 °C, 5 min, seguido de 22 °C, 10 min, y 37 °C, 15 min.
- Después de la incubación de 30 minutos, centrifugar las células (500 × g, 5 min, 4 °C), retirar el sobrenadante, añadir 1 ml de WB y centrifugar las células de nuevo (500 × g, 5 min, 4 °C). Retire el sobrenadante y resuspenda las células en un volumen adecuado del BiB.
- Pipetear 50 μL de las células resuspendidas en cada pocillo de una placa negra helada de 96 pocillos. Mantenga las células en hielo para inhibir la internalización de la proteína de interés.
- Pipetear 50 μL de los aptámeros sobre un volumen de 50 μL de células, mezclar e incubar en la oscuridad a 4 °C durante 30 min. Centrifugar la placa a 500 × g, 5 min, 4 °C y retirar con cuidado el sobrenadante.
- Resuspender cuidadosamente el pellet en WB y centrifugar a 500 × g durante 5 min. Repetir el paso de lavado (4.7) 2x y resuspender en 100 μL de WB para el análisis citométrico de flujo.
NOTA: Consulte la Figura 3 para obtener un diagrama de interacciones entre aptámeros y células.

Figura 2: Un diagrama que representa los pasos para realizar un ensayo de unión a proteína aptámero. Abreviaturas: SELEX = Evolución sistemática de ligandos por enriquecimiento exponencial; BB = búfer de bloqueo; WB = Tampón de lavado; BiB = búfer de enlace. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Un diagrama que muestra los diferentes tipos de células y aptámeros necesarios para realizar el ensayo de unión de aptámeros. Abreviatura: EpCAM = molécula de adhesión celular epitelial. Esta figura se creó utilizando Biorender.com. Haga clic aquí para ver una versión más grande de esta figura.
5. Citometría de flujo y análisis de datos
NOTA: Antes de encender el citómetro de flujo, asegúrese de que no haya "burbujas" en las unidades de filtro de membrana para la solución de cierre, la solución de limpieza y el líquido de la vaina (0.9% de NaCl). "Sangrar" burbujas si hay burbujas en las cápsulas. Asegúrese de que el contenedor de desechos esté vacío y que los recipientes de líquido de vaina, agua y lejía al 1% en agua ultrapura estén llenos.
- Encienda el citómetro de flujo y luego la computadora.
NOTA: Los detalles del funcionamiento del citómetro de flujo explicados aquí son específicos de la máquina y el software que se muestran en el video (consulte la Tabla de materiales). Otro software requeriría una capacitación adecuada para su uso. - Abra el software de análisis de citometría de flujo, inicie sesión en el programa y, en la pestaña Citómetro , ejecute Fluidics Start up.
- Para crear un nuevo experimento, en la pestaña experimento, haga clic en Nueva carpeta y asigne al nombre apropiado la carpeta/experimento.
- Haga clic en la nueva carpeta para resaltar, luego, en la pestaña experimento nuevamente, haga clic en Nuevo experimento y asigne el nombre apropiado al experimento.
- Para agregar la primera muestra/muestra, en la pestaña experimento, haga clic en Nueva muestra y asígnele el nombre apropiado a esta muestra (nombre de la línea celular/muestra de control/muestra del experimento).
- Para agregar una muestra de tubo, resalte la muestra (grupo) y, en la pestaña experimento, haga clic en Nuevo tubo. Agregue el número apropiado de tubos y el nombre.
- Para preparar los gráficos necesarios, en la pestaña hoja de cálculo , abra una nueva hoja de cálculo. Una vez que aparezca la nueva ventana de la hoja de trabajo, abra lo siguiente usando la pantalla de la hoja de trabajo (pase el mouse sobre el logotipo / imágenes para encontrar los nombres):
- Prepare un gráfico de puntos borrado de dispersión directa (FSC) frente a dispersión lateral (SCC) para seleccionar la población de interés. Defina la primera puerta identificando y seleccionando la población de interés (P1) en un gráfico de densidad de dispersión hacia adelante y hacia los lados. Excluir los desechos, que constituyen la población con la señal de dispersión directa más baja.
NOTA: El parámetro FSC detecta celdas o eventos en función de su tamaño y el SCC los discrimina en función de su granularidad20. - Prepare un gráfico de puntos de área FSC (FSC-A) versus altura FSC (FSC-H) para seleccionar la población de una sola célula. Defina la segunda puerta excluyendo las poblaciones de células dobles, ya que las células dobletes afectan considerablemente los resultados y las conclusiones. Excluya dobletes mediante el uso de gráficos de densidad FSC-H versus FSC-A, donde las celdas del mismo tamaño muestran un área y altura similares. Por lo tanto, los singletes se agrupan diagonalmente y se separan de los dobletes.
NOTA: FSC es aproximadamente proporcional al tamaño de la celda. Los pulsos de voltaje se definen como FSC-H, la intensidad de la señal, el ancho FSC que refleja el tamaño de la celda y la duración de la señal, y FSC-A, que es H × W. Los dobletes tienen un doble ancho y valor de área; por lo tanto, la activación para singletes se basa en detectar desproporciones entre H, W y A causadas por dobletes. - Prepare un histograma del número de eventos contra el fluoróforo de interés.
- Prepare un gráfico de puntos borrado de dispersión directa (FSC) frente a dispersión lateral (SCC) para seleccionar la población de interés. Defina la primera puerta identificando y seleccionando la población de interés (P1) en un gráfico de densidad de dispersión hacia adelante y hacia los lados. Excluir los desechos, que constituyen la población con la señal de dispersión directa más baja.
- Antes de comenzar la citometría de flujo, asegúrese de que el panel de adquisición para controlar la adquisición de muestras, el inspector y el citómetro para ajustar los parámetros de voltaje, así como la hoja de trabajo con todos los gráficos estén abiertos.
NOTA: Para realizar el análisis se necesitan al menos 100 μL de una suspensión de 10 × 104 células en un tubo de citometría de flujo. Especialmente en caso de menores viabilidades, se puede realizar tinción con yoduro de propidio para seleccionar la población celular viable21,22. - Para ejecutar la primera muestra, en el lado izquierdo de la pantalla, asegúrese de que la flecha que apunta al tubo sea verde. Si esta flecha no es verde, haga clic en la flecha para que sea verde.
- Con una pipeta, transfiera cada muestra de la placa negra de 96 pocillos a un tubo de citometría de flujo. Ejecute la muestra de control sin tratar y sin teñir a baja velocidad.
- En el panel de adquisiciones, elija un número adecuado de eventos para registrar (30.000), cambie el caudal a bajo y haga clic en Adquirir datos.
- Ajuste el voltaje para los parámetros FSC y SCC. Asegúrese de que la población celular esté centralizada dentro del diagrama de puntos y que ninguna celda toque ninguno de los ejes del gráfico para evitar perder las celdas de interés.
- Aumentar la velocidad de adquisición a media o alta para analizar las muestras más rápido pero no superar más de 200 eventos/s. A continuación, haga clic en Grabar datos.
- Realice la compuerta para P1 (Figura 4A) y la población unicelular (Figura 4B). Construya el histograma de eventos contra el fluorocromo utilizado y seleccione P1 basado en los datos (aloficocianina [APC] en este caso) (Figura 4C).
- Después de ajustar el voltaje, la activación y el registro de los datos, saque la muestra y haga clic en Next Tube (Siguiente tubo).
- Inserte la siguiente muestra y repita los datos de registro para todas las muestras de control y prueba (Figura 3).
- Una vez que se hayan recopilado todos los datos, lave el citómetro de flujo haciendo correr tres tubos de lejía al 50%, enjuague FACS y agua ultrapura, cada uno durante 5 minutos a un alto caudal.
- Luego, en el menú desplegable Citómetro , haga clic en Apagar fluidos.
- Antes de cerrar el software y apagar la máquina y la computadora, exporte los resultados como archivos .fcs a una unidad USB para transferirlos y analizarlos, de la siguiente manera:
- En el software de análisis, presione el botón NUEVO para crear un nuevo documento y una ventana para manejar el análisis. Arrastre los archivos de ejemplo a la nueva ventana.
- Haga doble clic para abrir la muestra sin teñir. Elija la población P1, haga doble clic en la población P1 para crear un gráfico FSC-H frente a FSC-A y abra la puerta de la población de una sola célula.
- Haga doble clic en las celdas individuales cerradas para crear un histograma de eventos contra el fluorocromo utilizado.
- En la ventana original, seleccione P1 y celdas individuales y arrástrelas a Todas las muestras para que todas las muestras ahora contengan el mismo gating.
- Haga clic en el botón Editor de diseño para abrir la ventana Diseños . Arrastre dos muestras (control y prueba) una sobre la otra para crear un histograma de superposición.
Resultados
Un aspecto importante del descubrimiento y desarrollo de nuevos fármacos es asegurar la selectividad y especificidad del candidato a fármaco. Esto significa que el candidato a fármaco debe ser capaz de discriminar entre diferentes células y sólo afectar a la población celular de interés (selectividad). La selectividad se estudia utilizando líneas celulares que difieren en términos de expresión de la proteína de interés. En este estudio, las líneas celulares MDA-MB-231 y HEK 293T fueron elegidas como células...
Discusión
El desafío clave con el desarrollo de nuevos aptámeros es la falta de directrices estándar que se aplican a los diferentes pasos de este proceso. McKeague et al. han demostrado recientemente algunos de los desafíos asociados, que conducen a presentaciones poco claras de los datos en las publicaciones y al fracaso de replicar la investigación. Propusieron directrices fundamentales necesarias para su consideración en la caracterización de aptámeros19. Un ensayo de unión de aptámeros es un ...
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Los autores reconocen la financiación de SEED del Instituto de Salud Mental y Física y Traducción Clínica (IMPACT), el programa "Alfred Deakin Postdoctoral Research Fellowship" en la Universidad de Deakin y la "Beca del Programa de Capacitación en Investigación del Gobierno de Australia".
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tubes with attached lid | Sigma-Aldrich | T6649 | |
| 15 mL CellStar blue screw cap, conical bottom tube | Greiner Bio One | 188271 | |
| 5 mL serological pipettes | Greiner Bio One | 606180 | |
| BD FACSCanto II Flow Becton Dickinson Cytometer | Becton Dickinson | N/A | |
| BD FACSDiva V9.0 | BD Biosciences | N/A | |
| Bovine Serum Albumin (BSA), Lyophilized powder | Sigma-AldrichTM | A7906-50G | |
| Bright-line Hemocytometer | Sigma-Aldrich | Z359629 | |
| Dulbecco’s Modified Eagle Medium (DMEM) High Glucose Media Powder | Life Technologies | 12100046 | |
| Dulbecco’s Phosphate- Buffered Saline (DPBS) | Life Technologies | 21300025 | |
| FlowJo, LLC 10.8.1 | BD Biosciences | N/A | |
| Foetal Bovine Serum (FBS) | Bovogen | SFBS-F | |
| HEK293T | American Type Culture Collection | ACS-4500 | |
| Heracell 150i CO2 Incubator | Thermo Fisher Scientific | N/A | |
| Heraeus Megafuge 16R Centrifuge | Thermo Fisher Scientific | N/A | |
| Magnesium Chloride (MgCl2) | Sigma-Aldrich | M8266 | |
| MDA-MB-231 | American Type Culture Collection | CRM-HTB-26 | |
| Microplate, PS, 96 well, F-bottom (Chimney well), Black | Greiner Bio One | 655076 | |
| MiniAmp Thermal Cycler | Thermo Fisher Scientific | A37834 | |
| Phosphate-Buffered Saline (PBS) tablets | Life Technologies | 18912014 | |
| Pyrogen- and RNase-free ultrapure water | Milli-Q | ||
| T75 Cell Culture flask | Cellstar | 658170 | |
| TENN | Integrated DNA Technologies | N/A | 5′-GC GCG TGCA CGC GC TA ACG GA TTCCTTT TCC GT-3 |
| TEPP | Integrated DNA Technologies | N/A | 5′-GC GCG GTAC CGC GC TA ACG GA GGTTGCG TCC GT-3′ |
| Transfer RNA (tRNA) | Sigma-Aldrich | R8508-5X1ML | |
| Trypan Blue Solution | Life Technologies | 15250061 | |
| Trypsin-EDTA | Gibco | 15400054 |
Referencias
- Cancer. World Health Organization Available from: https://www.who.int/news-room/fact-sheets/detail/cancer#:~:text=Cancer%20is%20a%20leading%20cause.and%20rectum%20and%20prostate%20cancers (2022)
- Liu, J. K. H. The history of monoclonal antibody development - Progress, remaining challenges and future innovations. Annals of Medicine and Surgery. 3 (4), 113-116 (2014).
- Nakhjavani, M., Shigdar, S. Future of PD-1/PD-L1 axis modulation for the treatment of triple-negative breast cancer. Pharmacological Research. 175, 106019 (2022).
- Bukari, B., Samarasinghe, R. M., Noibanchong, J., Shigdar, S. L. Non-invasive delivery of therapeutics into the brain: the potential of aptamers for targeted delivery. Biomedicines. 8 (5), 120 (2020).
- Wu, X., Chen, J., Wu, M., Zhao, J. X. Aptamers: active targeting ligands for cancer diagnosis and therapy. Theranostics. 5 (4), 322 (2015).
- Feng, X., et al. The aptamer functionalized nanocomposite used for prostate cancer diagnosis and therapy. Journal of Nanomaterials. 2022, (2022).
- Huang, J., et al. Advances in aptamer-based biomarker discovery. Frontiers in Cell and Developmental Biology. 9, 571 (2021).
- Ashrafuzzaman, M. Aptamers as both drugs and drug-carriers. BioMed Research International. 2014, (2014).
- Nakhjavani, M., Samarasinghe, R. M., Shigdar, S. Triple-negative breast cancer brain metastasis: an update on druggable targets, current clinical trials, and future treatment options. Drug Discovery Today. , (2022).
- Macdonald, J., et al. Development of a bifunctional aptamer targeting the transferrin receptor and epithelial cell adhesion molecule (EpCAM) for the treatment of brain cancer metastases. ACS Chemical Neuroscience. 8 (4), 777-784 (2017).
- Macdonald, J., et al. Bifunctional aptamer-doxorubicin conjugate crosses the blood-brain barrier and selectively delivers its payload to EpCAM-positive tumor cells. Nucleic Acid Therapeutics. 30 (2), 117-128 (2020).
- Shigdar, S., Agnello, L., Fedele, M., Camorani, S., Cerchia, L. Profiling cancer cells by cell-SELEX: use of aptamers for discovery of actionable biomarkers and therapeutic applications thereof. Pharmaceutics. 14 (1), 28 (2021).
- Rahimizadeh, K., et al. Development of cell-specific aptamers: recent advances and insight into the selection procedures. Molecules. 22 (12), 2070 (2017).
- Chen, M., et al. Development of cell-SELEX technology and its application in cancer diagnosis and therapy. International Journal of Molecular Sciences. 17 (12), 2079 (2016).
- Shigdar, S., et al. The use of sensitive chemical antibodies for diagnosis: detection of low levels of EpCAM in breast cancer. PLoS One. 8 (2), 57613 (2013).
- Ni, J., et al. Role of the EpCAM (CD326) in prostate cancer metastasis and progression. Cancer and Metastasis Reviews. 31 (3), 779-791 (2012).
- Ni, J., et al. Epithelial cell adhesion molecule (EpCAM) is associated with prostate cancer metastasis and chemo/radioresistance via the PI3K/Akt/mTOR signaling pathway. The International Journal of Biochemistry & Cell Biology. 45 (12), 2736-2748 (2013).
- McKeague, M., Kruse, P. F., Patterson, M. K., et al. . Tissue Culture. , 395-397 (1973).
- McKeague, M., et al. The minimum aptamer publication standards (MAPS guidelines) for de novo aptamer selection. Aptamers. 6, 10-18 (2022).
- Schoofs, G., Van Hout, A., D'huys, T., Schols, D., Van Loy, T. A flow cytometry-based assay to identify compounds that disrupt binding of fluorescently-labeled CXC Chemokine ligand 12 to CXC Chemokine receptor 4. Journal of Visualized Experiments. (133), e57271 (2018).
- McKinnon, K. M. Flow cytometry: an overview. Current Protocols in Immunology. 120 (1), 1-11 (2018).
- Kamiloglu, S., Sari, G., Ozdal, T., Capanoglu, E. Guidelines for cell viability assays. Food Frontiers. 1 (3), 332-349 (2020).
- Ruscito, A., DeRosa, M. C. Small-molecule binding aptamers: Selection strategies, characterization, and applications. Frontiers in Chemistry. 4, 14 (2016).
- McKeague, M., et al. Comprehensive analytical comparison of strategies used for small molecule aptamer evaluation. Analytical Chemistry. 87 (17), 8608-8612 (2015).
- Henri, J., Bayat, N., Macdonald, J., Shigdar, S. A guide to using nucleic acid aptamers in cell based assays. Aptamers. 23, (2019).
- Mao, H., et al. The mechanism and regularity of quenching the effect of bases on fluorophores: the base-quenched probe method. Analyst. 143 (14), 3292-3301 (2018).
- McKeague, M., et al. Analysis of in vitro aptamer selection parameters. Journal of Molecular Evolution. 81 (5), 150-161 (2015).
- Chen, B., et al. Targeting negative surface charges of cancer cells by multifunctional nanoprobes. Theranostics. 6 (11), 1887 (2016).
- Shigdar, S., et al. RNA aptamers targeting cancer stem cell marker CD133. Cancer Letters. 330 (1), 84-95 (2013).
- Amraee, M., Oloomi, M., Yavari, A., Bouzari, S. DNA aptamer identification and characterization for E. coli O157 detection using cell based SELEX method. Analytical Biochemistry. 536, 36-44 (2017).
- Yu, X. -. X., et al. Selection and characterization of a novel DNA aptamer, Apt-07S specific to hepatocellular carcinoma cells. Drug Design, Development and Therapy. 14, 1535 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados