Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Анализ связывания белка клеточной поверхности на поверхности проточной цитометрии для оценки селективности и специфичности противоопухолевого аптамера
В этой статье
Резюме
Необходимым шагом в разработке противоопухолевого аптамера является проверка его связывания с мишенью. Мы демонстрируем анализ на основе проточной цитометрии для изучения этого связывания, подчеркивая важность включения отрицательного контрольного аптамера и раковых клеток, которые являются положительными или отрицательными для этого конкретного белка.
Аннотация
Ключевой задачей при разработке противоопухолевого аптамера является эффективное определение селективности и специфичности разработанного аптамера к белку-мишени. Благодаря своим преимуществам перед моноклональными антителами, разработка аптамера приобрела огромную популярность среди исследователей рака. Систематическая эволюция лигандов путем экспоненциального обогащения (SELEX) является наиболее распространенным методом разработки аптамеров, специфичных для интересующих белков. Следуя SELEX, быстрый и эффективный связывающий анализ ускоряет процесс идентификации, подтверждая селективность и специфичность аптамера.
В этой статье объясняется пошаговый проточный цитометрический анализ связывания аптамера, специфичного для молекулы клеточной адгезии эпителия (EpCAM). Трансмембранный гликопротеин EpCAM чрезмерно экспрессируется в большинстве карцином и играет роль в инициации, прогрессировании и метастазировании рака. Поэтому он является ценным кандидатом для адресной доставки лекарств к опухолям. Для оценки селективности и специфичности аптамера к мембранно-связанному EpCAM требуются EpCAM-положительные и -отрицательные клетки. Кроме того, требуется несвязывающий аптамер EpCAM с аналогичной длиной и 2-мерной (2D) структурой, что и EpCAM-связывающий аптамер. Анализ связывания включает в себя различные буферы (блокирующий буфер, буфер промывки, буфер инкубации и буфер FACS) и этапы инкубации.
Аптамер инкубируется с клеточными линиями. После этапов инкубации и промывки клетки будут оценены с использованием чувствительного анализа проточной цитометрии. Анализ результатов показывает связывание EpCAM-специфического аптамера с EpCAM-положительными клетками, а не с EpCAM-отрицательными клетками. В EpCAM-положительных клетках это изображается как сдвиг полосы в связывании аптамера EpCAM вправо по сравнению с несвязывающим контролем аптамера. В EpCAM-отрицательных клетках соответствующие полосы EpCAM-связывающих и -несвязывающих аптамеров перекрываются. Это демонстрирует избирательность и специфичность аптамера EpCAM. Хотя этот протокол ориентирован на аптамер EpCAM, протокол применим к другим опубликованным аптамерам.
Введение
Рак по-прежнему является одной из ведущих причин смертности во всем мире1. Несмотря на значительное улучшение лечения рака в последние десятилетия, разработка противоопухолевых препаратов по-прежнему является весьма обсуждаемой темой. Это связано с тем, что химиотерапия, как основа лечения рака, сопровождается серьезными побочными эффектами, которые ограничивают соблюдение пациентом лечения. Кроме того, вызванная химиотерапией устойчивость рака к лечению ограничила его применение в качестве единственного выбора медицинского вмешательства. Применение моноклональных антител (mAbs) вводило усиленный ответ на лечение рака2. Обоснование применения mAbs заключалось в повышении эффективности химиотерапевтических средств и минимизации их побочных реакций. Тем не менее, администрирование mAbs также стало проблемой. Это произошло не только из-за иммунологических реакций, вызванных mAb, но и из-за зависящих от животных и дорогостоящих производственных затрат и сложных условий хранения3. Внедрение аптамеров в 1990-х годах4 породило новые надежды в лечении рака, поскольку применение аптамеров может решить проблемы, связанные с mAbs.
Аптамеры представляют собой короткие последовательности нуклеиновых кислот, которые специально производятся для определенной мишени. Систематическая эволюция лигандов путем экспоненциального обогащения (SELEX) является распространенным методом в производстве аптамеров. В SELEX интересующий белок инкубируется с библиотекой случайных нуклеотидных последовательностей, и через серию итеративных циклов аптамер, специфичный для этого белка, очищается. Аптамеры имеют аналогичную селективность и специфичность мишеней с mAbs, и поэтому разработка лекарств в этой области показывает многообещающие будущие применения. Аптамеры, специфичные для биомаркеров рака, могут применяться как отдельные препараты и инструменты диагностики рака 5,6,7. Из-за их наноразмерной структуры эти аптамеры могут также выступать в качестве носителей лекарств для доставки цитотоксических агентов конкретно к опухоли8. Это повысит эффективность целевой доставки лекарств и уменьшит связанные с химиотерапией побочные реакции. Кроме того, эти нанолекарства обладают высоким проникновением в ткани, что делает их желательным кандидатом для доставки и лечения препаратов с глубокой опухолью. Аптамеры также могут быть разработаны для нацеливания на транспортеры, экспрессируемые на гематоэнцефалическом барьере (ГЭБ), для улучшения доставки лекарств к опухолям головного мозга9. Хорошим примером такого аптамера являются бифункциональные аптамеры, нацеленные на рецептор трансферрина (TfR)10 для улучшения доставки лекарств через ГЭБ и доставляющие полезную нагрузку цитотоксического препарата к опухолевым клеткам11.
Несмотря на все преимущества аптамеров, разработка лекарств в этой области еще не дала продаваемого, успешного противоопухолевого препарата. Одной из причин этого может быть отсутствие стандартных и воспроизводимых методов, которым могли бы следовать исследователи в этой области во всем мире. В этой статье продемонстрирован пошаговый протокол связывания аптамера с нативным белком, экспрессируемым на поверхности клетки. Этот протокол является обязательным этапом доклинической оценки противоопухолевых аптамеров. Анализ проводится, чтобы показать селективность и специфичность очищенного аптамера, собранного из SELEX или опубликованной последовательности аптамеров для подтверждения селективности и специфичности. Этот проточный цитометрический анализ представляет собой быстрый, надежный, чувствительный анализ, который точно показывает селективность и специфичность аптамера, где аптамер тестируется против белков на поверхности клетки 12,13,14. Этот метод продемонстрирован с использованием связывания аптамера, специфичного для EpCAM, показанного в настоящем документе15. EpCAM, как трансмембранный гликопротеин, играет роль в передаче сигналов опухолевых клеток, прогрессировании, миграции и метастазировании16,17. Чтобы показать селективность и специфичность этого аптамера, использовались EpCAM-положительные и -отрицательные раковые клетки. Ранее разработанный специфический аптамер EpCAM, TEPP (5'-GC GCG GTAC CGC GC TA ACG GA GGTTGCG TCC GT-3'), и отрицательный контрольный аптамер, TENN (5'-GC GCG TGCA CGC GC TA ACG GA TTCCTTT TCC GT-3), были использованы в качестве EpCAM-связывающих и -несвязывающих аптамеров, соответственно10. 3'-дюймовый конец TEPP и TENN были помечены флуорофором TYE665.
TEPP - это бифункциональный аптамер, который нацелен на EpCAM с одного конца и TfR на другом. Это сделало TEPP подходящим кандидатом для доставки лекарств к опухолям головного мозга EpCAM+ . Используя свой TfR-специфический конец, TEPP пересекает гематоэнцефалический барьер и, используя EpCAM-специфический конец, находит опухоль и доставляет ее груз (например, цитотоксические препараты) к опухоли. TENN имеет такую же длину и 2D-структуру, как TEPP, но он не имеет сродства к EpCAM или TfR и, следовательно, является подходящим отрицательным управляющим аптамером. Используя TEPP и TENN, тестирование связывания аптамера с целевым белком с помощью проточной цитометрии показано в этой статье. Этот протокол применяется к разработке клеточных аптамеров. Он также применим к дальнейшим дополнительным и подтверждающим анализам последовательностей аптамеров, имеющихся в литературе. Протокол также может быть использован новичками в области аптамеров, которые рассматривают возможность использования ранее опубликованного аптамера для своих целей исследований и разработок (НИОКР). В данной работе исследуются две аптамерные последовательности, имеющиеся в литературе.
протокол
ПРИМЕЧАНИЕ: Перед началом эксперимента наденьте средства индивидуальной защиты, включая лабораторный халат, перчатки и очки. Смотрите Таблицу материалов для получения подробной информации о материалах, реагентах, оборудовании и программном обеспечении, используемых в этом протоколе.
1. Буферы, необходимые для анализа
- Подготовьте буферы, необходимые для этого эксперимента — буфер SELEX, необходимый для складывания аптамера, блокирующий буфер (BB), буфер промывки (WB) и буфер связывания (BiB) (таблица 1) — в день эксперимента и держите их на льду или при температуре 4 °C.
ПРИМЕЧАНИЕ: Каждый аптамер требует уникального условия складывания. Это включает в себя буфер SELEX и температурные режимы складывания. Следует позаботиться о том, чтобы полностью воспроизвести методы из оригинальной статьи, описывающей аптамер10. В этом эксперименте все буферы получают в фосфатно-буферном физиологическом растворе Dulbecco (DPBS). Объем буфера, необходимый в каждом эксперименте, зависит от количества клеточных линий, количества реплик и количества тестируемых концентраций аптамеров.
| Ингредиенты | Требуемый объем | ||
| Пункт | Концентрация | ||
| Буфер SELEX | МгКл2 | 5 мМ | 50 мкл на образец + 10% погрешность дозирования |
| Блокировка буфера | МгКл2 | 5 мМ | 500 мкл на клеточную линию |
| БСА а | 1 мг/мл | ||
| тРНК b | 0,1 мг/мл | ||
| ФБС c | 10% (об/об) | ||
| Буфер для стирки | МгКл2 | 5 мМ | 1 мл для первой промывки + 100 мкл на испытуемый образец + 10% погрешность дозирования |
| Буфер привязки | МгКл2 | 5 мМ | 50 мкл на образец + 10% погрешность дозирования |
| БСА | 2 мг/мл | ||
| тРНК | 0,2 мг/мл | ||
| ФБС | 20% (об/об) | ||
Таблица 1: Буферы, необходимые для анализа привязки. a Бычий сывороточный альбумин, bТрансфер рибонуклеиновая кислота, cФетальная бычья сыворотка.
2. Приготовление аптамеров
ПРИМЕЧАНИЕ: Аптамеры, используемые в анализе, помечены молекулой-репортером флуоресценции, и поэтому следует позаботиться о том, чтобы защитить их от света.
- Перед началом эксперимента подготовьте запас 100 мкМ (запас А) тестовых и контрольных аптамеров с использованием сверхчистой воды, не содержащей пирогенов и РНКаз (рисунок 1).
ПРИМЕЧАНИЕ: Для длительного хранения запас А следует хранить в морозильной камере при -20 °C. - Подготавливают запас В в качестве рабочей концентрации аптамеров путем разбавления запаса А с использованием буфера SELEX (таблица 1). Чтобы следовать этому протоколу, разбавьте запас А до 1 000 нМ запасов для подготовки запаса В (рисунок 1).
- Чтобы сделать аптамер готовым к образованию 3-мерной (3D) структуры, в трубке объемом 250 мкл разбавляют запас B буфером SELEX для подготовки необходимого объема и концентрации аптамера для складывания.
ПРИМЕЧАНИЕ: Сложенные аптамеры будут подвергаться воздействию равного объема клеток. Поэтому концентрация аптамера, которая устанавливается для складывания, должна быть в 2 раза более концентрированной, чем желаемая конечная концентрация. Используйте уравнение (1) для расчета требуемых объемов и концентраций. Не забудьте рассмотреть дополнительный объем 10% для ошибки пипетирования.
Концентрационный запас A ×Объемный запас A = Концентрационныйзапас B ×Объемный запас B (1)
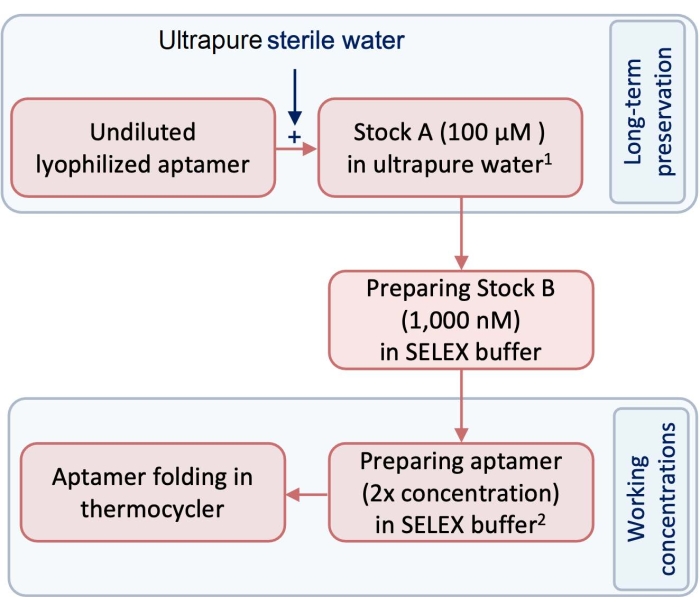
Рисунок 1: Диаграмма, показывающая этапы приготовления аптамеров. 1Запас 1 хранят при -20 °C для длительного сохранения. 2 См. Рабочие концентрации готовятся в буфере SELEX и не хранятся. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Поддержание раковых клеток
ПРИМЕЧАНИЕ: Перед началом исследования убедитесь, что клетки находятся на ранних стадиях, показывают свои типичные морфологические особенности и свободны от микоплазм. Чтобы проверить селективность и специфичность аптамера, в идеале требуются клеточные линии, которые являются высокими, умеренными и низкими / отрицательными экспрессорами интересующего белка.
- Засевайте клетки в колбу для культивирования Т75, используя соответствующие условия культивирования. Выращивайте их в 5% увлажненном инкубатореCO2 при 37 °C.
ПРИМЕЧАНИЕ: В этом исследовании использовалась модифицированная орлиная среда Dulbecco (DMEM), дополненная 10% фетальной бычьей сывороткой (полная среда). - Когда клетки достигнут ~80% сливания, переведите их в новую колбу, содержащую свежую полную среду.
ПРИМЕЧАНИЕ: В зависимости от интересующего белка и клеточной линии, 80% слияние может обеспечить подходящую клеточную популяцию для анализа связывания. Для клеточных линий в этом эксперименте, MDA-MB-231 и HEK 293T, подходит 80% слияние. На этом этапе перейдите к разделу 4, обязательному анализу. Всегда проверяйте экспрессию интересующего белка, используя mAbs, специфичные для этого белка.
4. Обязательный анализ
ПРИМЕЧАНИЕ: На рисунке 2 обобщены этапы, необходимые для анализа связывания в адгезивных ячейках.
- В шкафу биобезопасности класса II собрать клетки каждой колбы в пробирки следующим образом:
- Соберите и выбросьте носитель в колбу, добавьте 2 мл PBS, распределите его по ячейкам, а затем соберите и выбросьте PBS. Повторите этот шаг еще дважды, чтобы удалить все следы среды, которые могут инактивировать трипсин. Добавляют 1 мл 0,25% трипсина/ЭДТА в каждую колбу и инкубируют в течение 5-10 мин при 37oC. Визуализируйте отслоение клеток под микроскопом.
- Добавьте 1 мл полной среды к клеткам и пипеткой по клеткам вверх и вниз, чтобы сделать одноклеточную суспензию. Пипетка клеток в соответствующую трубку и центрифугу по 200 × г в течение 5 мин.
ПРИМЕЧАНИЕ: Для неадгезивных клеток соберите ячейки в трубку, центрифугу (200 × г, 5 мин), и перейдите к этапу 4.1.3. - Выбросьте супернатант и повторно суспендируйте клетки в 1 мл свежей среды. Подсчитывайте клетки с помощью окрашивания трипана синим цветом, разбавляя определенный объем клеточной суспензии трипан-синим. Распределите ~15 мкл смеси между гемоцитометром и покровным стеклом. Подсчитайте ячейки, какописано ранее 18, используя уравнение (2):
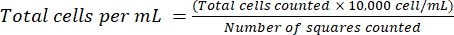 (2)
(2)
ПРИМЕЧАНИЕ: Используйте минимально возможный объем клеточной суспензии и обратите внимание на коэффициент разрежения. Например, смешивание равных объемов клеточной суспензии и 0,04% трипанового синего дает коэффициент разбавления 2. Обеспечьте высокую жизнеспособность (живые клетки / общее количество клеток × 100) ~ 90% для большинства адгезивных клеточных линий, прежде чем продолжить. Мертвые клетки неспецифически поглощают аптамеры и изменяют результаты19. Можно использовать другие методы подсчета клеток, такие как использование счетчика клеток. - Соберите необходимое количество клеток, убедившись, что на каждом тестовом образце должно быть 10 × 104 клетки. Рассмотрите дополнительный объем 10% для ошибки пипетирования.
ПРИМЕЧАНИЕ: Важно всегда поддерживать одно и то же количество клеток между экспериментами и репликами. - Инкубируйте клетки при 37 °C в течение 2 ч, чтобы обеспечить стабилизацию белка, представляющего интерес, на клеточной мембране после ферментативной отслойки.
ПРИМЕЧАНИЕ: Этот инкубационный период может отличаться в зависимости от интересующего белка.
- Во время этой 2-часовой инкубации:
- Установите температуру центрифуги на 4 °C. Оставляйте тРНК и запасы аптамера при комнатной температуре или на льду для оттаивания. Чтобы защитить молекулу-репортер флуоресценции, защитите трубки аптамера от света.
ПРИМЕЧАНИЕ: Роль тРНК заключается в блокировании сайтов связывания нуклеиновых кислот. - Подготовьте буфер SELEX, BB, WB и BiB (см. раздел 1), сохраняя их все на льду или при температуре 4 °C. Установите термоциклерную машину на пустой цикл. Поместите на лед 96-луночную черную пластину и проточные цитометрические трубки.
ПРИМЕЧАНИЕ: Установка термоциклера на пустой цикл подготавливает систему охлаждения и отопления и помогает генерировать более воспроизводимые результаты.
- Установите температуру центрифуги на 4 °C. Оставляйте тРНК и запасы аптамера при комнатной температуре или на льду для оттаивания. Чтобы защитить молекулу-репортер флуоресценции, защитите трубки аптамера от света.
- После 2-часовой инкубации центрифугируют клетки при 500 × г в течение 5 мин. Выбросьте супернатант и повторно суспендируйте клетки в 500 мкл ВВ. Инкубировать клетки при 4 °C в течение 30 мин с прерывистым перемешиванием.
- Во время этой 30-минутной инкубации выполните складывание аптамера следующим образом:
- Составьте 2-кратные концентрации аптамеров (см. раздел 2), а затем смешайте и инкубируйте аптамеры в термоциклерной машине в соответствии с требуемыми условиями складывания. Для этого аптамера EpCAM используйте следующие условия складывания 95 °C, 5 мин, затем 22 °C, 10 мин, и 37 °C, 15 мин.
ПРИМЕЧАНИЕ: Всегда включайте отрицательный элемент управления (т.е. буфер SELEX без аптамеров).
- Составьте 2-кратные концентрации аптамеров (см. раздел 2), а затем смешайте и инкубируйте аптамеры в термоциклерной машине в соответствии с требуемыми условиями складывания. Для этого аптамера EpCAM используйте следующие условия складывания 95 °C, 5 мин, затем 22 °C, 10 мин, и 37 °C, 15 мин.
- После 30 мин инкубации центрифугируют клетки (500 × г, 5 мин, 4 °C), удаляют супернатант, добавляют 1 мл WB и центрифугируют клетки снова (500 × г, 5 мин, 4 °C). Удалите супернатант и повторно суспендируйте клетки в подходящем объеме BiB.
- Пипетка 50 мкл повторно суспендированных клеток в каждую лунку ледяной, 96-луночной черной пластины. Держите клетки на льду, чтобы ингибировать интернализацию интересующего белка.
- Пипетка 50 мкл аптамеров на 50 мкл объема клеток, перемешивают и инкубируют в темноте при 4 °C в течение 30 мин. Центрифугируйте пластину при 500 × г, 5 мин, 4 °C и осторожно удалите супернатант.
- Осторожно повторно суспендировать гранулы в WB и центрифуге при 500 × г в течение 5 мин. Повторите стадию промывки (4,7) 2x и повторно суспендируйте в 100 мкл WB для проточного цитометрического анализа.
ПРИМЕЧАНИЕ: См. Рисунок 3 для диаграммы взаимодействий между аптамерами и клетками.

Рисунок 2: Диаграмма, изображающая этапы выполнения анализа, связывающего аптамер-белок. Сокращения: SELEX = Систематическая эволюция лигандов путем EXponential Enrichment; BB = блокирующий буфер; WB = буфер стирки; BiB = буфер привязки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Диаграмма, показывающая различные типы клеток и аптамеров, необходимых для выполнения анализа связывания аптамера. Аббревиатура: EpCAM = молекула эпителиальной клеточной адгезии. Этот рисунок был создан с использованием Biorender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Проточная цитометрия и анализ данных
ПРИМЕЧАНИЕ: Перед включением проточного цитометра убедитесь, что в мембранных фильтрующих блоках нет «пузырьков» для отключающего раствора, чистящего раствора и оболочки жидкости (0,9% NaCl). «Кровоточит» пузырьки, если в капсулах есть пузырьки. Убедитесь, что контейнер для отходов пуст, а контейнеры с жидкостью, водой и 1% отбеливателем в сверхчистой воде заполнены.
- Включите проточный цитометр, а затем компьютер.
ПРИМЕЧАНИЕ: Подробности запуска проточного цитометра, описанные здесь, относятся к машине и программному обеспечению, продемонстрированным в видео (см. Таблицу материалов). Для использования другого программного обеспечения потребуется соответствующая подготовка. - Откройте программное обеспечение для анализа проточной цитометрии, войдите в программу и на вкладке Cytometer запустите Fluidics Start up.
- Чтобы создать новый эксперимент, на вкладке эксперимент нажмите кнопку Создать папку и присвойте ей соответствующее имя.
- Щелкните новую папку , чтобы выделить, затем на вкладке эксперимента снова нажмите « Новый эксперимент» и назовите эксперимент соответствующим образом.
- Чтобы добавить первый образец/образец, на вкладке эксперимент нажмите кнопку Новый образец и назовите этот образец соответствующим образом (название клеточной линии/контрольного образца/образца эксперимента).
- Чтобы добавить образец трубки, выделите образец (группу) и на вкладке эксперимента нажмите кнопку Новая трубка. Добавьте соответствующее количество трубок и название.
- Чтобы подготовить необходимые графики, на вкладке листа откройте новый лист. Как только появится новое окно листа, откройте следующую команду с помощью экрана листа (наведите указатель мыши на логотип/изображения, чтобы найти имена):
- Подготовьте точечный график прямого рассеяния (FSC) и бокового рассеяния (SCC), чтобы выбрать интересующую популяцию. Определите первый затвор, определив и выбрав интересующую популяцию (P1) на прямом и боковом графике плотности рассеяния. Исключить мусор, который составляет популяцию с наименьшим сигналом прямого рассеяния.
ПРИМЕЧАНИЕ: Параметр FSC обнаруживает ячейки или события на основе их размера, а SCC дискриминирует их на основе их гранулярности20. - Подготовьте точечный график FSC-области (FSC-A) и высоты FSC (FSC-H) для выбора одноклеточной популяции. Определите второй вход, исключив популяции дублетных клеток, так как дублетные клетки значительно влияют на результаты и выводы. Исключите дублеты, используя графики плотности FSC-H и FSC-A, где ячейки одинакового размера показывают одинаковую площадь и высоту. Следовательно, синглеты группируются по диагонали и отделяются от дублетов.
ПРИМЕЧАНИЕ: FSC примерно пропорционален размеру ячейки. Импульсы напряжения определяются как FSC-H, интенсивность сигнала, FSC-ширина, которая отражает размер ячейки и длительность сигнала, и FSC-A, которая составляет H × W. Дублеты имеют двойную ширину и значение площади; поэтому гатинг для синглетов основан на обнаружении диспропорций между H, W и A, вызванных дублетами. - Подготовьте гистограмму количества событий против интересующего флуорофора.
- Подготовьте точечный график прямого рассеяния (FSC) и бокового рассеяния (SCC), чтобы выбрать интересующую популяцию. Определите первый затвор, определив и выбрав интересующую популяцию (P1) на прямом и боковом графике плотности рассеяния. Исключить мусор, который составляет популяцию с наименьшим сигналом прямого рассеяния.
- Перед началом проточной цитометрии убедитесь, что панель сбора для управления сбором образцов, инспектор и цитометр для регулировки параметров напряжения, а также рабочий лист со всеми графиками открыты.
ПРИМЕЧАНИЕ: Для проведения анализа необходимо по меньшей мере 100 мкл 10 × 104-клеточной суспензии в проточной цитометрической трубке. Особенно в случае более низкой жизнеспособности окрашивание йодида пропидия может быть выполнено для отбора жизнеспособной клеточной популяции21,22. - Чтобы запустить первый образец, в левой части экрана убедитесь, что стрелка, указывающая на трубку, зеленая. Если эта стрелка не зеленая, нажмите на стрелку, чтобы сделать ее зеленой.
- Используя пипетку, перенесите каждый образец из 96-луночной черной пластины в проточную цитометрическую трубку. Запустите необработанный, неиспорченный контрольный образец на низкой скорости.
- На панели мониторинга сбора выберите соответствующее количество событий для записи (30 000), измените скорость потока на низкую и нажмите кнопку Получить данные.
- Отрегулируйте напряжение для параметров FSC и SCC. Убедитесь, что клеточная популяция централизована внутри точечного графика и что ни одна клетка не касается ни одной оси графа, чтобы избежать потери интересующих клеток.
- Увеличьте скорость сбора данных до средней или высокой, чтобы анализировать образцы быстрее, но не превышать более 200 событий/с. Затем щелкните Записать данные.
- Выполните забор для P1 (рисунок 4A) и одноклеточной популяции (рисунок 4B). Постройте гистограмму событий против используемого фторхрома и выберите P1 на основе данных (аллофикоцианин (APC) в данном случае) (рисунок 4C).
- После регулировки напряжения, блокировки и записи данных, извлеките образец и нажмите Next Tube.
- Вставьте следующий образец и повторите запись данных для всех контрольных и тестовых образцов (рисунок 3).
- После того, как все данные собраны, промыть проточный цитометр, запустив три трубки с 50% отбеливателем, промывкой FACS и сверхчистой водой, каждая в течение 5 минут при высокой скорости потока.
- Затем в раскрывающемся меню Cytometer выберите Fluidics Shut Down (Отключение Fluidics).
- Перед закрытием программного обеспечения и выключением устройства и компьютера экспортируйте результаты в виде файлов .fcs на USB-накопитель для их передачи и анализа следующим образом:
- В аналитическом программном обеспечении нажмите кнопку NEW , чтобы создать новый документ и окно для обработки анализа. Перетащите образцы файлов в новое окно.
- Дважды щелкните, чтобы открыть незапятнанный образец. Выберите популяцию P1 , дважды щелкните по популяции P1 , чтобы создать график FSC-H против FSC-A, и определите одноклеточную популяцию.
- Дважды щелкните по закрытым одиночным ячейкам, чтобы создать гистограмму событий против используемого фторхрома.
- В исходном окне выберите P1 и отдельные ячейки и перетащите их в раздел Все образцы, чтобы все образцы теперь содержали один и тот же гэтинг.
- Нажмите кнопку Редактор макетов , чтобы открыть окно Макеты . Перетащите два образца (контрольный и тестовый) друг на друга, чтобы создать гистограмму наложения.
Результаты
Важным аспектом открытия и разработки новых лекарств является обеспечение избирательности и специфичности препарата-кандидата. Это означает, что препарат-кандидат должен уметь различать разные клетки и влиять только на интересующую популяцию клеток (селективность). Селективность из...
Обсуждение
Ключевой проблемой при разработке новых аптамеров является отсутствие стандартных руководящих принципов, которые применяются к различным этапам этого процесса. McKeague et al. недавно продемонстрировали некоторые из связанных с этим проблем, которые приводят к неясному представлению данн...
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Авторы признают финансирование Seed Института психического и физического здоровья и клинического перевода (IMPACT), программу «Стипендия Альфреда Дикина для постдокторских исследований» в Университете Дикина и «Стипендию Австралийской правительственной исследовательской учебной программы».
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tubes with attached lid | Sigma-Aldrich | T6649 | |
| 15 mL CellStar blue screw cap, conical bottom tube | Greiner Bio One | 188271 | |
| 5 mL serological pipettes | Greiner Bio One | 606180 | |
| BD FACSCanto II Flow Becton Dickinson Cytometer | Becton Dickinson | N/A | |
| BD FACSDiva V9.0 | BD Biosciences | N/A | |
| Bovine Serum Albumin (BSA), Lyophilized powder | Sigma-AldrichTM | A7906-50G | |
| Bright-line Hemocytometer | Sigma-Aldrich | Z359629 | |
| Dulbecco’s Modified Eagle Medium (DMEM) High Glucose Media Powder | Life Technologies | 12100046 | |
| Dulbecco’s Phosphate- Buffered Saline (DPBS) | Life Technologies | 21300025 | |
| FlowJo, LLC 10.8.1 | BD Biosciences | N/A | |
| Foetal Bovine Serum (FBS) | Bovogen | SFBS-F | |
| HEK293T | American Type Culture Collection | ACS-4500 | |
| Heracell 150i CO2 Incubator | Thermo Fisher Scientific | N/A | |
| Heraeus Megafuge 16R Centrifuge | Thermo Fisher Scientific | N/A | |
| Magnesium Chloride (MgCl2) | Sigma-Aldrich | M8266 | |
| MDA-MB-231 | American Type Culture Collection | CRM-HTB-26 | |
| Microplate, PS, 96 well, F-bottom (Chimney well), Black | Greiner Bio One | 655076 | |
| MiniAmp Thermal Cycler | Thermo Fisher Scientific | A37834 | |
| Phosphate-Buffered Saline (PBS) tablets | Life Technologies | 18912014 | |
| Pyrogen- and RNase-free ultrapure water | Milli-Q | ||
| T75 Cell Culture flask | Cellstar | 658170 | |
| TENN | Integrated DNA Technologies | N/A | 5′-GC GCG TGCA CGC GC TA ACG GA TTCCTTT TCC GT-3 |
| TEPP | Integrated DNA Technologies | N/A | 5′-GC GCG GTAC CGC GC TA ACG GA GGTTGCG TCC GT-3′ |
| Transfer RNA (tRNA) | Sigma-Aldrich | R8508-5X1ML | |
| Trypan Blue Solution | Life Technologies | 15250061 | |
| Trypsin-EDTA | Gibco | 15400054 |
Ссылки
- Cancer. World Health Organization Available from: https://www.who.int/news-room/fact-sheets/detail/cancer#:~:text=Cancer%20is%20a%20leading%20cause.and%20rectum%20and%20prostate%20cancers (2022)
- Liu, J. K. H. The history of monoclonal antibody development - Progress, remaining challenges and future innovations. Annals of Medicine and Surgery. 3 (4), 113-116 (2014).
- Nakhjavani, M., Shigdar, S. Future of PD-1/PD-L1 axis modulation for the treatment of triple-negative breast cancer. Pharmacological Research. 175, 106019 (2022).
- Bukari, B., Samarasinghe, R. M., Noibanchong, J., Shigdar, S. L. Non-invasive delivery of therapeutics into the brain: the potential of aptamers for targeted delivery. Biomedicines. 8 (5), 120 (2020).
- Wu, X., Chen, J., Wu, M., Zhao, J. X. Aptamers: active targeting ligands for cancer diagnosis and therapy. Theranostics. 5 (4), 322 (2015).
- Feng, X., et al. The aptamer functionalized nanocomposite used for prostate cancer diagnosis and therapy. Journal of Nanomaterials. 2022, (2022).
- Huang, J., et al. Advances in aptamer-based biomarker discovery. Frontiers in Cell and Developmental Biology. 9, 571 (2021).
- Ashrafuzzaman, M. Aptamers as both drugs and drug-carriers. BioMed Research International. 2014, (2014).
- Nakhjavani, M., Samarasinghe, R. M., Shigdar, S. Triple-negative breast cancer brain metastasis: an update on druggable targets, current clinical trials, and future treatment options. Drug Discovery Today. , (2022).
- Macdonald, J., et al. Development of a bifunctional aptamer targeting the transferrin receptor and epithelial cell adhesion molecule (EpCAM) for the treatment of brain cancer metastases. ACS Chemical Neuroscience. 8 (4), 777-784 (2017).
- Macdonald, J., et al. Bifunctional aptamer-doxorubicin conjugate crosses the blood-brain barrier and selectively delivers its payload to EpCAM-positive tumor cells. Nucleic Acid Therapeutics. 30 (2), 117-128 (2020).
- Shigdar, S., Agnello, L., Fedele, M., Camorani, S., Cerchia, L. Profiling cancer cells by cell-SELEX: use of aptamers for discovery of actionable biomarkers and therapeutic applications thereof. Pharmaceutics. 14 (1), 28 (2021).
- Rahimizadeh, K., et al. Development of cell-specific aptamers: recent advances and insight into the selection procedures. Molecules. 22 (12), 2070 (2017).
- Chen, M., et al. Development of cell-SELEX technology and its application in cancer diagnosis and therapy. International Journal of Molecular Sciences. 17 (12), 2079 (2016).
- Shigdar, S., et al. The use of sensitive chemical antibodies for diagnosis: detection of low levels of EpCAM in breast cancer. PLoS One. 8 (2), 57613 (2013).
- Ni, J., et al. Role of the EpCAM (CD326) in prostate cancer metastasis and progression. Cancer and Metastasis Reviews. 31 (3), 779-791 (2012).
- Ni, J., et al. Epithelial cell adhesion molecule (EpCAM) is associated with prostate cancer metastasis and chemo/radioresistance via the PI3K/Akt/mTOR signaling pathway. The International Journal of Biochemistry & Cell Biology. 45 (12), 2736-2748 (2013).
- McKeague, M., Kruse, P. F., Patterson, M. K., et al. . Tissue Culture. , 395-397 (1973).
- McKeague, M., et al. The minimum aptamer publication standards (MAPS guidelines) for de novo aptamer selection. Aptamers. 6, 10-18 (2022).
- Schoofs, G., Van Hout, A., D'huys, T., Schols, D., Van Loy, T. A flow cytometry-based assay to identify compounds that disrupt binding of fluorescently-labeled CXC Chemokine ligand 12 to CXC Chemokine receptor 4. Journal of Visualized Experiments. (133), e57271 (2018).
- McKinnon, K. M. Flow cytometry: an overview. Current Protocols in Immunology. 120 (1), 1-11 (2018).
- Kamiloglu, S., Sari, G., Ozdal, T., Capanoglu, E. Guidelines for cell viability assays. Food Frontiers. 1 (3), 332-349 (2020).
- Ruscito, A., DeRosa, M. C. Small-molecule binding aptamers: Selection strategies, characterization, and applications. Frontiers in Chemistry. 4, 14 (2016).
- McKeague, M., et al. Comprehensive analytical comparison of strategies used for small molecule aptamer evaluation. Analytical Chemistry. 87 (17), 8608-8612 (2015).
- Henri, J., Bayat, N., Macdonald, J., Shigdar, S. A guide to using nucleic acid aptamers in cell based assays. Aptamers. 23, (2019).
- Mao, H., et al. The mechanism and regularity of quenching the effect of bases on fluorophores: the base-quenched probe method. Analyst. 143 (14), 3292-3301 (2018).
- McKeague, M., et al. Analysis of in vitro aptamer selection parameters. Journal of Molecular Evolution. 81 (5), 150-161 (2015).
- Chen, B., et al. Targeting negative surface charges of cancer cells by multifunctional nanoprobes. Theranostics. 6 (11), 1887 (2016).
- Shigdar, S., et al. RNA aptamers targeting cancer stem cell marker CD133. Cancer Letters. 330 (1), 84-95 (2013).
- Amraee, M., Oloomi, M., Yavari, A., Bouzari, S. DNA aptamer identification and characterization for E. coli O157 detection using cell based SELEX method. Analytical Biochemistry. 536, 36-44 (2017).
- Yu, X. -. X., et al. Selection and characterization of a novel DNA aptamer, Apt-07S specific to hepatocellular carcinoma cells. Drug Design, Development and Therapy. 14, 1535 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены