需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
评估从3D多细胞肺肿瘤球体中分离的癌症相关成纤维细胞的线粒体健康
摘要
用肺腺癌细胞、成纤维细胞和单核细胞制备多细胞3D肿瘤球体,然后从这些球体中分离癌症相关成纤维细胞(CAF)。将分离的CAF与正常成纤维细胞进行比较,通过研究线粒体跨膜电位,活性氧和酶活性来评估线粒体健康状况。
摘要
癌症相关成纤维细胞(CAF)是肿瘤微环境中最丰富的基质细胞之一,可促进肿瘤生长和进展。肿瘤微环境中的复杂性,包括肿瘤分泌组、低度炎症、缺氧和氧化还原失衡,促进了异型相互作用,并允许无活性的常驻成纤维细胞转化为活性 CAF。CAF 在代谢上与正常成纤维细胞 (NF) 不同,因为它们具有更高的糖酵解活性,产生更高水平的活性氧 (ROS),并且过表达乳酸输出剂 MCT-4,导致线粒体通透性过渡孔 (MPTP) 的打开。这里描述了一种方法来分析从多细胞3D肿瘤球体中分离的活化CAF的线粒体健康,该球状体包括人肺腺癌细胞(A549),人单核细胞(THP-1)和人肺成纤维细胞(MRC5)。肿瘤球体以不同的时间间隔分解,并通过磁激活细胞分选分离出CAF。使用JC-1染料评估CAF的线粒体膜电位,通过2',7'-二氯二氢荧光素二乙酸酯(DCFDA)染色产生ROS以及分离CAF中的酶活性。分析分离CAF的线粒体健康有助于更好地了解反向Warburg效应,也可用于研究CAF线粒体变化的后果,例如代谢通量和相应的肺癌异质性调控机制。因此,本研究提倡了解肿瘤 - 基质相互作用对线粒体健康的影响。它将提供一个平台来检查线粒体特异性候选药物对CAF作为肿瘤微环境中潜在疗法的有效性,从而防止CAF参与肺癌进展。
引言
实体瘤由肿瘤微环境(TME)引导的异质细胞群组成,然而,大多数细胞的起源尚未被发现。主要是基质和免疫细胞(成纤维细胞、内皮细胞、单核细胞、巨噬细胞、树突状细胞、B 细胞、T 细胞及其亚群)反映了肺癌、乳腺癌、肾癌和其他实体癌的肿瘤异质性1,2,3。了解每种亚型的起源及其转分化潜力对于开发针对这些癌症的先进疗法至关重要。由于肿瘤类型、部位、分期、样本量限制和患者特异性变异性,在人活检中对这种多样化细胞群的分析本身就面临着一些挑战4。因此,需要一个实验模型,该模型不仅可靠,而且可以模拟体内肿瘤状况,证明其是研究肿瘤-基质串扰及其参与疾病病理生理学的理想选择。
三维(3D)多细胞肿瘤球状体(MCTS)培养物是一种有利的 体外 肿瘤模型系统,因为它们与天然对应物相似。与2D细胞培养模型相比,MCTS可以更好地复制实体瘤的各个方面,包括其空间结构,生理反应,可溶性介质的释放,基因表达模式和耐药机制。此外,MCTS的一个主要优点是它可用于研究肿瘤异质性和肿瘤微环境(TME)。悬挂-下降法是开发和分析 MCTS5 最常用的工具。在这种方法中,带有培养基的不同细胞以液滴的形式悬浮,这允许其以相干的3D聚集体方式生长,并且易于检查。该技术很简单;它不需要很多细胞,并且消除了球状体发育所需的特殊底物(如琼脂糖)6。该方法的另一个优点在于其技术的可重复性。此外,该方法还用于共培养混合细胞群,例如内皮细胞和肿瘤细胞,以模拟早期肿瘤血管生成7。
本研究采用模拟肺肿瘤微环境的悬挂滴法制备了含有肺腺癌细胞、成纤维细胞和单核细胞的多细胞三维肺肿瘤球体。然后分离癌症相关成纤维细胞(CAF)群体以调查线粒体健康状况。开发这些微球背后的主要思想是分离CAF,因为微球中细胞之间的串扰可以将成纤维细胞转化为肌成纤维细胞样激活的CAF状态。其次,这项研究也可能描述异常的ROS产生和线粒体功能障碍如何驱动正常的成纤维细胞走向更具侵略性的CAF表型。结果发现,在肿瘤球体内组装的成纤维细胞具有肌成纤维细胞特征,ROS活性增加,代谢基因表达诱导增加。该协议强调了肿瘤微环境在激活CAF中的重要性,并且可以成为 体外 生成和研究CAF表型特征的优秀模型。
研究方案
1. 细胞培养
- 在补充有10%FBS和1%青霉素 - 链霉素的RPMI1640培养基中培养人肺腺癌细胞系A549和人单核细胞系THP-1,在5%CO2的加湿室中。
- 在补充有10%FBS和1%青霉素 - 链霉素溶液的DMEM培养基中培养MRC-5人肺成纤维细胞,在37°C的加湿室中,在5%CO2。
2. 使用A549肺腺癌细胞系,MRC5成纤维细胞和THP-1单核细胞制备多细胞肿瘤球状体
注意:在90mm细胞培养皿中使用悬挂滴法制备多细胞致瘤和非致瘤3D球体。下面详细介绍了这些球体的发展。除非另有说明,否则所有细胞培养试剂(如完全培养基、PBS 和 0.25% 胰蛋白酶-EDTA 溶液)应在使用前在 37 °C 下预热。
- 细胞悬液的制备
- 在DMEM完全生长培养基(Dulbecco的改良鹰培养基[DMEM] + 10%胎牛血清[FBS] + 1%青霉素 - 链霉素)中培养A549和MRC5贴壁细胞(每个5 x 106 个细胞)在37°C的加湿室中,在5%CO2的加湿室中。
- 对于THP-1细胞,在T25烧瓶中的完全生长培养基(RPMI1640 + 10%FBS + 1%青霉素 - 链霉素)中培养细胞悬液(5 x 106 细胞)。为了更好地生长,将T25烧瓶置于37°C的加湿室中,5%CO2 处于站立位置。
- 3天后,在80%-85%汇合时,通过在每个烧瓶中加入1mL PBS(25-30°C)并吸出,用不含钙和镁的PBS(磷酸盐缓冲盐水)洗涤A549和MRC5细胞1分钟。
- 从烧瓶中收获A549和MRC5细胞,方法是在含有5%CO 2的加湿培养箱中与500μL的0.25%胰蛋白酶-EDTA溶液在37°C下孵育5分钟。 之后,立即加入 4 mL 完全生长培养基以灭活胰蛋白酶。
- 将T25烧瓶中的细胞悬液收集到15mL管中,并以125× g 沉淀5分钟。除去上清液并将细胞重悬于5mL完全生长培养基中。
- 多细胞肿瘤球体的建立
注意:肿瘤球状体形成的所有步骤都应在生物安全柜内进行,以保持无菌条件。细胞悬液的最大体积已标准化为 25 μL 的液滴,以制备液滴,使其在倒盖时不会掉落。- 使用细胞计数器计数 A549、MRC5 和 THP-1 细胞数。对于每个球状体液滴(25μL),按照Arora等人描述的方案保持以下细胞数:5,000个A549细胞,4,000个MRC5细胞和1,000个THP-1细胞7。相应地计算 1 mL 体积的细胞数。
注意:球体最初是用每个球体三种不同的细胞计数(即5000、8000和10,000)制备的。此外,还检查了肿瘤细胞/成纤维细胞/单核细胞的不同细胞比例(1:1:1、2:2:1、4:2:1、5:2:1 和 5:4:1)。最后,观察到成功的3D多细胞球体形成,比例为5:4:1,并用于研究。成纤维细胞浓度根据其在肿瘤微环境中的比例而增加,进一步增强了肿瘤球状体的刚性。Arora等人最近的出版物7报道了详细的程序。 - 以 5(A549,2 x 10 5 个细胞/mL)与 4(MRC5,1.6 x 10 5 个细胞/mL)到 1(THP-1,5 x 104 个细胞/mL)的比例制备细胞悬液,并用完整的 DMEM 将体积补足至 1 mL。
- 将一滴 25 μL 细胞悬液混合物滴在 90 mm 培养皿的盖子上(约 50 滴/90 mm 培养皿)。用 10 mL 无菌水填充 90 mm 培养皿的底部。
- 小心地将盖子倒置在充满水的水合室上,并将培养皿放入细胞培养箱中 3 天。
- 在第4天以10倍放大倍率在显微镜下监测球体。要获取图像,请打开电源开关,将60毫米培养皿小心地放在载物台上,然后选择放大倍率(10倍)。调整镜片并检查细胞以分析细胞聚集和增殖。按下显微镜上提供的冻结和保存按钮以捕获图像。
- 在第 4 天更换生长培养基,从每个液滴中小心地吸出 20 μL 培养基并用新鲜的完整生长培养基替换它。
- 使用细胞计数器计数 A549、MRC5 和 THP-1 细胞数。对于每个球状体液滴(25μL),按照Arora等人描述的方案保持以下细胞数:5,000个A549细胞,4,000个MRC5细胞和1,000个THP-1细胞7。相应地计算 1 mL 体积的细胞数。
3. 肿瘤球状体的活死体分析
- 在第 7 天和第 10 天,小心地倒置生物安全柜中的 90 mm 培养皿,并使用 200 μL 移液管从每个液滴中收集球状体。在 1.5 mL 管中收集每个球体五个球体。
- 将 500 μL 的 1x PBS 加入含有球状体的 1.5 mL 管中,并以 125 x g 离心 5 分钟。小心弃去上清液,并将球状体重悬于200μL的1x PBS中。不要严格移液以避免球体崩解。
- 使用 200 μL 移液器在 60 mm 培养皿上移出球体,用于钙黄绿素-AM 和碘化丙啶染色。
- 将 5 μL 1 μM 钙黄绿素-AM 溶液和 5 μL 2 mg/mL 碘化丙啶溶液放在球状体上。孵育10分钟。孵育期结束后,用1x PBS轻轻洗涤球体两次。
- 将含有球体的60 mm培养皿置于荧光倒置显微镜下,观察并通过在显微镜软件中选择荧光选项并选择FITC的FITC(绿色荧光通道;激发490 nm,发射515 nm)和德克萨斯红色通道(TXR;激发535 nm,发射617 nm)以10倍放大倍率捕获图像。
- 要获取图像,请打开 Ctr Adv,即开关 1,然后打开 CPU。等待软件系统启动。启动后,将60毫米培养皿小心地放在载物台上,并选择放大倍率(10倍)和荧光通道(FITC,TXR)。调整镜头并扫描图像。
- 要查看系统中的映像,请选择" 实时 "选项并查看映像。调整荧光强度以进行适当的优化。通过单击保存图像 保存 按钮。
注意:在此阶段,球体将通过肉眼可见。在光学显微镜下,球体在10倍放大镜下将显示为圆形刚性球体。使用200 μL移液器可以一次收集多个球体。
4.肿瘤球体的崩解和细胞悬液
- 在第 7 天和第 10 天分别收集 200 个肿瘤球体,在 15 mL 管中使用 1 mL 移液管。
注意:在收集之前,在将其转移到显微镜载玻片或30毫米培养皿上并在显微镜下观察后,仔细检查单个球体的形状和形式。 - 通过以125× g 离心5分钟来沉淀球体。小心吸出上清液,不要干扰肿瘤球状体。
- 用200μLPBS小心洗涤球体,以125× g 离心5分钟,并小心地弃去上清液。
- 对于球体崩解,加入 400 μL 0.25% 胰蛋白酶-EDTA 溶液,并在 37 °C 下保持 10 分钟。进行剧烈移液以使球体完全崩解。
- 通过加入 1 mL 完整的 DMEM 生长培养基来中和胰蛋白酶。以125× g 离心5分钟,小心弃去上清液。
- 将沉淀重悬于1 mL完全DMEM培养基中并计数细胞总数。
5. 通过微珠分离癌症相关成纤维细胞 (CAF)
- 为了从肿瘤球体中分离 CAF,将 1 x 10 7 个细胞重悬于 80 μL 冷磁活化细胞分选 (MACS) 缓冲液中(pH7.2 的 PBS,含有 0.5% 牛血清白蛋白 [BSA] 和 2 mM 乙二胺四乙酸 [EDTA])。
- 用 20 μL 抗成纤维细胞微珠孵育细胞悬液(包含 1 x 107 个细胞)。轻轻敲击试管充分混合,并在室温下孵育30分钟。
- 用 1 mL 冷 MACS 缓冲液洗涤细胞,以 125 x g 离心 5 分钟,然后吸出上清液。将细胞重悬于 500 μL MACS 缓冲液中。
- 对于基于磁珠的细胞分离,用 3 mL MACS 缓冲液冲洗 MACS 色谱柱。
- 将细胞悬液放入色谱柱中,然后收集含有未标记细胞群的流通液。
- 用 3 mL MACS 缓冲液洗涤色谱柱 3 次。从分离器中取出色谱柱并将其放在收集管上。
- 通过添加 5 mL MACS 缓冲液并将柱塞牢固地推入柱中来收集抗成纤维细胞微珠标记的细胞。
- 将标记的细胞以125× g 离心5分钟。继续分离的成纤维细胞用于下游应用。
6. 基于流式细胞术分析分离CAF中 ACTA2 的表达
- 计算分离的CAF的数量,并使用大约6 x 104 个细胞。用PBS洗涤细胞一次,以125× g 离心5分钟,并吸出上清液。
- 加入 100 μL 细胞透化缓冲液(PBS + 0.5% BSA + 0.3% v/v Triton X-100),并将细胞在 4 °C 下孵育 30 分钟。
- 间歇性地涡旋细胞以维持单细胞悬液。将细胞离心并重悬于 100 μL 细胞透化缓冲液中。
- 加入 2 μL APC 偶联的抗人 α-SMA 抗体,并在 4 °C 下孵育 45 分钟。孵育后,加入 1 mL 透化缓冲液并以 125 x g 离心 5 分钟以去除多余的抗体。
- 将沉淀重悬于 400 μL 透化缓冲液中,用于流式细胞术分析。在流式细胞仪中采集每个样品的总共 10,000 个事件。根据细胞的前向和侧向散射区分细胞群后,选择 单 线态细胞群,然后选择在单参数直方图上显示为单个峰的 ACTA2 阳性细胞。
7. JC-1染色测定线粒体膜电位
- 计数分离的CAF的数量,并使用大约6 x 104 个细胞使用流式细胞术对5,5,6,6'-四氯-1,1',3,3'四乙基苯并咪-达唑基羰花青碘化物(JC-1)染色。
- 用PBS彻底洗涤细胞,以125× g 离心5分钟,吸出上清液,并加入100μL细胞染色缓冲液。
- 加入工作浓度为2μM的JC-1染料,并在室温下孵育30分钟。孵育结束时,用PBS洗涤细胞,以125× g 离心5分钟,并以400μL的终体积重悬。
- 在流式细胞仪中采集每个样品的总共 20,000 个事件。通过测量 FL-2 通道上的红移 JC-2 聚集体和 FL-1 通道上的绿移单体来量化线粒体膜电位。
8. DCFDA 染色以估计细胞活性氧 (ROS) 水平
- 使用整个微球(50 个数字)以及从微球中分离的 CAF(6 x 104 个细胞)进行 2',7'-二氯二氢荧光素二乙酸酯 (DCFDA) 染色。
- 用PBS彻底洗涤细胞,以125× g 离心5分钟,吸出上清液,并加入100μL细胞染色缓冲液。
- 加入工作浓度为1μM的DCFDA染料,并在室温下孵育30分钟。用PBS洗涤细胞两次,以125× g 离心5分钟,然后重悬于400μL的最终体积中。
- 在流式细胞仪中采集每个样品的总共 20,000 个事件。通过测量第7天和第10天的荧光来评估球体以及分离的CAF的ROS水平。
9. CAF标志物和糖酵解基因的RT-qPCR分析
- 按照制造商的方案,使用单细胞裂解试剂盒从分选的 CAF 中提取 RNA。按照制造商的指南,使用 cDNA 合成试剂盒从 100 ng RNA 制备 cDNA。
- 进行 RT-qPCR 以分析相对 CAF 标志物(ACTA2 8 和 COL1A29)和糖酵解基因(GLUT1 10 和 MCT4 11)表达。在最终延伸后进行熔融曲线分析,以确保产品的特异性。使用GAPDH的表达作为参考基因对数据进行归一化。用于RT-qPCR的引物序列列于补充表1中。
10. 从CAF中提取和定量细胞蛋白
注意:在冰上执行蛋白质提取的所有步骤,以避免蛋白质降解。
- 将大约 4 x 106 CAF 细胞重悬于 100 μL 冰冷的 RIPA 裂解缓冲液中(含有 30 mM HEPES、150 mM NaCl、1% NP-40、0.1% SDS 和 0.5% 脱氧胆酸钠与 5 mM Halt 蛋白酶和磷酸酶抑制剂混合物,以及 pH 7.4 下的 5 mM EDTA)。
- 严格涡旋以获得适当的细胞裂解。以 20 Hz 频率、20% 振幅 15 秒和 3x 脉冲超声处理细胞悬液。
- 超声处理后,将蛋白质提取物在4°C下以13,000× g 离心15分钟。 将上清液转移到预冷的 1.5 mL 管中。进行BCA蛋白质测定以定量蛋白质。
11. CAF中酶活性的分光光度分析
注意:在肿瘤球状体衍生的CAF中分析以下酶活性。
- 琥珀酸脱氢酶活性的测定
- 为了评估CAF中琥珀酸脱氢酶(SDH)的活性,用250 mM蔗糖,10 mM 4-(2-羟乙基)-1-哌嗪乙烷磺酸(HEPES)和1 mM乙二醇-双(β-氨基乙醚)-N,N,N′,N′-四乙酸(EGTA)制备SHE缓冲液,并将pH调节至7.3。在SHE缓冲液中加入0.4 mM吩嗪甲硫酸盐(PMS),0.2 mM 2,6-二氯吲哚酚(DCPIP),50 mM MgCl2,0.02%Triton X-100和1 mM氰化物,并保持在37°C。
- 如步骤10(2 x 106个细胞 )中所述,从CAF中提取细胞蛋白。在 96 孔板的每个孔中,将 100 μL 0.1 mg 细胞蛋白与 100 μL SHE 反应混合物在 37 °C 下孵育 15 分钟。
- 为了开始酶活性,加入10mM琥珀酸酯12。通过测量 600 nm 处吸光度的变化来计算以 nM/min/mL 为单位的酶活性。
- DCIP的换算系数为0.0215 A/nM,基于其摩尔消光系数12。使用上述公式计算SDH的相对活性:
相对活性 (nM/分钟/mL/酶) =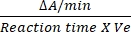 X X
X X  V
V
其中 ΔA/min = 酶促反应速率(A初始 -A 最终)/(时间最终 - A/min初始),Ve = 样品体积,V = 反应体积。
- 细胞色素c氧化酶活性的估计
- 为了评估 CAF 中的细胞色素 c 氧化酶 (COX) 活性,在含有 KME 缓冲液(125 mM KCl、20 mM 3-(N-吗啉基)丙烷磺酸 [MOPS]和 1 mM EGTA,pH 7.4)、0.02 % Triton X-100 和 5 mM 抗坏血酸钠的 KME 反应缓冲液中加入 0.2 mg/mL 细胞蛋白。
- 在单独的管中,将50μM马心细胞色素c与5mM抗坏血酸钠混合,并在37°C孵育5分钟13。孵育后,将 20 μL 还原的细胞色素 c 加入 500 μL 含有细胞蛋白的 KME 反应缓冲液中。
- 通过测量 550 nm 处吸光度的变化来计算以单位/μL 为单位的酶活性。细胞色素c在550nm处的吸收随其氧化态而变化。还原和氧化细胞色素c之间的消光系数(mM)差异在550nm14处为21.84。计算细胞裂解物中的酶活性量为:
单位/μL =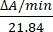
其中 ΔA/min = A/min样品 A/min 空白 和 21.84 = ΔmM 在 550 nm 处氧化细胞色素 c 和还原细胞色素 c 之间
- 乳酸脱氢酶活性评估
- 按照制造商的说明使用乳酸脱氢酶细胞检测试剂盒进行乳酸脱氢酶 (LDH) 测定。
- 将LDH测试试剂(10μL)加入0.5mg / mL细胞蛋白中,并在37°C孵育5分钟。 孵育结束时,每1分钟测量45nm处的吸光度8分钟。
- 使用 0(空白)、2.5、5、7.5、10 和 12.5 nM/孔的 NADH 制备用于比色检测的 NADH 标准品,然后将 LDH 测试试剂添加到 50 μL 的最终体积中。
- 绘制 T初始 和 T最终 与 NADH 标准曲线之间的吸光度差异,以确定 NADH 生成量。使用上述公式评估LDH的活性:
乳酸脱氢酶活性 =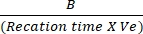 X 样品稀释因子
X 样品稀释因子
其中 B = 在 T 初始和 T 最终之间产生的 NADH 量 (nmole),反应时间 = T最终 - T初始(分钟),Ve = 样品体积 (mL) 加入孔中。
结果
图1显示了使用三种不同的细胞群-A549(肺腺癌),MRC-5(成纤维细胞)和THP-1(单核细胞)通过悬挂滴法在显微镜下观察到的第7天和第10天多细胞肿瘤球状体的发展。在第7天,球体紧凑而坚硬,直径为260 ± 5.3 μm,在第10天,球体直径为480±7.5μm(图1A上面板,图1B-D)。第7天和第10天的球体是紧密的聚集体,在整个批次...
讨论
本研究介绍了使用改进的悬挂滴法开发包括肿瘤细胞、基质细胞群(即成纤维细胞)和免疫细胞群(即单核细胞)的多细胞肿瘤球体。成纤维细胞和单核细胞/巨噬细胞是构成肿瘤微环境(TME)的最重要群体之一,它们的存在通常与患者预后不良有关16。当存在于TME中时,成纤维细胞发生转化,表现出特定的癌症相关成纤维细胞(CAF)表型,因为肿瘤微环境线索17
披露声明
作者没有利益冲突需要披露。
致谢
这项工作得到了印度塞尔维亚妇女卓越奖项目(SB/WEA-02/2017)和印度塞尔维亚-早期职业研究奖项目(ECR/2017/000892)的支持。作者LA和SR承认IIT Ropar和MHRD的研究奖学金。MK感谢ICMR的研究奖学金。
材料
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| APC anti-human α-SMA | R&D systems | Cat# IC1420A | |
| Anti-fibroblast microbeads | Miltenyi Biotec | Cat# 130-050-601 | |
| Cell lines | |||
| A549 lung adenocarcinoma cells | NCCS Pune | - | |
| MRC-5 fetal lung fibroblasts | ATCC | CCL-171 | |
| THP-1 Human monocytes | NCCS Pune | - | |
| Chemicals | |||
| BSA | Himedia | Cat# 9048-46-8 | |
| 2,6-dichloroindophenol (DCPIP) | SRL | Cat# 55287 | |
| Calcein-AM | Thermo Fisher Scientific | Cat# C3099 | |
| DAPI | Thermo Fisher Scientific | Cat# D1306 | |
| DCFDA | Sigma | Cat# D6883 | |
| DMEM | Gibco | Cat# 11995073 | |
| DPBS | Gibco | Cat# 14190-144 | |
| EDTA | Thermo fisher scientific | Cat# 17892 | |
| EGTA | SRL | Cat# 62858 | |
| EZcoun Lactate Dehydrogenase Cell Assay Kit | HiMedia | Cat# CCK036 | |
| FBS | Gibco | Cat# 10082147 | |
| Halt Protease and Phosphatase Inhibitor Cocktail (100X) | Thermo Fisher Scientific | Cat# 87786 | |
| HEPES | Thermo Fisher Scientific | Cat# 15630080 | |
| Horse heart Cytochrome c | SRL | Cat# 81551 | |
| Image-iT Red hypoxia reagent | Thermo Fisher Scientific | Cat# H10498 | |
| JC-1 Dye | Thermo Fisher Scientific | Cat# T3168 | |
| KCl | Merck | Cat# P9541 | |
| MgCl2 | Merck | Cat# M8266 | |
| MOPS | Thermo Fisher Scientific | Cat# 69824 | |
| Nacl | Sigma-Aldrich | Cat# S9888 | |
| NADH MB Grade | SRL | Cat# 54941 | |
| NP-40 | Thermo Fisher Scientific | Cat# 85124 | |
| Penicillin/Streptomycin | Gibco | Cat# 15140122 | |
| Phenazine methosulfate (PMS) | SRL | Cat# 55782 | |
| Propidium iodide | Thermo fisher scientific | Cat# P1304MP | |
| RPMI 1640 | Gibco | Cat# 11875093 | |
| Single Cell Lysis Kit | Thermo Fisher Scientific | Cat# 4458235 | |
| Sodium ascorbate | Merck | Cat# A7631 | |
| Sodium cyanide | Sigma | Cat# 205222 | |
| Sodium Deoxycholate | Thermo Fisher Scientific | Cat# 89904 | |
| Sodium dodecyl sulphate | Sigma-Aldrich | Cat# L3771 | |
| Sodium succinate hexahydrate | SRL | Cat# 36313 | |
| Sucrose | Sigma | Cat# S0389 | |
| SuperScript VILO cDNA synthesis kit | Thermo Fisher Scientific | Cat# 11754-050 | |
| Triton X-100 | Sigma | Cat# T8787 | |
| Trypsin 0.25% EDTA | Gibco | Cat# 25200072 | |
| Universal SYBR Green Supermix | BIO-RAD | Cat# 172-5124 | |
| Plasticware | |||
| MACS LS Columns | Miltenyi Biotec | Cat# 130-042-401 | |
| Equipment | |||
| Countess II FL Automated Cell Counter | Thermo Fisher Scientific | Cat# AMQAF1000 | |
| EVOS XL core imaging system | Thermo Fisher Scientific | Serial Number F0518-1727-0191 | |
| LAS X software | Leica Microsystems | ||
| Leica fluorescent inverted microscope | s | DMi8 automated S/N 424150) | |
| Midi MACS separator | Miltenyi Biotec | Cat# 130-042-302 |
参考文献
- Kim, N., et al. Single-cell RNA sequencing demonstrates the molecular and cellular reprogramming of metastatic lung adenocarcinoma. Nature Communications. 11 (1), 1-5 (2020).
- Davidson, S., et al. Single-cell RNA sequencing reveals a dynamic stromal niche that supports tumor growth. Cell Reports. 31 (7), 107628 (2020).
- Zhang, Y., et al. Single-cell analyses of renal cell cancers reveal insights into tumor microenvironment, cell of origin, and therapy response. Proceedings of the National Academy of Sciences. 118 (24), (2021).
- Bray, L. J., Hutmacher, D. W., Bock, N. Addressing patient specificity in the engineering of tumor models. Frontiers in Bioengineering and Biotechnology. 7, 217 (2019).
- Timmins, N. E., Nielsen, L. K. Generation of multicellular tumor spheroids by the hanging-drop method. Tissue Engineering. , 141-151 (2007).
- Dituri, F., et al. Complex tumor spheroid formation and one-step cancer-associated fibroblasts purification from hepatocellular carcinoma tissue promoted by inorganic surface topography. Nanomaterials. 11 (12), 3233 (2021).
- Arora, L., et al. Development of a multicellular 3D tumor model to study cellular heterogeneity and plasticity in NSCLC tumor microenvironment. Frontiers in Oncology. 12, 881207 (2022).
- Nurmik, M., Ullmann, P., Rodriguez, F., Haan, S., Letellier, E. In search of definitions: Cancer-associated fibroblasts and their markers. International Journal of Cancer. 146 (4), 895-905 (2020).
- Zhang, Y., et al. HIF-1α is necessary for activation and tumour-promotion effect of cancer-associated fibroblasts in lung cancer. Journal of Cellular and Molecular Medicine. 25 (12), 5457-5469 (2021).
- Bu, L., et al. Biological heterogeneity and versatility of cancer-associated fibroblasts in the tumor microenvironment. Oncogene. 38 (25), 4887-4901 (2019).
- Whitaker-Menezes, D., et al. Evidence for a stromal-epithelial "lactate shuttle" in human tumors: MCT4 is a marker of oxidative stress in cancer-associated fibroblasts. Cell cycle. 10 (11), 1772-1783 (2011).
- Mandujano-Tinoco, E. A., Gallardo-Pérez, J. C., Marín-Hernández, A., Moreno-Sánchez, R., Rodríguez-Enríquez, S. Anti-mitochondrial therapy in human breast cancer multi-cellular spheroids. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research. 1833 (3), 541-551 (2013).
- Bregman, A. A. . Laboratory Investigations in Cell and Molecular Biology. , (2002).
- Berry, E. A., Trumpower, B. L. Simultaneous determination of hemes a, b, and c from pyridine hemochrome spectra. Analytical Biochemistry. 161 (1), 1-15 (1987).
- Avagliano, A., et al. Metabolic reprogramming of cancer associated fibroblasts: the slavery of stromal fibroblasts. BioMed Research International. , (2018).
- Lorusso, G., Rüegg, C. The tumor microenvironment and its contribution to tumor evolution toward metastasis. Histochemistry and Cell Biology. 130 (6), 1091-1103 (2008).
- Liu, T., Zhou, L., Li, D., Andl, T., Zhang, Y. Cancer-associated fibroblasts build and secure the tumor microenvironment. Frontiers in Cell and Developmental Biology. 7, 60 (2019).
- Sebastian, A., et al. Single-cell transcriptomic analysis of tumor-derived fibroblasts and normal tissue-resident fibroblasts reveals fibroblast heterogeneity in breast cancer. Cancers. 12 (5), 1307 (2020).
- Elyada, E., et al. Cross-species single-cell analysis of pancreatic ductal adenocarcinoma reveals antigen-presenting cancer-associated fibroblasts. Cancer Discovery. 9 (8), 1102-1123 (2019).
- Ganguly, D., et al. Cancer-associated fibroblasts: Versatile players in the tumor microenvironment. Cancers. 12 (9), 2652 (2020).
- Harryvan, T. J., Verdegaal, E. M., Hardwick, J. C., Hawinkels, L. J., vander Burg, S. H. Targeting of the cancer-associated fibroblast-T-cell axis in solid malignancies. Journal of Clinical Medicine. 8 (11), 1989 (2019).
- Santi, A., Kugeratski, F. G., Zanivan, S. Cancer associated fibroblasts: the architects of stroma remodeling. Proteomics. 18 (5-6), 1700167 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。