Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
3D Çok Hücreli Akciğer Tümörü Sferoidlerinden İzole Edilen Kanserle İlişkili Fibroblastlarda Mitokondriyal Sağlığın Değerlendirilmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Çok hücreli 3D tümör sferoidleri, akciğer adenokarsinom hücreleri, fibroblastlar ve monositler ile hazırlandı ve bunu kanserle ilişkili fibroblastların (CAF'lar) bu sferoidlerden izole edilmesi izledi. İzole CAF'lar, mitokondriyal transmembran potansiyelini, reaktif oksijen türlerini ve enzimatik aktiviteleri inceleyerek mitokondriyal sağlığı değerlendirmek için normal fibroblastlarla karşılaştırıldı.
Özet
Kanserle ilişkili fibroblastlar (CAF'lar), tümör mikroortamında bulunan ve tümör büyümesini ve ilerlemesini kolaylaştıran en bol stromal hücreler arasındadır. Tümör sekretumu, düşük dereceli inflamasyon, hipoksi ve redoks dengesizliği dahil olmak üzere tümör mikroçevresi içindeki karmaşıklık, heterotipik etkileşimi teşvik eder ve inaktif yerleşik fibroblastların aktif CAF'lar haline gelmesine izin verir. CAF'lar, glikolitik olarak daha aktif oldukları, daha yüksek seviyelerde reaktif oksijen türleri (ROS) ürettikleri ve laktat ihracatçısı MCT-4'ü aşırı eksprese ettikleri için normal fibroblastlardan (NF'ler) metabolik olarak ayırt edilirler ve bu da mitokondriyal geçirgenlik geçiş gözeneklerinin (MPTP) açılmasına yol açar. Burada, insan akciğer adenokarsinom hücrelerinden (A549), insan monositlerinden (THP-1) ve insan akciğer fibroblast hücrelerinden (MRC5) oluşan çok hücreli 3D tümör sferoidlerinden izole edilen aktif CAF'ların mitokondriyal sağlığını analiz etmek için bir yöntem tanımlanmıştır. Tümör sferoidleri farklı zaman aralıklarında parçalandı ve manyetik aktive hücre sıralaması yoluyla CAF'lar izole edildi. CAF'ların mitokondriyal membran potansiyeli, JC-1 boyası, 2',7'-diklorodihidrofloresein diasetat (DCFDA) boyaması ile ROS üretimi ve izole CAF'larda enzim aktivitesi kullanılarak değerlendirildi. İzole CAF'ların mitokondriyal sağlığını analiz etmek, ters Warburg etkisinin daha iyi anlaşılmasını sağlar ve ayrıca metabolik akılar ve buna karşılık gelen düzenleyici mekanizmalar gibi CAF mitokondriyal değişikliklerinin akciğer kanseri heterojenliği üzerindeki sonuçlarını incelemek için de uygulanabilir. Bu nedenle, bu çalışma mitokondriyal sağlık üzerindeki tümör-stroma etkileşimlerinin anlaşılmasını savunmaktadır. Mitokondriyal spesifik ilaç adaylarını, tümör mikroortamında potansiyel terapötikler olarak CAF'lara karşı etkinlikleri açısından kontrol etmek için bir platform sağlayacak ve böylece akciğer kanseri progresyonunda CAF katılımını önleyecektir.
Giriş
Solid tümörler, tümör mikroçevresi (TME) tarafından yönlendirilen heterojen hücre popülasyonlarından oluşur, ancak hücrelerin çoğunun kökeni henüz keşfedilmemiştir. Esas olarak stromal ve immün hücreler (fibroblastlar, endotel hücreleri, monositler, makrofajlar, dendritik hücreler, B hücreleri, T hücreleri ve bunların alt kümeleri) akciğer, meme, böbrek ve diğer katı kanserlerdeki tümör heterojenliğini yansıtır 1,2,3. Her bir alt tipin kökenini ve trans-farklılaşma potansiyellerini anlamak, bu kanserlere karşı ileri tedaviler geliştirmek için son derece gereklidir. İnsan biyopsilerindeki bu çeşitli hücre popülasyonunun analizi, tümör tipi, bölgesi, evresi, numune miktarının sınırlandırılması ve hastaya özgü değişkenlikler nedeniyle çeşitli zorluklarla kendini göstermektedir4. Bu nedenle, sadece güvenilir değil, aynı zamanda in vivo tümör durumunu simüle edebilen, tümör-stroma çapraz konuşmasını ve hastalık patofizyolojisine katılımını incelemek için ideal olduğunu kanıtlayan deneysel bir modele ihtiyaç vardır.
Üç boyutlu (3D) çok hücreli tümör sferoid (MCTS) kültürleri, doğal muadillerine benzerlikleri nedeniyle tümörlerin in vitro model bir sistemidir. MCTS, katı tümörlerin yönlerini, mekansal mimarileri, fizyolojik tepkileri, çözünür mediatörlerin salınması, gen ekspresyon paternleri ve ilaç direnci mekanizmaları dahil olmak üzere 2D hücre kültürü modellerinden daha iyi çoğaltabilir. Ayrıca, MCTS'nin temel avantajlarından biri, tümör heterojenitesini ve tümör mikroçevresini (TME) incelemek için kullanılabilmesidir. Asılı bırakma yöntemi, MCTS5'i geliştirmek ve analiz etmek için en yaygın kullanılan araçtır. Bu yöntemde, ortama sahip farklı hücreler, tutarlı bir 3D agrega tarzında büyümesine izin veren ve inceleme için erişilmesi kolay olan damlacıklar şeklinde askıya alınır. Teknik basittir; çok fazla hücre gerektirmez ve küresel gelişim için agaroz gibi özel bir substratın gerekliliğini ortadan kaldırır6. Bu yöntemin ek bir avantajı, tekniğinin tekrarlanabilirliğinde yatmaktadır. Ayrıca, bu yöntem aynı zamanda erken tümör anjiyogenezini simüle etmek için endotel hücreleri ve tümör hücreleri gibi karışık hücre popülasyonlarını birlikte kültürlemek için de kullanılmıştır7.
Bu çalışmada, akciğer tümörü mikroçevresini taklit eden asılı damla yöntemi kullanılarak akciğer adenokarsinom hücreleri, fibroblastlar ve monositler ile çok hücreli 3D akciğer tümörü sferoidleri hazırlanmıştır. Daha sonra mitokondriyal sağlığı araştırmak için kanserle ilişkili fibroblast (CAF) popülasyonu izole edildi. Bu sferoidlerin geliştirilmesinin ardındaki ana fikir, sferoidlerdeki hücreler arasındaki çapraz konuşma, fibroblastları miyo-fibroblast benzeri aktif bir CAF durumuna dönüştürebileceğinden, CAF'ları izole etmektir. İkincisi, bu çalışma aynı zamanda anormal ROS üretiminin ve mitokondriyal disfonksiyonun normal fibroblastları daha agresif CAF fenotipine doğru nasıl yönlendirdiğini de gösterebilir. Tümör sferoidleri içinde toplanan fibroblastların, artmış ROS aktivitesi ve metabolik gen ekspresyonunun indüksiyonu ile miyofibroblastik özellikler kazandığı bulunmuştur. Bu protokol, tümör mikroçevresinin CAF'ı aktive etmedeki önemini vurgulamaktadır ve in vitro üretim ve CAF fenotipik özelliklerinin incelenmesi için mükemmel bir model olabilir.
Protokol
1. Hücre kültürü
- Kültür insan akciğer adenokarsinomu hücre hattı A549 ve RPMI1640 ortamındaki insan monositik hücre hattı THP-1, % 5 CO2 ile nemlendirilmiş bir odada% 10 FBS ve% 1 penisilin-streptomisin ile 37 ° C'de% 1 ile desteklenmiştir.
- DMEM ortamındaki kültür MRC-5 insan akciğer fibroblast hücreleri,% 5 CO2 ile nemlendirilmiş bir odada% 10 FBS ve% 1 penisilin-streptomisin çözeltisi ile 37 ° C'de% 1 penisilin-streptomisin çözeltisi ile desteklenir.
2. A549 akciğer adenokarsinom hücre hattı, MRC5 fibroblastları ve THP-1 monositleri kullanılarak çok hücreli tümör sferoidlerinin hazırlanması
NOT: Çok hücreli tümörojenik ve tümörojenik olmayan 3D sferoidler, 90 mm'lik bir hücre kültürü kabında asılı bırakma yöntemi kullanılarak hazırlanmıştır. Bu sferoidlerin gelişiminin ayrıntılı bir açıklaması aşağıda verilmiştir. Tam ortam, PBS ve% 0.25 tripsin-EDTA çözeltisi gibi tüm hücre kültürü reaktifleri, aksi belirtilmedikçe kullanımdan önce 37 ° C'de önceden ısıtılmalıdır.
- Hücre süspansiyonunun hazırlanması
- DMEM tam büyüme ortamında (Dulbecco'nun modifiye kartal ortamı [DMEM] +% 10 fetal sığır serumu [FBS] +% 10 penisilin-streptomisin) T25 şişelerinde% 5 CO 2 ile nemlendirilmiş bir odada 37 ° C'de A549 ve MRC5 yapışkan hücreleri (her biri 5 x 106 hücre) büyütün.
- THP-1 hücreleri için, hücre süspansiyonunu (5 x 106 hücre) T25 şişelerinde tam büyüme ortamında (RPMI1640 +% 10 FBS +% 1 penisilin-streptomisin) büyütün. Daha iyi büyüme için, T25 şişelerini 37 °C'de, %5 CO2 ile ayakta duran nemlendirilmiş bir odaya yerleştirin.
- 3 gün sonra,% 80-85 oranında, A549 ve MRC5 hücrelerini, her şişeye 1 dakika boyunca 1 mL PBS (25-30 ° C) ekleyerek ve aspire ederek kalsiyum ve magnezyum içermeyen PBS (fosfat tampon salin) ile yıkayın.
- A549 ve MRC5 hücrelerini, %5 CO2'li nemlendirilmiş bir inkübatörde 37 °C'de 5 dakika boyunca 500 μL% 0.25 tripsin-EDTA çözeltisi ile inkübe ederek şişeden toplayın. Hemen sonra, tripsini inaktive etmek için 4 mL tam büyüme ortamı ekleyin.
- Hücre süspansiyonunu T25 şişesinden 15 mL'lik bir tüpe toplayın ve 5 dakika boyunca 125 x g'de toplayın. Süpernatantı çıkarın ve hücreleri 5 mL'lik tam büyüme ortamında yeniden askıya alın.
- Çok hücreli tümör sferoidlerinin kurulması
NOT: Tümör sferoid oluşumunun tüm adımları, steril koşulları korumak için biyogüvenlik kabini içinde gerçekleştirilmelidir. Hücre süspansiyonunun maksimum hacmi, kapakları ters çevirirken düşmeyeceği şekilde bir damlacık hazırlamak için 25 μL'lik bir damla olarak standartlaştırılmıştır.- Bir hücre sayacı kullanarak A549, MRC5 ve THP-1 hücre numaralarını sayın. Her sferoid damlacık (25 μL) için aşağıdaki hücre sayılarını koruyun: Arora ve ark.7 tarafından açıklanan protokolü izleyerek 5.000 A549 hücre, 4.000 MRC5 hücresi ve 1.000 THP-1 hücresi. 1 mL'lik bir hacim için hücre numaralarını buna göre hesaplayın.
NOT: Sferoidler başlangıçta sferoid başına üç farklı hücre sayımı ile hazırlanmıştır (yani, 5000, 8000 ve 10.000). Ayrıca, tümör hücrelerinin / fibroblastların / monositlerin farklı hücre oranları (1: 1: 1, 2: 2: 1, 4: 2: 1, 5: 2: 1 ve 5: 4: 1) kontrol edildi. Son olarak, 5: 4: 1 oranında başarılı bir 3D çok hücreli sferoid oluşumu görüldü ve çalışma için kullanıldı. Fibroblast konsantrasyonu, tümör mikroortamındaki oranına bağlı olarak arttırıldı ve bu da tümör sferoidlerinin sertliğini daha da arttırdı. Ayrıntılı prosedür, Arora ve ark.7 tarafından yakın tarihli bir yayında bildirilmiştir. - Hücre süspansiyonunu 5 (A549, 2 x 10 5 hücre / mL) ila 4 (MRC5, 1.6 x 10 5 hücre / mL) ila 1 (THP-1,5 x 104 hücre / mL) oranında hazırlayın ve tam DMEM ile hacmi 1 mL'ye kadar oluşturun.
- 90 mm'lik bir kültür kabının kapağına 25 μL hücre süspansiyon karışımı damlası yerleştirin (yaklaşık 50 damla / 90 mm tabak). 90 mm'lik kültür kabının tabanını 10 mL steril suyla doldurun.
- Kapağı suyla dolu hidrasyon odasının üzerine dikkatlice ters çevirin ve çanağı 3 gün boyunca bir hücre kültürü inkübatörüne yerleştirin.
- Sferoidleri mikroskop altında 4. günde 10x büyütmede izleyin. Görüntü elde etmek için güç düğmesini açın, 60 mm'lik çanağı sahneye dikkatlice yerleştirin ve büyütmeyi (10x) seçin. Lensleri ayarlayın ve hücre toplanmasını ve çoğalmasını analiz etmek için hücreleri inceleyin. Görüntüyü yakalamak için mikroskopta sağlanan Dondur ve Kaydet düğmelerine basın.
- 4. günde, her damlacıktan 20 μL besiyeri dikkatlice aspire ederek ve taze bir tam büyüme ortamı ile değiştirerek büyüme ortamını değiştirin.
- Bir hücre sayacı kullanarak A549, MRC5 ve THP-1 hücre numaralarını sayın. Her sferoid damlacık (25 μL) için aşağıdaki hücre sayılarını koruyun: Arora ve ark.7 tarafından açıklanan protokolü izleyerek 5.000 A549 hücre, 4.000 MRC5 hücresi ve 1.000 THP-1 hücresi. 1 mL'lik bir hacim için hücre numaralarını buna göre hesaplayın.
3. Tümör sferoidlerinin canlı-ölü analizi
- 7. ve 10. günlerde, biyogüvenlik kabinindeki 90 mm'lik kabı dikkatlice ters çevirin ve her damlacıktan sferoidleri toplamak için 200 μL'lik bir pipet kullanın. Her biri 1,5 mL'lik bir tüpte beş sferoid toplayın.
- Sferoidler içeren 1,5 mL tüpe 500 μL 1x PBS ekleyin ve 5 dakika boyunca 125 x g'de santrifüj yapın. Süpernatantı dikkatlice atın ve sferoidleri 200 μL 1x PBS'de yeniden askıya alın. Küresel parçalanmayı önlemek için titizlikle pipet uygulamayın.
- Kalsein-ve propidium iyodür boyama için 60 mm'lik bir çanak üzerinde 200 μL'lik bir pipet kullanarak sferoidleri pipetleyin.
- Sferoidlerin üzerine 5 μL 1 μM kalsein-çözeltisi ve 5 μL 2 mg / mL propidium iyodür çözeltisi koyun. 10 dakika boyunca kuluçkaya yatırın. Kuluçka süresinin tamamlanmasından sonra, sferoidleri iki kez 1x PBS ile nazikçe yıkayın.
- Sferoidler içeren 60 mm'lik kabı floresan ters mikroskop altına yerleştirin, mikroskop yazılımında floresan seçeneğini seçerek ve kalsein ve Teksas kırmızı kanalı (TXR; uyarma 535 nm, emisyon 617 nm) için FITC'yi (yeşil floresan kanalı; uyarma 490 nm, emisyon 515 nm) seçerek görüntüleri 10x büyütmede gözlemleyin ve yakalayın.
- Görüntüyü elde etmek için, anahtar 1 olan Ctr Adv'yi açın ve ardından CPU'yu açın. Yazılım sisteminin önyüklenmesini bekleyin. Önyüklendiğinde, 60 mm'lik çanağı sahneye dikkatlice yerleştirin ve büyütme (10x) ve floresan kanalları (FITC, TXR) seçin. Lensleri ayarlayın ve görüntüyü tarayın.
- Görüntüyü sistemde görüntülemek için Canlı seçeneğini belirleyin ve görüntüyü görüntüleyin. Uygun optimizasyon için floresan yoğunluğunu ayarlayın. Kaydet düğmesini tıklatarak görüntüyü kaydedin .
NOT: Bu aşamada, sferoidler çıplak gözle görülebilecektir. Işık mikroskobu altında, sferoidler 10x büyütmede yuvarlak, sert küreler olarak görünecektir. 200 μL'lik bir pipet kullanılarak aynı anda birden fazla sferoid toplanabilir.
4. Tümör sferoidlerinin parçalanması ve hücre süspansiyonu
- 15 mL'lik bir tüpte 1 mL'lik bir pipet kullanarak 7. ve 10. günlerde her biri 200 tümör sferoidi toplayın.
NOT: Toplamadan önce, mikroskobik bir slayta veya 30 mm'lik bir kaba aktardıktan sonra tek bir sferoidin şeklini ve formunu dikkatlice kontrol edin ve mikroskop altında gözlemleyin. - Spheroidleri 5 dakika boyunca 125 x g'de santrifüjleme ile pelet edin. Süpernatantı tümör sferoidlerini rahatsız etmeden dikkatlice aspire edin.
- Sferoidleri 200 μL PBS ile dikkatlice yıkayın, 5 dakika boyunca 125 x g'de santrifüj yapın ve süpernatanı dikkatlice atın.
- Küresel parçalanma için, 400 μL% 0.25 tripsin-EDTA çözeltisi ekleyin ve 10 dakika boyunca 37 ° C'de tutun. Sferoidlerin tamamen parçalanması için kuvvetli pipetleme yapın.
- 1 mL tam DMEM büyüme ortamı ekleyerek tripsini nötralize edin. 5 dakika boyunca 125 x g'de santrifüj yapın ve süpernatantı dikkatlice atın.
- Peleti 1 mL'lik tam DMEM ortamında yeniden askıya alın ve toplam hücre sayısını sayın.
5. Mikroboncuklar yoluyla kanserle ilişkili fibroblast (CAF) izolasyonu
- CAF'ların tümör sferoidlerinden izolasyonu için, 80 μL soğuk manyetik aktif hücre sıralama (MACS) tamponunda 1 x 10 7 hücreyi yeniden askıya alın (pH 7.2'de PBS,% 0.5 sığır serum albümini [BSA] ve 2 mM etilendiamin tetraasetik asit [EDTA] içerir).
- Hücre süspansiyonunu (1 x 107 hücre içeren) 20 μL anti-fibroblast mikroboncukları ile inkübe edin. Tüpe hafifçe dokunarak iyice karıştırın ve oda sıcaklığında 30 dakika boyunca inkübe edin.
- Hücreleri 1 mL soğuk MACS tamponu ile yıkayın, 5 dakika boyunca 125 x g'de santrifüj yapın ve süpernatanı aspire edin. Hücreleri 500 μL MACS tamponunda yeniden askıya alın.
- Manyetik boncuk bazlı hücre ayrımı için, MACS sütununu 3 mL MACS tamponu ile durulayarak hazırlayın.
- Hücre süspansiyonunu sütuna yerleştirin ve ardından etiketsiz hücre popülasyonunu içeren akış toplama işlemini yapın.
- Kolonu 3 mL MACS tamponuyla üç kez yıkayın. Kolonu ayırıcıdan çıkarın ve toplama tüpünün üzerine yerleştirin.
- 5 mL MACS tamponu ekleyerek ve pistonu kolona sıkıca iterek anti-fibroblast mikroboncuk etiketli hücreleri toplayın.
- Etiketli hücreleri 5 dakika boyunca 125 x g'de santrifüj yapın. Aşağı akış uygulamaları için izole fibroblastlarla devam edin.
6. İzole CAF'larda ACTA2 ekspresyonunun akış sitometrisine dayalı analizi
- İzole edilmiş CAF'ların sayısını sayın ve yaklaşık 6 x 104 hücre kullanın. Hücreleri PBS ile bir kez yıkayın, 5 dakika boyunca 125 x g'de santrifüj yapın ve süpernatanı aspire edin.
- 100 μL hücre geçirgenlik tamponu (PBS +% 0.5 BSA +% 0.3 v / v Triton X-100) ekleyin ve hücreleri 30 dakika boyunca 4 ° C'de inkübe edin.
- Tek bir hücre süspansiyonunu korumak için hücreleri aralıklı olarak vorteksleyin. Hücreleri 100 μL hücre geçirgenlik tamponunda santrifüj yapın ve yeniden askıya alın.
- 2 μL APC konjuge anti-insan α-SMA antikoru ekleyin ve 45 dakika boyunca 4 ° C'de inkübe edin. Kuluçkayı takiben, fazla antikoru çıkarmak için 1 mL geçirgenlik tamponu ekleyin ve 5 dakika boyunca 125 x g'de santrifüj yapın.
- Akış sitometrik analizi için peleti 400 μL geçirgenlik tamponunda yeniden askıya alın. Bir akış sitometresinde her numunenin toplam 10.000 olayını elde edin. ACTA2 pozitif hücrelerini, hücre popülasyonlarını ileri ve yan saçılmalarına göre ayırt ettikten sonra, singlet popülasyonunu seçtikten sonra tek parametreli histogramda tek bir tepe noktası olarak görünen ACTA2 pozitif hücrelerini seçerek seçin.
7. Mitokondriyal membran potansiyelini belirlemek için JC-1 boyama
- İzole CAF'ların sayısını sayın ve akış sitometrisi kullanarak 5,5,6,6'-tetrakloro-1,1',3,3' tetraetilbenzimi-dazoylcarbocyanine iyodür (JC-1) boyama için yaklaşık 6 x 104 hücre kullanın.
- Hücreleri PBS ile iyice yıkayın, 5 dakika boyunca 125 x g'de santrifüj yapın, süpernatanı aspire edin ve 100 μL hücre boyama tamponu ekleyin.
- JC-1 boyasını 2 μM'lik bir çalışma konsantrasyonunda ekleyin ve 30 dakika boyunca oda sıcaklığında inkübe edin. Kuluçkanın sona ermesi üzerine, hücreleri PBS ile yıkayın, 5 dakika boyunca 125 x g'de santrifüj yapın ve 400 μL'lik son bir hacimde yeniden askıya alın.
- Bir akış sitometresinde her numunenin toplam 20.000 olayını elde edin. FL-2 kanalındaki kırmızıya kaymış JC-1 agregalarını ve FL-1 kanalındaki yeşil kaymış monomerleri ölçerek mitokondriyal membran potansiyelini ölçün.
8. Hücresel reaktif oksijen türleri (ROS) seviyelerini tahmin etmek için DCFDA boyama
- 2',7'-diklorodihidrofloresein diasetat (DCFDA) boyama için tüm sferoidleri (50 sayı) ve ayrıca sferoidlerden izole edilmiş CAF'ları (6 x 104 hücre) kullanın.
- Hücreleri PBS ile iyice yıkayın, 5 dakika boyunca 125 x g'de santrifüj yapın, süpernatanı aspire edin ve 100 μL hücre boyama tamponu ekleyin.
- DCFDA boyasını 1 μM'lik bir çalışma konsantrasyonunda ekleyin ve 30 dakika boyunca oda sıcaklığında inkübe edin. Hücreleri PBS ile iki kez yıkayın, 5 dakika boyunca 125 x g'de santrifüj yapın ve ardından 400 μL'lik son bir hacimde yeniden askıya alın.
- Bir akış sitometresinde her numunenin toplam 20.000 olayını elde edin. Sferoidler ve izole CAF'lar için 7. ve 10. günlerde floresanı ölçerek ROS seviyelerini değerlendirin.
9. CAF belirteçlerinin ve glikolitik genlerin RT-qPCR analizi
- Üreticinin protokolünü izleyerek tek hücreli bir lizis kiti kullanarak sıralanmış CAF'lardan RNA'yı çıkarın. Üreticinin yönergelerini izleyerek bir cDNA sentez kiti kullanarak 100 ng RNA'dan cDNA hazırlayın.
- Göreceli CAF belirteçlerini (ACTA2 8 ve COL1A29) ve glikolitik geni (GLUT1 10 ve MCT4 11) ekspresyonunu analiz etmek için RT-qPCR gerçekleştirin. Ürünlerin özgüllüğünü sağlamak için son uzatmadan sonra erime eğrisi analizi yapın. Referans gen olarak GAPDH ifadesini kullanarak verileri normalleştirin. RT-qPCR için kullanılan primer dizileri Ek Tablo 1'de listelenmiştir.
10. Hücresel proteinin CAF'lardan ekstraksiyonu ve nicelleştirilmesi
NOT: Protein yıkımını önlemek için buz üzerinde protein ekstraksiyonunun tüm adımlarını uygulayın.
- 100 μL buz gibi soğuk RIPA lizis tamponunda yaklaşık 4 x 106 CAF hücresini yeniden askıya alın (30 mM HEPES, 150 mM NaCl,% 1 NP-40,% 0.1 SDS ve% 0.5 sodyum deoksikolat ile 5 mM Halt proteaz ve fosfataz inhibitörü kokteyli ve pH 7.4'te 5 mM EDTA içerir).
- Uygun hücre lizisi için titizlikle vorteks. Hücre süspansiyonunu 20 Hz frekansında, 20 s için% 15 genlikte ve 3x darbede sonikleştirin.
- Sonikasyondan sonra, protein ekstraktını 13,000 ° C'de 15 dakika boyunca 4 x g'de santrifüj edin. Süpernatantı önceden soğutulmuş 1,5 mL'lik bir tüpe aktarın. Proteini ölçmek için BCA protein testini yapın.
11. CAF'larda enzimatik aktivitelerin spektrofotometrik analizi
NOT: Aşağıdaki enzim aktiviteleri tümör sferoid kaynaklı CAF'larda analiz edilir.
- Süksinat dehidrogenaz aktivitesinin ölçülmesi
- CAF'larda süksinat dehidrogenaz (SDH) aktivitesini değerlendirmek için, 250 mM sakaroz, 10 mM 4-(2-hidroksietil)-1-piperazineetansülfonik asit (HEPES) ve 1 mM etilen glikol-bis (β-aminoetil eter)-N, N, N′, N′-tetraasetik asit (EGTA) ile SHE tamponu hazırlayın ve pH'ı 7.3'e ayarlayın. SHE tamponuna 0,4 mM fenazin metosülfat (PMS), 0,2 mM 2,6-dikloroindofenol (DCPIP), 50 mM MgCl2,% 0,02 Triton X-100 ve 1 mM siyanür ekleyin ve 37 °C'de tutun.
- Hücresel proteini adım 10'da (2 x 106 hücre) açıklandığı gibi CAF'lardan çıkarın. 96 delikli bir plakanın her bir kuyucuğunda, 15 dakika boyunca 37 ° C'de 100 μL SHE reaksiyon karışımı ile 100 μL 0.1 mg hücresel proteini inkübe edin.
- Enzimatik aktiviteyi başlatmak için 10 mM süksinat12 ekleyin. 600 nm'de absorbanstaki değişiklikleri ölçerek enzim aktivitesini nM / dak / mL cinsinden hesaplayın.
- DCIP için dönüşüm faktörü, azı dişi yok olma katsayısı 12'ye bağlı olarak0.0215 A / nM'dir. Belirtilen formülü kullanarak SDH'nin göreli aktivitesini hesaplayın:
Bağıl aktivite (nM/min/mL/enzim) =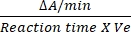 X X
X X  V
V
Burada ΔA/dk = enzimatik reaksiyon hızı (Ailk- Afinal)/(zamanfinali- A/dkbaşlangıç), Ve = numune hacmi ve V = reaksiyonun hacmi.
- Sitokrom c oksidaz aktivitesinin tahmini
- CAF'lardaki sitokrom c oksidaz (COX) aktivitesini değerlendirmek için, KME tamponu (125 mM KCl, 20 mM 3-(N-morfolino)propan sülfonik asit [MOPS] ve 1 mM EGTA, pH 7.4), % 0.02 Triton X-100 ve 5 mM sodyum askorbat içeren bir KME reaksiyon tampon çözeltisine 0.2 mg / mL hücresel protein ekleyin.
- Ayrı bir tüpte, 50 μM at kalbi sitokrom c'yi 5 mM sodyum askorbat ile karıştırın ve 5 dakika13 boyunca 37 ° C'de inkübe edin. Kuluçkadan sonra, hücresel protein içeren 500 μL KME reaksiyon tampon çözeltisine 20 μL indirgenmiş sitokrom c ekleyin.
- 550 nm'de absorbanstaki değişiklikleri ölçerek enzim aktivitesini birim / μL cinsinden hesaplayın. Sitokrom c'nin 550 nm'de emilimi, oksidasyon durumu ile değişir. İndirgenmiş ve oksitlenmiş sitokrom c arasındaki yok olma katsayılarındaki (mM) fark, 550 nm 14'te21.84'tür. Hücresel lizattaki enzim aktivitesi miktarını şu şekilde hesaplayın:
Birimler/μL =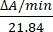
Burada ΔA / dak = A / daknumune-A / dakboş ve 21.84 = ΔӑmM, oksitlenmiş sitokrom c ile 550 nm'de indirgenmiş sitokrom c arasında
- Laktat dehidrogenaz aktivitesinin değerlendirilmesi
- Üreticinin talimatlarını izleyerek bir laktat dehidrogenaz hücre testi kiti kullanarak laktat dehidrogenaz (LDH) testi yapın.
- LDH test reaktifini (10 μL) 0.5 mg / mL hücresel proteinlere ekleyin ve 37 ° C'de 5 dakika boyunca inkübe edin. Kuluçkanın sona ermesi üzerine, absorbansı 8 dakika boyunca her 1 dakikada bir 45 nm'de ölçün.
- Kolorimetrik algılama için NADH standartlarını 0 (boş), 2.5, 5, 7.5, 10 ve 12.5 nM / kuyu kullanarak hazırlayın ve ardından 50 μL'lik son hacme LDH test reaktifi ekleyin.
- NADH üretim miktarını belirlemek için NADH standart eğrisine Tbaşlangıç ve Tson arasındaki absorbans farklarını çizin. Belirtilen formülü kullanarak LDH aktivitesini değerlendirin:
LDH aktivitesi =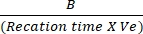 X numune seyreltme faktörü
X numune seyreltme faktörü
Burada B = T başlangıç ve T son arasında üretilen NADH miktarı (nmol), reaksiyon süresi = Tson - Tbaşlangıç (min) ve Ve = numune hacmi (mL) kuyuya eklenir.
Sonuçlar
Şekil 1, mikroskop altında 7. gün ve 10. günde gözlemlendiği gibi asılı damla yöntemiyle üç farklı hücre popülasyonu (A549 (akciğer adenokarsinomu), MRC-5 (fibroblastlar) ve THP-1 (monositler) kullanılarak çok hücreli tümör sferoidlerinin gelişimini göstermektedir. 7. günde, sferoidler 260 ± 5.3 μm çapında kompakt ve sertti ve 10. günde sferoidler 480 ± 7.5 μm çapındaydı (Şekil 1A üst panel, Şekil ...
Tartışmalar
Bu çalışma, modifiye edilmiş bir asılı damla yöntemi kullanılarak tümör hücrelerini, stromal hücre popülasyonunu (yani fibroblastları) ve immün hücre popülasyonunu (yani monositleri) içeren çok hücreli tümör sferoidlerinin gelişimini tanıtmaktadır. Fibroblastlar ve monositler/makrofajlar, tümör mikroçevresini (TME) oluşturan en önemli popülasyonlar arasındadır ve varlıkları genellikle kötü hasta prognozu ile bağlantılıdır16. TME'de mevcut olduğunda, fibrob...
Açıklamalar
Yazarların açıklayacağı bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, DP'ye SERB-Kadın Mükemmellik Ödülü Projesi, Hindistan (SB/WEA-02/2017) ve SERB-Erken Kariyer Araştırma Ödülü Projesi Hindistan (ECR/2017/000892) tarafından desteklenmiştir. Yazarlar, LA ve SR, IIT Ropar ve MHRD'yi araştırma bursları için kabul eder. MK, ICMR'yi araştırma bursu için kabul ediyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| APC anti-human α-SMA | R&D systems | Cat# IC1420A | |
| Anti-fibroblast microbeads | Miltenyi Biotec | Cat# 130-050-601 | |
| Cell lines | |||
| A549 lung adenocarcinoma cells | NCCS Pune | - | |
| MRC-5 fetal lung fibroblasts | ATCC | CCL-171 | |
| THP-1 Human monocytes | NCCS Pune | - | |
| Chemicals | |||
| BSA | Himedia | Cat# 9048-46-8 | |
| 2,6-dichloroindophenol (DCPIP) | SRL | Cat# 55287 | |
| Calcein-AM | Thermo Fisher Scientific | Cat# C3099 | |
| DAPI | Thermo Fisher Scientific | Cat# D1306 | |
| DCFDA | Sigma | Cat# D6883 | |
| DMEM | Gibco | Cat# 11995073 | |
| DPBS | Gibco | Cat# 14190-144 | |
| EDTA | Thermo fisher scientific | Cat# 17892 | |
| EGTA | SRL | Cat# 62858 | |
| EZcoun Lactate Dehydrogenase Cell Assay Kit | HiMedia | Cat# CCK036 | |
| FBS | Gibco | Cat# 10082147 | |
| Halt Protease and Phosphatase Inhibitor Cocktail (100X) | Thermo Fisher Scientific | Cat# 87786 | |
| HEPES | Thermo Fisher Scientific | Cat# 15630080 | |
| Horse heart Cytochrome c | SRL | Cat# 81551 | |
| Image-iT Red hypoxia reagent | Thermo Fisher Scientific | Cat# H10498 | |
| JC-1 Dye | Thermo Fisher Scientific | Cat# T3168 | |
| KCl | Merck | Cat# P9541 | |
| MgCl2 | Merck | Cat# M8266 | |
| MOPS | Thermo Fisher Scientific | Cat# 69824 | |
| Nacl | Sigma-Aldrich | Cat# S9888 | |
| NADH MB Grade | SRL | Cat# 54941 | |
| NP-40 | Thermo Fisher Scientific | Cat# 85124 | |
| Penicillin/Streptomycin | Gibco | Cat# 15140122 | |
| Phenazine methosulfate (PMS) | SRL | Cat# 55782 | |
| Propidium iodide | Thermo fisher scientific | Cat# P1304MP | |
| RPMI 1640 | Gibco | Cat# 11875093 | |
| Single Cell Lysis Kit | Thermo Fisher Scientific | Cat# 4458235 | |
| Sodium ascorbate | Merck | Cat# A7631 | |
| Sodium cyanide | Sigma | Cat# 205222 | |
| Sodium Deoxycholate | Thermo Fisher Scientific | Cat# 89904 | |
| Sodium dodecyl sulphate | Sigma-Aldrich | Cat# L3771 | |
| Sodium succinate hexahydrate | SRL | Cat# 36313 | |
| Sucrose | Sigma | Cat# S0389 | |
| SuperScript VILO cDNA synthesis kit | Thermo Fisher Scientific | Cat# 11754-050 | |
| Triton X-100 | Sigma | Cat# T8787 | |
| Trypsin 0.25% EDTA | Gibco | Cat# 25200072 | |
| Universal SYBR Green Supermix | BIO-RAD | Cat# 172-5124 | |
| Plasticware | |||
| MACS LS Columns | Miltenyi Biotec | Cat# 130-042-401 | |
| Equipment | |||
| Countess II FL Automated Cell Counter | Thermo Fisher Scientific | Cat# AMQAF1000 | |
| EVOS XL core imaging system | Thermo Fisher Scientific | Serial Number F0518-1727-0191 | |
| LAS X software | Leica Microsystems | ||
| Leica fluorescent inverted microscope | s | DMi8 automated S/N 424150) | |
| Midi MACS separator | Miltenyi Biotec | Cat# 130-042-302 |
Referanslar
- Kim, N., et al. Single-cell RNA sequencing demonstrates the molecular and cellular reprogramming of metastatic lung adenocarcinoma. Nature Communications. 11 (1), 1-5 (2020).
- Davidson, S., et al. Single-cell RNA sequencing reveals a dynamic stromal niche that supports tumor growth. Cell Reports. 31 (7), 107628 (2020).
- Zhang, Y., et al. Single-cell analyses of renal cell cancers reveal insights into tumor microenvironment, cell of origin, and therapy response. Proceedings of the National Academy of Sciences. 118 (24), (2021).
- Bray, L. J., Hutmacher, D. W., Bock, N. Addressing patient specificity in the engineering of tumor models. Frontiers in Bioengineering and Biotechnology. 7, 217 (2019).
- Timmins, N. E., Nielsen, L. K. Generation of multicellular tumor spheroids by the hanging-drop method. Tissue Engineering. , 141-151 (2007).
- Dituri, F., et al. Complex tumor spheroid formation and one-step cancer-associated fibroblasts purification from hepatocellular carcinoma tissue promoted by inorganic surface topography. Nanomaterials. 11 (12), 3233 (2021).
- Arora, L., et al. Development of a multicellular 3D tumor model to study cellular heterogeneity and plasticity in NSCLC tumor microenvironment. Frontiers in Oncology. 12, 881207 (2022).
- Nurmik, M., Ullmann, P., Rodriguez, F., Haan, S., Letellier, E. In search of definitions: Cancer-associated fibroblasts and their markers. International Journal of Cancer. 146 (4), 895-905 (2020).
- Zhang, Y., et al. HIF-1α is necessary for activation and tumour-promotion effect of cancer-associated fibroblasts in lung cancer. Journal of Cellular and Molecular Medicine. 25 (12), 5457-5469 (2021).
- Bu, L., et al. Biological heterogeneity and versatility of cancer-associated fibroblasts in the tumor microenvironment. Oncogene. 38 (25), 4887-4901 (2019).
- Whitaker-Menezes, D., et al. Evidence for a stromal-epithelial "lactate shuttle" in human tumors: MCT4 is a marker of oxidative stress in cancer-associated fibroblasts. Cell cycle. 10 (11), 1772-1783 (2011).
- Mandujano-Tinoco, E. A., Gallardo-Pérez, J. C., Marín-Hernández, A., Moreno-Sánchez, R., Rodríguez-Enríquez, S. Anti-mitochondrial therapy in human breast cancer multi-cellular spheroids. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research. 1833 (3), 541-551 (2013).
- Bregman, A. A. . Laboratory Investigations in Cell and Molecular Biology. , (2002).
- Berry, E. A., Trumpower, B. L. Simultaneous determination of hemes a, b, and c from pyridine hemochrome spectra. Analytical Biochemistry. 161 (1), 1-15 (1987).
- Avagliano, A., et al. Metabolic reprogramming of cancer associated fibroblasts: the slavery of stromal fibroblasts. BioMed Research International. , (2018).
- Lorusso, G., Rüegg, C. The tumor microenvironment and its contribution to tumor evolution toward metastasis. Histochemistry and Cell Biology. 130 (6), 1091-1103 (2008).
- Liu, T., Zhou, L., Li, D., Andl, T., Zhang, Y. Cancer-associated fibroblasts build and secure the tumor microenvironment. Frontiers in Cell and Developmental Biology. 7, 60 (2019).
- Sebastian, A., et al. Single-cell transcriptomic analysis of tumor-derived fibroblasts and normal tissue-resident fibroblasts reveals fibroblast heterogeneity in breast cancer. Cancers. 12 (5), 1307 (2020).
- Elyada, E., et al. Cross-species single-cell analysis of pancreatic ductal adenocarcinoma reveals antigen-presenting cancer-associated fibroblasts. Cancer Discovery. 9 (8), 1102-1123 (2019).
- Ganguly, D., et al. Cancer-associated fibroblasts: Versatile players in the tumor microenvironment. Cancers. 12 (9), 2652 (2020).
- Harryvan, T. J., Verdegaal, E. M., Hardwick, J. C., Hawinkels, L. J., vander Burg, S. H. Targeting of the cancer-associated fibroblast-T-cell axis in solid malignancies. Journal of Clinical Medicine. 8 (11), 1989 (2019).
- Santi, A., Kugeratski, F. G., Zanivan, S. Cancer associated fibroblasts: the architects of stroma remodeling. Proteomics. 18 (5-6), 1700167 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır